La vitamina D, un micronutriente esencial en la homeostasis del calcio y la salud ósea, tiene un papel importante en la fisiología del sistema cardiovascular. En estudios experimentales, el déficit de vitamina D se asocia con cambios estructurales en los cardiomiocitos y la matriz extracelular que favorecen el desarrollo de insuficiencia cardiaca (IC). Las personas con déficit de vitamina D tienen más incidencia de IC a lo largo de los años y, cuando aparece, peor pronóstico. Sin embargo, los estudios de suplementación con vitamina D en personas sanas no han demostrado una disminución de la incidencia de esta enfermedad. En personas con IC y déficit de vitamina D, la suplementación tiene beneficios discretos y sobre todo en objetivos indirectos. Estos resultados se podrían explicar por la diversidad de los regímenes utilizados para la administración del suplemento, la heterogeneidad de la población incluida o factores hormonales desconocidos implicados en la fisiopatología de la IC. Estudios de aleatorización mendeliana recientes indican que el aumento de riesgo cardiovascular se produce por debajo del umbral de 20 ng/ml de concentración plasmática de vitamina D. En la IC, aún no hay evidencia científica robusta para la suplementación con vitamina D ni para la prevención ni para su tratamiento.
Palabras clave
Las enfermedades cardiovasculares (CV) y especialmente la insuficiencia cardiaca (IC) hoy son una de las principales causas de mortalidad. Su aparición está ligada a factores de riesgo «clásicos» como la hipertensión arterial, la diabetes mellitus o la edad avanzada. Sin embargo, recientemente se han relacionado también otros factores menos conocidos. Uno de ellos es el déficit de vitamina D —un micronutriente esencial en la homeostasis del calcio, el fósforo y el metabolismo óseo—, que cobra especial interés si se tiene en cuenta su extensión en la población general.
Implicación de la vitamina D en la fisiopatología de la ICSegún se ha descrito en el artículo dedicado al sistema hormonal de la vitamina D, esta ejerce su actividad a través de su metabolito activo (la 1,25-dihidroxivitamina D) que, tras ligar el receptor de la vitamina D (RVD), se traslada al núcleo celular. Aquí se heterodime- riza con el receptor retinoide X y, a través del elemento de respuesta de la vitamina D, se produce la activación de la región promotora de los múltiples genes diana de la vitamina D. El RVD se expresa en cardiomiocitos, fibroblastos cardiacos, células endoteliales, células del músculo liso vascular y linfocitos, lo que indica que la vitamina D tiene un papel significativo en la fisiología del sistema CV. Además, los cardiomiocitos ventriculares expresan 1α-hidroxilasa, que trasforma el metabolito inactivo 25-hidroxivitamina D en metabolito activo (1,25-dihidroxivitamina D), que va a ejercer efectos autocrinos y paracrinos en el miocardio. Independientemente de los efectos a través de la síntesis proteica, la vitamina D tiene una actividad no genómica por medio de sitios de unión alternativos del RVD que produce efectos rápidos en los canales iónicos implicados en la contracción y la relajación miocárdicas1,2.
Gran parte de la evidencia científica sobre la implicación fisiológica de la vitamina D en el sistema CV deriva de experimentos animales. La 1,25-dihidroxivitamina D bloquea la hipertrofia inducida por endotelina en los cardiomiocitos de ratones en periodo neonatal, inhibe su proliferación y disminuye la liberación de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP)3. En modelos animales con hipertensión o aumento de la poscarga, el metabolito activo de la vitamina D mitiga la hipertrofia y la disfunción diastólica1. La supresión selectiva del RVD en los cardiomiocitos de ratones conlleva hipertrofia ventricular3. La vitamina D parece tener efectos fisiológicos también en la matriz extracelular cardiaca. Los ratones knock-out para el gen del RVD desarrollan cardiomegalia con aumento del espacio intercelular y del contenido de colágeno independientemente de la concentración sanguínea de calcio3. En este modelo de ratón, se ha identificado un aumento de la actividad de las metaloproteinasas 2 y 9 de la matriz extracelular y una disminución de los inhibidores tisulares 1 y 3 de las metaloproteinasas1. Los fibroblastos cardiacos con supresión del RVD segregan un exceso de colágeno en la matriz extracelular3. Todos estos hallazgos indican que la vitamina D podría participar en la aparición de miocardiopatía. La vitamina D también tiene efectos inotrópicos y lusitrópicos mediados por su actividad no genómica. Sus metabolitos activos interaccionan con RVD situados en la membrana celular y, a través de la caveolina-3, conectan con los túbulos T del retículo endoplásmico, liberan calcio al interior celular y estimulan la contracción miocárdica1. Durante la diástole, mediante la fosforilación de la proteincinasa C, favorece la relajación miocárdica. Estos efectos desaparecen en los ratones knockout para el RVD1.
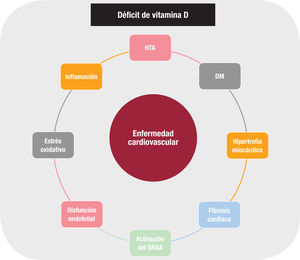
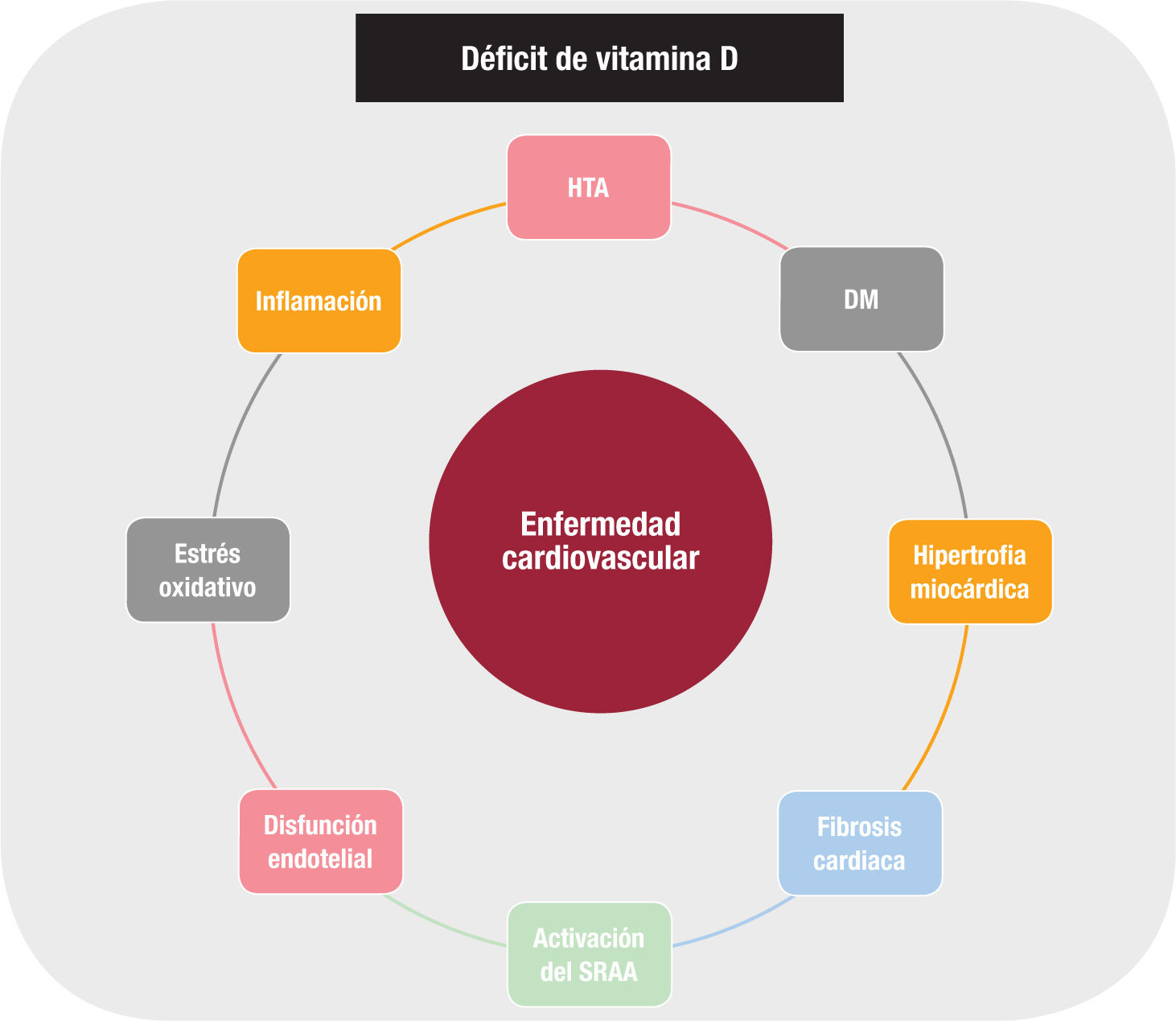
La deficiencia de vitamina D parece influir en el sistema renina- angiotensina-aldosterona, que tiene un papel fundamental en múltiples enfermedades CV. Los ratones knock-out para el RVD y para la 1 a-hidroxilasa muestran aumentos de renina, angiotensina II y aldos- terona en comparación con los ratones sin modificación genética3. Esta activación del sistema renina-angiotensina-aldosterona se mitiga con la suplementación oral con vitamina D. Además, esta suprime la transcripción nuclear del gen de la renina. El tratamiento con inhibidores de la enzima de conversión de la angiotensina o con antagonistas del receptor de la angiotensina II revierte la hipertrofia ventricular inducida en estos animales con un mecanismo independiente del calcio3.
Otros mecanismos que parecen relacionar el déficit de vitamina D con la aparición de eventos adversos CV incluyen la aceleración de la ateroesclerosis, la inflamación, la disfunción endotelial o la trombosis2. La calcificación vascular se ve favorecida por dietas pobres en vitamina D en animales con supresión genética del RVD, pero también cuando hay un exceso de vitamina D y especialmente en la insuficiencia renal1. El déficit de vitamina D parece favorecer la aparición de hipertensión arterial y diabetes mellitus, 2 factores profundamente implicados en la desarrollo de enfermedad CV3.
El sistema hormonal de la vitamina D está estrechamente relacionado con la actividad de la parathormona (PTH) de tal forma que el déficit de vitamina D se relaciona con un aumento de la concentración plasmática de esta4. El hiperparatiroidismo secundario aumenta la aldosterona plasmática, estimula la hipertrofia de los cardiomioci- tos, aumenta la rigidez arterial y se asocia con hipertrofia ventricular, calcificación valvular, arritmias e IC4. Sin embargo, hay más factores hormonales implicados en el metabolismo mineral que afectan a la función cardiaca, parte de ellos recién identificados y con elevada complejidad5. La hiperfosfatemia y las altas concentraciones de los metabolitos activos de la vitamina D estimulan la síntesis ósea del factor 23 de crecimiento fibroblástico (FGF-23), una hormona que favorece la fosfaturia e inhibe la 1α-hidroxilasa renal. Los valores elevados de FGF-23 se asocian con anomalías cardiacas funcionales y morfológicas (hipertrofia ventricular, dilatación auricular) independientemente de la existencia de factores de riesgo. En la IC, el FGF-23 está aumentado, y como biomarcador se ha demostrado su valor pronóstico en el infarto agudo de miocardio con elevación de segmento ST5. La elevación plasmática de FGF-23 se asocia estrechamente con la mortalidad global y especialmente con la cardiovascular5.
Estudios observacionales que relacionan el déficit de vitamina D con la ICInicialmente, la relación entre el déficit de vitamina D y la IC se describió a raíz del caso clínico de un niño con raquitismo por déficit grave de vitamina D e hipocalcemia junto con disfunción ventricular grave, que mejoró con la suplementación6. Esta situación clínica es excepcional en el momento actual, pero el déficit de vitamina D es una condición muy frecuente en nuestra sociedad (un 30-50% de la población general) en relación con edad avanzada, sedentarismo, obesidad, enfermedad inflamatoria intestinal o uso generalizado de protectores solares3.
Múltiples estudios prospectivos relacionan los valores bajos de vitamina D con enfermedad y mortalidad CV a largo plazo2, pero también con aparición de IC e IC de peor pronóstico4,7,8. En una población de 3.299 personas sometidas a coronariografía diagnóstica y seguidos durante 7,7 años, tras ajuste por factores de riesgo, el déficit grave de vitamina D (< 10 ng/ml) se asoció con un riesgo relativo (RR) de 2,84 (intervalo de confianza del 95% [IC95%], 1,20-6,74) de sufrir IC y RR = 5 (IC95%, 2,13-11,97) de muerte súbita cardiaca4. En un estudio prospectivo, este riesgo de IC fue 1,3 y 2 veces superior en personas mayores de 50 años con cifras de vitamina D bajas (16-30 ng/ml) y muy bajas (< 15 ng/ml) respectivamente (ambas, p < 0,05)7. En otros trabajos en personas mayores de edad o de origen multiétnico, la elevación de PTH secundaria a déficit de vitamina D parece tener una relación más estrecha con la aparición de IC, mientras que las concentraciones plasmáticas de 25-hidroxivitamina D no se asocian de manera signifi- cativa9’10.
En pacientes con IC, el déficit de vitamina D es una situación clínica muy frecuente, con una prevalencia de hasta un 90%11,12. En un grupo de personas con IC avanzada candidatos a trasplante cardiaco, los pacientes listados como urgentes tenían en mayor proporción concentraciones plasmáticas bajas de 1,25-dihidroxivitamina D en comparación con los trasplantes electivos. Además, esta concentración fue un predictor independiente de eventos al año de segui- miento13. Muchos otros estudios también encuentran que el déficit de vitamina D valorado a través de los valores plasmáticos de 25-hidro- xivitamina D es un predictor independiente de mortalidad e ingre- sos14,15,16,17,18,19 en pacientes con IC, la mayoría con fracción de eyección del ventrículo izquierdo (FEVI) reducida. Una publicación notifica que la concentración plasmática de 1,25-dihidroxivitamina D y el cociente 1,25-dihidroxivitamina D/PTH tienen valor pronóstico, mientras que la 25-hidroxivitamina D no tiene asociación significativa20. Otro trabajo encuentra un mayor porcentaje de déficit de vitamina D en pacientes no respondedores a la resincronización cardiaca en comparación con los respondedores21. Tras el implante de una asistencia ventricular izquierda, los valores bajos de 25-hidroxivitamina D < 20 ng/ml se asocian con más reingresos en el primer año (RR = 2,46; IC95%, 1,067-5,769) y más incidencia de infección del driveline (RR = 11,467; IC95%, 1,204-109,26)22. También parece que las bajas concentraciones de vitamina D se asocian con peor clase funcional, menos distancia recorrida en el test de los 6 min de marcha y peor calidad de vida19. Un estudio basado en parámetros ecocardiográficos en personas mayores de 70 años encuentra una correlación inversa entre los valores plasmáticos de vitamina D y el diámetro telesistólico del ventrículo izquierdo y directa con la fracción de acortamiento y la FEVI23. Otro trabajo retrospectivo mediante propensity score matching de 10.974 pacientes mayores con un primer ingreso por IC encuentra beneficio en mortalidad durante el ingreso y a los 30 días para los tratados con suplementos de vitamina D24. Este beneficio no se mantuvo en los menores de 75 años, los diabéticos o los que tomaban betabloqueantes o antagonistas del sistema renina-angiotensina.
Aunque la información derivada de estudios observacionales indica una implicación de la vitamina D en la IC, su valor científico se ve limitado por múltiples sesgos y posiblemente causalidad inversa. La concentración plasmática de vitamina D se ve influida por el estado funcional y nutricional, la función renal, el metabolismo del calcio y el fosforo, la PTH y el FGF23 que podrían actuar como factores de confusión o modificadores de efecto. La IC se asocia con edad avanzada, sedentarismo, obesidad y mala absorción intestinal, que a su vez son factores que influyen en el déficit de vitamina D.
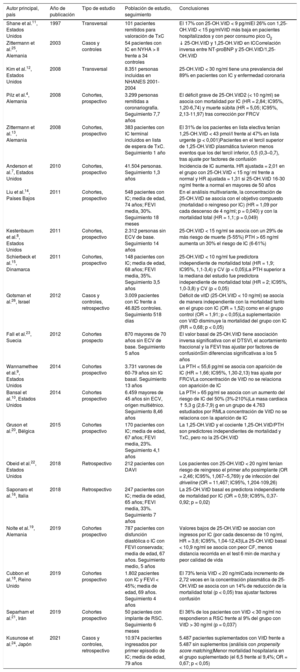
La tabla 1). refleja los principales estudios observacionales que relacionan la concentración de vitamina D con la IC.
Estudios observacionales que relacionan vitamina D e insuficiencia cardiaca cardiaca.
| Autor principal, país | Año de publicación | Tipo de estudio | Población de estudio, seguimiento | Conclusiones |
|---|---|---|---|---|
| Shane et al.11, Estados Unidos | 1997 | Transversal | 101 pacientes remitidos para valoración de TxC | El 17% con 25-OH.VitD < 9 pg/mlEl 26% con 1,25-OH.VitD < 15 pg/mlVitD más baja en pacientes hospitalizados y con peor consumo pico O2 |
| Zittermann et al.25, Alemania | 2003 | Casos y controles | 54 pacientes con IC en NYHA > II frente a 34 controles | ↓ 25-OH.VitD y 1,25-OH.VitD en ICCorrelación inversa entre NT-proBNP y 25-OH.VitD/1,25-OH.VitD |
| Kim et al.12, Estados Unidos | 2008 | Transversal | 8.351 personas incluidas en NHANES 2001-2004 | 25-OH.VitD < 30 ng/ml tiene una prevalencia del 89% en pacientes con IC y enfermedad coronaria |
| Pilz et al.4, Alemania | 2008 | Cohortes, prospectivo | 3.299 personas remitidas a coronariografía. Seguimiento 7,7 años | El déficit grave de 25-OH.VitD2 (< 10 ng/ml) se asocia con mortalidad por IC (HR = 2,84; IC95%, 1,20-6,74) y muerte súbita (HR = 5,05; IC95%, 2,13-11,97) tras corrección por FRCV |
| Zittermann et al.13, Alemania | 2008 | Cohortes, prospectivo | 383 pacientes con IC terminal incluidos en lista de espera de TxC. Seguimiento 1 año | El 31% de los pacientes en lista electiva tenían 1,25-OH.VitD < 43 pmol/l frente al 47% en lista urgente (p < 0,001)Pacientes en el tercil superior de 1,25-OH.VitD plasmática tuvieron menos eventos que los del tercil inferior, 0,5 (0,3–0,7), tras ajuste por factores de confusión |
| Anderson et al.7, Estados Unidos | 2010 | Cohortes, prospectivo | 41.504 personas. Seguimiento 1,3 años | Incidencia de IC aumenta. HR ajustada = 2,01 en el grupo con 25-OH.VitD < 15 ng/ ml frente a normal y HR ajustada = 1,31 si 25-OH.VitD 16-30 ng/ml frente a normal en mayores de 50 años |
| Liu et al.14, Países Bajos | 2011 | Cohortes, prospectivo | 548 pacientes con IC; media de edad, 74 años; FEVI media, 30%. Seguimiento 18 meses | En el análisis multivariante, la concentración de 25-OH.VitD se asocia con el objetivo compuesto (mortalidad o reingreso por IC) (HR = 1,09 por cada descenso de 4 ng/ml; p = 0,040) y con la mortalidad total (HR = 1,1; p = 0,049) |
| Kestenbaum et al.8, Estados Unidos | 2011 | Cohortes, prospectivo | 2.312 personas sin ECV de base. Seguimiento 14 años | 25-OH.VitD < 15 ng/ml se asocia con un 29% de más riesgo de muerte (5-55%) PTH > 65 ng/ml aumenta un 30% el riesgo de IC (6-61%) |
| Schierbeck et al.15, Dinamarca | 2011 | Cohortes, prospectivo | 148 pacientes con IC; media de edad, 68 años; FEVI media, 35%. Seguimiento 3,5 años | 25-OH.VitD < 10 ng/ml fue predictora independiente de mortalidad total (HR = 1,9; IC95%, 1,1-3,4) y CV (p < 0,05)La PTH superior a la mediana del estudio fue predictora independiente de mortalidad total (HR = 2; IC95%, 1,0-3,8) y CV (p < 0,05) |
| Gotsman et al.26, Israel | 2012 | Casos y controles, retrospectivo | 3.009 pacientes con IC frente a 46.825 controles. Seguimiento 518 días | Déficit de vitD (25-OH.VitD < 10 ng/ml) se asocia de manera independiente con la mortalidad tanto en el grupo con IC (OR = 1,52) como en el grupo control (OR = 1,91; p < 0,05)La suplementación con VitD disminuye la mortalidad del grupo con IC (RR = 0,68; p < 0,05) |
| Fall et al.23, Suecia | 2012 | Cohortes prospecto | 870 mayores de 70 años sin ECV de base. Seguimiento 5 años | El valor basal de 25-OH.VitD tiene asociación inversa significativa con el DTSVI, el acortamiento fraccional y la FEVI tras ajustar por factores de confusiónSin diferencias significativas a los 5 años |
| Wannamethee et al.9, Estados Unidos | 2014 | Cohortes prospectivo | 3.731 varones de 60-79 años sin IC basal. Seguimiento 13 años | La PTH < 55,6 pg/ml se asocia con aparición de IC (HR = 1,66; IC95%, 1,30-2,13) tras ajuste por FRCVLa concentración de VitD no se relaciona con aparición de IC |
| Bansal et al.10, Estados Unidos | 2014 | Cohortes prospectivo | 6.459 mayores de 45 años sin ECV, origen multiétnico. Seguimiento 8,46 años | La PTH > 65 pg/ml se asocia con un aumento del riesgo de IC del 50% (3%-210%)La masa cardiaca ↑ 5,3 g (2,6-7,9) g en un grupo de 4.763 estudiados por RMLa concentración de VitD no se relaciona con la aparición de IC |
| Gruson et al.20, Bélgica | 2015 | Cohortes prospectivo | 170 pacientes con IC; media de edad, 67 años; FEVI media, 23%. Seguimiento 4,1 años | La 1,25-OH.VitD y el cociente 1,25-OH.VitD/PTH son predictores independientes de mortalidad y TxC, pero no la 25-OH.VitD |
| Obeid et al.22, Estados Unidos | 2018 | Retrospectivo | 212 pacientes con DAVI | Los pacientes con 25-OH.VitD < 20 ng/ml tenían riesgo de reingreso el primer año posimplante (OR = 2,46; IC95%, 1,067–5,769) y de infección del driveline (OR = 11,467; IC95%, 1,204-109,26) |
| Saponaro et al.16, Italia | 2018 | Retrospectivo | 247 pacientes con IC; media de edad, 65 años; FEVI media, 33%. Seguimiento 7 años | La 25-OH.VitD basal es predictora independiente de mortalidad por IC (OR = 0,59; IC95%, 0,37-0,92; p = 0,02) |
| Nolte et al.19, Alemania | 2019 | Cohortes prospectivo | 787 pacientes con disfunción diastólica o IC con FEVI conservada; media de edad, 67 años. Seguimiento medio, 5 años | Valores bajos de 25-OH.VitD se asocian con ingresos por IC (por cada descenso de 10 ng/ml, HR = 3,6; IC95%, 1,04-12,43)La 25-OH.VitD basal < 10,9 ng/ml se asocia con peor CF, menos distancia recorrida en el test 6 min de marcha y peor calidad de vida |
| Cubbon et al.18, Reino Unido | 2019 | Cohortes prospectivo | 1.802 pacientes con IC y FEVI < 45%; media de edad, 69 años. Seguimiento 4 años | El 73% tenía VitD < 20 ng/mlCada incremento de 2,72 veces en la concentración plasmática de 25-OH.VitD se asocia con un 14% de reducción de la mortalidad total (p < 0,05) tras ajustar factores confusión |
| Separham et al.21, Irán | 2019 | Cohortes prospectivo | 50 pacientes con implante de RSC. Seguimiento 6 meses | El 36% de los pacientes con VitD < 30 ng/ml no respondieron a RSC frente al 9% del grupo con VitD > 30 ng/ml (p = 0,037) |
| Kusunose et al.24, Japón | 2021 | Casos y controles, retrospectivo | 10.974 pacientes ingresados por primer episodio de IC; media de edad, 79 años | 5.487 pacientes suplementados con VitD frente a 5.487 sin suplementos (análisis con propensity score matching)Menor mortalidad hospitalaria en el grupo suplementado (el 6,5 frente al 9,4%; OR = 0,67; p < 0,05) |
1,25-OH.VitD: 1,25-dihidroxivitamina D; 25-OH.VitD: 25-hidroxivitamina D; CF: clase funcional; DAVI: dispositivo de asistencia ventricular izquierda; DTSVI: diámetro telesistólico del ventrículo izquierdo; ECV: enfermedad cardiovascular; FEVI: fracción de eyección del ventrículo izquierdo; FRCV: factores de riesgo cardiovascular; HR: hazard ratio; IC: insuficiencia cardiaca; OR: odds ratio; PTH: paratirina; RM: resonancia magnética; RSC: resincronización cardiaca; TxC: trasplante cardiaco; VitD: vitamina D. Tabla de elaboración propia.
Si el déficit de vitamina D tiene un papel significativo en la aparición de IC, la suplementación debería tener un efecto protector. En este sentido, un estudio que aleatorizó a 35.983 mujeres de 50 a 79 años a recibir 400 UI diarias de vitamina D3 y calcio detectó que, tras 7,1 años de seguimiento, la incidencia de IC se redujo en el grupo de mujeres con bajo riesgo de IC (según antecedentes de hipertensión arterial, diabetes y enfermedad coronaria) con una hazard ratio (HR) de 0,63 (IC95%, 0,46–0,87). En la población total del estudio y en el grupo con alto riesgo de IC, sin embargo, este efecto no fue significa- tivo27. Otro ensayo en 5.110 pacientes aleatorizados a 100.000 UI mensuales de vitamina D3 y seguidos durante 3,3 años no encontró diferencias significativas en ningún objetivo CV, incluido un grupo preespecificado con bajos valores basales de vitamina D28. El VITAL- HF29 es un estudio auxiliar, derivado del ensayo VITAL30, con diseño factorial 2 x 2 que aleatorizó a 25.871 personas a tratamiento con vitamina D3 2.000 UI diarias o ácidos grasos omega-3 (1 g/día), ambos o placebo con una mediana de seguimiento de 5,3 años. VITAL-HF tampoco encontró diferencias significativas en cuanto a incidencia del primer ingreso por IC (HR = 0,93; IC95%, 0,78-1,11) o recurrencia de hospitalización por IC (HR = 0,94; IC95%, 0,81-1,09) entre los tratados con vitamina D y el grupo a placebo29. En el ensayo VITAL tampoco se encontraron diferencias significativas en la incidencia de cáncer invasivo o enfermedad CV con la suplementación de vitamina D frente a placebo30. La limitación fundamental de este trabajo es que solamente el 12% de la población incluida tenía déficit de vitamina D (< 20 ng/ml), mientras que el 32% tenía valores plasmáticos entre 20 y 30 ng/ml. Aun así, el análisis del subgrupo con vitamina D < 20 ng/ml tampoco identificó diferencias significativas en cuanto a los objetivos del estudio.
Los ensayos aleatorizados con vitamina D en pacientes con IC destacan por una marcada heterogeneidad en cuanto a la forma de vitamina D empleada (vitamina D2 o D3), dosis, frecuencia de administración (diaria, semanal, mensual) y la combinación con calcio. La población estudiada, generalmente IC con FEVI reducida, también presenta varios grados de déficit de vitamina D, la mayoría con cifras < 30 ng/ml, pero en esta categoría se incluye la insuficiencia grave (< 20 ng/ml) y la deficiencia leve-moderada (20-30 ng/ml). En consecuencia, también los resultados son en gran medida discordantes.
Varios trabajos describen efectos favorables de la suplementación con vitamina D en el perfil hormonal (disminución de PTH31, renina32 o aldosterona33) y de citocinas (aumento interleucina 10 con efecto antiinflamatorio, disminución de TNFα31) mientras que otros no encuentran diferencias significativas34 o hay un pequeño efecto deletéreo (aumento de renina35). Varios estudios pequeños hallan efectos favorables en parámetros ecocardiográficos como un aumento de FEVI (entre un 2,436 y un 6%37,38) o remodelado negativo del ventrículo izquierdo36,38 con suplementación de vitamina D, aunque el efecto no es generalizado33. Algunos ensayos describen un pequeño descenso de NT-proBNP34’39 en los pacientes tratados. En cuanto a la capacidad funcional y la calidad de vida, los resultados son dispares. Solo un pequeño estudio encuentra una ligera mejoría en los test de calidad de vida39, pero la mayoría advierte un efecto neutro33,34,38,40 e incluso un ligero empeoramiento38. El estudio alea- torizado más robusto (EVITA41) incluyó a 400 pacientes con IC y FEVI reducida que tomaron 4.000 UI/día de vitamina D3 durante 3 años de seguimiento. No hubo diferencias significativas entre los 2 grupos en el objetivo primario del estudio, que era la mortalidad total, aunque los autores reconocen poca potencia estadística. Uno de los objetivos secundarios de este estudio era la necesidad de implante de una asistencia circulatoria mecánica. Los pacientes tratados con vitamina D3 tuvieron significativamente más riesgo de necesitarla (HR = 1,96; IC95%, 1,04-3,66; p = 0,03). Este evento adverso se produjo sobre todo en el subgrupo de pacientes con valores basales de vitamina D > 12 ng/ml que durante el estudio alcanzaron cifras > 40 ng/ml. Los autores postulan que la relación entre la concentración plasmática de vitamina D y los eventos adversos CV sería en forma de U, con aumento de riesgo por debajo de 12 ng/ml y por encima de 40 ng/ml. Otra explicación sería una elevación de la calcemia en el grupo tratado, ya que este hallazgo ya se había asociado con mayor incidencia de IC41. La tabla 2). resume los principales ensayos aleatori- zados con vitamina D en sujetos con IC.
Ensayos clínicos aleatorizados con suplementación de vitamina D en IC.
| Autor, año de publicación | Población del estudio, seguimiento | Vitamina D basal | Dosis y fármaco | Conclusiones |
|---|---|---|---|---|
| Estudios que demuestran efecto beneficioso | ||||
| Schleithoff et al.31, 2006 | n = 93; IC en NYHA i II; FEVI media, 32%. Seguimiento 9 meses | 15,2 ng/ml | VitD3 2.000 UI/día + Ca 500 mg/día frente a placebo | ↓ significativa de PTH en grupo tratado↑ significativo de IL-10 con efecto antiinflamatorio en grupo tratado↑ significativo de TNFα (proinflamatoria) en grupo control frente a sin cambios en grupo control |
| Schroten et al.32, 2013 VitD-CHF trial | n = 101, IC con FEVI media 35%; media de edad, 64 años. Seguimiento 6 semanas | El 56% tenía < 20 ng/ml | VitD3 2.000 UI/día frente a placebo | ↓ significativa de la actividad de la renina plasmática en el grupo tratado frente a ligero T en el grupo de control |
| Dalbeni et al.37 2013 | n = 23, IC con FEVI media del 43%; media de edad, 74 años. Seguimiento 6 meses | < 30 ng/ml | VitD2 4.000 UI/día frente a placebo | ↑ significativo de la FEVI en el grupo tratado (6,71% frente a -4,3% en el grupo de control; p < 0,001)↓ de la PA en el grupo tratado (129 frente a 122 mmHg; p < 0,05) |
| Witte et al.38, 20 16 | n = 229, IC con FEVI media del 26%; media de edad, 68 años. Seguimiento 1 año | < 20 ng/ml | VitD3 4.000 UI/día frente a placebo | Mejoría de la FEVI (6,7%; IC95%, 3,2%-8,95%; p < 0,0001) en el grupo tratadoRemodelado inverso, DTDVI (-2,5 mm; p = 0,002) y DTSVI (-2,09 mm; p = 0,043) en el grupo tratadoNo hubo diferencias en T6M (objetivo primario del estudio) |
| Moretti et al.39, 20 1 7 | n = 40, IC y NYHA ≥ II y FEVI media del 28%, con déficit de vitamina D. Seguimiento 6 meses | < 32 ng/ml | VitD3 10.000 UI/día frente a placebo | Mejora significativa de los tests de calidad de vida (Kansas City)Menor incremento BNP a los 6 meses respecto al basal en el grupo tratado frente al de control |
| Zittermann et al.36, 20 19 EVITA (post hoc) | n = 400, IC con NYHA ≥ II; media de edad, 54 años; FEVI media, 30%. Seguimiento 3 años | < 30 ng/ml | VitD3 4.000 UI/día frente a placebo | Incremento de la FEVI del 2,6% (-2,47% al 7,67%) en el subgrupo de menores de 50 años tratados con VitDDisminución del DTDVI de -0,67 (-4,1 a 2,7) mm en los mayores de 50 años tratados con VitD |
| Estudios que demuestran efecto neutro o desfavorable | ||||
| Witham et al.34, 20 10 | n = 105, IC con NYHA ≥ II y FEVI reducida. Seguimiento 20 semanas | < 20 ng/ml | VitD2 100.000 UI basal y a las 10 semanas frente a placebo | Sin diferencias en T6M, capacidad funcional y TNFα Empeoramiento de la calidad de vida en el grupo de VitD (score de Minnesota, 3,4 ± 12,1 frente a -2,0 ± 11,2; p = 0,03)Mejora de la NT-proBNP en el grupo de VitD (-22 frente a +78 pg/ml; p = 0,04) |
| Boxer et al.40, 2013 | n = 64, IC con NYHA ≥ II; FEVI media, 37%; media de edad, 65 años; el 64% afroamericanos. Seguimiento 6 meses | < 37,5 ng/ml | VitD3 50.000 UI/ semana + Ca frente a placebo | Sin cambios en consumo pico de O2, distancia recorrida en T6M y capacidad física |
| Boxer et al.33, 2014 | n = 64, IC con NYHA ≥ II; FEVI media, 37%; media de edad, 65 años; el 64% afroamericanos. Seguimiento 6 meses | < 37,5 ng/ml | VitD3 50.000 UI/ semana + Ca frente a placebo | ↓ del 37% dela aldosterona en el grupo tratado frente a sin cambios en el grupo de control (p = 0,02)Sin cambios en la renina, parámetros ecocardiográficos y la calidad vida (KCCQ) |
| Zittermann et al.41, 2017 EVITA | n = 400, IC con NYHA i II; FEVI media, 30%; media de edad, 54 años. Seguimiento 3 años | < 30 ng/ml | VitD3 4.000 UI/día frente a placebo | Sin diferencias en mortalidad total (objetivo primario) ↑ necesidad de implante de asistencia circulatoria en el grupo tratado con VitD (HR = 1,96; IC95%, 1,04-3,66; p = 0,03)Otros objetivos secundarios (ingresos, TxC, hipercalcemia), sin diferencias |
| Zittermann et al.35, 2018 EVITA (post hoc) | n = 165, IC con NYHA i II; FEVI media, 30%; media de edad, 54 años. Seguimiento 3 años | < 30 ng/ml | VitD3 4.000 UI/día frente a placebo | Sin diferencias en concentración de fosforo, FGF23, renina y aldosterona Aumento de renina en el subgrupo con VitD basal < 12,5 ng/ml |
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; FGF-23: factor 23 de crecimiento fibroblástico; HR: hazard ratio; IC: insuficiencia cardiaca; IL: interleucina; KCCQ: Kansas City Cardiomyopathy Questionnaire; PA: presión arterial; PTH: paratirina; T6M: test de los 6 min de marcha; TNFα: factor de necrosis tumoral alfa; TxC: trasplante cardiaco; vVitD: vitamina D; VitD2: vitamina D2; VitD3: vitamina D3. Tabla de elaboración propia.
Por último, un metanálisis42 que incluye 10 estudios aleatorizados concluye que los pacientes con IC crónica tratados con suplementos de vitamina D presentan mejora de la calidad de vida y disminución de la proteína C reactiva. Sin embargo, no hubo mejoras significativas en cuanto a mortalidad, FEVI, péptidos natriuréticos o distancia recorrida en el test de 6 min de marcha. Solo hubo una ligera mejoría de la FEVI en los pacientes tratados con vitamina D, pero sin suplementación de calcio (diferencia de media ponderada, 6,75; IC95%, 4,16-9,34; p < 0,001).
En base a toda la evidencia científica publicada, los beneficios de la suplementación con vitamina D en la IC son cuando menos discretos. La discreta mejoría en objetivos indirectos en la IC es muy variable entre los diversos trabajos, mientras que ninguno de ellos ha demostrado beneficios clínicos claros. Los resultados se podrían explicar en parte por la gran heterogeneidad en cuanto a dosis y forma de suple- mentación, si se combinó o no con suplementación de calcio, y la inclusión de una población con grados variados de déficit de vitamina D. Es posible que el tratamiento con dosis moderadas-altas de la forma activa de la vitamina D en pacientes con déficit solo moderado y la combinación con suplementos de calcio tengan incluso efectos deletéreos en algunos pacientes.
Los resultados de los estudios aleatorizados divergen de las observaciones previas sobre la implicación de la vitamina D en la fisiopato- logía de la IC y de las conclusiones de los estudios observacionales. Una explicación sería que el déficit de vitamina D es un epifenómeno de la IC y no un factor causal. Específicamente, la reducción de actividad física y la exposición al sol, el empeoramiento de la función renal y la mala absorción intestinal relacionada con la congestión promueven mayor déficit de vitamina D según avanza la IC. Otra posibilidad sería que, una vez empleados los tratamientos neurohormonales con beneficio demostrado, la normalización de la concentración de vitamina D por sí sola no sea capaz de añadir beneficios clínicos significativos. Efectivamente, en los estudios animales que demuestran reversibilidad de las alteraciones miocárdicas relacionadas con el déficit de vitamina D, la comparación se hizo con placebo3. Un estudio retrospectivo en sujetos ingresados por IC describe beneficios de la suple- mentación con vitamina D solo en los que no recibían tratamiento neurohormonal24.
El sistema hormonal de la vitamina D es complejo y la mayoría de los ensayos no han estudiado la implicación de otras hormonas como el FGF-23, que parece tener una estrecha relación con el remodelado cardiaco y los eventos adversos CV5. Los pacientes con insuficiencia renal terminal, cuya principal causa de muerte es la enfermedad CV, frecuentemente tienen muy elevado el FGF-235. En modelos animales nefrectomizados con valores plasmáticos de FGF-23 altos, se ha demostrado que los bloqueadores de los receptores de FGF-23 revierten la hipertrofia del ventrículo izquierdo típica de la enfermedad renal avanzada5. En la práctica clínica, el cinacalcet, un calciomimé- tico oral empleado en el tratamiento del hiperparatiroidismo secundario a la insuficiencia renal, reduce el FGF-23 plasmático y la mortalidad CV, por arritmias e IC de los pacientes en diálisis5. Al contrario, el tratamiento con vitamina D3 en esta categoría de pacientes no ha demostrado los mismos efectos CV beneficiosos. Además, hay evidencia científica de que la suplementación con más de 2.000 UI de vitamina D o la forma activada 1,25-dihidroxivitamina D3 podría aumentar el FGF-23 plasmático de los pacientes con IC o insuficiencia renal43. La elevación de FGF-23 en relación con la suplementación con dosis altas de vitamina D podría ser otra explicación de los resultados decepcionantes de los ensayos aleatorizados que, en la mayoría de los trabajos, no se ha valorado.
La aleatorización mendeliana se emplea en epidemiología para inferir causalidad sin necesidad de ensayos clínicos aleatorizados. Se basa en analizar el riesgo de una enfermedad en sujetos agrupados según la presencia de variantes genéticas, lo que permite, por ejemplo, comparar a personas expuestas a concentraciones de vitamina D altas y bajas44. Este tipo de análisis controla los factores de confusión y la causalidad inversa. Los estudios iniciales de aleatorización men- deliana que asumían una relación lineal entre las cifras de vitamina D y los eventos CV no encontraron una asociación significativa45. Un trabajo recién publicado demuestra que la relación tiene forma de L, con un marcado aumento del riesgo CV con niveles de vitamina D plasmática < 20 ng/ml45. Corregir la vitamina D hasta alcanzar concentraciones superiores disminuye el riesgo CV un 4,4% según la estimación de este estudio45. Aunque aún no hay datos específicos sobre la IC, este trabajo reconcilia, al menos parcialmente, la brecha abierta entre los estudios experimentales y observacionales y los ensayos aleatori- zados.
ConclusionesEstudios experimentales en modelos animales indican que la vitamina D tiene un papel significativo en el correcto funcionamiento del sistema CV. El déficit de vitamina D genera alteraciones en el funcionamiento de los cardiomiocitos que favorecen la aparición de IC. En estudios observacionales, el déficit de vitamina D se correlaciona con empeoramiento de los factores de riesgo CV y aparición de enfermedades CV. Más aun, en la población con IC establecida, el déficit de vitamina D parece tener un valor predictivo negativo independientemente de los factores pronósticos establecidos. Todo ello ha llevado a diseñar estudios aleatorizados con suplementos de vitamina D, pero tanto los estudios de prevención de la IC como de tratamiento de la IC han arrojado resultados apenas discretos. La heterogeneidad de los regímenes de suplementación y de la población incluida con valores plasmáticos de vitamina D muy diversos son posibles explicaciones para estos resultados. Además, el sistema hormonal de la vitamina D es extremadamente complejo, y es posible que no se hayan valorado correctamente los efectos biológicos de la suplementación. Trabajos poblacionales más recientes indican que existe un umbral por debajo del cual se manifiesta el efecto CV deletéreo del déficit de vitamina D. La esperanza de que la suplementación con vitamina D aporte beneficios en la IC pasa por identificar correctamente tanto a la población diana como la dosis y la formulación idóneas de esta poderosa vitamina.
FinanciaciónEste trabajo se ha elaborado sin ninguna fuente de financiación.
Contribución de los autoresTodos los autores han contribuido sustancialmente a la concepción, el diseño y la redacción del artículo.
Conflicto de interesesC. Mitroi declara haber recibido honorarios por presentaciones, lecturas y contenido para eventos educativos, así como honorarios por viajes de Bayer, Daiichi-Sankyo, Pfizer y Abbott. El resto de autores declara no tener conflictos de intereses relacionados con el trabajo actual.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Sistema endocrino de la vitamina D y enfermedades cardiovasculares», que ha sido patrocinado por FAES Farma.