El levosimendán ambulatorio repetitivo es una opción como puente al trasplante cardiaco (TxC), aunque la evidencia sobre su eficacia y su seguridad es escasa. El objetivo del registro LEVO-T es describir a los pacientes en lista de TxC que reciben levosimendán, sus pautas y los eventos clínicos durante el seguimiento, en comparación con los que no lo reciben.
MétodosSe revisó en retrospectiva a los pacientes en lista de espera para TxC electivo de 14 centros españoles desde 2015 hasta 2020.
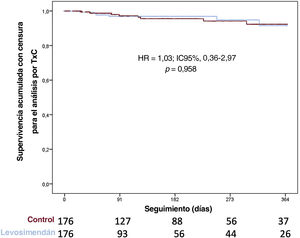
ResultadosSe incluyó a 1.015 pacientes consecutivos; los 238 (23,4%) que recibieron levosimendán mostraron más ingresos por insuficiencia cardiaca (IC) el año anterior y peor perfil clínico. Las dosis fijas por necesidades clínicas fueron la pauta más frecuente. Dos pacientes (0,8%) presentaron arritmias ventriculares no mortales. No hubo diferencias en hospitalizaciones por IC entre los que comenzaron levosimendán en los primeros 30 días después de inclusión y los que no (el 33,6 frente al 34,5%; p=0,848). De estos últimos, 102 (32,9%) pasaron a levosimendán después de un ingreso por IC, y la tasa de ingresos por IC/mes varió de 0,57 antes del levosimendán a 0,21 después. El análisis mediante emparejamiento por puntuación de propensión no mostró diferencias entre los pacientes con y sin levosimendán en la supervivencia a 1 año tras la inclusión en lista (HR=1,03; IC95%, 0,36-2,97; p=0,958) ni en la supervivencia tras el TxC (HR=0,97; IC95%, 0,60-1,56; p=0,958).
ConclusionesEl levosimendán ambulatorio repetitivo como puente al trasplante cardiaco es un tratamiento frecuente y seguro que podría reducir ingresos por IC.
Palabras clave
La insuficiencia cardiaca (IC) es una de las principales causas de morbilidad y mortalidad en todo el mundo, con una prevalencia estimada del 1 al 2% de la población adulta de los países desarrollados1,2. Las opciones terapéuticas actuales han mejorado de manera significativa los síntomas y el pronóstico, pero el trasplante de corazón (TxC) continúa siendo el último recurso para los pacientes con IC avanzada (ICA)3–5. Sin embargo, el TxC tiene limitaciones debido al escaso número de donantes, que conlleva unos tiempos de espera diversos en las listas de espera para trasplante, que pueden ser más largos para los receptores grandes o de grupo sanguíneo 06. Los pacientes que están en lista de espera son especialmente vulnerables, ya que están en alto riesgo de ingreso por IC y shock cardiogénico, lo cual puede poner en peligro su supervivencia, su elegibilidad para el TxC o los resultados de este7–9. En consecuencia, puede ser necesaria una opción de tratamiento puente para el TxC mediante asistencia circulatoria mecánica o medicación inotrópica para los receptores con alto riesgo5,10,11.
El levosimendán es un fármaco inodilatador intravenoso que aumenta la sensibilidad de los sarcómeros al calcio, con lo que incrementa la contractilidad miocárdica sin elevar las concentraciones de calcio intracelular, a diferencia de lo que hacen otros fármacos inotrópicos. Además, el levosimendán actúa como vasodilatador mediante la activación de los canales de potasio dependientes de la adenosina trifosfato (ATP) en los miocitos vasculares12. Las propiedades farmacológicas del levosimendán dan lugar tras la infusión a un metabolito activo de larga duración en el plasma, lo cual permite la administración ambulatoria mediante ciclos repetitivos en pacientes con ICA crónica13. En estudios previos se ha observado que esta modalidad terapéutica con levosimendán es capaz de reducir las concentraciones de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) y es posible que reduzca la mortalidad y las rehospitalizaciones, aunque la evidencia al respecto es poco uniforme14–17.
En algunos países, el levosimendán se emplea con frecuencia en pacientes con ICA. Sin embargo, se dispone de poca información sobre las características de los pacientes tratados con levosimendán, la forma de administración del fármaco y su seguridad. El objetivo principal de nuestro estudio es describir el perfil clínico de los pacientes tratados con levosimendán en una consulta clínica de la práctica clínica real incluidos en lista de espera para TxC electivo. Se examinan también los patrones de prescripción y la seguridad de dicho tratamiento en esta población. Nuestros objetivos secundarios son describir los eventos clínicos, incluida la mortalidad, las hospitalizaciones y otros resultados clínicos de interés, y comparar estos eventos con los observados en un grupo de control de pacientes incluidos en lista de espera para TxC electivo a los que no se trató con levosimendán.
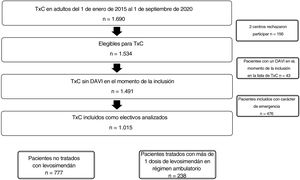
MÉTODOSPoblación del estudioSe invitó a participar en el registro LEVO-T a todos los centros españoles con un programa de TxC de adultos (N=16). Los criterios de inclusión englobaron a todos los pacientes de edad > 18 años incluidos en lista de espera para TxC electivo entre el 1 de enero de 2015 y el 1 de septiembre de 2020. Se examinó a los pacientes en retrospectiva y se llevó a cabo un seguimiento hasta junio de 2021. Se incluyó en el grupo de tratamiento a los pacientes que recibieron más de 1 dosis de levosimendán en régimen ambulatorio mientras estaban en lista de espera y antes del TxC, y se incluyó en el grupo de control a los pacientes que no necesitaron levosimendán. Se excluyó a los pacientes con dispositivos de asistencia ventricular en el momento de su inclusión en lista de espera. Cada centro tomó la decisión individual de administrar el tratamiento con levosimendán basándose en los criterios locales, que se establecieron en función de la experiencia clínica previa. La Organización Nacional de Trasplantes de España no prioriza a los pacientes adultos en tratamiento con fármacos inotrópicos, que se mantienen, pues, en lista de espera para TxC electivo.
El estudio fue aprobado por el comité de ética de investigación del Hospital Universitari de Bellvitge y se atuvo a lo establecido en los principios de la Declaración de Helsinki y en la declaración de ética de la International Society for Heart and Lung Transplantation (ISHLT). Todos los pacientes firmaron un documento de consentimiento informado para la recogida prospectiva y anonimizada de sus datos como parte de su inclusión en el Registro Español de Trasplante Cardiaco. Los autores de cada uno de los centros participantes garantizan la integridad de los datos. Este estudio se diseñó según las directrices Strengthening the Reporting of Observational studies in Epidemiology (STROBE)
Obtención de los datosCada uno de los centros recopiló datos del Registro Español de Trasplante Cardiaco y de las historias clínicas electrónicas (véase el apéndice 2). La evaluación basal se llevó a cabo en el momento de la inclusión en la lista de espera para TxC. Las variables determinadas incluyeron parámetros demográficos, síntomas de IC, comorbilidades, ingresos por IC, tratamiento médico y uso de dispositivos. Las exploraciones complementarias consideradas fueron los análisis de laboratorio, la ecocardiografía y el cateterismo cardiaco derecho antes de la inclusión. De los pacientes tratados con levosimendán, se obtuvieron otros datos adicionales en el momento de la primera administración: dosis, velocidad de infusión, número de dosis, constantes vitales, análisis de laboratorio, parámetros ecocardiográficos y datos del cateterismo cardiaco derecho. Los eventos recogidos durante el seguimiento fueron los siguientes: arritmias ventriculares con necesidad de ingreso en el servicio de urgencias o tratamientos del desfibrilador automático implantable para arritmias ventriculares, ingresos por IC definidos como una hospitalización por IC durante superior a 24 h, necesidad de asistencia circulatoria mecánica e inclusión en lista de espera para TxC de urgencia o de emergencia, TxC o muerte. De los pacientes sometidos a TxC, se obtuvo información adicional consistente en análisis de laboratorio y parámetros ecocardiográficos antes del TxC, así como datos relativos a la disfunción primaria del injerto según la definición de consenso de la ISHLT18, necesidad de uso de un oxigenador extracorpóreo de membrana (ECMO) y supervivencia después del TxC. Con objeto de asegurar la calidad de los datos, se establecieron varios criterios: a) los datos solamente podían incluirse si estaban dentro de un intervalo de valores razonables definido previamente por el equipo de investigación para cada variable cuantitativa; b) las fechas de los diferentes periodos analizados debían ser correlativas, y c) antes del análisis estadístico se realizó una búsqueda de datos faltantes y anómalos y se pidió a los investigadores que los revisaran.
Análisis estadísticoLas variables continuas de distribución normal se expresan en forma de media±desviación estándar, mientras que las variables con una distribución no normal se expresan como mediana [intervalo intercuartílico]. Los datos de las variables cualitativas se presentan en número y porcentaje. Se utilizó la prueba de Kolmogorov-Smirnov para evaluar la distribución normal de las variables continuas. Se utilizaron las pruebas de la t de Student y de la U de Mann-Whitney para comparar las variables con o sin distribución normal respectivamente. Se utilizó la prueba de la χ2 para comparar las variables cualitativas. Se empleó la prueba de la t de Student para muestras emparejadas en la comparación de las características de los pacientes durante el seguimiento.
Se usó el método de Kaplan-Meier para describir la supervivencia de los pacientes incluidos en lista de espera y después del TxC. En el seguimiento se censuraron los datos para el análisis en el momento del TxC o de la exclusión de la lista de espera por falta de elegibilidad. Las diferencias entre los grupos se analizaron con modelos de regresión de Cox. Dado que se observaron diferencias entre el grupo de levosimendán y el grupo de control, se aplicó una técnica de emparejamiento mediante puntuación de propensión con objeto de reducir al mínimo esas diferencias. Se introdujo un ajuste por las siguientes covariables (tabla 1 del material adicional): edad, sexo, etiología isquémica y los siguientes parámetros en el momento de la inclusión en la lista de espera: peso, índice de masa corporal, clase funcional IV de la New York Heart Association (NYHA), número de ingresos previos por IC, portadores de desfibrilador automático implantable, portadores de terapia de resincronización cardiaca (TRC), uso de tratamiento neurohormonal y de diuréticos, valores de creatinina, fracción de eyección del ventrículo izquierdo, presión arterial pulmonar media, presión capilar pulmonar enclavada, gasto cardiaco y resistencia vascular pulmonar. Para llevar a cabo el emparejamiento, se realizó primero un análisis de regresión logística sin restricción en el que la variable dependiente fue «tratamiento con levosimendán» y las variables independientes, las antes mencionadas. A continuación se aplicó un emparejamiento en relación 1:1 en el que la condición para generar cada par fue que la diferencia en las probabilidades fuera < 0,024 (un 20% de la desviación estándar de las probabilidades, que fue 0,12). Luego, se verificó de dos maneras que las covariables estuvieran bien equilibradas en los 2 grupos: verificación de la ausencia de diferencias significativas (p> 0,05) y cálculo de la diferencia estandarizada entre los 2 grupos para cada covariable. Se consideró que los valores bajos (≤ 10%) respaldaban el supuesto de equilibrio en los 2 grupos.
Se comparó la tasa de ingresos por IC de los pacientes que iniciaron el tratamiento con levosimendán en los 30 primeros días tras la inclusión con la observada en los demás pacientes mediante la prueba de la t de Student para muestras emparejadas. Además, se realizó un subanálisis de la supervivencia y los efectos adversos para comparar a los pacientes con un patrón de dosis flexible con los tratados con otros patrones posológicos.
El análisis estadístico se llevó a cabo con el programa informático SPSS versión 21 (IBM Corp., Estados Unidos).
RESULTADOSSe dispuso de la información correspondiente a 1.015 pacientes consecutivos incluidos en la lista de espera para TxC electivo proporcionada por 14 de los 16 (87,5%) centros activos con un programa de TxC de adultos de España (figura 1). Puede consultarse información detallada sobre los centros participantes y el número de pacientes aportado por cada centro en las tablas 2 y 3 del material adicional. En total, 238 pacientes (23,4%) recibieron más de 1 dosis de levosimendán en régimen ambulatorio, mientras que 777 pacientes (76,6%) no necesitaron levosimendán y constituyeron el grupo de control.
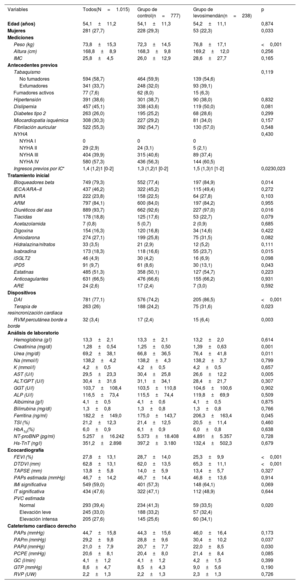
En la tabla 1 se presentan las principales características basales de la cohorte en el momento de la inclusión en lista de espera para TxC. La media de edad fue 54,1±11,2 años y un 27,7% de los pacientes eran mujeres. La causa subyacente de la IC fue la miocardiopatía isquémica en 308 pacientes (30,3%); 522 (55,3%) presentaban una fibrilación auricular concomitante y la mayoría (n=580, 57,3%) se encontraban en NYHA IV. En términos generales, los pacientes recibían un tratamiento médico óptimo para la IC, excepto por la baja prescripción de inhibidores del cotransportador de sodio-glucosa 2 durante el periodo de estudio (2015-2020). La media de la concentración de NT-proBNP fue de 5.257±16.242 pg/ml y la media de la fracción de eyección del ventrículo izquierdo fue del 27,8±13,1%.
Características basales de la cohorte en el momento de la inclusión en lista de espera para TxC
| Variables | Todos(N=1.015) | Grupo de control(n=777) | Grupo de levosimendán(n=238) | p |
|---|---|---|---|---|
| Edad (años) | 54,1±11,2 | 54,1±11,3 | 54,2±11,1 | 0,874 |
| Mujeres | 281 (27,7) | 228 (29,3) | 53 (22,3) | 0,033 |
| Mediciones | ||||
| Peso (kg) | 73,8±15,3 | 72,3±14,5 | 76,8±17,1 | <0,001 |
| Altura (cm) | 168,8±8,9 | 168,3±9,8 | 169,2±12,0 | 0,256 |
| IMC | 25,8±4,5 | 26,0±12,9 | 28,6±27,7 | 0,165 |
| Antecedentes previos | ||||
| Tabaquismo | 0,119 | |||
| No fumadores | 594 (58,7) | 464 (59,9) | 139 (54,6) | |
| Exfumadores | 341 (33,7) | 248 (32,0) | 93 (39,1) | |
| Fumadores activos | 77 (7,6) | 62 (8,0) | 15 (6,3) | |
| Hipertensión | 391 (38,6) | 301 (38,7) | 90 (38,0) | 0,832 |
| Dislipemia | 457 (45,1) | 338 (43,6) | 119 (50,0) | 0,081 |
| Diabetes tipo 2 | 263 (26,0) | 195 (25,2) | 68 (28,6) | 0,299 |
| Miocardiopatía isquémica | 308 (30,3) | 227 (29,2) | 81 (34,0) | 0,157 |
| Fibrilación auricular | 522 (55,3) | 392 (54,7) | 130 (57,0) | 0,548 |
| NYHA | 0,430 | |||
| NYHA I | 0 | 0 | 0 | |
| NYHA II | 29 (2,9) | 24 (3,1) | 5 (2,1) | |
| NYHA III | 404 (39,9) | 315 (40,6) | 89 (37,4) | |
| NYHA IV | 580 (57,3) | 436 (56,3) | 144 (60,5) | |
| Ingresos previos por IC* | 1,4 (1,2)1 [0-2] | 1,3 (1,2)1 [0-2] | 1,5 (1,3)1 [1-2] | 0,0230,023 |
| Tratamiento inicial | ||||
| Bloqueadores beta | 749 (79,3) | 552 (77,4) | 197 (84,9) | 0,014 |
| IECA/ARA–II | 437 (46,2) | 322 (45,2) | 115 (49,4) | 0,272 |
| INRA | 222 (23,8) | 158 (22,5) | 64 (27,8) | 0,103 |
| ARM | 797 (84,1) | 600 (84,0) | 197 (84,2) | 0,955 |
| Diuréticos del asa | 889 (93,7) | 662 (92,6) | 227 (97,0) | 0,016 |
| Tiacidas | 178 (18,8) | 125 (17,6) | 53 (22,7) | 0,079 |
| Acetazolamida | 7 (0,8) | 5 (0,7) | 2 (0,9) | 0,685 |
| Digoxina | 154 (16,3) | 120 (16,8) | 34 (14,6) | 0,422 |
| Amiodarona | 274 (27,1) | 199 (25,8) | 75 (31,5) | 0,082 |
| Hidralazina/nitratos | 33 (3,5) | 21 (2,9) | 12 (5,2) | 0,111 |
| Ivabradina | 173 (18,3) | 118 (16,6) | 55 (23,7) | 0,015 |
| iSGLT2 | 46 (4,9) | 30 (4,2) | 16 (6,9) | 0,098 |
| iPD5 | 91 (9,7) | 61 (8,6) | 30 (13,1) | 0,043 |
| Estatinas | 485 (51,3) | 358 (50,1) | 127 (54,7) | 0,223 |
| Anticoagulantes | 631 (66,5) | 476 (66,6) | 155 (66,2) | 0,931 |
| ARE | 24 (2,6) | 17 (2,4) | 7 (3,0) | 0,592 |
| Dispositivos | ||||
| DAI | 781 (77,1) | 576 (74,2) | 205 (86,5) | <0,001 |
| Terapia de resincronización cardiaca | 263 (26) | 188 (24,2) | 75 (31,6) | 0,023 |
| RVM percutánea borde a borde | 32 (3,4) | 17 (2,4) | 15 (6,4) | 0,003 |
| Análisis de laboratorio | ||||
| Hemoglobina (g/l) | 13,3±2,1 | 13,3±2,1 | 13,2±2,0 | 0,614 |
| Creatinina (mg/dl) | 1,28±0,54 | 1,25±0,50 | 1,39±0,63 | 0,001 |
| Urea (mg/dl) | 69,2±38,1 | 66,8±36,5 | 76,4±41,8 | 0,011 |
| Na (mmol/l) | 138,2±4,2 | 138,2±4,3 | 138,2±3,7 | 0,799 |
| K (mmol/l) | 4,2±0,5 | 4,2±0,5 | 4,2±0,5 | 0,657 |
| AST (U/l) | 29,5±23,3 | 30,4±25,8 | 26,6±12,2 | 0,005 |
| ALT/GPT (U/l) | 30,4±31,6 | 31,1±34,1 | 28,4±21,7 | 0,307 |
| GGT (U/l) | 103,7±108,4 | 103,5±110,8 | 104,6±100,6 | 0,902 |
| ALP (U/l) | 116,5±73,4 | 115,5±74,4 | 119,8±69,9 | 0,509 |
| Albúmina (g/l) | 4,1±0,5 | 4,1±0,6 | 4,1±0,5 | 0,875 |
| Bilirrubina (mg/dl) | 1,3±0,8 | 1,3±0,8 | 1,3±0,8 | 0,766 |
| Ferritina (ng/ml) | 182,2±149,0 | 175,0±143,7 | 206,3±163,4 | 0,045 |
| TSI (%) | 21,2±12,3 | 21,4±12,5 | 20,5±11,4 | 0,460 |
| HbA1c(%) | 6,0±0,9 | 6,1±0,9 | 6,0±0,8 | 0,638 |
| NT-proBNP (pg/ml) | 5.257±16.242 | 5.373±18.408 | 4.891±5.357 | 0,728 |
| Hs-TnT (ng/l) | 351,2±2.898 | 397,2±3.180 | 132,4±502,3 | 0,679 |
| Ecocardiografía | ||||
| FEVI (%) | 27,8±13,1 | 28,7±14,0 | 25,3±9,9 | <0,001 |
| DTDVI (mm) | 62,8±13,1 | 62,0±13,5 | 65,3±11,1 | <0,001 |
| TAPSE (mm) | 13,8±5,8 | 14,0±5,9 | 13,4±5,7 | 0,327 |
| PAPs estimada (mmHg) | 46,7±14,2 | 46,7±14,4 | 46,8±13,6 | 0,914 |
| IMi significativa | 549 (59,0) | 401 (57,3) | 148 (64,1) | 0,069 |
| IT significativa | 434 (47,6) | 322 (47,1) | 112 (48,9) | 0,644 |
| PVC estimada | ||||
| Normal | 293 (39,4) | 234 (41,3) | 59 (33,5) | 0,020 |
| Elevación leve | 245 (33,0) | 188 (33,2) | 57 (32,4) | |
| Elevación intensa | 205 (27,6) | 145 (25,6) | 60 (34,1) | |
| Cateterismo cardiaco derecho | ||||
| PAPs (mmHg) | 44,7±15,8 | 44,3±15,6 | 46,0±16,4 | 0,173 |
| PAPm (mmHg) | 29,2±9,8 | 28,8±9,6 | 30,4±10,2 | 0,037 |
| PAPd (mmHg) | 21,0±7,9 | 20,7±7,7 | 22,0±8,5 | 0,030 |
| PCPE (mmHg) | 20,6±8,1 | 20,4±8,0 | 21,4±8,4 | 0,085 |
| GC (l/min) | 4,1±1,2 | 4,1±1,2 | 4,2±1,5 | 0,399 |
| GTP (mmHg) | 8,6±4,7 | 8,5±4,3 | 9,0±5,6 | 0,190 |
| RVP (UW) | 2,2±1,3 | 2,2±1,3 | 2,3±1,3 | 0,726 |
ALP: fosfatasa alcalina; ALT: alanina aminotransferasa; ARA-II: antagonistas del receptor de la angiotensina II; ARE: antagonistas del receptor de la endotelina; ARM: antagonistas del receptor de mineralocorticoides; AST: aspartato aminotransferasa; DAI: desfibrilador automático implantable; DTDVI: diámetro telediastólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; GC: gasto cardiaco; GTP: gradiente transpulmonar; HbA1c: glucohemoglobina; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; IMi: insuficiencia mitral; INRA: inhibidor de la neprilisina y el receptor de la angiotensina; iPD5: inhibidores de la fosfodiesterasa 5; iSGLT2: inhibidores del cotransportador de sodio-glucosa 2; IT: insuficiencia tricuspídea; NT-proBNP: porción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; PAPd: presión arterial pulmonar diastólica; PAPm: presión arterial pulmonar media; PAPs: presión arterial pulmonar sistólica; PCPE: presión capilar pulmonar enclavada; PVC: presión venosa central; RVM: reparación de la válvula mitral; RVP: resistencia vascular pulmonar; TAPSE: deplazamiento sistólico del anillo tricuspídeo; TnTas: troponina T de alta sensibilidad; TSI: índice de saturación de transferrina; TxC: trasplante cardiaco; VI: ventrículo izquierdo.
Los valores expresan n (%), media ± desviación estándaro mediana [intervalo intercuartílico].
En comparación con el grupo de control, los pacientes que necesitaron tratamiento con levosimendán tenían una mayor frecuencia de ingresos por IC durante el año anterior, una mayor proporción de portadores de desfibrilador automático implantable (el 86,5 frente al 74,2%; p <0,001), TRC (el 31,6 frente al 24,2%; p=0,023), reparación percutánea borde a borde de la válvula mitral (el 6,4 frente al 2,4%; p=0,003) y valores superiores de presión pulmonar media (30,4 frente a 28,8mmHg; p=0,037) y diastólica (22 frente a 20,7mmHg; p=0,030). Entre los pacientes del grupo de control hubo una mayor frecuencia de mujeres (el 29,3 frente al 22,3%; p=0,033), una menor necesidad de tratamiento con diuréticos del asa (el 92,6 frente al 97,0%; p=0,016), un menor uso de bloqueadores beta (el 77,4 frente al 84,9%; p=0,014), una concentración sérica de creatinina más baja (1,25±0,5 frente a 1,39±0,6mg/dl; p=0,001) y un valor superior de la fracción de eyección del ventrículo izquierdo (28,7±14,0 frente a 25,3±9,9%; p <0,001). No se observaron diferencias estadísticamente significativas en cuanto a la edad, la clase funcional o las concentraciones de NT-proBNP.
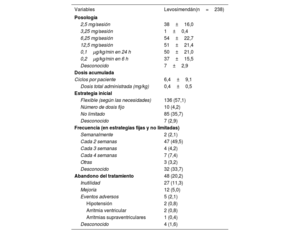
Patrones de infusión del levosimendánEn la tabla 2 se muestran las principales características de los patrones de infusión del levosimendán en los diversos centros. Más de la mitad de los pacientes iniciaron el tratamiento con levosimendán en los primeros 30 días después de la inclusión (mediana, 29 [10-119] días) y un 55,5% ya había recibido levosimendán antes en el contexto de una hospitalización por IC aguda. Se observó una amplia heterogeneidad en los patrones de dosis, pero la prescripción de dosis fijas fue más frecuente que la de dosis ajustadas según el peso. La dosis más frecuente fue de 6,25mg por sesión (n=54, 22,7%) seguida de la de 12,5mg por sesión (n=51, 21,4%) y la de 0,1μg/kg/min en 24h (n=50, 21,0%). Para la mayoría de los pacientes se utilizaron infusiones flexibles según las necesidades clínicas durante el seguimiento (n=136, 57,1%), en vez de pautas de tratamiento estables (fijas o sin limitación). Se utilizaron infusiones bisemanales en un 49,5% de los pacientes con pauta de tratamiento estable.
Patrones de infusión del levosimendán
| Variables | Levosimendán(n=238) |
|---|---|
| Posología | |
| 2,5 mg/sesión | 38±16,0 |
| 3,25 mg/sesión | 1±0,4 |
| 6,25 mg/sesión | 54±22,7 |
| 12,5 mg/sesión | 51±21,4 |
| 0,1μg/kg/min en 24 h | 50±21,0 |
| 0,2μg/kg/min en 6 h | 37±15,5 |
| Desconocido | 7±2,9 |
| Dosis acumulada | |
| Ciclos por paciente | 6,4±9,1 |
| Dosis total administrada (mg/kg) | 0,4±0,5 |
| Estrategia inicial | |
| Flexible (según las necesidades) | 136 (57,1) |
| Número de dosis fijo | 10 (4,2) |
| No limitado | 85 (35,7) |
| Desconocido | 7 (2,9) |
| Frecuencia (en estrategias fijas y no limitadas) | |
| Semanalmente | 2 (2,1) |
| Cada 2 semanas | 47 (49,5) |
| Cada 3 semanas | 4 (4,2) |
| Cada 4 semanas | 7 (7,4) |
| Otras | 3 (3,2) |
| Desconocido | 32 (33,7) |
| Abandono del tratamiento | 48 (20,2) |
| Inutilidad | 27 (11,3) |
| Mejoría | 12 (5,0) |
| Eventos adversos | 5 (2,1) |
| Hipotensión | 2 (0,8) |
| Arritmia ventricular | 2 (0,8) |
| Arritmias supraventriculares | 1 (0,4) |
| Desconocido | 4 (1,6) |
Los valores expresan n (%) o media ± desviación estándar.
Las infusiones de levosimendán fueron bien toleradas, y hubo una proporción baja de pacientes (n=5, 2,1%) que sufrieron eventos adversos que motivaran la interrupción definitiva del tratamiento. Concretamente, 2 pacientes (0,8%) presentaron hipotensión sintomática, 2 (0,8%) tuvieron arritmias ventriculares no mortales y 1 (0,4%), arritmias supraventriculares. Además, 27 pacientes (11,3%) abandonaron el tratamiento con levosimendán debido a falta de respuesta clínica y 12 (5%), como consecuencia de una mejoría clínica significativa. En total, durante el seguimiento se retiró el fármaco al 20,2% de los pacientes. La interrupción del fármaco fue menos frecuente en los pacientes con un patrón de dosis flexible que entre los tratados con otros patrones: 9 (7,1%) frente a 40 (40,2%), principalmente debido a su inutilidad (tabla 4 del material adicional).
SeguimientoEn conjunto, los pacientes estuvieron en lista de espera para TxC durante una mediana de 4,2 [1,4-9,1] meses. Un total de 935 pacientes (92,1%) se sometieron a un TxC durante el seguimiento, 8 (0,8%) estaban en lista de espera en el momento de la última evaluación, 33 (3,3%) fallecieron en lista de espera y se excluyó a 39 (3,8%) debido a la aparición de contraindicaciones (n=22) o una mejoría clínica significativa (n=17). No se perdió el seguimiento de ninguno de los pacientes. Los pacientes tratados con levosimendán permanecieron en lista de espera para TxC significativamente más (mediana, 169 [72-292] frente a 103 [39-241] días; p <0,001).
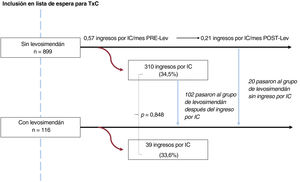
Ingresos por insuficiencia cardiaca, uso de asistencia circulatoria mecánica y supervivencia en lista de esperaEn la figura 2 se presenta un diagrama de flujo de los ingresos por IC según el momento de inicio del tratamiento con levosimendán. La proporción de pacientes que necesitaron hospitalización no mostró diferencias significativas entre los pacientes que iniciaron el tratamiento con levosimendán en los primeros 30 días tras la inclusión y los demás (n=39 [33,6%] frente a n=310 [34,5%]; p=0,848). En este último grupo, casi una tercera parte (n=102; 32,9%) pasó a formar parte del grupo de levosimendán después de un ingreso por IC y la tasa de ingresos por IC se redujo de 0,57 a 0,21 ingresos al mes tras el inicio de la administración de levosimendán. Las tasas totales de ingresos por IC mientras los pacientes estaban en lista de espera fueron similares entre quienes no recibieron levosimendán en ningún momento, los que iniciaron el tratamiento en los primeros 30 días tras la inclusión y los que iniciaron el tratamiento más tarde (0,21, 0,24 y 0,26 respectivamente).
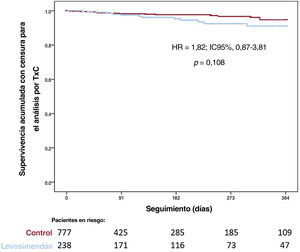
En total, 169 pacientes (16,6%) necesitaron asistencia circulatoria mecánica mientras estaban en lista de espera y 133 (13,1%), asistencia circulatoria mecánica urgente debido a un shock cardiogénico agudo (35 con Centrimag izquierdo, 13 con Centrimag biventricular, 25 con ECMO venoarterial, 30 con balón de contrapulsación intraaórtico y 32 con Impella); en 36 pacientes (3,5%) fueron necesarios dispositivos de asistencia del ventrículo izquierdo (DAVI) de larga duración a causa de un agravamiento de la IC crónica. Necesitaron un TxC urgente 170 pacientes y no se observaron diferencias entre los grupos en cuanto a la proporción de pacientes que precisaron un TxC urgente (el 20 frente al 17,7%; p=0,445). En la figura 3 se muestra la supervivencia a 1 año estando en lista de espera de los pacientes tratados con levosimendán y los del grupo de control. No se observaron diferencias significativas entre los grupos (hazard ratio [HR] = 1,82; IC95%, 0,87-3,81; p=0,108). En el análisis de la supervivencia a 1 año en lista de espera utilizando un emparejamiento por puntuación de propensión, no hubo diferencias entre los grupos (HR = 1,03; IC95%, 0,36-2,97; p=0,958), como se muestra en la figura 4. No se observaron diferencias significativas en la supervivencia a 1 año en lista de espera con los diversos patrones de prescripción (figura 1 del material adicional).
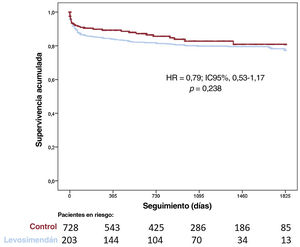
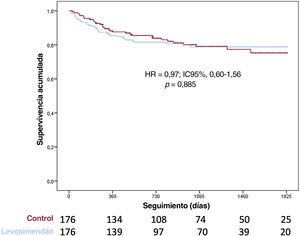
Hubo una proporción significativa de pacientes (n=203; 21,7%) que presentaron un fallo primario del injerto después del TxC y 167 (17,9%) necesitaron asistencia circulatoria mecánica. No se observaron diferencias entre los grupos por lo que respecta al fallo primario del injerto (el 17,1 frente al 23,0%; p=0,068) o el implante de dispositivos de asistencia circulatoria mecánica (el 18 frente al 17,8%; p=0,937). La supervivencia después del TxC fue similar en los diversos grupos (HR = 0,79; IC95%, 0,53-1,17; p=0,238) (figura 5) incluso tras el ajuste con emparejamiento por puntuación de propensión (HR = 0,97; IC95%, 0,60-1,56; p=0,958) (figura 6).
Los principales resultados de nuestro estudio (figura 7), en el que se incluye a la mayoría de los pacientes incluidos en lista de espera para TxC electivo de la mayoría de los centros de España, con un total de más de 1.000 pacientes y 5 años de seguimiento, fueron los siguientes: a) casi una cuarta parte de los pacientes tratados con TxC recibieron infusiones ambulatorias de levosimendán mientras estaban en lista de espera; b) estos pacientes tendían a tener un perfil clínico más desfavorable (ingresos por IC más frecuentes durante el año anterior, menor fracción de eyección del ventrículo izquierdo, presiones pulmonares más altas y peor función renal); c) los patrones de prescripción mostraron amplias diferencias entre los distintos centros, y el patrón más frecuente fue el de dosis fijas en función de las necesidades clínicas; d) el levosimendán parece ser un tratamiento seguro en esa población, de tal manera que se produjeron eventos adversos graves en menos del 1% de los pacientes; e) no hubo diferencias en la supervivencia entre los pacientes tratados con levosimendán y los del grupo de control, antes o después del TxC, tras aplicar un ajuste con emparejamiento por puntuación de propensión, y f) es posible que se reduzcan las hospitalizaciones por IC.
El TxC continúa siendo la mejor alternativa para los pacientes con ICA cuando fallan el tratamiento convencional y el uso de dispositivos5,19,20. Sin embargo, mientras los pacientes están en lista de espera, el riesgo de reingreso por IC y de mortalidad es alto y, más allá del uso de DAVI, las opciones para su tratamiento son limitadas. Entre ellas se encuentran la TRC y la reparación percutánea borde a borde de la válvula mitral, con evidencia que procede en su mayor parte de estudios observacionales21,22. Así pues, dado que no todos los pacientes son candidatos a DAVI o reparación percutánea borde a borde de la válvula mitral, se necesitan alternativas terapéuticas en esta situación. Los fármacos inotrópicos se han utilizado en pacientes con ICA para reducir los síntomas, pero preocupa su seguridad23. Las infusiones ambulatorias de levosimendán han surgido como opción terapéutica en algunos centros, debido a sus posibles ventajas en comparación con los fármacos catecolaminérgicos clásicos. Este tratamiento proporciona un aumento de la contractilidad miocárdica sin incrementar el calcio intracelular, puede usarse en pacientes en tratamiento con bloqueadores beta y, además, reduce las presiones pulmonares. Tiene como característica particular que su acción, que se produce a través del metabolito activo OR-1896, tiene un efecto prolongado que va más allá del momento de la administración y persiste varios días, con lo que se evita la necesidad de infusiones intravenosas continuas que resultan molestas24,25. Con esta modalidad de tratamiento concreta con levosimendán, se han observado posibles beneficios clínicos y hemodinámicos en pacientes con ICA, así como una mejora de los marcadores neurohormonales14–17. Aunque las infusiones ambulatorias de levosimendán en hospitales de día son una pauta de tratamiento que queda fuera de las indicaciones aprobadas, esta modalidad se ha adoptado en muchos programas de IC de algunos países de Europa, incluida España, como medida paliativa para reducir las hospitalizaciones por IC y mejorar la calidad de vida12–15. Sin embargo, hay pocos datos sobre su uso en pacientes en lista de espera como puente al TxC26–28.
En nuestro registro se observó que casi una cuarta parte de los pacientes recibieron este tratamiento mientras estaban en lista de espera. Al parecer, los factores que llevan a los clínicos a iniciar este tratamiento como puente al TxC son un cuadro clínico basal más grave o una hospitalización por IC mientras el paciente estaba en lista de espera. Dada la falta de consenso sobre la mejor pauta de infusión del levosimendán en esta situación, los centros difieren ampliamente en la forma de administrar este tratamiento. Aunque la pauta para la que hay mayor evidencia es la de un número fijo de sesiones con dosis ajustadas según el peso, la prescripción según las necesidades del paciente y en dosis fijas son las modalidades más ampliamente utilizadas en la práctica clínica debido a su simplicidad14,17. Un hallazgo importante de nuestro registro es que, a pesar de la situación de ICA de los pacientes tratados con levosimendán (INTERMACS 3), la seguridad de este fármaco fue notable, de tal manera que tan solo un 0,8% de los pacientes presentaron una arritmia ventricular no mortal durante el empleo de infusiones intermitentes de levosimendán, ya que la mayoría de los pacientes eran portadores de un desfibrilador automático implantable que podía examinarse. Otra ventaja del uso de levosimendán es que su efecto inotrópico no se ve afectado por los bloqueadores beta, lo cual puede tener consecuencias para el pronóstico de los pacientes con IC25,29. En este estudio hubo más pacientes tratados con bloqueadores beta en el grupo de levosimendán (el 84,9 frente al 77,4%; p=0,014).
Aunque los pacientes tratados con levosimendán pasaron 2 meses más en la lista de espera, esto no se reflejó en los eventos clínicos. La mortalidad estando en lista de espera fue baja, tal como se ha descrito en informes previos del Registro Español de Trasplante Cardiaco6,30. Aunque hubo una tendencia a una mayor mortalidad en los pacientes tratados con levosimendán mientras estaban en lista de espera, lo cual puede explicarse también por su peor perfil clínico, no se observaron diferencias entre los grupos a 1 año, a pesar de aplicarse un análisis con emparejamiento por puntuación de propensión. Por lo que respecta a los ingresos por IC, se llevaron a cabo 2 análisis. En primer lugar, se comparó a los pacientes que iniciaron el tratamiento con levosimendán al inicio del estudio (en el primer mes de inclusión en la lista de espera, ya que ello correspondía a más de la mitad de los pacientes con este tratamiento) con los demás pacientes, y no se observaron diferencias en los ingresos por IC. Sin embargo, una observación interesante fue que en este último grupo hubo 102 pacientes que pasaron al grupo de tratamiento con levosimendán después de un ingreso por IC y tan solo 20 iniciaron este tratamiento sin que hubiera habido un ingreso por IC. Por consiguiente, el inicio del tratamiento con levosimendán podría ser un marcador de riesgo, ya que parece que en general lo desencadena un ingreso por IC. En segundo lugar, en el grupo de pacientes a los que no se administró levosimendán durante el primer mes de inclusión en la lista de espera, se analizó la tasa de ingresos por IC de los pacientes que después recibieron infusiones ambulatorias. La tasa de ingresos por IC fue mayor (0,57 al mes) antes del inicio del tratamiento con levosimendán en comparación con lo observado después (0,21 al mes). No hubo diferencias por lo que respecta a la necesidad de asistencia circulatoria mecánica o TxC urgente. Por último, el 92% de los pacientes incluidos en nuestro estudio se sometieron a trasplante, y el empleo de levosimendán mientras estaban en la lista de espera no influyó en su supervivencia antes ni después del TxC.
LimitacionesEn primer lugar, este estudio tiene las limitaciones inherentes a su diseño observacional y a la obtención retrospectiva de los datos relativos al uso del levosimendán. Sin embargo, todos los datos correspondientes a la situación previa al TxC y los resultados posteriores a este se habían recogido en el registro nacional de trasplantes y fueron transferidos directamente a nuestra base de datos. Dado que los pacientes que recibieron levosimendán no estaban en un estado tan grave como el de los pacientes a los que no se administró el fármaco, se llevó a cabo un emparejamiento por puntuación de propensión para comparar la supervivencia de los 2 grupos. Teniendo en cuenta el carácter retrospectivo de nuestros datos, nuestro objetivo no fue comparar los 2 grupos, sino evaluar la seguridad de este tratamiento.
En segundo lugar, cuando se trata a los pacientes con infusiones ambulatorias de levosimendán, es posible que se utilicen también otros tratamientos intravenosos como furosemida o hierro, y no se dispuso de esta información. El seguimiento durante las infusiones tiende a ser más estricto, y ello puede ayudar a detectar descompensaciones de la IC y ajustar mejor los diuréticos y la medicación para la IC.
En tercer lugar, de los pacientes a los que se administró levosimendán, un 55% había recibido una infusión previa durante una hospitalización anterior, y ello podría haber causado una selección de pacientes sin eventos adversos previos.
Por último, las limitaciones inherentes a nuestros datos de registro son la falta de un algoritmo estandarizado respecto a cuándo y cómo iniciar la administración de levosimendán, la heterogeneidad de los patrones de prescripción (sin ningún protocolo del estudio para la administración) y la diversidad de duración de la exposición al levosimendán entre los distintos pacientes.
CONCLUSIONESLas infusiones ambulatorias repetitivas de levosimendán en pacientes que están en lista de espera para TxC electivo constituyen una práctica clínica frecuente, en la que hay heterogeneidad por lo que respecta a los patrones de prescripción. Los pacientes tratados con levosimendán tendieron a tener un perfil clínico más desfavorable y permanecieron más en lista de espera. Los eventos adversos graves fueron muy infrecuentes, no hubo aumento de la mortalidad y es posible que las hospitalizaciones por IC de los pacientes tratados con levosimendán se reduzcan en comparación con los que no reciben este fármaco.
- –
El levosimendán es un fármaco inotrópico que puede reducir los signos y síntomas de la IC.
- –
La prescripción ambulatoria de levosimendán a pacientes con ICA es frecuente en algunos centros, pero hay cierta preocupación respecto al perfil de los pacientes, la seguridad y la eficacia.
- –
Para los pacientes que están en lista de espera para TxC, el levosimendán parece ser seguro, a pesar de que estos pacientes tienden a tener un peor perfil clínico.
- –
Puede considerarse la posibilidad de utilizar levosimendán como opción terapéutica para los pacientes con ICA para fomentar la estabilidad clínica mientras están en lista de espera para TxC.
Este estudio fue iniciado por el investigador y recibió apoyo económico de Orion Pharma para la creación de la base de datos online y la realización del análisis del estudio. El diseño y el análisis de los datos y la redacción de la versión inicial del manuscrito corrieron a cargo de los investigadores de forma independiente.
CONTRIBUCIÓN DE LOS AUTORESJ. de Juan Bagudá y F. de Frutos contribuyeron por igual como primeros autores. Todos los autores participaron en la obtención de datos, el análisis, la redacción del manuscrito y la revisión crítica de este.
CONFLICTO DE INTERESESJ. de Juan Bagudá ha recibido honorarios por conferencias de Orion Pharma. J. Guzman-Bofarull ha recibido apoyo para la asistencia a congresos de Sanofi, Bayer, Bristol, Pfizer, Novartis, Rovi y Boehringer-Ingelheim. C. Mitroi ha recibido honorarios por conferencias de Pfizer, Lilly, Daiichi-Sankyo y Abbott y apoyo para la asistencia a congresos de Pfizer, Rovi, Lilly y Bayer. M.D. García-Cosío Carmena ha recibido honorarios por conferencias de AstraZeneca y Chiesi y apoyo para la asistencia a congresos de Abbot y Rovi. D. Dobarro ha recibido honorarios por conferencias de Orion Pharma, Boehringer-Ingelheim, AstraZeneca y Novartis y ha formado parte de consejos asesores de Orion Pharma, AstraZeneca, Boehringer-Ingelheim y Novartis. F. González-Vílchez ha recibido honorarios por conferencias de Novartis y apoyo para la asistencia a congresos de Pfizer. J. González-Costello ha recibido honorarios por conferencias de Abbott, Orion Pharma, Pfizer, Alnylam, Boehringer-Ingelheim, Zoll, Rovi y AstraZeneca, ha formado parte de consejos asesores de Abbott, Chiesi, Pfizer, Alnylam, Novartis, Bayer y AstraZeneca y ha recibido apoyo para la asistencia a congresos de Abbott, AstraZeneca, Zoll y Alnylam. Los demás autores declaran no tener conflictos de intereses que tengan relación con el contenido de este artículo.