El tratamiento antiagregante plaquetario doble (TAPD), que combina ácido acetilsalicílico y un inhibidor del receptor P2Y12, es la piedra angular de la prevención antitrombótica secundaria para los pacientes que se someten a una intervención coronaria percutánea (ICP) e implante de stent1,2. La introducción de plataformas de stent seguras, junto con una mejor apreciación de los riesgos asociados con el sangrado tras la ICP, ha contribuido a posibilitar un cambio general hacia una menor duración del TAPD y, al mismo tiempo, conllevan una incertidumbre clínica en el contexto de la cardiopatía isquémica estable (CPIE). En el ensayo Dual Antiplatelet Therapy (DAPT), se aleatorizó a 9.961 pacientes sin eventos isquémicos ni hemorrágicos en los primeros 12 meses tras la ICP a un TAPD adicional con ácido acetilsalicílico más clopidogrel o prasugrel durante 18 meses o a ácido acetilsalicílico en monoterapia. La prolongación del TAPD produjo una reducción absoluta del 2,0% en infartos de miocardio (IM) y un aumento absoluto del 0,9% en los eventos de hemorragia moderada o grave (según los criterios del Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries [GUSTO]), con un incremento limítrofe de la mortalidad total3. Numerosos análisis combinados en los que se ha comparado la duración del TAPD corta con otra más larga han confirmado la conclusión clave de ese ensayo: que es innecesario prolongar el TAPD a todos los pacientes y puede asociarse con un mayor efecto nocivo4,5. Es posible que estos resultados reflejen, en parte, el riesgo duradero de mortalidad tras un evento hemorrágico, que parece comparable al de un IM. Otra posibilidad es que los eventos trombóticos se caractericen por una atenuación temporal del riesgo de mortalidad, con lo que se reduciría la necesidad clínica de una inhibición plaquetaria continua. Por consiguiente, las guías vigentes han incorporado estas observaciones en sus recomendaciones, y establecen una duración del TAPD de 6 meses y el uso de escalas de riesgo para informar la decisión clínica de prolongar del TAPD a los pacientes con CPIE1,2. Hasta la fecha, la investigación se ha centrado en mejorar la apreciación del riesgo relacionado con el TAPD, y se han elaborado varias escalas de riesgo como apoyo para los médicos en la toma de decisiones4,6-10. Es de destacar que las escalas TAPD, PRECISE-TAPD y PARIS se elaboraron en cohortes contemporáneas de pacientes tratados con ICP4,8-10. A pesar de la tendencia existente a utilizar un TAPD de menor duración para los pacientes con CPIE, las guías siguen recomendando uniformemente un mínimo de 1 año de TAPD para los pacientes con síndrome coronario agudo (SCA)1,2. Los ensayos que han comparado duraciones cortas del TAPD en el contexto de un SCA indican un efecto nocivo, mientras que siguen sin demostrarse otros enfoques alternativos, como el desescalado. Sin embargo, los pacientes con SCA también tienen riesgo de complicaciones hemorrágicas, por lo que identificar a los pacientes que podrían ser candidatos a un tratamiento farmacológico más breve o menos intenso es una estrategia que parece clínicamente intuitiva. Para abordar estas lagunas en el conocimiento, en un reciente artículo publicado en Revista Española de Cardiología, Raposeiras-Roubín et al.11 exploraron los resultados de las escalas de riesgo de trombosis coronaria y de hemorragia PARIS en el RENAMI (REgistry of New Antiplatelet therapy in patients with acute Myocardial Infarction), en el que se incluyó a una amplia cohorte de pacientes con SCA dados de alta con ácido acetilsalicílico y un inhibidor potente del receptor P2Y12 (ticagrelor o prasugrel). Debe felicitarse a los autores por este análisis, que es el primer intento de evaluar el rendimiento de la escala PARIS en pacientes con SCA tratados exclusivamente con inhibidores potentes del receptor P2Y12. Para situar en el contexto adecuado estos resultados, se debe señalar varias diferencias clave entre la cohorte de creación del PARIS y la cohorte de validación externa. Es de la máxima importancia que el RENAMI esté compuesto en su totalidad por pacientes con SCA (el 58,0% con IAM con elevación del segmento ST), mientras que la mayoría de los participantes en el PARIS tenían síndromes estables6,12. En segundo lugar, las escalas de riesgo PARIS se obtuvieron en una cohorte tratada con clopidogrel, mientras que todos los participantes en el RENAMI tomaron inhibidores potentes del P2Y12. En tercer lugar, mientras que el PARIS es un estudio prospectivo con validación («adjudicación») externa de los resultados, este trabajo es un estudio retrospectivo. Por último, los pacientes tuvieron un seguimiento de 1 año, a diferencia de los 2 años de la cohorte de origen del PARIS. Los autores señalan que la escala PARIS para los eventos trombóticos coronarios tuvo un rendimiento moderado en la discriminación de las tasas de IM o trombosis del stent a 1 año (estadístico C=0,64). En cambio, la discriminación en cuanto a la hemorragia fue relativamente mala (estadístico C=0,54). No obstante, cuando los autores analizaron ambas escalas conjuntamente, se identificó a pacientes con diversos grados de riesgo trombótico y hemorrágico para quienes las decisiones terapéuticas pueden ser individualizadas. Concretamente, de los pacientes considerados en alto riesgo trombótico, solo el 11,3% tenía también alto riesgo hemorrágico. De igual manera, de los pacientes con un riesgo isquémico bajo, se clasificó al 85,5% como en riesgo trombótico también bajo. Los autores llegan a la conclusión de que esta diferenciación puede ser útil en la clínica para personalizar el tratamiento. Por ejemplo, para los pacientes con riesgo hemorrágico alto y riesgo trombótico bajo, una duración corta del TAPD podría aportar beneficio, mientras que puede pensarse lo contrario de los pacientes con riesgo trombótico alto y riesgo hemorrágico bajo.
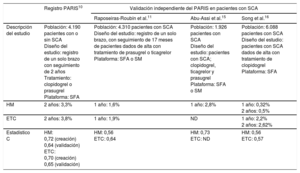
Como ejercicio de validación externa, este estudio es necesario para documentar la utilidad o inutilidad de instrumentos empíricos como las escalas de riesgo PARIS para orientar la toma de decisiones clínicas sobre la duración del TAPD (tabla 1). En este contexto, los resultados aportados por Raposerias-Roubín et al.11 indican que la escala de riesgo trombótico PARIS tiene un rendimiento razonablemente bueno en una población con SCA tratada con ticagrelor o prasugrel. En consecuencia, los factores clave determinantes de la trombosis, como diabetes mellitus, deterioro de la función renal y revascularización previa, parecen coincidir en gran medida entre distintos registros, presentaciones clínicas y tratamientos de base. En cambio, la discriminación en cuanto a la hemorragia no resultó tan útil, con un estadístico C=0,54. Aunque es de prever que el rendimiento de una escala predictiva se reduzca algo al aplicarla a una cohorte externa, hay otros factores que pueden influir. La tasa de hemorragias relativamente baja observada en el RENAMI es algo inesperada, y ello reduce al mínimo su potencial de discriminación. Esta tasa baja plantea dudas acerca de la validez de la adjudicación de eventos hemorrágicos en un registro retrospectivo. En otro estudio con una tasa de hemorragias superior, la escala de riesgo hemorrágico PARIS mostró un estadístico C superior, de 0,73. Además, los factores que tienen un papel importante en el riesgo hemorrágico, como la fragilidad o el cáncer, no se incluyeron en la cohorte del PARIS y podrían conducir también al nivel de rendimiento observado. Por último, el riesgo no es estático, sino que va cambiando y, sin embargo, los constructos predictivos, como las escalas PARIS, se basan en la asignación del riesgo en un momento concreto. Serán necesarios abordajes informáticos más avanzados para emparejar mejor la asignación del riesgo con la exposición longitudinal y los eventos reales.
Validación de las escalas de riesgo PARIS en pacientes con síndrome coronario agudo
| Registro PARIS10 | Validación independiente del PARIS en pacientes con SCA | |||
|---|---|---|---|---|
| Raposeiras-Roubín et al.11 | Abu-Assi et al.15 | Song et al.16 | ||
| Descripción del estudio | Población: 4.190 pacientes con o sin SCA Diseño del estudio: registro de un solo brazo con seguimiento de 2 años Tratamiento: clopidogrel o prasugrel Plataforma: SFA | Población: 4.310 pacientes con SCA Diseño del estudio: registro de un solo brazo, con seguimiento de 17 meses de pacientes dados de alta con tratamiento de prasugrel o ticagrelor Plataforma: SFA o SM | Población: 1.926 pacientes con SCA Diseño del estudio: pacientes con SCA; clopidogrel, ticagrelor y prasugrel Plataforma: SFA o SM | Población: 6.088 pacientes con SCA Diseño del estudio: pacientes con SCA dados de alta con tratamiento de clopidogrel Plataforma: SFA |
| HM | 2 años: 3,3% | 1 año: 1,6% | 1 año: 2,8% | 1 año: 0,32% 2 años: 0,5% |
| ETC | 2 años: 3,8% | 1 año: 1,9% | ND | 1 año: 2,2% 2 años: 2,62% |
| Estadístico C | HM: 0,72 (creación) 0,64 (validación) ETC: 0,70 (creación) 0,65 (validación) | HM: 0,56 ETC: 0,64 | HM: 0,73 ETC: ND | HM: 0,56 ETC: 0,57 |
ETC: eventos trombóticos coronarios; HM: hemorragia mayor; ND: no disponible; SCA: síndrome coronario agudo; SFA: stents farmacoactivos; SM: stents metálicos.
Desde una perspectiva clínica, estos resultados introducen el concepto de posible personalización del tratamiento para los pacientes con SCA, una idea que continúa siendo algo discordante respecto a las guías de práctica clínica actuales, que recomiendan como mínimo 1 año de TAPD para esos pacientes. Sin embargo, hay una base de evidencia creciente que parece poner en duda esta convención y podría acabar influyendo en la práctica clínica. Hasta la fecha hay 1 ensayo clínico aleatorizado que ha comparado una duración corta del TAPD con otra larga en una cohorte de pacientes con SCA, y ha demostrado un mayor riesgo de trombosis coronaria con la duración corta (ensayo SMART-DATE)13. En cambio, en el ensayo GLOBAL-LEADERS, se observó que la monoterapia antiplaquetaria con ticagrelor se asociaba con un riesgo de muerte o IM similar al de una pauta de TAPD convencional en pacientes con SCA14. Otros estudios indican que reducir la intensidad de la inhibición plaquetaria al pasar a clopidogrel en vez de suspender el TAPD o el desescalado pueden ser también comparables a las pautas de TAPD convencionales que incluyen prasugrel o ticagrelor. Por último, el ensayo SHORT-DAPT actualmente en marcha (NCT03218787), que incluye a pacientes con alto riesgo hemorrágico con y sin SCA, evaluará la seguridad de un TAPD de 3 meses seguido de ácido acetilsalicílico en monoterapia.
En conjunto, parece que la tendencia inicial a una menor duración del TAPD se está ampliando también a los pacientes con SCA, aunque de manera más matizada y gradual. Dado el grado de riesgo trombótico que persiste tras un infarto agudo de miocardio, será necesario caracterizar adecuadamente los riesgos trombótico y hemorrágico de un modo fiable y exacto para informar las decisiones clínicas relativas a la duración o la intensidad de la inhibición plaquetaria en esos pacientes. Validar los instrumentos existentes en cohortes de SCA como han hecho Raposeiras-Roubín et al.11 es un paso importante en esta dirección. En última instancia, los estudios aleatorizados que incorporan esos instrumentos para orientar las decisiones, como se está haciendo en el ensayo aleatorizado MASTER DAPT, actualmente en marcha (NCT03023020), serán la mejor forma de decidir la utilidad de un enfoque personalizado del TAPD para los pacientes con SCA de alto riesgo.
CONFLICTO DE INTERESESR. Mehran declara pagos personales de Abbott Laboratories, Abiomed, Boston Scientific, CardioKinetix, Cardiovascular Systems Inc., Medscape, Siemens Medical Solutions, Spectranetics, The Medicines Company, Roivant Sciences Inc., Volcano Corporation, AstraZeneca, Bayer, Beth Israel Deaconess, BMS, CSL Behring, Eli Lilly/DSI, Medtronic, Novartis Pharmaceuticals y OrbusNeich. R. Mehran declara también otras relaciones con Claret Medical, Elixir Medical, Janssen Pharmaceuticals, Osprey Medical, Bristol-Meyers-Squibb y Watermark Research Partners sin relación con el trabajo presentado. U. Baber y S. Sorrentino no tienen conflictos de intereses.