Se han usado varios biomarcadores para la evaluación y la cuantificación de la lesión miocárdica tras ablación. Estudiamos las posibles diferencias en la estabilidad térmica y las posibilidades de uso de las proteínas liberadas por las células cardiacas lesionadas mediante diferentes fuentes de energía.
MétodosEn primer lugar, estudiamos la estabilidad térmica in vitro de la creatincinasa (CK), la isoenzima miocárdica de la creatincinasa (CK-MB), las troponinas I (cTnI) y las troponinas T (cTnT) en muestras de sangre obtenidas de 15 pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) confirmado. En segundo lugar, se obtuvieron y se analizaron los biomarcadores en 82 pacientes tratados mediante ablación con radiofrecuencia (ARF) y en 79 pacientes tratados mediante crioablación con balón (CAB).
ResultadosLos experimentos in vitro mostraron que todos los biomarcadores eran estables a temperaturas bajas (–30°C). Las troponinas se mostraron estables al analizarlas a altas temperaturas. En cambio, se observó un descenso importante en los valores de CK y CK-MB a 50 y 40°C, respectivamente. El estudio in vivo mostró que el aumento de las cifras de CK-MB fue significativamente elevado en pacientes sometidos a CAB exclusivamente. Se observaron valores patológicos de CK-MB en el 24% de los pacientes con ARF y en el 98% de los pacientes sometidos a CAB. Se observaron valores patológicos de cTnI en todos los pacientes y el aumento de la concentración de cTnI fue muy significativo en ambos grupos tras la ablación.
ConclusionesTanto los resultados in vitro como los obtenidos in vivo muestran que la CK-MB no puede usarse para la determinación cuantitativa de las lesiones miocárdicas producidas por la energía de radiofrecuencia. Sólo las troponinas reflejan las lesiones miocárdicas independientemente de la fuente de energía, y se debería utilizarlas para comparar los efectos en los biomarcadores de la crioablación frente a la ablación con radiofrecuencia.
Palabras clave
La corriente de radiofrecuencia (RF) se usa como fuente habitual de energía para llevar a cabo el aislamiento de venas pulmonares (AVP) por vía percutánea en una gran mayoría de los pacientes con fibrilación auricular (FA). Durante los últimos años también se ha recurrido a la técnica con criobalón como nueva modalidad para llevar a cabo el AVP1,2,3. Puesto que varios marcadores se han demostrado útiles para el diagnóstico y la evaluación de la magnitud de la lesión miocárdica tras un episodio isquémico grave, muchos autores han tratado de implementar diferentes biomarcadores para poder evaluar y cuantificar la magnitud de las lesiones por ablación4,5,6,7,8,9,10,11,12.
La ablación tisular produce una necrosis miocárdica inmediata, y el proceso habitualmente es más lento en los episodios isquémicos. En consecuencia, la liberación de marcadores de lesiones miocárdicas tiene lugar antes5,6. Un problema adicional que aparece al analizar la liberación de biomarcadores tras la lesión derivada de la ablación es la influencia de las temperaturas bajas o altas en su estabilidad. Aún no hay consenso sobre si lograr una temperatura efectiva intratisular de 42°C durante la ablación puede conducir o no a la desnaturalización de la estructura de los biomarcadores13. En tal caso, los resultados sobre la actividad y la concentración de los biomarcadores no tendrían ninguna fiabilidad. Sólo un artículo14, publicado en 1995, describe la inactivación de la creatincinasa (CK) a 65°C.
Los estudios, tanto antiguos como publicados recientemente, usaron la CK, la isoenzima miocárdica de la creatincinasa (CK-MB) y la troponina I cardiaca (cTnI) y la troponina T (cTnT) para evaluar la lesión en el miocardio tras la ablación4,5,6,7,8,9,10,11,12. Algunos resultados arrojaron dudas sobre la fiabilidad de las determinaciones que mostraron erróneamente pequeños aumentos de la CK y la CK-MB tras la ablación efectiva con radiofrecuencia (ARF). Por lo tanto, sometimos a examen la hipótesis sobre las posibles diferencias en la estabilidad térmica de las proteínas liberadas por las células cardiacas tras ser lesionadas mediante diferentes fuentes de energía. Además, los estudios publicados que describen la estabilidad in vitro de los biomarcadores a diferentes temperaturas son escasos15,16. Si conociéramos la influencia de las diferentes temperaturas en los valores de los biomarcadores, podríamos comprender mejor el grado de éxito o fracaso de la ablación en determinados pacientes.
El primer paso del estudio consistió en ensayar, en un experimento conjunto in vitro, la estabilidad térmica de los biomarcadores cardiacos estudiados. El segundo objetivo fue clarificar qué biomarcadores podían utilizarse en la evaluación, la cuantificación y la comparación de las lesiones producidas por diferentes fuentes de energía. Llevamos a cabo la determinación de la concentración sérica de biomarcadores cardioespecíficos, antes y después de la ablación, como indicadores de la masa celular lesionada.
MétodosEstudio in vitro de la estabilidad térmica y de la resistencia térmica de los biomarcadores cardiacosObtuvimos muestras de sangre de 10 ml de 15 pacientes que habían sufrido infarto agudo de miocardio con elevación del segmento ST (IAMCEST) confirmado. La mediana de tiempo hasta el episodio índice de IAMCEST fue de 13,7 h.
Tras centrifugar durante 15 min a 3.000rpm, se recogió el suero sobrenadante y se determinó la actividad de la CK y la CK-MB y la concentración sérica de cTnI y cTnT a 37°C durante 1 h. Este valor se definió como valor basal. Cada paciente fue su propio control.
Las muestras de suero restantes se almacenaron a –30°C durante las 2 semanas siguientes. Transcurrido ese tiempo, las muestras se descongelaron y se analizaron de nuevo a 37°C para estudiar la influencia de la congelación. Otras 5 muestras de cada paciente se incubaron por separado en una cubeta térmica a 40, 45, 50, 55 y 60°C durante 5 min cada una. Posteriormente se determinó la concentración final a 37°C.
Utilizamos kits de laboratorio convencionales: CL NAC, CKMBL, Troponin T (Roche®) y STAT Troponin I (Abott®). La reproducibilidad de las concentraciones en todos los biomarcadores estudiados, obtenida mediante triplicados de las muestras, fue de ±10%. La calidad de los resultados se confirmó en el laboratorio de bioquímica central de nuestro centro de cardiología mediante control de calidad transcurridos 6 meses.
Estudio in vivoLa población del estudio consistió en 161 pacientes consecutivos con FA sintomática y resistente a fármacos, documentada al menos en dos electrocardiogramas en los 3 meses previos a la intervención de ablación. La indicación de la ablación se basó en las directrices vigentes17. Se excluyó del estudio a los pacientes con concentraciones iniciales desconocidas o elevadas de cualquiera de los marcadores estudiados (cTnI, CK-MB) en el periodo basal.
Los riesgos derivados de la intervención se explicaron con detalle a todos los pacientes y se obtuvo su consentimiento informado por escrito antes de la ablación. El estudio contó con la aprobación del comité ético local. Las características generales de la población de estudio se muestran en la Tabla 1.
Tabla 1. Características de los pacientes *
| Grupo RF | Grupo CAB | p | |||||
| Mediana | 25 | 75 | Mediana | 25 | 75 | ||
| Pacientes | 82 | x | x | 79 | X | X | NS |
| FAP | 48 | x | x | 76 | x | x | <0,001 |
| Varones | 61 | x | x | 49 | x | x | NS |
| Edad [años] | 57 | 49 | 65 | 56 | 49 | 63 | NS |
| Eje largo de la ETT [mm] | 56 | 51 | 61 | 53 | 48 | 56 | 0.002 |
| Eje corto de la ETT [mm] | 40 | 37 | 42 | 38 | 35 | 41 | 0.01 |
| FEVI por ETT (%) | 60 | 55 | 62 | 60 | 58 | 65 | 0.004 |
| Hipertensión | 53 | x | x | 42 | x | x | NS |
| Coronariopatía | 10 | x | x | 7 | x | x | NS |
| IMC | 27 | 25 | 29 | 26 | 23 | 28 | NS |
| Otras enfermedades cardíacas | 9 | x | x | 5 | x | x | NS |
AFP: pacientes con fibrilación auricular paroxística; ETT: ecocardiografía transtorácica; FEVI: fracción de eyección ventricular izquierda; IMC: índice de masa corporal; NS: estadísticamente no significativo; RF: radiofrecuencia.
* Los datos expresan n o mediana [intervalo intercuartílico].
Alcanzamos la aurícula izquierda mediante abordaje transeptal doble y realizamos una angiografía selectiva de las venas pulmonares (VP). La ARF se realizó con un catéter Thermo-cool 7F irrigado de 4 mm (Biosense Webster, Diamond Bar, Estados Unidos). El criterio de valoración de la ablación fue la desaparición total de potenciales de VP. Usamos un catéter MESH (catéter de cartografía de malla de alta densidad; Bard Electrophysiology, Lowell, Massachusetts, Estados Unidos) colocado en el ostium de cada VP. En los pacientes con FA crónica (FAC) se provocaron lesiones adicionales (línea del techo, línea del istmo mitral). La crioablación con balón (CAB) se realizó con un balón de doble pared (Arctic Front, Cryocath). El tiempo de aplicación fue de 240-360 s por congelación. El AVP se confirmó con un catéter Lasso (Biosense Webster). El procedimiento se ha descrito recientemente con detalle3. También se calculó y se registró el número de aplicaciones, la energía de RF y el tiempo de congelación acumulados.
Determinación de biomarcadores en pacientes sometidos a ablación con radiofrecuencia y a crioablación con balónSe obtuvieron muestras de sangre durante la punción venosa antes de la ablación y 1, 6 y 24 h después de la ablación. Todas las muestras de sangre se analizaron mediante los kits de laboratorio convencionales ya mencionados. Los valores de referencia de la CK-MB y la cTnI para el diagnóstico de infarto de miocardio (25 y 0,01 ng/ml respectivamente) se consideraron como patológicamente aumentados.
Análisis estadísticoLos datos paramétricos se expresaron como mediana [intervalo intercuartílico 25-75]. Para el análisis paramétrico se utilizó el test de la U de Mann-Whitney y para los datos no paramétricos, la prueba de la χ2 o el test exacto de Fisher. Los valores de p<0,05 se consideraron como estadísticamente significativos.
ResultadosEstabilidad in vitro de los biomarcadores a diferentes temperaturasEncontramos un descenso importante del 46% en la actividad de la CK medida a 50°C. El calentamiento de las muestras de sangre a 50 y 60°C dio lugar a una caída de las concentraciones de CK muy por debajo de los valores basales. La CK-MB, con mayor especificidad cardiaca, reacciona en mayor medida a la exposición al calor, con un importante descenso del 48% a 40°C (Figura 1A) y otro descenso a temperaturas superiores. Ambas troponinas (cTnT y cTnI) sólo mostraron pequeños cambios de ±10% a diferentes temperaturas (Figura 1B y C). La dispersión de los datos en porcentajes de medianas, para expresar la estabilidad de los biomarcadores expuestos a diferentes temperaturas, osciló entre el 8 y el –12%.
Figura 1. Estudio in vitro. A) Estabilidad térmica de la isoenzima miocárdica de la creatincinasa (CK-MB). B) Troponina cardiaca T (cTnT). C) Troponina cardiaca I (cTnI). Los datos se presentan como diagramas de cajas con la mediana [intervalo intercuartílico].
Estudio in vivoLas características de los pacientes se presentan en la Tabla 1. La ARF se practicó en 82 pacientes: 48 con FA paroxística (FAP) y 34 con FAP persistente o FAC.
El grupo de CAB consistió en 79 pacientes e incluyó sólo a 3 pacientes con FAC. Las diferencias significativas en cuanto al tamaño de la aurícula izquierda (AI) y en la fracción de eyección del ventrículo izquierdo (FEVI) entre los grupos se dieron, como era de esperar, en el mayor número de pacientes con CAF en el grupo tratado con ARF.
Ninguno de los pacientes refirió síntomas de posible isquemia ni presentó signos de episodios de isquemia coronaria, ni antes ni al final del procedimiento. No encontramos ningún cambio en el segmento ST al comparar las curvas electrocardiográficas obtenidas antes, durante y después del procedimiento.
En el caso de la CK-MB, no se produjo aumento significativo tras la ablación respecto a los valores basales en el grupo de ablación con RF (Figura 2). Sólo la mediana de las muestras obtenidas a la sexta hora se encontró en el límite de la significación (p=0,05). Ahora bien, el aumento de la CK-MB tras la CAB resultó altamente significativo en los controles. El factor de comparación de los valores máximos (picos) fue 2,6 veces superior en el grupo de la CAB (p<0,05). Se observaron valores patológicos de CK-MB en el 24% de los pacientes sometidos a ARF y en el 98% de los pacientes sometidos a CAB.
Figura 2. Comparación de la cinética de la isoenzima miocárdica de la creatincinasa (CK-MB) en los grupos con radiofrecuencia (ARF) y con crioablación con balón (CAB). Los datos se presentan como diagramas de cajas con la mediana [intervalo intercuartílico]. IAM: nuestro valor de laboratorio de referencia de la CK-MB (25 ng/ml) para la detección del infarto de miocardio. aDiferencia estadísticamente no significativa (p=0,5) en comparación con la determinación del valor basal. bDiferencia estadísticamente significativa (p=0,005) en comparación con la determinación del valor basal. cDiferencia estadísticamente significativa (p<0,0001) en comparación con la determinación del valor basal.
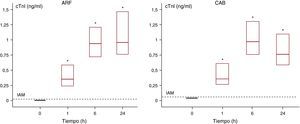
El aumento de la cTnI fue altamente significativo en ambos grupos tras la ablación (Figura 3). La mediana de los valores máximos en el grupo sometido a RF fue de 1,29 [0,86-1,86] ng/ml y fue 1,4 veces el valor correspondiente del grupo sometido a CAB, 0,89 [0,62-1,25] ng/ml. La diferencia no mostró significación estadística (p=0,05). Se observaron valores patológicos de cTnI en todos los pacientes.
Figura 3. Comparación de la cinética de la troponina I cardiaca (cTnI) en los grupos con radiofrecuencia (ARF) y con crioablación con balón (CAB). Los datos se presentan como diagramas de cajas con la mediana [intervalo intercuartílico]. *Diferencia estadísticamente significativa (p<0,0001) en comparación con la determinación del valor basal.
A 19 pacientes sometidos a RF y 8 sometidos a CAB, se les aplicó una cardioversión con corriente continua (CC). Al analizar los valores de la CK, que hipotéticamente podrían estar afectados por la CC, no encontramos diferencias estadísticamente significativas entre los sujetos que requirieron CC para restaurar el ritmo sinusal ni en el resto de la población estudiada.
DiscusiónEl resultado principal de nuestro estudio es que se observaron valores patológicos de la cTnI en todos los pacientes, independientemente de la fuente de energía usada, y se observaron valores patológicos de la CK-MB en el 24 y el 98% de los pacientes sometidos a ARF y a CAB, respectivamente.
Desnaturalización de los biomarcadores cardiacos por la temperaturaLa determinación in vitro que llevamos a cabo pretendía evaluar las resistencias térmicas y la estabilidad de los biomarcadores cardiacos. Observamos las diferentes sensibilidades a la temperatura de los biomarcadores estudiados. Tanto la cTnI como la cTnT fueron estables a todas las temperaturas estudiadas.
La actividad detectada de CK-MB y CK cayó repentinamente a casi el 50% respecto a sus valores basales a 40 y 50°C, respectivamente. Nuestras observaciones clínicas son afines a nuestro experimento de calentamiento in vitro. El proceso de desnaturalización de la CK-MB liberada se inicia a las mismas temperaturas a las que se produce el daño celular en la ARF eficaz13. La pérdida de concentraciones detectables de CK se inicia a mayores temperaturas. La caída de sensibilidad también comienza en la gama de temperaturas deseadas para una temperatura intratisular que se sitúe entre 45 y 60°C durante la ARF.
La temperatura inferior en nuestro estudio in vitro fue de –30°C, que fue aún mayor que las temperaturas determinada durante la CAB eficaz (habitualmente<–40°C). Ahora bien, esta temperatura es suficientemente baja para suponer la muerte celular, con rotura de las membranas celulares, debido a la formación de cristales de hielo que comienza mucho antes, a –10°C18. No encontramos ninguna influencia importante de la baja temperatura en la actividad detectable de los cuatro biomarcadores estudiados. Nuestras observaciones son similares a las descritas por Buttery et al15, que confirmaron la estabilidad de la CK-MB a –20°C, y Woltersdorf et al16, que describieron la ausencia de cambios significativos en la concentración sérica de las troponinas y de actividad de la CK. Sorprendentemente, la concentración de CK-MB aumentó significativamente en las muestras congeladas, pero la temperatura de almacenamiento (–70°C) fue la mitad que en nuestro estudio in vitro o incluso más baja.
Determinación de biomarcadores en pacientes sometidos a ablación con radiofrecuenciaNuestras observaciones son similares a las descritas por otros autores4,5,6,7,8. Hirose encontró sólo una correlación significativa para la cTnT en relación con la cantidad acumulada de energía RF aplicada, pero el estudio se limitó a cuatro tipos de arritmias diferentes con muy diverso número de aplicaciones necesarias para la ablación en estos 34 pacientes4. Otros autores6 también comunicaron una precisión diagnóstica de la cTnI superior a la de CK-MB en grupos no homogéneos de pacientes tras la ARF5,6,7. En una gran cohorte de 118 pacientes con seis tipos diferentes de arritmias, sólo se encontró una correlación importante respecto a los cambios de concentración de la cTnI8. El valor basal medio de la actividad de la CK-MB fue extremadamente bajo (0,6 U/l), en comparación con nuestro estudio y con otros5,6,11. Además, presumía que una desactivación térmica parcial de la actividad de la CK y la desnaturalización de la CK-MB eran razones que explicaban la falta de correlación para la aplicación de energía de RF. Su suposición8 de la dependencia térmica debida a cambios estructurales de la CK se basaba, al igual que en el caso de otros autores4,5,6,7,9,10,11,12, en el estudio de Haines et al14. Ese es el único artículo en la literatura que describe la inactivación térmica de la CK en biopsias de corazones de perro tras ablaciones con energía de RF o tras el calentamiento directo de las muestras de tejido. Como temperatura crítica midió 65°C, que parece demasiado elevada en comparación con nuestros resultados in vitro. Tampoco se midió la temperatura intratisular.
Algunos estudios han mostrado un aumento significativo de la concentración de CK-MB tras la ARF9,10,11. Aunque esto parece estar en contradicción con nuestros resultados, este fenómeno puede explicarse por las bajas temperaturas intratisulares efectivas (40-45°C) alcanzadas durante la ablación en diferentes partes del corazón, especialmente en la región del nodo auriculoventricular. Es conocida la existencia de un gradiente intramural negativo de temperatura a partir del subendocardio. Hay alguna probabilidad de que, en algunas de sus aplicaciones de RF, no se alcanzara la temperatura crítica para la inactivación de la CK en la masa del miocardio afectado.
Determinación de biomarcadores en pacientes sometidos a crioablación con balónUn único artículo que describía los biomarcadores de daño miocárdico tras la crioablación demostró valores máximos significativamente superiores tanto de la CK-MB como de la cTnT a las 6 h de la ablación12. Los resultados concuerdan con nuestras observaciones. Aunque nosotros medimos la cTnI y no la cTnT, también observamos valores superiores de la cTnI en la muestra obtenida a las 6 h en los pacientes sometidos a CAB. Los autores argumentaron que los valores superiores de la CK-MB en el grupo de crioablación reflejan la formación de lesiones diferentes y el uso de introductores mayores (de 10 Fr) en el grupo de la crioablación produjo valores más elevados12. Teniendo presentes nuestros resultados in vitro, nos atrevemos a afirmar que fue más bien consecuencia de la inestabilidad térmica de los biomarcadores en un entorno de RF.
LimitacionesEl mayor número de pacientes con FAC en el grupo sometido a ARF que en el grupo sometido a CAB posiblemente sesgue los resultados a favor del grupo de RF al comparar la cTnI en ambos grupos. No podemos comentar la cinética detallada de los biomarcadores, ya que no se obtuvieron muestras de sangre entre las horas 6 y 24. No podemos olvidar que alcanzar temperaturas de –70°C e inferiores puede producir un aumento de la concentración medida de CK-MB. Por otro lado, la temperatura mediana más baja observada durante la CAB en la población del estudio rondaba los –40°C.
ConclusionesTanto los resultados in vitro como los obtenidos in vivo muestran que la CK-MB no puede usarse para la determinación cuantitativa de la lesión miocárdica producida por la energía de RF. Sólo las troponinas reflejan la lesión miocárdica independientemente de la fuente de energía y se podrá considerarlas en estudios futuros para comparar los efectos en los biomarcadores de la crioablación frente a la ablación con RF.
Conflicto de interesesMaciej Wojcik recibió una beca de la European Heart Rhythm Association (Asociación Europea del Ritmo Cardiaco) (2 años de residencia en electrofisiología clínica). Sebastien Janin recibió una beca de la Fédération Française de Cardiologie (Federación Francesa de Cardiología.
Recibido 7 Febrero 2010
Aceptado 25 Agosto 2010
Autor para correspondencia: Department of Cardiology, Medical University of Lublin. SPSK Nr 4, ul.Jaczewskiego 8, Lublin, Polonia. m.wojcik@am.lublin.pl