El coactivador 1α del receptor activado gamma del proliferador de peroxisoma (PGC-1α) es un regulador metabólico que se induce durante la isquemia y previene el remodelado cardiaco en modelos animales. Su actividad puede estimarse en pacientes con infarto agudo de miocardio con elevación del segmento ST. Nuestro objetivo es evaluar el valor predictivo de los niveles en sangre de PGC-1α en la extensión del área necrótica y el remodelado ventricular tras infarto.
MétodosEstudio prospectivo de 31 pacientes con primer infarto de miocardio de localización anterior y reperfusión exitosa. Se determinó la expresión de PGC-1α en sangre periférica al ingreso y a las 72h, evaluando su correlación con el daño miocárdico y el volumen ventricular y la función sistólica a los 6 meses. El edema y la necrosis miocárdica se estimaron mediante resonancia magnética cardiaca durante la primera semana. A los 6 meses, una resonancia de control evaluó tamaño del infarto y remodelado ventricular, definido como el incremento > 10% del volumen telediastólico del ventrículo izquierdo. Se definió miocardio salvado como la diferencia entre las áreas de edema y de necrosis.
ResultadosSe observó más miocardio salvado en los pacientes con expresión de PGC-1α detectable al ingreso (el 18,3%±5,3% frente al 4,5%±3,9%; p=0,04). La inducción de PGC-1α a las 72h se correlacionó con mayor remodelado ventricular (variación del volumen telediastólico del ventrículo izquierdo a los 6 meses, el 29,7%±11,2% frente al 1,2%±5,8%; p=0,04).
ConclusionesEl grado de expresión basal de PGC–1α y una respuesta atenuada del sistema tras infarto agudo de miocardio se asocian con más miocardio salvado y predicen menos remodelado ventricular.
Palabras clave
El infarto agudo de miocardio con elevación del segmento ST (IAMCEST) es una de las principales causas de muerte por enfermedad cardiovascular1. En los últimos años, el progreso en estrategias de reperfusión que reducen el tiempo de isquemia ha permitido una mejora en la supervivencia y la calidad de vida de los pacientes con IAMCEST. A pesar de ello, actualmente muchos pacientes todavía sufren necrosis miocárdicas extensas que condicionan su evolución clínica2. Numerosos estudios han demostrado que parte de la muerte celular miocárdica que ocurre en este contexto se precipita durante la fase de restauración del flujo coronario, en un fenómeno conocido como lesión por reperfusión3.
La investigación en terapias de cardioprotección contra el daño por isquemia-reperfusión (IR) supone, por lo tanto, la oportunidad de reducir el grado de necrosis celular y, en consecuencia, mejorar el pronóstico de estos pacientes. Sin embargo, actualmente muchos aspectos de la lesión por IR permanecen inciertos4–6. Diversos estudios han evaluado el efecto de mecanismos de defensa contra el estrés oxidativo, como el uso de antioxidantes7 o la regulación de enzimas mitocondriales8, en modelos de infarto de miocardio. No obstante, la existencia de un mecanismo coordinado que regule el sistema de protección mitocondrial en tejidos celulares con altas tasas metabólicas como el cardiaco está por dilucidar.
El coactivador 1α del receptor activado gamma del proliferador de peroxisoma (PGC-1α) es un coactivador transcripcional que actúa como regulador maestro de los genes implicados en el metabolismo oxidativo y la biogénesis mitocondrial y tiene un papel fundamental en el control metabólico del músculo cardiaco y la diferenciación madurativa de los miocardiocitos9.
En modelos animales de isquemia cardiaca, se ha observado la reducción en la expresión miocárdica de PGC-1α tras ligadura de la arteria coronaria10 y que el uso de fármacos agonistas de los receptores activados del proliferador peroxisómico (PPAR)11, que mantienen su expresión, es capaz de reducir el tamaño del infarto y la apoptosis celular miocárdica y preservar en mayor grado la función ventricular.
La homeostasis mitocondrial es clave en la tolerancia miocárdica a situaciones de isquemia y estrés oxidativo. Por un lado, se ha demostrado que la deleción genética de PGC-1α causa incapacidad del miocardio para adaptarse a estímulos de sobrecarga12 y, por el contrario, la sobrexpresión de PGC-1α ocasiona un aumento desmesurado del número de mitocondrias que altera la estructura sarcomérica de los miocardiocitos y produce disfunción contráctil13. Por lo tanto, la inducción de PGC-1α como respuesta al daño celular por estrés oxidativo debe ser transitoria y proporcionada14.
Según esta evidencia, la monitorización de la concentración de PGC-1α tras un IAMCEST puede ser útil en la evaluación de la recuperación miocárdica, de manera que el análisis tanto de los valores basales de la molécula como de su inducción posthipóxica permitiría estimar la tolerancia de las células cardiacas a la isquemia.
Nuestro grupo ha descrito recientemente la posibilidad de detectar inducción de PGC-1α en pacientes con IAMCEST por su grado de expresión en linfocitos procedentes de muestras de sangre periférica15. Los pacientes con mayor inducción de PGC-1α tuvieron en la evolución infartos más extensos y más frecuencia de disfunción ventricular izquierda. Esta respuesta deletérea podría explicarse en parte por la sobrexpresión de adenine nucleotide translocase 1 (ANT-1) mediada por PGC-1α, componente del complejo de transición de permeabilidad mitocondrial (mtPTP) que regula la apoptosis celular miocárdica en situaciones de isquemia16.
Con la finalidad de caracterizar el grado de expresión de PGC-1α en respuesta al estrés oxidativo miocárdico desencadenado por IR, nos planteamos como objetivo evaluar si los valores basales de la molécula y su inducción tras el IAMCEST se relacionaban con la extensión de la necrosis, el área miocárdica en riesgo y la función ventricular, con objeto de definir un perfil de activación cardioprotector.
MÉTODOSMuestraSe incluyó prospectivamente a 31 pacientes atendidos en nuestro centro hospitalario con diagnóstico de IAMCEST de localización anterior y sometidos a estrategia de reperfusión en el periodo comprendido entre junio de 2009 y mayo de 2011. Los criterios de inclusión fueron: primer episodio de IAMCEST, localización anterior del infarto con lesión causal en segmento proximal o medio de la arteria coronaria descendente anterior y terapia de reperfusión mediante angioplastia primaria o de rescate. Siguiendo las guías de práctica clínica de la Sociedad Europea de Cardiología17, se estableció el diagnóstico de IAMCEST en los pacientes con síntomas isquémicos, elevación persistente del segmento ST en el electrocardiograma y elevación típica de biomarcadores de necrosis miocárdica. Inicialmente los pacientes fueron informados verbalmente de su participación en el estudio, y luego firmaron el correspondiente consentimiento informado, aprobado por el Comité Ético de Investigación Clínica del hospital.
Los criterios de exclusión y los datos recogidos durante el estudio se detallan en el .
Estudios de resonancia cardiacaSe realizaron dos estudios de resonancia magnética cardiaca durante el seguimiento. Una primera exploración entre el tercer y el quinto día tras el infarto, con el fin de evaluar el porcentaje de miocardio salvado (MS), definido por la diferencia entre el edema miocárdico en fase aguda del infarto y la necrosis cardiaca estimada por el área de realce tardío de gadolinio, y un estudio de control a los 6 meses para evaluar la cicatriz ya establecida. Asimismo, el análisis comparativo entre el área de edema miocárdico en la exploración inicial y el área de necrosis a los 6 meses permitió estimar el MS en la evolución a largo plazo (figura 1).
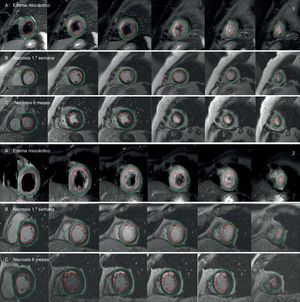
Comparación de estudios de resonancia magnética cardiaca entre dos pacientes paradigmáticos según la inducción de PGC-1α tras infarto de miocardio (1: paciente con inducción; 2: paciente sin inducción): área en riesgo estimada por edema miocárdico en secuencias T2-weighted Short Tau Inversion Recovery (T2-STIR) (A), y área de necrosis estimada por realce tardío de gadolinio durante la primera semana (B) y a los 6 meses (C). Las áreas de necrosis y edema (líneas de color granate) se calcularon con respecto a la masa miocárdica total, trazando manualmente los contornos epicárdico (línea verde) y endocárdico (línea roja). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La metodología de las exploraciones de resonancia magnética cardiaca se detalla en el .
Preparación de las muestras de sangre periférica y análisis de biología molecularSe obtuvieron 6ml de sangre periférica mediante tubos Vacutainer™ con EDTA al ingreso y a las 72h. Se aislaron células mononucleares por centrifugación en gradiente de densidad mediante técnica de Ficoll-Hypaque (Ficoll-Paque™, Miltenyi Biotec). Se determinó mediante reacción en cadena de la polimerasa (PCR) cuantitativa de ADNc retrotranscrito (qRT-PCR) la expresión relativa de ARN de PGC-1α y sus dianas génicas citocromo C, manganeso superóxido dismutasa (MnSOD), glutatión peroxidasa (GPx) y ANT-1, utilizando sondas específicas18.
Los detalles de la extracción de ARN y el análisis de proteínas se detallan en el .
Para el análisis de resultados, se dividió la muestra en dos grupos: por un lado, según la expresión basal de PGC-1α al ingreso, si esta era detectable en sangre periférica en la primera determinación o no, y por otro lado, en función de la inducción de PGC-1α tras el infarto, teniendo en cuenta los valores de expresión de ARN en las muestras al ingreso y a las 72h. Se definió inducción de PGC-1α como el incremento > 2 veces de la expresión determinada por qRT-PCR en la segunda muestra.
En el análisis de ANT-1, se definió igualmente inducción como el incremento > 2 veces en la determinación seriada a las 72h.
Análisis estadísticoMediante el test de Kolmogorov-Smirnov, se comprobó la normalidad en la distribución de las variables cuantitativas. Todas las variables continuas y normales se expresaron como media±desviación estándar, y las variables categóricas, como número (porcentaje). La comparación de las variables continuas entre los grupos se realizó mediante el test de la t de Student para muestras independientes y el test de Mann-Whitney para variables con distribución no normal, y las variables no continuas se compararon mediante el test de la χ2 y la prueba exacta de Fisher cuando fue apropiado. Se estudió el porcentaje de MS en cada uno de los grupos definidos, así como el remodelado ventricular (RV), y se compararon las medias también mediante prueba de la t de Student para muestras independientes. El análisis de las variaciones en el tamaño de la necrosis y el MS a largo plazo en cada paciente se realizó mediante el test de la t de Student para muestras apareadas. Se representó en diagramas de barras de error el cambio porcentual en los diferentes subgrupos. El análisis estadístico se realizó mediante el programa SPSS para Windows versión 17.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos). Se consideraron significativos los valores de p<0,05.
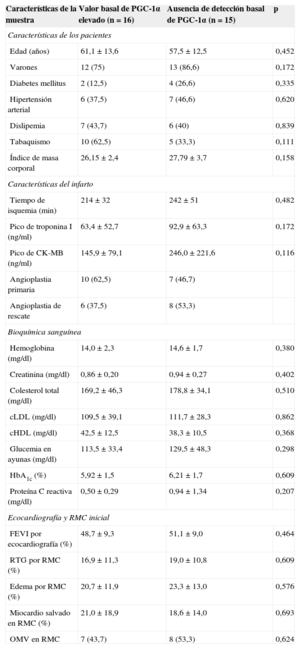
RESULTADOSExpresión basal de PGC-1αAl dividir la muestra en función de la expresión basal de PGC-1α en la muestra sanguínea al ingreso, establecimos dos grupos claramente diferenciados: pacientes con expresión constitutiva y pacientes sin expresión basal detectable. Así, encontramos que la ausencia de detección periférica de PGC-1α en el momento inicial tendía a ser más frecuente en pacientes diabéticos y se correlacionaba positivamente con valores más elevados de proteína C reactiva, aunque sin alcanzar significación estadística. El análisis de factores de riesgo cardiovascular y características del infarto no halló diferencias entre los grupos (tabla 1).
Características de la muestra según grado de expresión basal de PGC-1α: factores de riesgo cardiovascular, características del infarto y bioquímica general
| Características de la muestra | Valor basal de PGC-1α elevado (n=16) | Ausencia de detección basal de PGC-1α (n=15) | p |
|---|---|---|---|
| Características de los pacientes | |||
| Edad (años) | 61,1±13,6 | 57,5±12,5 | 0,452 |
| Varones | 12 (75) | 13 (86,6) | 0,172 |
| Diabetes mellitus | 2 (12,5) | 4 (26,6) | 0,335 |
| Hipertensión arterial | 6 (37,5) | 7 (46,6) | 0,620 |
| Dislipemia | 7 (43,7) | 6 (40) | 0,839 |
| Tabaquismo | 10 (62,5) | 5 (33,3) | 0,111 |
| Índice de masa corporal | 26,15±2,4 | 27,79±3,7 | 0,158 |
| Características del infarto | |||
| Tiempo de isquemia (min) | 214±32 | 242±51 | 0,482 |
| Pico de troponina I (ng/ml) | 63,4±52,7 | 92,9±63,3 | 0,172 |
| Pico de CK-MB (ng/ml) | 145,9±79,1 | 246,0±221,6 | 0,116 |
| Angioplastia primaria | 10 (62,5) | 7 (46,7) | |
| Angioplastia de rescate | 6 (37,5) | 8 (53,3) | |
| Bioquímica sanguínea | |||
| Hemoglobina (mg/dl) | 14,0±2,3 | 14,6±1,7 | 0,380 |
| Creatinina (mg/dl) | 0,86±0,20 | 0,94±0,27 | 0,402 |
| Colesterol total (mg/dl) | 169,2±46,3 | 178,8±34,1 | 0,510 |
| cLDL (mg/dl) | 109,5±39,1 | 111,7±28,3 | 0,862 |
| cHDL (mg/dl) | 42,5±12,5 | 38,3±10,5 | 0,368 |
| Glucemia en ayunas (mg/dl) | 113,5±33,4 | 129,5±48,3 | 0,298 |
| HbA1c (%) | 5,92±1,5 | 6,21±1,7 | 0,609 |
| Proteína C reactiva (mg/dl) | 0,50±0,29 | 0,94±1,34 | 0,207 |
| Ecocardiografía y RMC inicial | |||
| FEVI por ecocardiografía (%) | 48,7±9,3 | 51,1±9,0 | 0,464 |
| RTG por RMC (%) | 16,9±11,3 | 19,0±10,8 | 0,609 |
| Edema por RMC (%) | 20,7±11,9 | 23,3±13,0 | 0,576 |
| Miocardio salvado en RMC (%) | 21,0±18,9 | 18,6±14,0 | 0,693 |
| OMV en RMC | 7 (43,7) | 8 (53,3) | 0,624 |
cHDL: colesterol unido a lipoproteínas de alta densidad; CK-MB: fracción MB de la creatincinasa; cLDL: colesterol unido a lipoproteínas de baja densidad; FEVI: fracción de eyección del ventrículo izquierdo; HbA1c: glucohemoglobina; OMV: obstrucción microvascular; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio.
Significación estadística, p<0,05. Los valores indican n (%) o media±desviación estándar.
Con el fin de evaluar qué implicación tenía la activación basal de PGC-1α en la recuperación del miocardio tras el infarto, decidimos comparar el MS a largo plazo entre los dos grupos. De esta forma, se observó que, si bien no se hallaron diferencias en MS al comparar los grupos en la exploración inicial, los pacientes con grado de expresión de PGC-1α elevado al ingreso presentaron mayor índice de MS en el estudio de control (porcentaje de MS a los 6 meses, el 39,3%±4,5% frente al 23,2%±5,6%; p=0,033) (figura 2).
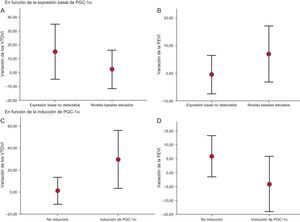
Además, en el estudio del volumen ventricular, se observó una tendencia hacia mayor RV en el grupo de pacientes sin expresión basal de PGC-1α detectable (variación porcentual del volumen telediastólico del ventrículo izquierdo, el 15,2%±9,2% frente al 2,3%±6,5%; p=0,26) (figura 3A), mientras que en los pacientes con mayor actividad basal de PGC-1α mejoró la función sistólica a los 6 meses, aunque las diferencias no fueron significativas (variación porcentual de la fracción de eyección del ventrículo izquierdo, el 6,9%±4,7% frente al –0,5%±3,2%; p=0,20) (figura 3B).
Variación de los volúmenes ventriculares y la función sistólica a los 6 meses (A y B). Variación según la expresión basal de PGC-1α (C y D). Variación según la inducción de PGC-1α tras infarto agudo de miocardio con elevación del segmento ST. FEVI: fracción de eyección del ventrículo izquierdo; VTDVI: volumen telediastólico del ventrículo izquierdo.
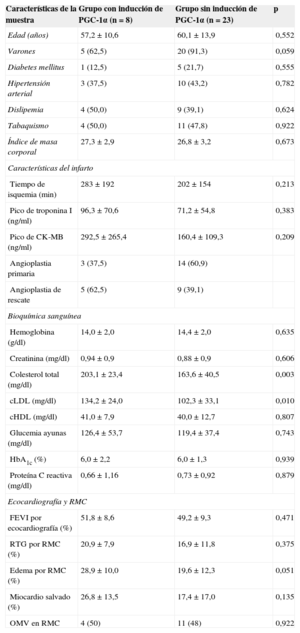
Con objeto de estudiar la repercusión funcional de la inducción de PGC-1α tras IAMCEST, la muestra se dividió en dos grupos en función de su presencia o ausencia, teniendo en cuenta el grado de expresión de PGC-1α en las muestras sanguíneas al ingreso y a las 72h. De esta manera, observamos que se detectó inducción de PGC-1α más frecuentemente en el contexto de infartos extensos (área necrótica y edema estimado por resonancia magnética cardiaca; realce tardío de gadolinio, el 20,99 frente al 16,91%; p=0,37; edema miocárdico, el 28,91 frente al 19,59%; p=0,051) y con mayor pico enzimático (valor máximo de troponina I, 96,3 frente a 71,2 ng/dl; p=0,38; CK-MB, 292,5 frente a 160,4 ng/dl; p=0,20), aunque sin alcanzar la significación estadística. Asimismo, la inducción de PGC-1α se correlacionó positivamente con los valores de colesterol total y colesterol unido a lipoproteínas de baja densidad, pero no se hallaron otras diferencias significativas entre los grupos en el análisis de factores de riesgo cardiovascular y las características del infarto (tabla 2).
Características de la muestra según inducción de PGC-1α tras el infarto: factores de riesgo cardiovascular, características del infarto y bioquímica general
| Características de la muestra | Grupo con inducción de PGC-1α (n=8) | Grupo sin inducción de PGC-1α (n=23) | p |
|---|---|---|---|
| Edad (años) | 57,2±10,6 | 60,1±13,9 | 0,552 |
| Varones | 5 (62,5) | 20 (91,3) | 0,059 |
| Diabetes mellitus | 1 (12,5) | 5 (21,7) | 0,555 |
| Hipertensión arterial | 3 (37,5) | 10 (43,2) | 0,782 |
| Dislipemia | 4 (50,0) | 9 (39,1) | 0,624 |
| Tabaquismo | 4 (50,0) | 11 (47,8) | 0,922 |
| Índice de masa corporal | 27,3±2,9 | 26,8±3,2 | 0,673 |
| Características del infarto | |||
| Tiempo de isquemia (min) | 283±192 | 202±154 | 0,213 |
| Pico de troponina I (ng/ml) | 96,3±70,6 | 71,2±54,8 | 0,383 |
| Pico de CK-MB (ng/ml) | 292,5±265,4 | 160,4±109,3 | 0,209 |
| Angioplastia primaria | 3 (37,5) | 14 (60,9) | |
| Angioplastia de rescate | 5 (62,5) | 9 (39,1) | |
| Bioquímica sanguínea | |||
| Hemoglobina (g/dl) | 14,0±2,0 | 14,4±2,0 | 0,635 |
| Creatinina (mg/dl) | 0,94±0,9 | 0,88±0,9 | 0,606 |
| Colesterol total (mg/dl) | 203,1±23,4 | 163,6±40,5 | 0,003 |
| cLDL (mg/dl) | 134,2±24,0 | 102,3±33,1 | 0,010 |
| cHDL (mg/dl) | 41,0±7,9 | 40,0±12,7 | 0,807 |
| Glucemia ayunas (mg/dl) | 126,4±53,7 | 119,4±37,4 | 0,743 |
| HbA1c (%) | 6,0±2,2 | 6,0±1,3 | 0,939 |
| Proteína C reactiva (mg/dl) | 0,66±1,16 | 0,73±0,92 | 0,879 |
| Ecocardiografía y RMC | |||
| FEVI por ecocardiografía (%) | 51,8±8,6 | 49,2±9,3 | 0,471 |
| RTG por RMC (%) | 20,9±7,9 | 16,9±11,8 | 0,375 |
| Edema por RMC (%) | 28,9±10,0 | 19,6±12,3 | 0,051 |
| Miocardio salvado (%) | 26,8±13,5 | 17,4±17,0 | 0,135 |
| OMV en RMC | 4 (50) | 11 (48) | 0,922 |
cHDL: colesterol unido a lipoproteínas de alta densidad; CK-MB: fracción MB de la creatincinasa; cLDL: colesterol unido a lipoproteínas de baja densidad; FEVI: fracción de eyección del ventrículo izquierdo; HbA1c: glucohemoglobina; OMV: obstrucción microvascular; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio.
Significación estadística, p<0,05. Los valores indican n (%) o media ± desviación estándar.
Evaluando los efectos a largo plazo de la inducción de PGC-1α durante la fase aguda del infarto, comparamos nuevamente el índice de MS a los 6 meses entre los dos grupos, y aunque se halló tendencia a mayor índice de MS en el grupo de inducción de PGC-1α (porcentaje de MS a los 6 meses, el 43,1%±9,9% frente al 27,5%±3,5%; p=0,071) (figura 4), esta era consecuencia de la mayor extensión del área de edema en fase aguda en estos pacientes. Por este motivo, se evaluó el área necrótica y el MS a largo plazo mediante un análisis por muestras apareadas, y se comprobó una mejora comparable en ambos grupos (tabla 3).
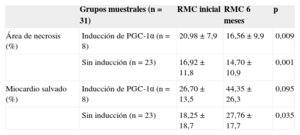
Área de necrosis y miocardio salvado: muestras apareadas en función de la inducción de PGC-1α en fase aguda del infarto. Comparación de porcentajes mediante test de la t de Student para muestras apareadas
| Grupos muestrales (n=31) | RMC inicial | RMC 6 meses | p | |
|---|---|---|---|---|
| Área de necrosis (%) | Inducción de PGC-1α (n=8) | 20,98±7,9 | 16,56±9,9 | 0,009 |
| Sin inducción (n=23) | 16,92±11,8 | 14,70±10,9 | 0,001 | |
| Miocardio salvado (%) | Inducción de PGC-1α (n=8) | 26,70±13,5 | 44,35±26,3 | 0,095 |
| Sin inducción (n=23) | 18,25±18,7 | 27,76±17,7 | 0,035 |
RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio.
Datos expresados en porcentajes. Significación estadística, p<0,05. Área de necrosis estimada por RTG. Miocardio salvado estimado por diferencia entre área de edema en fase aguda y área de necrosis.
Sin embargo, al comparar en estos grupos la evolución del volumen ventricular izquierdo a los 6 meses del infarto, se evidenció mayor RV en el grupo de inducción de PGC-1α (variación porcentual del volumen telediastólico del ventrículo izquierdo, el 29,7%±11,2% frente al 1,2%±5,8%; p=0,045) (figura 3C) y un deterioro no significativo de la función sistólica general (variación porcentual de la fracción de eyección del ventrículo izquierdo, el –4,1%±4,2% frente al 5,9%±3,6%; p=0,085) (figura 3D).
Respuesta inmune y PGC-1αVéase el .
Actividad molecular de PGC-1αVéase el .
Inducción de ANT-1 mediada por PGC-1αLa ANT-1 regula la apoptosis celular miocárdica en situaciones de IR con elevado estrés mitocondrial, y su expresión se induce en parte a través de PGC-1α. Al correlacionar los grados de expresión de PGC-1α y ANT-1 tras IAMCEST, encontramos que 7 de los 8 pacientes con inducción de PGC-1α tras el infarto inducían a su vez ANT-1 (tabla 4A).
Inducción de ANT-1 y remodelado ventricular en función de la inducción de PGC-1α y la presencia de obstrucción microvascular
| Muestra total (n=29)* | Inducción de PGC-1α (n=8) | Sin inducción de PGC-1α (n=21) | ||
|---|---|---|---|---|
| A | Inducción de ANT-1 | Inducción ANT-1 > 2 veces (n=15) | 7 | 8 |
| Inducción ANT-1<2 veces (n=14) | 1 | 13 |
| Muestra total (n=31) | Inducción de PGC-1α (n=8) | Sin inducción de PGC-1α (n=23) | ||
|---|---|---|---|---|
| B | Remodelado ventricular | Incremento de VTDVI > 10% (n=15) | 7 | 8 |
| Incremento VTDVI<10% (n=16) | 1 | 15 |
| Muestra total (n=31) | OMV (n=15) | Sin OMV (n=16) | ||
|---|---|---|---|---|
| C | Remodelado ventricular | Incremento de VTDVI > 10% (n=15) | 8 | 7 |
| Incremento de VTDVI<10% (n=16) | 7 | 9 |
| Muestra total (n=31) | Inducción de PGC-1α + OMV (n=4) | Sin asociación conjunta (n=27) | ||
|---|---|---|---|---|
| D | Remodelado ventricular | Incremento de VTDVI > 10% (n=15) | 4 | 11 |
| Incremento de VTDVI<10% (n=16) | 0 | 16 |
ANT-1: adenine nucleotide translocase 1; OMV: obstrucción microvascular; VTDVI: volumen telediastólico del ventrículo izquierdo.
Dado que los pacientes con inducción de PGC-1α presentaron mayor volumen telediastólico del ventrículo izquierdo en el control a los 6 meses y la obstrucción microvascular (OMV) es un factor pronóstico emergente de RV, decidimos comprobar la capacidad predictiva del análisis de PGC-1α tras IAMCEST tomando como referencia la presencia de OMV en el estudio inicial de resonancia magnética cardiaca. De esta manera, encontramos que 7 de los 8 pacientes (87,5%) con inducción de PGC-1α tras IAMCEST presentaban criterios de RV en la evolución (tabla 4B), en comparación con los 8 de los 15 pacientes (53,3%) con OMV en la resonancia cardiaca inicial (tabla 4C).
En el análisis conjunto de OMV e inducción de PGC-1α tras infarto, encontramos, por un lado, que la asociación de ambos factores se correlacionó con exactitud con la presencia de RV en el estudio de control (tabla 4D). En sentido opuesto, la ausencia de OMV e inducción de PGC-1α fue más frecuente en pacientes con infartos menos extensos, y se observó una mejora significativa de la fracción de eyección del ventrículo izquierdo a los 6 meses y tendencia a la preservación del volumen telediastólico del ventrículo izquierdo (tabla 5).
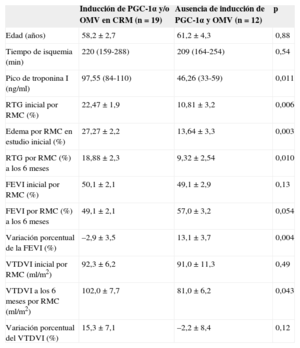
Características de la muestra según la inducción de PGC-1α tras IAMCEST y la presencia de OMV en el estudio de CRM inicial: valoración por CRM de FEVI, VTDVI y tamaño del infarto (estimado por valores máximos de TnI y área de necrosis según RTG)
| Inducción de PGC-1α y/o OMV en CRM (n=19) | Ausencia de inducción de PGC-1α y OMV (n=12) | p | |
|---|---|---|---|
| Edad (años) | 58,2±2,7 | 61,2±4,3 | 0,88 |
| Tiempo de isquemia (min) | 220 (159-288) | 209 (164-254) | 0,54 |
| Pico de troponina I (ng/ml) | 97,55 (84-110) | 46,26 (33-59) | 0,011 |
| RTG inicial por RMC (%) | 22,47±1,9 | 10,81±3,2 | 0,006 |
| Edema por RMC en estudio inicial (%) | 27,27±2,2 | 13,64±3,3 | 0,003 |
| RTG por RMC (%) a los 6 meses | 18,88±2,3 | 9,32±2,54 | 0,010 |
| FEVI inicial por RMC (%) | 50,1±2,1 | 49,1±2,9 | 0,13 |
| FEVI por RMC (%) a los 6 meses | 49,1±2,1 | 57,0±3,2 | 0,054 |
| Variación porcentual de la FEVI (%) | –2,9±3,5 | 13,1±3,7 | 0,004 |
| VTDVI inicial por RMC (ml/m2) | 92,3±6,2 | 91,0±11,3 | 0,49 |
| VTDVI a los 6 meses por RMC (ml/m2) | 102,0±7,7 | 81,0±6,2 | 0,043 |
| Variación porcentual del VTDVI (%) | 15,3±7,1 | –2,2±8,4 | 0,12 |
FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; OMV: obstrucción microvascular; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; TnI: troponina I; VTDVI: volumen telediastólico del ventrículo izquierdo.
Significación estadística, p<0,05. Los valores expresan media ± desviación estándar o media (intervalo).
El PGC-1α es un factor transcripcional maestro que regula la expresión génica mitocondrial y nuclear en el tejido cardiaco. Además de su participación en el metabolismo energético, PGC-1α activa la biogénesis mitocondrial y coordina el programa de defensa celular contra el estrés oxidativo19.
Sabiendo que la disfunción endotelial promovida por radicales libres de oxígeno es una característica precoz de las enfermedades cardiovasculares, el interés clínico de PGC-1α radica en su papel central de desintoxicación intracelular en situaciones como la isquemia miocárdica.
Cabe señalar que, si bien la inducción de PGC-1α se ha mostrado beneficiosa en la adaptación del tejido neuronal y el músculo esquelético a situaciones de isquemia y ejercicio intenso respectivamente, su papel en la respuesta al estrés en el corazón adulto es hasta el momento controvertido. En modelos animales, por un lado, se han observado efectos cardiotóxicos con la inducción de PGC-1α y, por otro, disfunción cardiaca tras su deleción transgénica. De la misma manera, estudios clínicos han descrito resultados contradictorios sobre el grado de expresión de PGC-1α en miocardiocitos disfuncionantes20,21. Centrados en esta aparente paradoja, otros trabajos han señalado que la sobrexpresión atenuada y transitoria de PGC-1α podría tener efectos beneficiosos en condiciones de estrés22. De esta forma, la supervivencia celular frente al daño por IR dependería del grado de activación inicial del sistema de defensa mitocondrial, su grado de respuesta al daño por oxidación y el mantenimiento de la respuesta tras el estímulo.
En nuestro trabajo se monitorizó la expresión de PGC-1α en pacientes con IAMCEST sometidos a estrategia de reperfusión y, por lo tanto, con lesión por IR en tejido cardiaco. Encontramos, en primer lugar, que el grado de activación basal del sistema era importante en la extensión de la necrosis miocárdica, de forma que los pacientes con expresión constitutiva de PGC-1α detectable en la primera muestra sanguínea presentaron mayor índice de MS en el estudio de control a los 6 meses. Además, se observó tendencia a menor RV y mayor grado de recuperación de la función sistólica. La ausencia de expresión basal de PGC-1α se encontró más frecuentemente en pacientes diabéticos, aunque de manera no significativa por el reducido tamaño muestral. Estos resultados refuerzan la evidencia de que la integridad del sistema regulado por PGC-1α es esencial para afrontar el daño agudo por IR, y podrían explicar en parte la peor evolución de los pacientes con trastornos del metabolismo glucídico, con base en la pérdida de actividad de PGC-1α descrita tradicionalmente en pacientes con diabetes mellitus23. En este sentido, el ensayo AleCardio ha evaluado recientemente el efecto de aleglitazar, como agonista dual de los PPAR, en la reducción de eventos cardiovasculares tras síndrome coronario agudo en pacientes diabéticos. Sin embargo, el ensayo se interrumpió prematuramente por recomendación del comité de seguridad debido a la falta de eficacia y el incremento de los objetivos de seguridad en un análisis intermedio no planificado24.
Al analizar la implicación pronóstica de la inducción de PGC-1α en pacientes con IAMCEST, observamos su correlación con el desarrollo de mayor RV, mientras que los grupos muestrales son comparables en tiempo de isquemia, estrategia de reperfusión, arteria causal del evento y área de necrosis inicial estimada por resonancia magnética cardiaca. Este incremento del volumen telediastólico del ventrículo izquierdo en el control a los 6 meses se acompañó de un deterioro no significativo de la función sistólica. La inducción de PGC-1α se siguió asimismo de un aumento significativo en la expresión de sus dianas génicas citocromo C y GPx. Estos datos respaldarían la hipótesis de que la inducción excesiva, tanto de PGC-1α como del sistema mitocondrial contra el estrés oxidativo que regula, tendría efectos deletéreos en la supervivencia celular en situaciones de IR. El mecanismo fisiopatológico causal podría explicarse en parte por la inducción de ANT-1 mediada por PGC-1α en respuesta a la lesión por IR, que incrementa la apoptosis celular de manera dependiente de la dosis en diversos tejidos, incluido el cardiaco25.
Recientemente se ha demostrado que la activación coordinada de ANT-1 y PGC-1α en modelos murinos de isquemia disminuye la tolerancia celular al estrés16. Ante la evidencia de disfunción contráctil tras la inducción de PGC-1α en situaciones de IR14, se ha propuesto que ANT-1 participa conjuntamente en el desarrollo de este fenotipo adverso, aunque esta situación no se ha probado clínicamente en pacientes. En nuestro estudio, al comparar los grupos según la inducción de PGC-1α tras IAMCEST, se observó mayor inducción de ANT-1 en los pacientes con inducción de PGC-1α. Por lo tanto, estos resultados respaldarían esta hipótesis por primera vez en un escenario clínico de lesión por IR.
Por otro lado, por la correlación observada entre la inducción de PGC-1α y el desarrollo de RV, se comparó su capacidad pronóstica tomando como referencia la presencia de OMV en la resonancia magnética cardiaca, pues se ha demostrado que es un excelente factor pronóstico de RV26,27. En nuestro estudio, la capacidad predictiva de la inducción de PGC-1α tras IAMCEST fue superior a la existencia de OMV, y el hallazgo conjunto de ambas variables se correlacionó exactamente con la aparición de RV en todos los pacientes. Además, y en sentido opuesto, la ausencia de OMV e inducción de PGC-1α se relacionó con mejor evolución tanto en la preservación del volumen telediastólico del ventrículo izquierdo como en la mejora de la fracción de eyección del ventrículo izquierdo. Aun con las limitaciones del reducido número de pacientes, estos datos indican el valor pronóstico de la inducción de PGC-1α en la recuperación miocárdica tras IAMCEST.
En resumen, hasta el momento la evidencia en investigación básica demuestra la participación de PGC-1α en la regulación del sistema de protección celular contra el daño por IR, con resultados inciertos sobre su papel en tejido cardiaco. Nuestro trabajo monitorizó en un escenario clínico la expresión sistémica de PGC-1α tras IAMCEST con el objeto de definir un perfil de activación cardioprotector. Así, mientras la expresión constitutiva de PGC-1α se asoció a mayor MS, su inducción inmediata tras IAMCEST se correlacionó con mayor RV en la evolución postinfarto. Este efecto perjudicial en la recuperación cardiaca podría explicarse en parte por la inducción de ANT-1 mediada por PGC-1α.
Estos datos en conjunto indican que la integridad del sistema de protección mitocondrial regulado por PGC-1α es esencial para una adecuada respuesta al daño por IR, mientras su activación excesiva y persistente tras el evento isquémico tendría efectos deletéreos en la recuperación cardiaca. Sin embargo, las implicaciones pronósticas de estos hallazgos escapan al ámbito de nuestro estudio.
Limitaciones del estudioLas principales limitaciones son el reducido tamaño muestral y el carácter eminentemente básico de la investigación. Así, aunque su diseño traslacional permite establecer hipótesis de trabajo con base en las conclusiones, conlleva la necesidad inherente de estudios clínicos futuros que permitan confirmar los hallazgos y definir el papel de la determinación de PGC-1α en la práctica clínica.
CONCLUSIONESLa expresión sistémica de PGC-1α puede monitorizarse en pacientes con IAMCEST. Mientras el incremento constitutivo de actividad del sistema regulado por PGC-1α se correlacionó con mayor MS, la inducción excesiva y persistente de PGC-1α tras IAMCEST se asoció a mayor RV. Este efecto deletéreo en la recuperación cardiaca podría estar relacionado con la inducción de ANT-1 mediada por PGC-1α, que promueve la apoptosis celular en la lesión por IR.
FINANCIACIÓNEste trabajo ha sido financiado por la Sociedad Española de Cardiología, a través de Beca para Proyectos de Investigación Básica en Cardiología, convocatoria 2010; el programa I3 de intensificación investigadora 2010 y 2012 del Instituto de Salud Carlos III y la Generalitat Valenciana; Fundación para la Investigación del Hospital General Universitario de Valencia, a través de Becas de Investigación Intramural, convocatorias 2008 y 2010; Ministerio de Ciencia e Innovación español, mediante proyectos SAF 2009-07599 y CSD 2007-00020; SAF2012-37693 del MINECO (Ministerio de Economía y Competitividad), y S2010/BMD-2361 de la Comunidad de Madrid.
CONFLICTO DE INTERESESNinguno.