Las guías de actuación del infarto agudo de miocardio con elevación del segmento ST (IAMCEST) resumen la evidencia científica disponible y proporcionan al cardiólogo clínico una ayuda para seleccionar el mejor tratamiento. Sin embargo, su aplicación práctica en la vida real obliga a superar diversas limitaciones. Lograr una reperfusión lo más precoz posible, farmacológica, con un agente fibrinolítico, o mecánica, mediante angioplastia coronaria percutánea primaria es el primer objetivo terapéutico. Sobre todo considerando que aún persiste un número significativo de pacientes a quienes no se administra o se hace demasiado tarde. El establecimiento de protocolos locales que integren las recomendaciones de las guías de actuación con la realidad concreta del medio, así como las circunstancias de los pacientes individuales, puede mejorar el tratamiento y el pronóstico de los enfermos con IAMCEST.
Palabras clave
El infarto agudo de miocardio con elevación del segmento ST (IAMCEST) es un problema de salud pública en los países desarrollados y lo será en los países en vías de desarrollo, y actualmente afecta a más de 3.000.000 de personas cada año1. Las mejoras introducidas en el manejo de estos enfermos, tanto en la estratificación de riesgo como en el tratamiento de reperfusión, el empleo de fármacos antiagregantes, las medidas de prevención secundaria, etc., han logrado reducir notablemente la morbimortalidad. Este eficaz tratamiento moderno se fundamenta en las evidencias derivadas de numerosos estudios clínicos realizados en los últimos 30 años. Las guías de actuación clínica proporcionan unas recomendaciones basadas en esa evidencia científica disponible, lo que permite contar con un documento de referencia para el diagnóstico y un mejor tratamiento de los pacientes. En el caso del IAMCEST, las últimas guías europeas y americanas publicadas cumplen esos objetivos2,3.
La aplicación práctica de éstas se fundamenta en su conocimiento, pero pasa por la adaptación a cada realidad, su integración en el manejo individual del paciente concreto, la adopción de las medidas necesarias —organizativas, equipamiento, personal, etc.— para implementarlas y una evaluación periódica.
Aplicar las guías en la práctica clínica depende de diversos factores, como la introducción de mejoras en las estructuras sanitarias, la formación del personal sanitario, la educación de los pacientes y las limitaciones económicas4.
El objetivo de este artículo es analizar algunas de las particularidades de la aplicación de las guías de manejo del IAMCEST en la vida real.
IMPORTANCIA DEL IAMCESTEl infarto agudo del miocardio (IAM) continúa siendo un problema de salud pública en los países desarrollados y en vías de desarrollo, por lo que son necesarios esquemas de tratamiento efectivos y factibles.
La mortalidad durante el primer año después de un infarto de miocardio se ha reducido sustancialmente en los últimos años, por los esfuerzos en administrar lo más precozmente posible el tratamiento de reperfusión y como consecuencia del aumento en el uso de tratamientos farmacológicos —antitrombóticos, bloqueadores beta, inhibidores de la enzima de conversión de angiotensina (IECA)—.
De esta forma, hemos pasado de una mortalidad hospitalaria del 25-30%, en los años sesenta, al 15% en los ochenta, hasta reducirse actualmente al 6% a 1 mes2.
Sin embargo, esta mortalidad es mayor en la vida real, como indican diferentes registros publicados. En nuestro medio la mortalidad hospitalaria se sitúa en torno al 7,6%, según los datos del estudio MASCARA5.
Para lograr unos resultados clínicos óptimos es preciso integrar una buena estratificación de riesgo, con el empleo de los tratamientos agudos apropiados, en el marco de un sistema efectivo que permita su aplicación y evaluación.
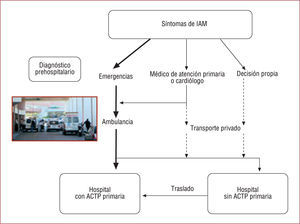
DIAGNÓSTICO DE IAMEl manejo óptimo del IAMCEST comienza por la actuación prehospitalaria; es fundamental establecer un sistema de emergencias que traslade, en ambulancias adecuadamente dotadas, a los pacientes hacia los hospitales de referencia (fig. 1).
Asistencia prehospitalaria en infarto agudo de miocardio (IAM). ACTP: angioplastia coronaria percutánea. Adaptada de Van de Werf et al2.
La primera limitación en esta etapa inicial son los retrasos debidos a que el paciente o sus familiares consultan o avisan al sistema de emergencias de forma poco rápida, por no reconocer los síntomas o porque, como sucede en el 50% de los casos, usan sus propios sistemas de transporte. La presentación es especialmente tardía en ancianos, diabéticos y mujeres.
En nuestro medio la mediana de tiempo desde el inicio de los síntomas hasta la consulta con el sistema sanitario supera los 95 min6.
Entre las medidas prácticas a introducir para mejorar estos tiempos estarían la información a los pacientes con enfermedad coronaria sobre los síntomas del IAM y cómo reaccionar en caso de presentarlos. Quizá también ayudaría difundir este mensaje entre la población general, al igual que la realización de cursos de reanimación básica.
Otro requisito básico es la existencia de un sistema de flujo de pacientes bien establecido, con un número suficiente de ambulancias bien dotadas y con personal entrenado. Se trata de un pilar fundamental para trasladar de forma rápida a los pacientes, administrar el tratamiento inicial y, también, para monitorizar a los enfermos y poder tratar precozmente las arritmias ventriculares que pudieran presentarse.
Es básico que la población general conozca la forma de contactar con el sistema de emergencias mediante un teléfono único conocido.
A menudo los pacientes consultan en su centro de salud y son los médicos de familia quienes obtienen el electrocardiograma (ECG) inicial, realizan el diagnóstico, monitorizan, desfibrilan, en caso necesario, y hacen la llamada que activa el sistema de transporte al hospital. Por lo tanto, el papel del médico puede ser crucial para tratar de forma rápida y eficaz al paciente con IAM.
Para el personal sanitario de emergencias es básico contar con protocolos de manejo escritos detallados y claros. Además sería útil que tuvieran la posibilidad de realizar consultas rápidas de ECG transtelefónicas con el hospital de referencia.
La ambulancia debería ser capaz de atender a la mayoría de los pacientes con dolor torácico en menos de 15min.
Finalmente, a la llegada al hospital deben evitarse los retrasos innecesarios en el área de urgencias. Se debe valorar de forma inmediata, y realizar un diagnóstico rápido con estratificación de riesgo, a los pacientes que acceden por sospecha de síndrome coronario agudo (SCA), para así establecer el tratamiento más adecuado.
El diagnóstico del IAMCEST se fundamenta en la clínica —dolor torácico prolongado—, el ECG —elevación persistente del segmento ST o bloqueo de rama izquierda del haz de His (BRIHH)—, y la determinación analítica —aumento de marcadores de necrosis miocárdica, fracción MB de la creatincinasa y troponinas—, aunque no se debe esperar el resultado para hacer el diagnóstico.
Sin embargo, el electrocardiograma inicial es diagnóstico sólo en un 50% de los casos, incrementando la sensibilidad los registros seriados. Una vez confirmado, es preciso mantener una monitorización electrocardiográfica continua para detectar arritmias potencialmente peligrosas.
La realización de un ecocardiograma es especialmente útil en casos dudosos y permite excluir otras causas de dolor torácico. Sin embargo, no debería retrasar el inicio del tratamiento y, en la práctica, no está disponible de forma urgente en la mayoría de los centros.
TRATAMIENTO FARMACOLÓGICO INICIAL- 1.
Alivio sintomático (dolor, ansiedad, etc.). Evitar el empleo de medicación intramuscular y de antiinflamatorios no esteroideos, la administración de morfina intravenosa (i.v.) es el tratamiento de elección para aliviar el dolor, con antieméticos para mitigar náuseas y vómitos.
- 2.
Tratamiento antiagregante. De forma muy precoz debe administrarse aspirina (150–325mg oral o 250–500mg i.v.) a todos los pacientes, excepto aquellos con alergia, trastornos hemorrágicos o sangrado gastrointestinal. El tratamiento antiagregante debe completarse con la administración de 300mg de clopidogrel como dosis de carga. En nuestro medio, se administra aspirina al 83% de los pacientes y clopidogrel al 55%6.
- 3.
En pacientes con disnea o insuficiencia cardiaca debe administrarse oxígeno.
El punto clave del tratamiento de los pacientes con IAMCEST con menos de 12h de evolución es restaurar el flujo coronario y reperfundir el tejido miocárdico, de forma mecánica, con angioplastia coronaria percutánea primaria (ACTPP) o farmacológica, administrando un fibrinolítico.
Incluso ese tratamiento de reperfusión debe considerarse si hay evidencias clínicas o electrocardiográficas de isquemia aunque los síntomas persistan más de 12h.
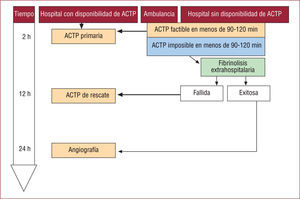
Las últimas guías de actuación2 establecen una clara preferencia por el tratamiento de reperfusión mecánico, mediante angioplastia primaria, siempre y cuando sea realizable en unas circunstancias, operativas, organizativas y temporales, adecuadas (fig. 2).
Estrategias de reperfusión en infarto agudo de miocardio (IAM). ACTP: angioplastia coronaria percutánea. Adaptada de Van de Werf et al2.
Podemos diferenciar tres situaciones concretas:
- 1.
Pacientes que ingresan en hospitales con ACTPP. Se trata de centros que cuentan con un equipo de cardiólogos intervencionistas experimentados, con guardias localizadas que cubren las 24h del día, 7 días a la semana, 365 días al año. La rápida disponibilidad de la técnica hace que en este caso el tratamiento de elección sea la ACTPP.
- 2.
Pacientes que ingresan en hospitales sin ACTPP in situ. Si la distancia entre hospitales y la disponibilidad de ambulancias permite trasladar al paciente en menos de 90–120min a otro hospital con equipo de alerta de hemodinámica, debe remitirse para ACTPP. En caso de que el traslado implique un retraso mayor que ese límite, debe intentarse la reperfusión farmacológica con tratamiento fibrinolítico. También debería optarse por este tratamiento cuando la sala de hemodinámica esté ocupada, conozcamos la anatomía coronaria del paciente y no sea revascularizable, haya problemas de acceso vascular u otras enfermedades concomitantes, etc.
- 3.
Pacientes atendidos por el sistema de emergencias y trasladados en ambulancia desde su domicilio. Si es posible trasladar al enfermo en menos de 90–120min a un hospital con equipo de alerta de hemodinámica, debe remitirse para ACTPP. Si el retraso supera ese límite debe realizarse fibrinolisis extrahospitalaria.
En la vida real los dos aspectos esenciales para administrar un tratamiento de reperfusión óptimo son el tiempo y la disponibilidad de un equipo intervencionista cualificado, con unas limitaciones derivadas del tiempo de evolución de los síntomas, los medios de transporte disponibles y la estructura organizativa establecida por el sistema sanitario.
Esa estructura se fundamenta en el diseño de unas redes locales que conecten los hospitales con y sin salas de hemodinámica.
Lo fundamental es administrar al paciente precozmente el tratamiento de reperfusión, mediante ACTPP o fibrinolisis.
Desde el punto de vista práctico, es necesario recordar que la superioridad de la ACTPP se reduce al aumentar el retraso en la aplicación del tratamiento entre 60 y 114min, intervalo que ha de ser lo más corto posible —inferior a 90min— en pacientes con presentación precoz (menos de 2h de evolución), escaso riesgo de hemorragia y gran cantidad de miocardio en peligro7.
En realidad, hay que considerar también el, generalmente, breve pero variable y necesario tiempo de procedimiento a realizar en el laboratorio de hemodinámica hasta lograr la apertura de la arteria causal del IAMCEST. De esta forma, el mensaje debería ser considerar 90min como el límite de tiempo de transporte para los pacientes ingresados en hospitales sin ACTPP o atendidos por las ambulancias —los supuestos en los puntos 2 y 3 antes comentados— desde que se diagnostica y se activa el sistema de emergencias hasta la llegada a la sala de hemodinámica.
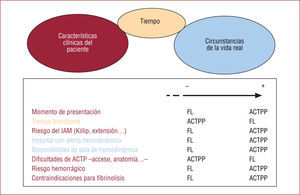
Al tomar la decisión, habrá que integrar las características clínicas del paciente (edad, riesgo hemorrágico, etc.) con las circunstancias del IAM (tiempo de evolución, localización, etc.) y el tiempo necesario para administrar uno u otro tratamiento (fig. 3). Las ventajas de la ACTPP se perderán antes en un paciente menor de 65 años con un IAM de menos de 2h de evolución, un caso en que la ACTPP sólo se justificaría si la demora del traslado fuese mínima.
Retos prácticos para la aplicación de las guías de actuación en el infarto agudo de miocardio (IAM). En función de estas variables se optará preferentemente por una u otra estrategia (flecha). -: indica ausencia de, menor o más corto intervalo; +: significa presencia de, mayor o intervalo más prolongado; ACTP: angioplastia coronaria percutánea; ACTPP: ACTP primaria; FL: fibrinolisis.
En el estudio DANAMI-2 el traslado para ACTPP se demostró factible y seguro, con menores tasas de accidente cerebrovascular (ACV), IAM recurrente y revascularización que la fibrinolisis, aunque sin diferencias en mortalidad8. Sin embargo, en Estados Unidos los datos del National Registry of Myocardial Infarction muestran que el tiempo puerta-balón medio es de 180min, con únicamente un 5% de los pacientes tratados dentro del intervalo ideal de 90min establecido en las guías9.
Estos tiempos puerta-balón son más prolongados en los casos que se presentan fuera del horario laboral habitual, mientras que no hay diferencias significativas en los pacientes tratados con fibrinolisis, con tiempos puerta-aguja similares10.
Finalmente, habrá que valorar el resultado del tratamiento de reperfusión elegido puesto que no se logra restaurar el flujo microvascular en un 40% de los pacientes con fibrinolisis y en un 20% de los tratados con ACTPP, generalmente por excesivos retrasos, aunque también influye la edad del paciente, la localización del IAM, la carga trombótica, etc.11.
Si la opción elegida es la del tratamiento fibrinolítico, resulta obligado contar con la cobertura de un hospital dotado de un equipo de alerta de hemodinámica, capaz de intervenir si no se logra la reperfusión farmacológica (ACTP de rescate), o de realizar de forma programada un estudio coronariográfico (estrategia farmacoinvasiva).
ACTP de rescateEn caso de persistir el dolor torácico y/o no resolverse más del 50% de la elevación del segmento ST a los 90min de la fibrinolisis, los resultados de una ACTP de rescate son superiores a los del tratamiento conservador o la readministración de fibrinolisis2.
Estrategia farmacoinvasivaLas guías recomiendan realizar un estudio coronariográfico de forma programada precoz, en torno a las 24h tras una fibrinolisis exitosa (fig. 2).
Frente a un manejo conservador, con coronariografía indicada según la demostración de isquemia tras el IAM, esta estrategia muestra una discreta reducción de la mortalidad (el 3,8 frente al 6,7%; p = 0,07) y una disminución en mortalidad e IAM a los 6 meses (el 7,4 frente al 13,2%; p < 0,01)12,13.
Además, algunos estudios han mostrado que la administración precoz de fibrinolisis con realización de ACTP en 24h logra resultados similares a los de la ACTPP14.
Esta estrategia farmacoinvasiva15 es diferente de la ACTP facilitada, con ACTP sistemática tras fibrinolisis, que en los estudios FINESSE y ASSENT-4 se ha demostrado inferior a la ACTPP.
En definitiva, lo fundamental es administrar el tratamiento de reperfusión y hacerlo de la forma más precoz posible16. Si consideramos que en el registro GRACE cerca del 40% de los pacientes no recibían tratamiento de reperfusión, probablemente más que luchar intensamente por imponer una estrategia u otra, podemos salvar más vidas si aumentamos el número de pacientes tratados y reducimos los tiempos necesarios para hacerlo17.
De forma esquemática, se debería establecer una red asistencial que permitiese realizar:
- –
Llegada de la ambulancia en menos de 15min.
- –
Transmisión electrocardiográfía en menos de 10min.
- –
Consulta telefónica electrocardiográfía en menos de 5min.
- –
Llegada de la ambulancia e inicio de fibrinolisis en menos de 30min.
- –
Llegada de la ambulancia e inicio de ACTPP en menos de 90min.
Los tiempos reales, el tratamiento de reperfusión administrado, la calidad de los cuidados, los resultados clínicos, etc., deben medirse y evaluarse periódicamente, e introducir las estrategias de mejora que sean necesaria.
ACTP PRIMARIA. PROCEDIMIENTOEn otros capítulos de esta monografía se abordan con detalle el procedimiento de ACTPP, los regímenes de tratamiento fibrinolítico y los fármacos a utilizar en la fase aguda del IAMCEST.
En concordancia con lo propuesto en las guías de actuación, los procedimientos de ACTPP se han incrementado notablemente en los últimos años16. En España, el 70% de los hospitales con salas de hemodinámica realizan alertas de 24h, lo que ha permitido pasar de 2.821 ACTPP en el año 2002 a 7.358 en 2007, con una media de165 procedimientos por millón de habitantes, si bien hay importantes diferencias entre regiones18.
En la práctica el establecimiento de un sistema de alertas de hemodinámica capaz de realizar ACTPP 24h al día, 7 días a la semana, los 365 días del año, no resulta sencillo. Son necesarios equipos especializados, con cardiólogos intervencionistas experimentados y personal de enfermería suficientemente entrenado. Se plantean problemas económicos —sistema de retribución, etc.— y organizativos, y es necesario asumir un volumen importante de actividad urgente, así como las libranzas tras las guardias y disponer de suficiente personal para mantener la actividad en época de vacaciones, imprevistos, etc.
Además, debe contarse con un adecuado sistema de retorno de los pacientes tratados a sus hospitales de referencia para continuar allí la recuperación.
EVALUACIÓN DEL RIESGOTras el tratamiento inicial de reperfusión es fundamental identificar a los pacientes con más riesgo de sufrir futuros eventos y adoptar las medidas preventivas necesarias. En torno a un 10% de los pacientes sufrirán un reinfarto durante el primer año y la mortalidad tras el alta es mayor que la de la población general19.
De forma resumida los pasos fundamentales serán:
- 1.
Valoración de la función ventricular. La ecocardiografía es la técnica ideal por su disponibilidad y sencillez, que debe realizarse en las primeras 24–48h.
- 2.
Detección de isquemia residual. Con la recomendable realización de la coronariografía precoz, se debe haber tratado la lesión causal y se conocerá el resto de la anatomía coronaria. Si no se ha realizado el estudio angiográfico o hay dudas sobre la repercusión funcional de determinadas lesiones, será necesario estudiar mediante prueba de esfuerzo, preferentemente con imagen (ecografía de estrés, gammagrafía de perfusión o resonancia magnética [RM]). En caso de ser necesario, deberán tratarse las lesiones coronarias mediante nueva ACTP o revascularización quirúrgica. El número de pacientes que precisan tratamiento con cirugía es reducido, pero está indicada en casos de ACTP fallida, lesiones no susceptibles de ACTP, shock o complicaciones mecánicas. En caso de poder solucionarse la lesión causal de forma percutánea, debe tratarse con implante de stent convencional y, luego, realizar cirugía en condiciones de mayor estabilidad una vez superada la fase aguda.
- 3.
Estudio de viabilidad miocárdica. La disfunción ventricular tras el infarto puede estar causada por necrosis, aturdimiento —transitorio en unas 2 semanas— o hibernación persistente hasta la revascularización. La detección de la viabilidad miocárdica puede realizarse en la mayoría de los centros mediante gammagrafía de perfusión o ecocardiograma de estrés, y en algunos, con métodos más sofisticados, como tomografía por emisión de positrones o RM.
- 4.
Evaluación del riesgo arrítmico y prevención de la muerte súbita. El riesgo es bajo en pacientes sin arritmias y fracción de eyección del ventrículo izquierdo (FEVI) > 40%, por lo que no precisan estudios específicos. Sin embargo, aquellos con disfunción ventricular izquierda y taquicardia ventricular (TV) no sostenida, insuficiencia cardiaca o TV inducible en el estudio electrofisiológico presentan un aumento del riesgo de muerte súbita.
Para mejorar el pronóstico de los pacientes, a las medidas terapéuticas iniciales deben seguir la prescripción al alta de los tratamientos farmacológicos establecidos y recomendaciones sobre adopción de hábitos de vida saludables, incluyendo cese del tabaco, realización de ejercicio físico, etc. El objetivo es que el paciente reanude su vida de la forma más completa posible, atendiendo aspectos físicos, psicológicos y socioeconómicos. Para ello el establecimiento de programas multidisciplinarios de rehabilitación cardiaca ha demostrado su utilidad.
Para reducir la lógica ansiedad del paciente que ha sufrido un infarto es importante comentar la situación con él y con sus familiares, así como advertir sobre el riesgo de depresión e irritabilidad tras el retorno a casa.
Conviene analizar sus factores de riesgo para aconsejar los cambios necesarios en el estilo de vida, incluyendo la realización de ejercicio físico considerando la edad, niveles de actividad previos, limitaciones físicas, etc.
El ejercicio mejora la función endotelial y el establecimiento de circulación colateral, reduce la progresión de la enfermedad coronaria y el riesgo trombogénico. Además, aporta al paciente seguridad y confianza en su recuperación.
Es aconsejable la realización de un ejercicio aeróbico moderado como caminar durante 5 períodos semanales de 30min.
La alimentación ha de ser variada, con predilección por verduras, frutas, cereales, pescado y productos con pobre contenido en grasas. Es necesario limitar el aporte calórico para evitar el sobrepeso, así como el contenido de sal. Los pacientes diabéticos deben extremar el control glucémico, con cifras de glucohemoblobina (HbA1c) < 6,5%.
Dejar de fumar es la medida de prevención secundaria más eficaz y una de las tareas fundamentales a realizar durante la convalecencia será ayudar y convencer al paciente de la necesidad de abandonar el tabaco. A pesar de que la mortalidad de los pacientes que continúan fumando es un tercio mayor que la de los que cesan, un 25% de los pacientes han vuelto a fumar 3 meses después del alta hospitalaria20.
En caso necesario pueden utilizarse tratamientos con nicotina o bupropión.
El empleo de antiagregación con aspirina (75–100mg/día) indefinidamente y clopidogrel (75mg/día) durante 12 meses reduce la recurrencia de eventos1.
En un trabajo publicado hace 2 años se analizó a 500 pacientes tratados con ACTPP e implante de stent farmacoactivo, y se encontró que el 14% no tomaba tienopiridinas a los 30 días. Entre los predictores de abandono de doble antiagregación se encontraba el nivel educativo del paciente, el coste de la medicación, pero también las instrucciones dadas por el médico hospitalario21.
Ante toda prescripción farmacológica para la fase posthospitalaria es necesario insistir en las explicaciones al paciente y su familia, además de considerar el estado socioeconómico del individuo. Algunos estudios confirman su relación con el riesgo de cardiopatía isquémica, una mayor dificultad en introducir cambios en el estilo de vida e incluso menos probabilidad de recibir tratamientos antiagregantes e hipolipemiantes22.
Los IECA o los antagonistas de los receptores de la angiotensina II (ARA-II) están indicados en pacientes con HTA, insuficiencia cardiaca, IAM anterior o recurrente, y deben combinarse antagonistas de la aldosterona en pacientes con FEVI < 40% e insuficiencia cardiaca o diabetes, siempre y cuando no presenten insuficiencia renal (creatinina < 2mg/ dl) o hiperpotasemia (K < 5mEq/l).
El uso de estatinas también ha demostrado reducir los eventos.
Continúa resultando básico el empleo de bloqueadores beta, fármacos de uso indefinido en ausencia de contraindicaciones pues han demostrado reducir la mortalidad y el reinfarto en un 25%. Los antagonistas del calcio verapamilo y diltiazem son una alternativa para los pacientes que no toleran los bloqueadores beta.
El desfibrilador automático implantable (DAI) está indicado en pacientes con FEVI < 40%, TV no sostenida espontánea y TV inducible en estudios electrofisiológicos; también en los pacientes con FEVI < 30% 1 mes después del IAM. En caso de realizar tratamiento de revascularización la decisión sobre si implantar un DAI debe tomarse transcurridos 3 meses del procedimiento.
CONCLUSIONESLas guías de actuación nos proporcionan una herramienta valiosa para seleccionar los tratamientos más apropiados según la evidencia disponible. Al aplicarlas en la vida real, es necesario individualizar al paciente concreto y la situación del medio en que nos encontramos.
La ACTPP es el tratamiento ideal de reperfusión en el IAMCEST si lo realiza precozmente un equipo experimentado. En caso de no disponer de este procedimiento, o sufrir un retraso excesivo para su realización, una estrategia farmacoinvasiva, con administración de un agente fibrinolítico y traslado a un hospital con laboratorio de hemodinámica, es una alternativa razonable.
Una vez superada la fase aguda, completar la estratificación de riesgo e iniciar las medidas de prevención secundaria con supervisión atenta durante el seguimiento también son pasos fundamentales para lograr una adecuada recuperación de los pacientes.