Las complicaciones cardiovasculares son frecuentes en el paciente con la enfermedad coronavírica de 2019 (COVID-19), y se asocian con una mayor mortalidad. Entre las complicaciones cardiovasculares, destacan el síndrome coronario agudo, el daño miocárdico agudo (elevación de troponinas con coronarias normales), arritmias (principalmente fibrilación auricular y arritmias ventriculares), insuficiencia cardiaca, pericarditis/derrame pericárdico y complicaciones tromboembólicas (tromboembolia arterial y venosa, trombosis microvascular, embolia pulmonar, ictus). Por lo tanto, uno de los objetivos del tratamiento del paciente con COVID-19, sobre todo en sus formas más graves, es la prevención de las complicaciones cardiovasculares y trombóticas, lo que sin duda tendría un impacto positivo en el pronóstico de estos pacientes.
Fuera de este contexto, los resultados provenientes tanto de ensayos clínicos como de estudios en la práctica clínica muestran que el rivaroxabán es eficaz y seguro en todo el espectro de la enfermedad cardiovascular (fibrilación auricular, enfermedad tromboembólica venosa y enfermedad cardiovascular ateroesclerótica), por lo que podría aportar un valor añadido en la prevención de las complicaciones trombóticas y cardiovasculares durante la pandemia de COVID-19.
Palabras clave
La infección por el SARS-CoV-2, que causa la enfermedad corona-vírica de 2019 (COVID-19), ha alcanzado cifras de pandemia mundial desde marzo de 2020, con diferentes oleadas e intensidad según la región1’2. Aunque en la mayoría de los pacientes cursa de manera leve o poco sintomatica (fiebre, tos seca, cansancio, mialgias, diarrea, cefa-lea, alteraciones del sentido del olfato o del gusto, alteraciones cuta-neas, etc.), en algunos casos pueden desarrollarse síntomas más graves, como neumonía grave intersticial, síndrome de dificultad respiratoria aguda, complicaciones cardiovasculares, trombosis veno-sas o arteriales y la muerte3-5. En las formas graves de la enfermedad, se producen una reaccion inflamatoria extrema, hipoxemia y un estado protrombótico que aumentan el riesgo de complicaciones y empeoran de manera marcada el pronóstico3-9.
Por lo tanto, uno de los objetivos del tratamiento del paciente con COVID-19, sobre todo en sus formas más graves, es la prevencion de las complicaciones cardiovasculares y trombóticas, lo que sin duda tendrá un impacto positivo en el pronóstico de estos pacientes9-11.
Trombosis en el paciente con COVID-19Los pacientes con COVID-19 tienen un riesgo de complicaciones tromboticas venosas y arteriales incrementado, lo que aumenta el riesgo de muerte12. Así, se ha descrito en pacientes críticos una incidencia de complicaciones tromboembólicas de un 5-15%, que incluso era mayor en las primeras publicaciones, probablemente por una insuficiente tromboprofilaxis al inicio de la pandemia13. En una revisión reciente se han comunicado incidencias de ictus del 3% y de tromboembolia venosa del 20% en pacientes hospitalizados por COVID-19, que era mayor en los pacientes más graves14.
Este aumento del riesgo protrombótico en el paciente con COVID-19 es multifactorial (tabla 1). En cuanto a las alteraciones de la coagulación, destacan un incremento de dímero-D, la prolongación del tiempo de protrombina, que no se detecta mediante la razón internacional normalizada (INR), y una moderada disminución de plaquetas6,12. Asimismo, en estudios necrópsicos se han observado depósitos microvasculares de trombos ricos en los pequeños vasos, tanto en los pulmones como en otros órganos, lo cual afecta a su función en los casos más graves. La microangiopatía trombótica se debe principal-mente a una interacción entre la hiperreactividad plaquetaria y la pared del vaso, mediada por el factor von Willebrand12. Además, también se ha descrito una activación significativa del sistema fibrinolítico12. Asimismo, en la COVID-19, sobre todo en las formas más graves, se produce un incremento de la actividad inflamatoria. De hecho, se ha observado un aumento en las concentraciones de citocinas proin-flamatorias, como el factor de necrosis tumoral alfa y varias interleu-cinas (IL), entre ellas, IL-1 e IL-6. La IL-6 es clave en la activación de la coagulación al inducir la expresión del factor tisular de las células mononucleares, y el factor de necrosis tumoral alfa y la IL-1 son capaces de suprimir las vías endógenas de la anticoagulación4,12,21. Además, la inmovilización y el daño vascular (endotelitis inflamatoria) que ocurren en estos pacientes incrementarían el riesgo de trombosis12. En una reciente serie francesa, los principales factores de riesgo de embolia pulmonar fueron el sexo y la concentración de proteína C reactiva, pero no los factores de riesgo tradicionales, y se enfatiza en los beneficios de la anticoagulación durante la hospitalización22.
Etiopatogenia del riesgo de complicaciones trombóticas venosas y arteriales en el paciente con infección por COVID-19
| Coagulopatía por COVID-19: |
| • Aumento dímero-D |
| • Reducción moderada de plaquetas |
| • prolongación del tiempo de protrombina |
| Microangiopatía trombótica (interacción entre las plaquetas activadas y la pared del vaso mediada por el factor von Willebrand) |
| Activación del sistema fibrinolítico |
| Incremento de la actividad inflamatoria (TNFα, IL-1, IL-6) |
| Mayor riesgo de fibrilación auricular |
Además, los pacientes con COVID-19 tienen un riesgo de fibrilación auricular (FA) incrementado a través de diversos mecanismos (hipoxia, alteraciones hidroelectroliticas, inflamacion, activación del sistema nervioso simpático, infiltración de leucocitos en el tejido auricular y estrés oxidativo, entre otros), lo que contribuiría a aumentar el riesgo de complicaciones tromboembólicas15-19.
Complicaciones cardiovasculares en el paciente con COVID-19Las complicaciones cardiovasculares son relativamente frecuentes en los pacientes con COVID-19, sobre todo los más graves9. De hecho, se estima que hasta un 10-30% de los pacientes hospitalizados por COVID-19 presentan daño cardiaco agudo, y esto se asocia con una mayor mortalidad3-5. Además, los pacientes que ya sufren una enfer-medad cardiovascular establecida tienen un peor pronóstico5.
El síndrome cardiovascular agudo descrito en los pacientes hospitalizados por COVID-19 presenta manifestaciones clínicas muy diversas. Entre estas se incluyen el síndrome coronario agudo (con y sin elevación del segmento ST), el daño miocárdico agudo (elevación de troponinas con coronarias normales), las arritmias (principalmente FA, taquicardia ventricular, fibrilación ventricular y bloqueo com-pleto), la insuficiencia cardiaca (de novo o descompensación de un paciente con insuficiencia cardiaca crónica), pericarditis/derrame pericárdico y complicaciones tromboembólicas (tromboembolia arterial, trombosis venosa profunda, trombo intracardiaco, trombo microvascular, embolia pulmonar e ictus)20.
El daño miocárdico agudo se caracteriza por aumento de los valores séricos de troponina. En general, el incremento de troponina no se debe tanto a una trombosis de las arterias coronarias, sino a multiples factores, que incluyen miocarditis, tormenta de citocinas, miocardiopatía inducida por estrés, trombosis microvascular, hipotensión (shock), taquiarritmias, hipoxemia y el antecedente de enfermedad cardiovascular20. También se ha descrito un mayor riesgo de trombo-sis del stent23. Por otra parte, es de destacar que, durante el periodo de confinamiento en España, se ha descrito una reducción de hasta el 50% en el número de procedimientos diagnósticos y terapéuticos coronarios, con el aumento del riesgo de morbimortalidad que esto supone24. Por lo tanto, y con vistas a reducir el riesgo de las posibles complicaciones cardiovasculares, es imprescindible, entre otras medidas, el empleo de los fármacos que proporcionen una mayor protección integral, que faciliten la adherencia terapéutica y requieran menos controles por su más previsible acción.
Con respecto al riesgo de arritmias, aproximadamente un 7-17% de los pacientes ingresados refieren palpitaciones, y hasta la mitad de los sujetos ingresados en las unidades de cuidados intensivos presentan FA9,25,26. En una encuesta realizada a cerca de 1.200 médicos provenientes de 76 países, la FA fue la taquiarritmia comunicada con más frecuencia, el 20% de los pacientes hospitalizados por COV1D-1927. Asimismo, los pacientes con FA previa tienen un mayor riesgo de sufrir tanto la COVID-19 como sus complicaciones, muerte y episodios tromboembólicos28-30. De hecho, al igual que ha ocurrido con el síndrome coronario agudo, se ha descrito un nfradiagnóstico de los casos de FA durante el confinamiento, y esto se ha asociado con mayor riesgo de ictus isquémico y muerte31. Así, un estudio danés objetivó que, respecto al año previo, se encontró un 47% menos nuevos casos de FA durante el confinamiento. Durante este periodo, el 5,3% de los pacientes con FA tuvieron un ictus y el 2,7% murió frente al 4,3 y el 1,3%, respectivamente, del año anterior (riesgo relativo [RR] = 1,41; intervalo de confianza del 95% [1C95%], 0,93-2,12)31. Por otra parte, ciertos fármacos que se han empleado para el tratamiento de la COVID-19 tienen un potencial riesgo proarrítmico26, por lo que es especialmente importante ser cuidadosos con el riesgo de interacciones entre los fármacos antivirales, antiarrítmicos, anticoagulantes y otros tratamientos como antieméticos o neurolépticos, entre otros, escogiendo los fármacos con menos posibilidad de interacciones clínicamente significativas9,32,33. En este contexto, la Sociedad Española de Cardiología ha desarrollado la aplicación InterAApp, que permite conocer las potenciales interacciones farmacológicas de los diferentes anticoagulantes orales34.
Anticoagulación del paciente con COVID-19Como ya se ha comentado, la incidencia de trombosis, sobre todo en los pacientes críticos, es elevada. Incluso los episodios trombóticos ocurren a pesar de la profilaxis con heparinas de bajo peso molecular (HBPM)35,36. Afortunadamente, diversos estudios muestran que el tra-tamiento anticoagulante es capaz de reducir la mortalidad de los pacientes ingresados por COVID-1937. Por lo tanto, es necesario identi-ficar el riesgo de episodios trombóticos para poder iniciar el trata-miento anticoagulante lo antes posible y disminuir el riesgo de posi-bles complicaciones35. Diferentes autores y consensos recomiendan para los pacientes hospitalizados el inicio de HBPM, ajustando la dosis en función del riesgo trombótico de cada sujeto (gravedad de la enfermedad, edad, inmovilización, obesidad, necesidad de tratamiento anticoagulante, etc.). Asimismo, para los pacientes que estuviesen tomando tratamiento anticoagulante previo, recomiendan suspender la anticoagulación oral e iniciar el tratamiento con HBPM o heparina no fraccionada10,33,38,39. Esta última recomendación se debe, fundamentalmente, al grado de gravedad y el potencial riesgo de interacciones con los fármacos antivirales (antagonistas de la vitamina K [AVK] y anticoagulantes orales de acción directa [ACOD]), así como con la dificultad de mantener la 1NR en rango terapéutico (AVK), aun-que podría ser una alternativa razonable para pacientes estables para quienes no se esperan procedimientos invasivos, antes del alta33,40.
Según las recomendaciones del Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología, al alta hospitalaria, para los pacientes que no necesiten tratamiento anticoagulante a largo plazo, se recomienda continuar con HBPM a dosis profilácticas o terapéuticas en función del riesgo trombótico, durante 7-10 días, fomentando la movilización precoz. En cambio, para los pacientes que requieran anticoagulación a largo plazo, si se va a seguir con medicación que tenga un potencial riesgo de interacciones farmacológicas relevantes, se continuará con HBPM. Sin embargo, si el paciente tomaba AVK pre-viamente y tenía un buen control previo o tuviese una prótesis mecánica, podría continuar con AVK. No obstante, si el paciente no estuviese anticoagulado previamente, tomara ACOD anteriormente y no existie-sen interacciones medicamentosas relevantes, tuviese un mal control previo de la 1NR con AVK o se quisiera evitar realizar los controles periódicos de la anticoagulación del 1NR para disminuir el riesgo de exposición a la COV1D-19, se iniciaría la anticoagulación con ACOD33.
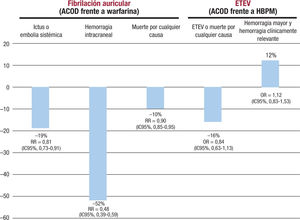
Independientemente de su mayor facilidad de manejo, los ACOD presentan un mejor perfil de beneficio-riesgo. Así, en el clásico metanálisis de Ruff de los 4 ensayos clínicos pivotales de los ACOD frente a la warfarina en pacientes con FA, en conjunto, los ACOD redujeron en un 19% el riesgo de ictus o embolia sistémica (RR = 0,81; 1C95%, 0,73-0,91), en un 51% el riesgo de ictus hemorrágico (RR = 0,49; 1C95%, 0,38-0,64), la mortalidad por cualquier causa en un 10% (RR = 0,90; 1C95%, 0,85-0,95) y la hemorragia intracraneal en un 52% (RR = 0,48; 1C95%, 0,39-0,59) (figura 1)41.
Eficacia y seguridad de los anticoagulantes orales de acción directa frente a la warfarina en pacientes con fibrilación auricular y frente a las heparinas de bajo peso molecular para la prevención de la enfermedad tromboembólica venosa. Datos de metanálisis41,42. ACOD: anticoagulantes orales de acción directa; ETEV: enfermedad tromboembólica venosa; HBPM: heparinas de bajo peso molecular; IC95%: intervalo de confianza del 95%; OR: odds ratio; RR: riesgo relativo.
Por otra parte, en un metanálisis realizado en pacientes ingresados por enfermedad médica en el que se analizaron los ensayos clínicos de fase III de ACOD frente a HBPM para la prevención de la enfermedad tromboembólica venosa, el tratamiento con ACOD se asoció con una reducción no significativa del 16% en el riesgo de enfermedad tromboembólica venosa y muerte por cualquier causa (odds ratio [OR] = 0,84; IC95%, 0,63-1,13), sin un incremento significativo en el riesgo de hemorragia mayor y hemorragia clinicamente relevante (OR = 1,12; IC95%, 0,83-1,53) (figura 1)42.
Asimismo, en un metanálisis realizado tras el alta hospitalaria de pacientes con riesgo de tromboembolia venosa, en el que se incluyeron ensayos clínicos de fase III que comparaban el uso extendido de los ACOD al alta frente a placebo para la prevención de la tromboembolia venosa, se objetivó una reducción del 21% en el riesgo de la variable compuesta tromboembolia venosa y mortalidad (OR = 0,79; IC95%, 0,69-0,91 ) y un 38% en el riesgo de tromboembolia venosa sintomática no mortal (OR = 0,62; IC95%, 0,47-0,83), si bien hubo un incremento de las hemorragias mayores (OR = 1,92; IC95%, 1,35-2,73)43. En el estudio MARINER, el rivaroxabán redujo significativamente el riesgo de tromboembolia venosa sintomática no mortal en un 54% (hazard ratio [HR] = 0,44; IC95%, 0,22-0,89) a los 45 días del alta hos-pitalaria44.
Papel del rivaroxabán en la prevención de las complicaciones cardiovascularesNumerosos ensayos clínicos y estudios en la práctica clínica demuestran el papel beneficioso del rivaroxabán en todo el espectro de la enfermedad cardiovascular, incluyendo la prevención del ictus en los pacientes con FA, la prevención y el tratamiento de la enfermedad tromboembólica venosa y la reducción en el riesgo de episodios adversos cardiovasculares mayores (MACE: muerte cardiovascular, ictus o infarto de miocardio) en los pacientes con enfermedad cardiovascular ateroesclerótica.
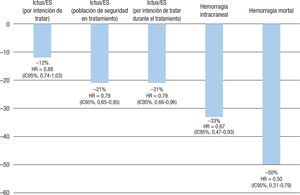
El estudio ROCKET-AF se realizó para conocer la eficacia y la seguridad del rivaroxabán 20 mg 1 vez al día (15 mg en caso de aclaramiento de creatinina 30-49 ml/min) frente a warfarina en 14.264 pacientes con FA no valvular y un alto riesgo de ictus. De hecho, el CHADS2 medio de los pacientes fue 3,5, claramente superior al de los ensayos clínicos con otros ACOD. Tras casi 2 años de seguimiento, el rivaroxabán fue al menos tan eficaz como la warfarina en la prevención de ictus o embolia sistémica (HR = 0,88; IC95%, 0,74-1,03; p < 0,001 para no inferioridad y p = 0,12 para superioridad en el análisis por intención de tratar; HR = 0,79; IC95%, 0,65-0,95; p = 0,02 para superioridad en el análisis de población de seguridad en tratamiento). En cuanto al riesgo de hemorragias, tanto las hemorragias mayores como las hemorragias clínicamente no relevantes ocurrieron de manera similar en ambos grupos de tratamiento. Sin embargo, en comparación con warfarina, los pacientes tratados con rivaroxabán presentaron un menor riesgo de hemorragias intracraneales (HR = 0,67; IC95%, 0,47-0,93; p = 0,02) y mortales (HR = 0,50; IC95%, 0,31-0,79; p = 0,003) (figura 2)45. Asimismo, en los pacientes con diabetes, el rivaroxabán redujo significativamente (20%) la mortalidad cardiovascular (HR = 0,80; IC95%, 0,64-0,99) en comparación con la warfarina, cosa que no se ha objetivado con los otros ACOD46-48.
Eficacia y seguridad del rivaroxabán frente a la warfarina en el estudio ROCKET-AF45. ES: embolia sistémica; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
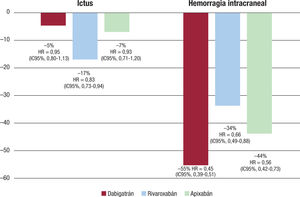
Los resultados obtenidos en el ensayo clínico ROCKET-AF se han visto confirmados en los estudios de práctica clínica habitual. Así, en un metanálisis de 27 estudios diferentes provenientes de 30 publica-ciones de pacientes con FA no valvular tratados con ACOD frente a AVK, se observó una reducción significativa del 17% en el riesgo de ictus y del 34% en el riesgo de hemorragia intracraneal con rivaroxa-ban (figura 3)49. Las discrepancias en la eficacia de los diferentes ACOD en la práctica real podría estar en relación con diferencias en la correcta dosificación entre los distintos ACOD en la práctica clínica50,51.
Riesgos de ictus y hemorragia intracraneal de los anticoagulantes orales de acción directa frente a la warfarina en los pacientes de la práctica clínica. Datos metanálisis49. HR: hazard ratio; IC95%: intervalo de confianza del 95%.
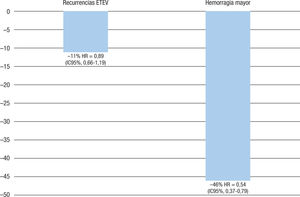
El tratamiento clásico de la enfermedad tromboembólica venosa consiste en la administración de HBPM seguida de AVK. En un análisis combinado de los estudios EINSTEIN-DVT y EINSTEIN-PE, con 8.282 pacientes, en comparación con el tratamiento estándar, el rivaroxabán (15 mg 2 veces al día durante 21 días, seguidos de 20 mg 1 vez al día) tuvo una eficacia similar a la del tratamiento estándar con respecto a las recurrencias de enfermedad tromboembólica venosa (HR = 0,89; IC95%, 0,66-1,19), pero con un menor riesgo de hemorragias mayores (HR = 0,54; IC95%, 0,37-0,79; p = 0,002). Además, estos resultados coincidieron en diferentes subgrupos de riesgo, como los pacientes frágiles o con antecedentes de cáncer (figura 4)52. Estos resultados también se han confirmado en los estudios en práctica clínica real. Así, en el registro XALIA, en el que se incluyó a 5.142 pacientes de 21 países con trombosis venosa profunda con o sin embolia de pulmón, en comparación con el tratamiento estándar, la frecuencia de hemorragia mayor fue del 0,8% en el grupo de rivaroxabán y el 2,1% en el de tratamiento estándar (HR = 0,77; IC95%, 0,40-1,50; p = 0,44), mientras que las frecuencias de recurrencia de la tromboembolia venosa fueron del 1,4 y el 2,3% respectivamente (HR = 0,91; IC95%, 0,54-1,54; p = 0,72). Asimismo se observó una tendencia a menos mortalidad entre los pacientes tratados con rivaroxabán (HR = 0,51; IC95%, 0,24-1,07; p = 0,074)53. Por lo tanto, el rivaroxabán supone una ventaja sobre el tratamiento estándar54.
Eficacia y seguridad del rivaroxabán frente al tratamiento estándar en el análisis combinado de los estudios EINSTEIN-DVT y EINSTEIN-PE. Figura elaborada con datos de Prins52. ETEV: enfermedad tromboembolica venosa; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
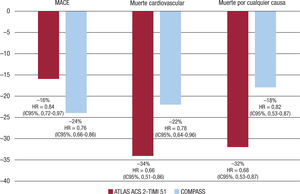
En cuanto a la enfermedad cardiovascular ateroesclerótica, el rivaroxabán se ha estudiado tanto en el contexto agudo como en el crónico. En el estudio ATLAS ACS 2-TIMI 51, se incluyó a 15.526 pacientes con un síndrome coronario agudo reciente (los pacientes fueron incluidos en la primera semana tras el evento). Se aleatorizó a los pacientes a rivaroxabán 2,5 mg 2 veces al día, rivaroxabán 5 mg 2 veces al día o placebo añadidos al tratamiento estándar. La mitad de los pacientes habían tenido un síndrome coronario agudo con elevación del segmento ST; el 26%, un síndrome coronario agudo sin elevación del ST y el 24%, angina inestable. Además de ácido acetilsalicílico, el 93% tomaba una tienopiridina. Tras un seguimiento medio de 13,1 meses, el tratamiento con rivaroxabán 2,5 mg redujo el riesgo de MACE en un 16% en comparación con placebo (HR = 0,84; 1C95%, 0,72-0,97), el riesgo de muerte cardiovascular en un 34% (HR = 0,66; 1C95%, 0,51-0,86), de muerte por cualquier causa en un 32% (HR = 0,68; 1C95%, 0,53-0,87) y de trombosis del stent en un 35% (HR = 0,65; 1C95%, 0,45-0,94) (figura 5), si bien hubo un aumento del riesgo de hemorragia mayor no relacionada con la cirugía de revascu-larización coronaria (HR = 3,46; 1C95%, 2,08-5,77) y hemorragia intra-craneal (HR = 2,83; 1C95%, 1,02-7,86), pero no de hemorragia mortal (HR = 0,67; 1C95%, 0,24-1,89)55.
En el estudio COMPASS se incluyó a 27.395 pacientes con enfermedad vascular ateroesclerótica estable (enfermedad coronaria o enfer-medad arterial periférica). Se aleatorizó a los pacientes a rivaroxabán 2,5 mg 2 veces al dia más ácido acetilsalicílico 100 mg/día, rivaroxabán 5 mg 2 veces al día o ácido acetilsalicílico 100 mg/día. Tras 23 meses de seguimiento (el estudio se interrumpió precozmente), en comparación con el ácido acetilsalicílico en monoterapia, la combinación de rivaroxabán más ácido acetilsalicílico redujo en un 24% el riesgo de MACE (HR = 0,76; 1C95%, 0,66-0,86), el de ictus en un 42% (HR = 0,58; 1C95%, 0,44-0,76), el de hospitalización cardiovascular un 8% (HR = 0,92; 1C95%, 0,86-1,00), el de muerte cardiovascular un 22% (HR = 0,78; 1C95%, 0,64-0,96) y el de muerte por cualquier causa un 18% (HR = 0,82; 1C95%, 0,71-0,96) (figura 5). En cuanto a la seguridad, el riesgo de hemorragias mayores fue superior con la combinación de rivaroxabán y ácido acetilsalicílico que con el ácido acetilsalicílico en monoterapia (HR = 1,70; 1C95%, 1,40-2,05), pero similar en cuanto a las hemorragias intracraneales (HR = 1,10; 1C95%, 0,59-2,04) o morta-les (HR = 1,49; 1C95%, 0,67-3,33). El beneficio clínico neto (MACE, hemorragia mortal o hemorragia sintomática en órgano crítico) fue claramente superior con la combinación de rivaroxabán más ácido acetilsalicílico (HR = 0,80; 1C95%, 0,70-0,91)56. Estos resultados bene-ficiosos del rivaroxabán en los pacientes con enfermedad cardiovascular ateroesclerótica se explicaría porque en la etiopatogenia de la aterotrombosis no solo interviene la agregación plaquetaria, sino también la cascada de la coagulación, en la que el factor X tiene un papel fundamental57,58. Por lo tanto, la clave para una mayor protección cardiovascular para el paciente con enfermedad cardiovascular ateroesclerótica de riesgo moderado a alto consistiria en la doble vía de inhibición mediante ácido acetilsalicílico y rivaroxabán59,60. El beneficio obtenido no parece un efecto de clase de los ACOD, sino que podría tratarse de un aspecto diferencial de la dosis vascular de rivaroxabán. Así, un metanálisis de 28 ensayos clínicos, con cerca de 200.000 pacientes incluidos, objetivó que los pacientes con menor riesgo de infarto de miocardio eran los tratados con rivaroxabán, seguidos de los que estaban con apixabán y edoxabán, con un mayor riesgo para los AVK y el dabigatrán61. De hecho, en un metanálisis de 9 ensayos clínicos realizados en diferentes contextos clínicos (FA, síndrome coronario agudo, prevención de trombosis venosa profunda y tratamiento de la trombosis venosa profunda/embolia pulmonar) que compararon el rivaroxabán con la enoxaparina o placebo, el rivaroxabán redujo un 18% el riesgo de infarto de miocardio (OR = 0,82; 1C95%, 0,72-0,94)62, lo que refuerza su efecto protector en la cardiopatía isquémica. En España, el estudio EM1R (Estudio observacional para la identificación de los factores de riesgo asociados a episodios cardio-vasculares Mayores en pacientes con FA no valvular tratados con Rivaroxabán) mostró que el tratamiento con rivaroxabán en sujetos con FA se asocia con bajas tasas de ictus, hemorragia mayor y episodios car-diovasculares63.
Finalmente, uno de los principales motivos señalados para el cambio a HBPM para el paciente ingresado por COV1D-19 son las posibles interacciones con los tratamientos antivirales, muchos de los cuales ya han sido desechados por su falta de eficacia. El rivaroxabán es sus-trato de la P-gp y se metaboliza aproximadamente en un 18% por el CYP3A4 («18%)64, lo que hace que el riesgo de interacciones potencial-mente significativas con los fármacos que actualmente se prescriben sea bajo en el caso de tocilizumab o inexistente en el caso del rem-desivir (tabla 2)65.
Interacciones del rivaroxabán con posibles tratamientos anti-COVID-19
| Interacción potente (no se recomienda la administración simultánea) | Atazanavir y lopinavir/ritonavir (potentes inhibidores de CYP3A4 y Pgp) |
| Interacción potencial (monitorización adicional) | Dexametasona |
| Interacción potencial (monitorización adicional) | Anakinra, azitromicina, canakinumab, cloroquina, hidroxicloroquina, sarilumab y tocilizumab |
| No interacción significativa | Baricitinib, favipiravir, hidrocortisona (oral o intravenosa), interferón beta, ivermectin, nitazoxanida, plasma convaleciente, remdesivir, ribavirina y ruxolitinib |
Tabla elaborada con datos del informe del Liverpool Drug Interactions Group65
En consecuencia, si bien es cierto que falta evidencia clínica sólida sobre la seguridad en los pacientes ingresados por COV1D-19, en general, se podría afirmar que, salvo que se empleara alguno de los fármacos con interacciones significativas, el rivaroxabán podría prescribirse como tratamiento anticoagulante de manera segura.
ConclusionesLas complicaciones cardiovasculares en los pacientes con COVID-19 son frecuentes, sobre todo los más graves. Entre las complicaciones cardiovasculares se incluyen el síndrome coronario agudo, la FA y las complicaciones tromboembólicas. En consecuencia, dada la dimensión de la pandemia, es necesario ser más eficientes en la prevención de la trombosis. En este contexto, el rivaroxabán se ha demostrado eficaz y seguro en todo el espectro de la enfermedad cardiovascular (FA, enfermedad tromboembólica venosa y enfermedad cardiovascular atereosclerótica), por lo que es una buena alternativa para la prevención de las complicaciones trombóticas y cardiovasculares en la época COVID-19.
Conflicto de interesesI. Fernández Lozano ha participado en estudios clínicos patrocinados por Medtronic, Abbott y Biotronik, ha participado en un comité asesor de Bayer durante 2020 y tiene becas para fellows patrocinadas por la SEC y la Fundación Interhospitalaria para la Investigación Cardiovascular.
Á. Cequier Fillat ha recibido becas o Ayudas Institucionales para Investigación de Abbott Vascular, Biomenco Spain, Biosensors International, Boston Scientific, Cordis, Medtronic, Orbus Neich y Sociedad Española de Cardiología, y honorarios por conferencias/consultorías de Abbott Vascular, AstraZeneca, Amgen, Bayer, Biosensors International, Biotronik, Boehringer Ingelheim, Daiichi-Sankyo, Ferrer International, Medtronic, Sanofi y Terumo.
V. Expósito García no declara conflictos de intereses en relación con este artículo.
J. Masjuan ha recibido honorarios por asesorías y conferencias con Bayer, Pfizer, BMS, Daichii Sankyo y Boehringer Ingelheim.
I. Roldán Rabadán ha recibido honorarios por consultoría de Bayer y Boehringer Ingelheim y por ponencia de Bayer, BMS-Pfizer, Daiichi-Sankyo Boehringer Ingelheim y AstraZeneca.
R. Freixa-Pamias ha recibido honorarios por ponencias de Bayer, Boehringer-Ingelheim, Daiichi Sankyo y Pfizer-BMS.
A. I. Pérez Cabeza ha recibido honorarios como asesor para Daiichi Sankyo, Bayer Hispania y Boehringer Ingelheim.
A. Valle Muñoz ha recibido honorarios por ponencias de Bayer, Boehringer-Ingelheim, Daiichi Sankyo y Pfizer-BMS.
C. Suárez ha recibido honorarios como ponente y/o asesoramiento de Bayer, Pfeizer/BMS y Daiichi Sankyo.
AgradecimientosContent Ed Net (Madrid) proporcionó asistencia editorial en la redacción de este manuscrito, con financiación de Bayer Hispania.