Palabras clave
INTRODUCCION
La aterosclerosis es una enfermedad sistémica y difusa del árbol arterial con manifestaciones locales causantes de los episodios clínicos (p. ej., infarto de miocardio, ictus, etc.). Las lesiones vulnerables (placas de alto riesgo) se caracterizan por un amplio núcleo necrótico, una capa fibrosa fina (fibroateroma) y un infiltrado inflamatorio (monocito/macrófagos, linfocitos T, mastocitos). Aunque la rotura de la placa fibrosa es la causa principal de trombosis intraluminal en los síndromes coronarios agudos y ocasiona el 75% de la mortalidad tras el infarto agudo de miocardio, también se han observado trombosis en placas erosionadas y en placas con nódulos calcificados1,2. En pacientes de alto riesgo, la vulnerabilidad de la placa es un fenómeno multifocal que implica diversas lesiones en el árbol coronario. En la práctica clínica, estas características patológicas son difíciles de discernir, por lo que en la actualidad los esfuerzos encaminados a la identificación del paciente vulnerable se basan en el empleo de biomarcadores, que pueden ser de 3 tipos: a) imágenes (p. ej., resonancia magnética, tomografía óptica coherente, imagen molecular, etc.), para caracterizar la composición de la placa de ateromas y detectar placas vulnerables; b) funcionales, que reflejan la homeostasis vascular (p. ej., engrosamiento arterial, respuesta vasodilatadora dependiente del endotelio), y c) circulantes, basados en la determinación en sangre de marcadores de inflamación, estrés oxidativo y trombosis3-6. El empleo de biomarcadores de remodelado de la matriz extracelular (MEC) ha sido menos estudiado, si bien la MEC proporciona la plataforma estructural y funcional de los vasos sanguíneos, por lo que las alteraciones en su síntesis y/o degradación serán clave en el desarrollo de la lesión aterosclerótica, el remodelado vascular y la rotura de la placa7,8. Esto ha llevado a que se propongan algunas MMP como biomarcadores potenciales de progresión aterosclerótica, como la proteína plasmática A asociada al embarazo (PAPP-A)9. El desequilibrio entre las moléculas y los factores que inducen la degradación de la MEC y las que favorecen su síntesis y acumulación será, por consiguiente, de gran relevancia en el desarrollo de los síndromes clínicos aterotrombóticos.
FISIOLOGIA DE LA MATRIZ EXTRACELULAR
En la pared arterial predominan los colágenos tipo I y III, así como los macrófagos y las células musculares lisas, que son los tipos celulares que gobiernan el remodelado de la MEC. Otras proteínas que contribuyen a la síntesis de MEC son la fibronectina, la laminina, la elastina y los proteoglucanos. El balance entre síntesis y degradación de la MEC está regulado por el equilibrio ente las proteasas que favorecen la degradación (MMP) y sus inhibidores (TIMP) (fig. 1). Las MMP son una familia de endopeptidasas dependientes de cinc, producidas por diversos tipos celulares (endotelio, músculo liso y monocitos), que degradan numerosos componentes de la MEC y otras proteínas no relacionadas. Las MMP se sintetizan y secretan como proenzimas inactivas y poseen un dominio propeptídico rico en cisteínas, capaz de plegarse e interactuar con el Zn++ del dominio catalítico, lo que impide su actividad enzimática. La activación de las MMP requiere la escisión del dominio propeptídico. Se clasifican en subgrupos basados en su estructura, especificidad por el sustrato y unión a membranas (tabla 1): colagenasas (MMP-1, 8 y 13), estromalisinas (MMP-3, 10 y 11), gelatinasas (MMP-2 y 9), tipo membrana (MT-MMP) y otras (matrilisina, metaloelastasa, etc.)10. La actividad de las MMP está regulada, dentro y fuera de las células, de 3 formas: transcripcional, postraduccional y a través de interacción con inhibidores específicos. Diversos factores de crecimiento, citocinas, trombina y hormonas aumentan su expresión transcripcional, mientras que la heparina, el factor transformante beta (TGFβ) y los corticoides la inhiben11,12. La activación extracelular de cimógenos latentes (pro-MMP) representaría el segundo punto de control: el principal activador fisiológico de las MMP es la plasmina, que convierte las formas latentes en activas mediante proteolisis del enlace propéptido y la exposición del dominio catalítico13. Otras enzimas, como la trombina, el factor Xa y las propias MMP también poseen la capacidad de activar MMP. Finalmente, hay un control de la actividad de MMP mediado por inhibidores específicos (TIMP), de los que se han descrito 4 miembros (TIMP-1, 2, 3 y 4). Los TIMP inhiben las MMP mediante unión irreversible a la forma activa de la enzima. En resumen, el balance proteolítico dependerá de la concentración relativa de activadores e inhibidores13 (fig. 1).
Fig. 1. Síntesis y degradación de la matriz extracelular (MEC) en aterosclerosis: balance metaloprotesas (MPP)/inhibidores de las metaloproteasas (TIMP).
MATRIZ EXTRACELULAR Y ATEROTROMBOSIS
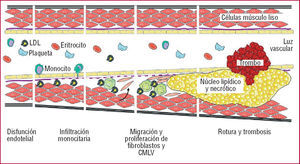
El equilibrio entre MMP/TIMP es crítico para el mantenimiento de la integridad del sistema cardiovascular13-16, lo que ha llevado a proponer que las alteraciones de éste, que favorecen la degradación de la MEC, contribuyen a la progresión de la aterosclerosis y a la inestabilidad de la placa17. Se ha constatado la participación de las MMP en distintos mecanismos fundamentales en la progresión aterotrombótica (fig. 2):
Fig. 2. Proceso aterosclerótico. LDL: lipoproteínas de baja densidad; CMLV: células de músculo liso vascular.
Las MMP favorecen la infiltración monocitaria de la pared vascular, de forma que un aumento en la expresión de determinadas MMP, como la MMP-12, conlleva una mayor infiltración macrofágica, con rotura de la lámina elástica interna y aceleración del proceso aterosclerótico18.
La inducción y la activación de las MMP, en particular la MMP-14 (MT1-MMP), favorecen la invasión de las células de músculo liso vascular y los fibroblastos, un proceso importante en el desarrollo de la hiperplasia intimal, al facilitar la migración y proliferación de estos tipos célulares19,20.
La actividad de las MMP-2 y 9, entre otras, resulta indispensable para la neovascularización de la placa aterosclerótica, un proceso asociado con la vulnerabilidad de las lesiones avanzadas inducido por estímulos proangiogénicos e inflamatorios, y que parece necesario para su crecimiento21,22.
El papel de las metaloproteasas en la formación y la resolución del trombo aún no se ha definido completamente (fig. 3). Se ha observado que la reducción anormal de la actividad ADAMTS-13 favorece la aparición de microangiopatías trombóticas23, y hay evidencias de interacciones moleculares de las MMP (MMP-3) con enzimas, sustratos e inhibidores del sistema fibrinolítico, que indican un papel de las MMP en la regulación de este sistema24, por lo que podrían desempeñar un papel en diversas enfermedades trombóticas. Finalmente, el propio trombo puede constituir una fuente de actividad proteolítica, con relevancia en el proceso aterotrombótico25.
Fig. 3. Representación esquemática del papel de las metaloproteasas en la trombosis y la fibrinolisis. MEC: matriz extracelular; MMP: metaloproteasa; PAI-1: inhibidor del activador del plasminógeno tipo 1; TAFI: inhibidor de la fibrinolisis activado por trombina; TIMP: inhibidores tisulares de metaloproteasas; t-PA: activador tisular del plasminógeno; u-PA: urocinasa. Modificado de Lijnen24.
La relevancia fisiopatológica de las alteraciones en el metabolismo de la MEC en el desarrollo de síndromes aterotrombóticos está apoyada por numerosas pruebas científicas. Es interesante considerar que la trombosis intravascular y el infarto agudo de miocardio son consecuencias poco frecuentes de la reestenosis, una de las limitaciones de la revascularización coronaria percutánea, cuando la placa reestenótica que resulta principalmente de la rápida proliferación de las células de músculo liso vascular y la acumulación de matriz extracelular en el lugar de la lesión presenta una baja frecuencia de rotura y raramente expresa la gelatinasa 2 (MMP-9)26. Por el contrario, la evolución de la placa aterosclerótica desde la estría grasa a la placa avanzada e inestable es un proceso lento, que se asocia tanto con el incremento de su contenido celular y de matriz como con el aumento de la actividad proteolítica, principalmente en los macrófagos y las células de músculo liso vascular localizados en los hombros de la lesión y alrededor del núcleo necrótico, con mayor expresión y concentración de MMP, fundamentalmente MMP-1 (colagenasa) y MMP-927,28. Asimismo, se ha observado un incremento de MMP-9 en las placas coronarias de pacientes con angina inestable respecto a los pacientes con angina estable29,30, y esta gelatinasa se ha relacionado con el remodelado ventricular postinfarto31,32. También se ha constatado la elevación de las concentraciones de MMP-9 en el tejido cerebral humano tras el ictus isquémico y hemorrágico, así como la inducción de la MMP-9 en la vasculatura cerebral tras la fibrinolisis, lo que indica que la MMP-9 puede contribuir a las lesiones isquémicas cerebrales y al edema perihematoma, así como a las hemorragias cerebrales y lesiones neurovasculares secundarias a la fibrinolisis33,34. Todas estas alteraciones locales pueden ser detectables en el conjunto sistémico, ya que los pacientes con pruebas angiográficas de enfermedad coronaria presentan una alteración del balance fibrinolisis/proteolisis en la sangre periférica35, y por otra parte, se ha encontrado un aumento de la concentración urinaria de MMP-9 tras el infarto agudo de miocardio, asociado con la disminución del TIMP-136.
La expresión y actividad de la MMP-9 en la placa aterosclerótica, principalmente asociada con macrófagos, pueden ser una consecuencia del aumento de la producción de anión superóxido NADPH-dependiente, ya que coincide con la expresión de la NADPH oxidasa y la producción de radicales libres37. Sin embargo, las gelatinasas y la colagenasas no son las únicas MMP asociadas con la aterosclerosis, ya que nuestro grupo ha demostrado recientemente un aumento de MMP-10 (estromalisina 2) en placas carotídeas avanzadas procedentes de endarterectomía38, y la MMP-10 también se ha asociado con aneurismas aórticos, caracterizados por un remodelado destructivo de la MEC vascular y rotura de la pared39. Finalmente, la observación del aumento del TIMP-1 en áreas calcificadas de placas humanas ateroscleróticas40 también indica que la inhibición de la actividad MMP puede estar relacionada con una mayor estabilidad de la placa.
METALOPROTEASAS Y FACTORES DE RIESGO ATEROSCLEROTICO
La mayoría de los factores «clásicos» de riesgo aterosclerótico se han relacionado con cambios en las concentraciones de diversos biomarcadores de MEC, así como con el riesgo vascular global de Framingham41,42, si bien el mecanismo que relaciona ambos hechos no se ha establecido. Es posible que los factores de riesgo modulen la estructura vascular y la estabilidad de la placa, y que esto tenga influencia en las concentraciones de MMP o TIMP, o a través de una regulación de la producción de colágeno. Tampoco puede descartarse que los valores alterados de los biomarcadores sean un epifenómeno o una respuesta adaptativa al propio proceso aterosclerótico.
Edad y sexo
La edad avanzada y el sexo masculino se han relacionado con concentraciones elevadas de TIMP-141. La terapia hormonal redujo la concentración de MMP-9 en mujeres posmenopáusicas43.
Dislipemia
En el ámbito clínico, en el Framingham Heart Study se ha observado que la MMP-9 sólo resulta detectable en un 20% de los sujetos, en los que se asocia con el colesterol unido a lipoproteínas de baja densidad (cLDL)42, mientras que el TIMP-1 se detecta en todos los sujetos y se asocia con el cociente colesterol total/colesterol unido a lipoproteínas de alta densidad (cHDL)41. En sujetos con hipercolesterolemia familiar se ha observado un aumento de los valores circulantes de MMP-3 y 9, y TIMP-1, particularmente en los sujetos que presentan un mayor riesgo cardiovascular, en los que las concentraciones séricas de MMP-3 y TIMP-1 se asocian con la presencia de lesiones ateroscleróticas en la carótida44. Además, los valores anormalmente elevados de MMP-9 en sujetos con hipercolesterolemia familiar y enfermedad coronaria pueden reducirse a través del tratamiento con estatinas, aunque no se ha observado una correlación entre la reducción de MMP y el descenso en las concentraciones de colesterol45.
En condiciones experimentales, se ha demostrado que la expresión vascular de MMP-1 tras la angioplastia aumenta en un modelo de hipercolesterolemia porcina, posiblemente como consecuencia del estrés oxidativo46. Por otra parte, in vitro, las LDL oxidadas incrementan la producción endotelial de MMP-1, 3 y 9, mientras que disminuyen la de TIMP-1 y, por el contrario, las HDL reducen la producción de varias MMP47,48. En los monocitos/macrófagos se ha observado que las LDL oxidadas sinergizan con factores proinflamatorios para inducir la expresión de MMP-1 y MMP-9, mientras que las HDL previenen la inducción de la MMP-1 por estos mismos agentes49.
Diabetes, obesidad y síndrome metabólico
Se ha observado aumento de MMP-9 y TIMP-1 en pacientes diabéticos y con síndrome metabólico50,51. En estudios experimentales se ha observado que las concentraciones elevadas de glucosa inducen la expresión de MMP-1 y 2 por células endoteliales y de MMP-9 por macrófagos, sin efecto en el TIMP-152. En un estudio clínico en pacientes diabéticos, el control de la glucemia y de los factores de riesgo aterosclerótico redujo el TIMP-1 sin modificar MMP-9 o TIMP-253.
La concentración de TIMP-1, pero no de MMP-9, se ha relacionado con el índice de masa corporal41. Finalmente, en un estudio realizado en mujeres obesas se observó un descenso de MMP-1 un año después de practicar una reducción gástrica54.
Hipertensión arterial
Se ha observado un aumento de MMP-9 circulante, pero también de TIMP-1 en sujetos con hipertensión y engrosamiento de la pared arterial55. En la hipertensión arterial, habría un patrón caracterizado por un incremento de la síntesis de colágeno y una reducción de su degradación56.
Tabaco y alcohol
Hay un aumento de MMP-9 y TIMP-1 en fumadores, en parte relacionado con la duración de la exposición al tabaco57. No se ha observado ninguna asociación entre la ingesta abusiva de alcohol y los valores circulantes de TIMP-1 y MMP-258, aunque sí se ha encontrado un aumento en la expresión de MMP-9 y 2 en los macrófagos alveolares, probablemente relacionado con el remodelado pulmonar en el contexto del síndrome de distrés respiratorio agudo59. Por otra parte, se ha podido observar una asociación inversa entre el consumo moderado de alcohol y las concentraciones circulantes de TIMP-141.
Inflamación
Diversos estímulos inflamatorios, como el TNFα y la interleucina 1, además de otros factores, regulan la expresión de MMP60. En estudios experimentales se ha demostrado que la proteína C reactiva (PCR), un biomarcador inflamatorio y de riesgo aterosclerótico, induce la expresión de MMP-1 por macrófagos y de MMP-10 por células endoteliales sin afectar a las concentraciones de TIMP-138,61. Se ha observado que los valores circulantes de MMP-9 en pacientes con enfermedad coronaria, superiores a los de los individuos sanos, presentan una asociación directa con marcadores de inflamación, como la concentración plasmática de PCR, interleucina 6 y fibrinógeno, mientras que no se observaron diferencias ni asociación para MMP-262. De manera similar, en otros estudios clínicos realizados en sujetos asintomáticos se han relacionado las concentraciones de PCR con las de MMP-9 y 10, pero no con las de MMP-2 o MMP-338. En un estudio reciente de nuestro grupo hemos demostrado que la PCR induce la expresión de MMP-1 y MMP-10 por células endoteliales humanas, y que sujetos asintomáticos con un perfil proinflamatorio muestran concentraciones elevadas de MMP-1038. La doxiciclina, que reduce la concentración de PCR, disminuye la actividad de MMP-963. Se ha propuesto que la infección de macrófagos o células musculares lisas con Chlamydia pneumoniae puede inducir la producción de MMP, ya que se ha observado una estrecha asociación entre la presencia de este germen y la inmunodetección de la MMP-9 en placas ateroscleróticas, si bien no se ha podido establecer una relación de causalidad64.
VALOR PRONOSTICO DE LOS BIOMARCADORES DE MATRIZ EXTRACELULAR
La cuantificación del turnover de la MEC en tejidos cardiovasculares presenta dificultades metodológicas y los diferentes procedimientos para evaluar la fibrosis/degradación en tejidos (p. ej., biopsia endomiocárdica, ultrasonidos intravasculares, etc.), además de invasivos, tienen una aplicabilidad limitada. Por otra parte, los biomarcadores circulantes de MEC no son específicos del tejido vascular y, además, dado que las MMP pueden unirse a la MEC, el incremento local no siempre se correlaciona con el sistémico. En el momento actual tampoco está suficientemente definido cuál, entre los casi 40 posibles biomarcadores de MEC, puede tener mayor valor pronóstico. Por ello, a la hora de establecer criterios de selección de biomarcadores con interés y aplicabilidad clínica debe tenerse en cuenta una serie de características: demostración científica de que el marcador refleja el remodelado de la MEC, evidencia de que se encuentran valores elevados en pacientes con enfermedad establecida, estabilidad en el plasma o el suero, estandarización del método y escasa variabilidad. Incluso, tras demostrar su buena reproducibilidad, los biomarcadores deben ser útiles en el diagnóstico, el pronóstico y el seguimiento terapéutico del proceso aterosclerótico3,4.
Varios estudios han señalado una asociación entre MMP y TIMP con un pronóstico adverso en un amplio grupo de enfermedades cardiovasculares65-68. Los biomarcadores circulantes más prometedores de degradación de la MEC son las MMP-9 (gelatinasa B) y 10 (estromalisina 2). Se ha demostrado que el aumento de MMP-9 predice el estrechamiento de la luz arterial, la reestenosis postendoprótesis y la muerte cardiovascular en pacientes con enfermedad coronaria69-72; también contribuye a la expansión y la rotura de aneurismas aórticos73,74, e incrementa el riesgo de transformación hemorrágica en pacientes con ictus75. Estos biomarcadores también pueden ofrecer información pronóstica en el ámbito de la prevención primaria. Así, MMP-9 predice cardiopatía isquémica y/o hipertensión arterial en sujetos sin enfermedad cardiovascular previa76 y nuestro grupo ha demostrado recientemente que la MMP-10 puede constituir un marcador de aterosclerosis subclínica, ya que se ha observado una correlación entre su concentración en el plasma y el espesor íntima-media de la arteria carótida en una amplia serie de pacientes sin historia cardiovascular previa77.
MATRIZ EXTRACELULAR COMO DIANA TERAPÉUTICA EN LA ATEROTROMBOSIS
La modulación de la proteolisis pericelular puede constituir una diana para la intervención terapéutica en el contexto de la aterosclerosis78. Quizá, el ejemplo más representativo del efecto de agentes terapéuticos sobre el remodelado vascular está representado por el tratamiento trombolítico, el cual ejerce una acción estimuladora de la expresión de MMP, vía plasmina, y degradación del colágeno79. También las estatinas reducen la concentración de MMP-9 y otras MMP80,81, así como los antagonistas del receptor de tipo 1 de la angiotensina II82, mientras que otros fármacos con acción cardiovascular, como el carvedilol y las tiazolidindionas, reducen la concentración de MMP-183,84. Algunos antibióticos, como la doxiciclina y las tetraciclinas, reducen la expresión vascular y sistémica de diversas MMP63 y los antioxidantes disminuyen la expresión de MMP-146.
Numerosas compañías farmacéuticas están, asimismo, interesadas en el desarrollo de inhibidores sintéticos de MMP, si bien no están disponibles para uso clínico85,86. Algunos estudios experimentales demuestran que la inhibición de MMP mediante el empleo de TIMP puede tener un efecto beneficioso al reducir la progresión de la placa aterosclerótica71,87. Además, la inhibición de MMP en fases avanzadas de la aterosclerosis puede proteger contra el desarrollo de placas inestables, la formación de aneurismas y la insuficiencia cardiaca88,89.
CONCLUSIONES
Numerosos estudios demuestran que el remodelado de la MEC en la pared arterial puede ser controlado mediante la determinación de las concentraciones circulantes de diversas MMP y TIMP. Estas moléculas podrían considerarse biomarcadores con utilidad pronóstica en relación con la recurrencia de cardiopatía isquémica, el desarrollo de insuficiencia cardiaca y la formación de aneurismas en sujetos con aterosclerosis clínica, pero también en sujetos asintomáticos con factores de riesgo y en pacientes con aterosclerosis subclínica. Estudios prospectivos en curso permitirán clarificar el papel diagnóstico y pronóstico de estos biomarcadores en las enfermedades vasculares y si pueden constituir nuevas dianas terapéuticas en la aterosclerosis.
Correspondencia: Dr. J.A. Rodríguez.
Laboratorio de Aterosclerosis. Área de Ciencias Cardiovasculares. CIMA.
Avda. Pío XII, 55. 31008 Pamplona. Navarra. España.
Correo electrónico: josean@unav.es