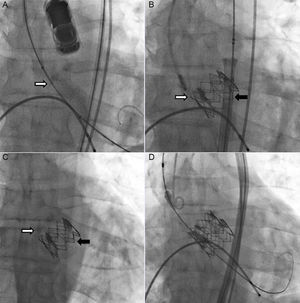
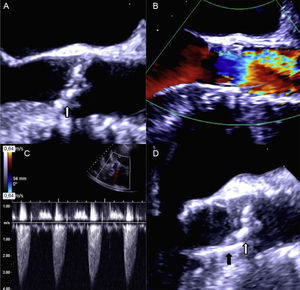
Un varón de 65 años con estenosis aórtica degenerativa grave (figura 1A y figura 2A) y función sistólica conservada fue evaluado por el equipo cardiológico de nuestro centro para un posible reemplazo quirúrgico de válvula aórtica o implante percutáneo de válvula aórtica (TAVI). Se optó por una intervención de TAVI, ya que presentaba una aorta intensamente calcificada. Antes de la intervención se obtuvo una angiotomografía computarizada (angio–TC) para elegir la vía adecuada y el tipo y el tamaño de la prótesis para la intervención. El paciente no tenía una arteriopatía periférica significativa, por lo que se optó por la vía transfemoral. El área de la raíz aórtica era de 430 mm2 en la angio–TC. El diámetro de la raíz aórtica medido con la ecocardiografía transesofágica bidimensional era de 24 mm. Por consiguiente, se optó por una válvula Edwards-SAPIEN XT de 26 mm. La intervención de TAVI se realizó (con ecocardiografía transesofágica) utilizando predilatación con balón y sin posdilatación, y no hubo complicaciones inmediatas. El balón se preparó según lo indicado en las recomendaciones del fabricante (es decir, sin preparación blanda, utilizando la menor cantidad de solución salina en el balón). La fluoroscopia (figuras 1A y B, ) y las ecocardiografías transesofágica y transtorácica (figuras 2A y B y ) confirmaron la apropiada colocación de la prótesis, con un gradiente medio de 9 mmHg y ausencia de fugas paravalvulares relevantes. Sin embargo, 24 h después de la intervención, se realizó una ecocardiografía transtorácica de seguimiento y se observó la aparición de novo de un gradiente aórtico medio de 42 mmHg (figura 2C). La válvula protésica había migrado retrocediendo hacia el tracto de salida, con lo que no cubría la válvula nativa, que volvía a ser funcionante (figura 1C y figura 2D, ). Se revisó el caso y se llegó a la conclusión de que se podría haber colocado la prótesis valvular en una posición ligeramente demasiado baja y podría haberse expandido de manera subóptima durante la intervención. Después de comentar el caso en el equipo cardiológico, se optó por una intervención valve-in-valve con una segunda válvula Edwards-SAPIEN XT de 26 mm (figura 1D y ). Esto permitió tratar con éxito la estenosis aórtica e impidió una mayor migración de la prótesis original. Se dio de alta al paciente 3 días después de la segunda intervención, y en el seguimiento realizado al cabo de un año no presentaba insuficiencia cardiaca y la prótesis tenía una función adecuada.
A: imágenes ecocardiográficas previas al implante. B: flujo a través de la prótesis inmediatamente después del implante. C: gradiente ventrículo izquierdo-aorta tras la migración de la prótesis. D: imagen bidimensional de la prótesis tras la migración. La flecha blanca señala el calcio de la válvula nativa. La flecha negra señala la prótesis. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La migración retrógrada de la válvula protésica tras TAVI es muy poco frecuente. Puede producirse durante la intervención1, en los primeros días tras ella2 o después3,4. El primer paso para poder resolverlo es identificar los factores que contribuyen a que la migración se produzca. Estos factores incluyen desde la colocación inadecuada de la prótesis (es decir, demasiado baja)1, hasta la expansión subóptima de la válvula, la calcificación desigual o insuficiente del anillo aórtico que haga que la fijación de la prótesis sea insuficiente, la regurgitación paravalvular aórtica, el tamaño insuficiente de la válvula4 y las válvulas bicúspides anatómicas o funcionales. En nuestro paciente, se consideró que la primera de ellas era la causa de la complicación, aunque no se puede asegurar que no se produjera también una expansión insuficiente. Es importante identificar las causas verdaderas de la migración, así como descartar otros posibles factores. Esto permite elegir soluciones apropiadas, a la vez que evita las que pueden ser lesivas. Por ejemplo, si se considera erróneamente que la causa de la migración es un tamaño valvular insuficiente, ello puede llevar al uso posterior de una válvula de tamaño excesivo, con gran riesgo de causar nuevos daños. Además, el uso de válvulas plenamente reposicionables puede reducir el riesgo de posición incorrecta y migración. También se plantea la posibilidad de que un implante directo (sin predilatación) pudiera reducir el riesgo de esta complicación.
Una vez determinadas las causas de la migración, el equipo cardiológico debe elegir rápidamente un abordaje quirúrgico o percutáneo, ya que las consecuencias de la migración valvular pueden ser catastróficas si la válvula va más allá del tracto de salida y se introduce en la cavidad del ventrículo izquierdo. En los pocos estudios que describen esta complicación, la cirugía fue el método preferido en casi todos los casos publicados. De hecho, encontramos solo un caso en el que este problema se resolvió con abordaje percutáneo5, pero fue un caso de tamaño valvular insuficiente y la complicación se produjo durante la intervención.
Aunque en nuestro caso se consideró la posibilidad de un abordaje quirúrgico, se pensó que una intervención valve-in-valve era la opción más segura para resolver el problema, ya que la prótesis no interfería en el aparato mitral, el paciente tenía aorta de porcelana y la migración era consecuencia de una expansión insuficiente de la válvula y una colocación ligeramente baja. La segunda prótesis se fijaría no solo al anillo nativo, sino también a la prótesis original, con lo que se impediría la migración de ambas válvulas. Este enfoque parece justificado, dada la evolución favorable del paciente.