Los coronavirus son virus de ARN monocatenarios que se distribuyen ampliamente en seres humanos y otros mamíferos. Aunque la mayoría de las infecciones por coronavirus humanos son leves, recientemente han causado 2 importantes pandemias: el síndrome respiratorio agudo grave (SARS) y el síndrome respiratorio del Medio Oriente (MERS), con tasas de mortalidad del 10 y el 37% respectivamente1. El coronavirus-2 del SARS (SARS-CoV-2) es un tipo de coronavirus descubierto y aislado por primera vez en diciembre de 2019 en Wuhan, China central, que es la causa de la pandemia actual denominada COVID-19.
Los síntomas comunes de la enfermedad son fiebre, tos, mialgia o disnea. Destacan entre las complicaciones más graves el síndrome de distrés respiratorio agudo (SDRA), la lesión cardiaca y la sobreinfección secundaria.
La fisiopatología de este virus continúa siendo desconocida. Múltiples estudios indican que los pacientes infectados por COVID-19 ttienen altas concentraciones de interleucina (IL) 1 beta, interferón (IFN) gamma, proteína 10 inducible por IFN (IP) y proteína quimiotáctica monocitaria (MCP) 1. Se ha demostrado que los pacientes más graves tienen mayores concentraciones del factor estimulador de colonias de granulocitos (GCSF), IP-10, MCP-1, proteína inflamatoria de macrófagos (MIP) 1A y factor de necrosis tumoral (TNF) alfa, lo que indica que la tormenta de citocinas podría determinar la gravedad de la enfermedad2. Cabe destacar que, entre los pacientes afectados por COVID-19, la concentración plasmática de IL-6 aumenta llamativamente en aquellos con lesión cardiaca3,4, al igual que la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) y las troponinas cardiacas (cTnI/T). Teniendo en cuenta que la tormenta de citocinas es también el mecanismo fisiopatológico central en la miocarditis fulminante, es lógico pensar en el daño cardiaco por COVID-19.
La etiología de la miocarditis es muy variada e incluye gran variedad de agentes infecciosos, enfermedades sistémicas, medicamentos y toxinas. La bibliografía existente sobre miocarditis por coronavirus es escasa, pero parece que se produce mayor daño cardiaco en los pacientes afectados por COVID-19 que por otros coronavirus5.
Se presenta el caso de una mujer de 59 años cuyos antecedentes personales incluyen hipertensión arterial, artropatía degenerativa cervical, lumbociática crónica, tuberculosis ganglionar diagnosticada por cuadro de eritema nudoso y migraña. En su tratamiento habitual, destaca el candesartán 32 mg/día.
Acudió en marzo de 2020 al servicio de urgencias por sensación distérmica de 5 días de evolución, acompañada de dolor torácico de características opresivas en ausencia de síntomas respiratorios. A su llegada presentaba SatO2 del 96% con gafas nasales a 2 l/min y presión arterial de 75/53mmHg. En la exploración física destacan signos de hipoperfusión periférica con auscultación respiratoria normal.
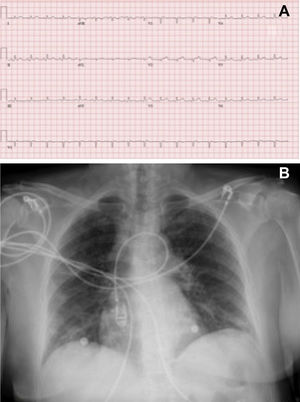
A pesar de la sobrecarga hídrica y la noradrenalina, persistía hipotensa con signos de hipoperfusión (frialdad cutánea y ácidos lácticos elevados: 3,9 mmol/l). En el electrocardiograma destacaba elevación cóncava del ST y descenso del PR, así como bajos voltajes (figura 1A). En la radiografía de tórax se observaron ligeros signos de redistribución vascular sin infiltrados (figura 1B). La reacción en cadena de la polimerasa (PCR) de virus del frotis nasofaríngeo resultó positiva para SARS-CoV-2 y negativo para adenovirus y virus Influenza A y B, con un ambiente epidemiológico positivo (familiares con fiebre y cuadro respiratorio días previos). Entre los datos del laboratorio, destacaba la elevación de troponinas (TnT, 220-1.100 ng/dl) y NT-proBNP (4.421 ng/l), ligera leucocitosis (14,17 × 109/l), linfocitos (2,59 × 109/l), PCR 10mg/l y dímero D a las 24 h (23.242 ng/ml). Una ecocardiografía mostró hipertrofia concéntrica moderada, volúmenes intraventriculares disminuidos con fracción de eyección del ventrículo izquierdo conservada sin segmentarismos y derrame pericárdico moderado sin claros signos de deterioro hemodinámico. Debido al cuadro tan indicativo de miocarditis (elevación concaviforme y difusa del ST, fiebre, derrame pericárdico y engrosamiento miocárdico) y la fracción de eyección del ventrículo izquierdo conservada sin segmentarismos, no se realizó coronariografía por baja sospecha clínica de síndrome coronario agudo. En la unidad coronaria, durante el implante de un catéter de Swan-Ganz, se produjo un rápido deterioro hemodinámico hasta llegar a una actividad eléctrica sin pulso que requirió reanimación cardiopulmonar, pericardiocentesis emergente (drenaje de líquido seroso) y altas dosis de vasopresores para la recuperación hemodinámica de la paciente.
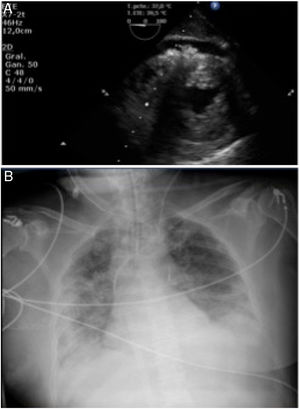
Se realizó otro ecocardiograma (a las 2h del ingreso), que mostró disfunción biventricular grave y edema miocárdico difuso (figura 2A), por lo que se decidió implantar un balón de contrapulsación y oxigenador extracorpóreo de membrana (ECMO) venoarterial femoral.
Se inició el tratamiento de la miocarditis con inmunoglubulinas (80 mg/día) durante 4 días y metilprenisolona (500 mg/día) en pauta descendente durante 14 días y tratamiento antiviral: IFN B (0,25 mg/48 h) y (ritonavir 400 mg/lopinavir 100 mg/12 h). Al quinto día de ingreso, se constató la normalización de la función biventricular, pero se mantuvo el dispositivo ECMO por distrés respiratorio (figura 2B), con hipoxemia refractaria, actualmente pendiente de evolución respiratoria.
No se realizó biopsia miocárdica por inestabilidad hemodinámica, coagulopatía importante y mejoría posterior de la función cardiaca.
La presentación clínica de los pacientes infectados por el SARS-CoV-2 es muy variable, y la clínica respiratoria es la más frecuente. Dada la situación epidemiológica actual, hay que pensar en este agente etiológico como causa de otros cuadros clínicos como la miocarditis aguda aun en ausencia de un cuadro respiratorio compatible.
La miocarditis fulminante es un síndrome con elevada morbimortalidad, por lo que son vitales el diagnóstico precoz y el tratamiento correcto. En este caso se destacó un cuadro clínico compatible con miocarditis aguda, con ausencia de cuadro respiratorio inicial y rápida evolución hacia el shock cardiogénico y necesidad de asistencia con ECMO venoarterial. La función biventricular se normalizó en escasos días, con una posterior disnea grave que obligó a mantener el ECMO.