Los datos acumulados indican que la insuficiencia cardiaca (IC) crónica es un problema de salud pública importante que va en aumento en todo el mundo. Aunque la incidencia de IC se mantiene estable, la prevalencia aumentará debido al envejecimiento de la población y al aumento de la prevalencia de los factores de riesgo de IC (p. ej., diabetes e hipertensión). Esto originará nuevos aumentos de los costes de la atención sanitaria. Por consiguiente, encontrar un tratamiento adecuado para la IC es una necesidad médica mundial de suma importancia. A pesar de los importantes avances en el tratamiento de la IC con fracción de eyección reducida (IC-FEr) durante las últimas décadas, hay un amplio consenso en que se necesitan nuevos tratamientos porque el riesgo residual sigue siendo inaceptablemente alto. Además, en los últimos años no se ha avanzado en la reducción de la mortalidad y la morbilidad de los pacientes con IC y fracción de eyección conservada (IC-FEc).
Conservar la función y la capacidad para llevar a cabo las actividades de la vida diaria no solo son potentes marcadores de longevidad, sino que al parecer también desempeñan un papel más importante en el control de la mortalidad cardiovascular y por cualquier causa1. Por lo tanto, preservar la capacidad funcional de los pacientes con IC podría ser el objetivo primordial de los profesionales clínicos, dado que su deterioro influye negativamente en el bienestar, la adaptación social, la calidad de vida y el pronóstico. En este contexto, los valores bajos de fuerza muscular y la pérdida acelerada de masa muscular (sarcopenia) también son prevalentes entre los pacientes con IC-FEc, especialmente en los de 70 o más años2. Por ello, para promover el tratamiento de la IC para mejorar la evolución clínica, la fuerza y la masa muscular, la capacidad funcional y la calidad de vida, parece conveniente implementar estrategias novedosas basadas en aspectos innovadores.
Uno de los síntomas más importantes de los pacientes con IC que deteriora su calidad de vida y su pronóstico es la intolerancia al ejercicio y una profunda astenia. En comparación con la visión tradicional, que considera que un mal funcionamiento del corazón es la principal causa de reducción de la capacidad de hacer ejercicio de los pacientes con IC, en los últimos 20 años ha habido una creciente evidencia del papel fundamental de la miopatía esquelética. Además, se han descrito asociaciones entre las alteraciones relacionadas con el músculo esquelético y la gravedad clínica y la evolución de los pacientes con IC. Este editorial describe la potencial implicación fisiopatológica e implicaciones clínicas en la IC de un grupo de moléculas, conocidas como miocinas, que se secretan en el músculo esquelético, y presta especial atención a los aspectos relacionados con su impacto miocárdico directo.
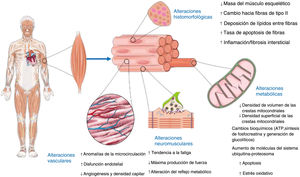
VISIÓN TRADICIONAL DE LA MIOPATÍA ESQUELÉTICA EN LA IC: EL MÚSCULO COMO VÍCTIMASe han descrito alteraciones en la morfología, el metabolismo y la función del músculo esquelético en pacientes con IC y es posible que estén muy implicadas en la reducción de la capacidad de ejercicio en estos pacientes (figura 1)3. Tradicionalmente, el origen de estas alteraciones se ha relacionado con la reducción de la circulación sanguínea muscular, en parte debido a la disminución del gasto cardiaco y en parte a la vasoconstricción de las pequeñas arterias musculares secundaria a la vasoconstricción sistémica neurohumoral que acompaña a la IC3. La inflamación sistémica crónica se perfila como un factor de riesgo de la enfermedad cardiovascular. De hecho, la inflamación del músculo esquelético y la fibrosis posterior, como un elemento de la inflamación sistémica y la respuesta reparadora que caracteriza a la IC, también se han implicado en el inicio y perdurabilidad de la lesión del músculo esquelético4. Asimismo, la IC se asocia generalmente con un incremento del catabolismo y una reducción del anabolismo. Por ejemplo, se ha demostrado que un aumento de la concentración sanguínea de hormonas catabólicas (p. ej., cortisol) y una disminución de las hormonas anabólicas (p. ej., testosterona) están estrechamente vinculados con la atrofia muscular, la gravedad de la miopatía y el mal pronóstico de los pacientes con IC5.
VISIÓN NOVEDOSA DE LA MIOPATÍA ESQUELÉTICA EN LA IC: EL MÚSCULO COMO CULPABLEEl concepto de músculo como órgano secretor, formulado en las últimas décadas, responde en parte a la cuestión de cómo se produce la interferencia entre el músculo esquelético y los tejidos distantes6. Los efectos beneficiosos del ejercicio trascienden la simple mejora de la funcionalidad del músculo esquelético: se han observado respuestas sistémicas al ejercicio (sobre todo durante la contracción muscular) en órganos distales, como el corazón, el riñón, el cerebro, el tejido adiposo y el hígado. También se han acumulado cada vez más datos sobre la síntesis, la cinética de liberación y las funciones biológicas de las citocinas musculares, ahora conocidas como miocinas. Una miocina es una molécula producida por las células del músculo esquelético, principalmente en respuesta a la contracción muscular, y posteriormente liberada al espacio extracelular y la circulación para ejercer efectos autocrinos y paracrinos en las células del músculo esquelético y efectos endocrinos en otras células, tejidos u órganos6. Desde la identificación de la interleucina 6 como el prototipo de la miocina, el interés por el concepto y el secretoma muscular conocido, definido en este caso como el «miocinoma», ha crecido constantemente, con un aumento exponencial del número de estudios que describen miocinas en los últimos años. Un análisis del secretoma de las células musculares humanas identificó recientemente varios cientos de moléculas secretadas no redundantes, de las cuales más de 300 se clasificaron como miocinas potenciales7. Sin embargo, el descubrimiento de miocinas es un reto y las moléculas a menudo se etiquetan prematuramente como miocinas antes de una validación adecuada o un análisis en profundidad de sus efectos una vez que se libera desde el músculo.
Al actuar de manera autocrino-paracrina, la mayoría de las miocinas están implicadas en la miogénesis y el crecimiento (tanto en lo que se refiere a proliferación de mioblastos como a hipertrofia de fibras), la protección contra procesos de muerte celular, como apoptosis y autofagia, la autorregulación metabólica (p. ej., generación no oxidativa de trifosfato de adenosina, así como densidad y composición de las mitocondrias) y la capacidad funcional general (p. ej., capacidad y tolerancia al ejercicio) de las células del músculo esquelético8,9. La mayoría de estos efectos están mediados por vías de señalización intracelular, entre ellas las cinasas Janus 1 y 2/transductor de señales 3 y 5 y el activador de proteínas de transcripción/factor nuclear kappa B, la fosfoinosítido cinasa 3 (PI3) y las vías de la proteincinasa activada por mitógenos8,9.
Además, las miocinas tienen una amplia gama de acciones endocrinas que tienen como primera consecuencia la regulación del tejido adiposo blanco (p. ej., reducción de la inflamación y aumento de la sensibilidad a la insulina, termogénesis, pardeamiento y peroxidación de lípidos) y la facilitación de un entorno antiinflamatorio sistémico (a saber, mediado por la interleucina 6, que actúa directamente en las células inflamatorias o mediante la producción suprarrenal de cortisol y la posterior regulación del tráfico de células inmunoinflamatorias)10.
El concepto elaborado durante las últimas décadas de que el músculo en contracción puede actuar liberando miocinas, algunas de las cuales se encuentran en el torrente circulatorio en un grado dependiente del tipo y la intensidad del ejercicio realizado, implica que la regulación del crecimiento, el metabolismo y las funciones mecánicas del músculo durante y después del entrenamiento también pueden derivarse (y además está garantizado) de los efectos de estas moléculas11. En este marco conceptual, se ha propuesto que las alteraciones de las miocinas podrían contribuir a la aparición de miopatía esquelética relacionada con la IC y otras comorbilidades metabólicas que acompañan a la IC, y así influir en la evolución clínica de este síndrome12.
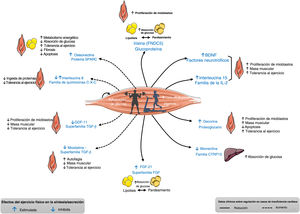
REGULACIÓN DEFECTUOSA DE LAS MIOCINAS EN LA IC: DATOS CLÍNICOS Y EXPERIMENTALESAdemás de los datos obtenidos a partir de modelos experimentales de IC, también se ha demostrado que la regulación de algunas miocinas es defectuosa en pacientes con IC, según se evaluó al medir sus concentraciones en sangre o su expresión tisular (figura 2)6,11,12. Por ejemplo, se demostró que las concentraciones plasmáticas de irisina eran más bajas en mujeres caquécticas con IC-FEr o IC-FEc que en mujeres no caquécticas con IC13. Otro estudio realizado en pacientes con IC-FEr mostró que la expresión del gen que codifica la irisina en biopsias musculares se relacionaba verdaderamente con el rendimiento aeróbico (evaluado utilizando el consumo de oxígeno y la eficiencia ventilatoria)14. En cambio, se ha comunicado que las concentraciones séricas de miostatina eran más elevadas en los pacientes con IC que en los controles15. Además, Ishida et al.16 demostraron que la proteína miostatina estaba muy aumentada en el músculo de mujeres con IC-FEr avanzada, pero no en el de los varones con IC-FEr avanzada, y ellas mostraban menor índice de masa corporal que ellos.
Características de algunas miocinas analizadas en pacientes con insuficiencia cardiaca, cuya regulación se encuentra alterada en sangre y/o su expresión tisular. BDNF: factor neurotrófico derivado del cerebro; CTRP15: mionectina; FGF-21: factor de crecimiento de fibroblastos; GDF-11: factor de diferenciación del crecimiento 11; IL-2: interleucina 2; TGF-β: factor de crecimiento transformador beta. Adaptado con autorización de Fiuza-Luces et al.6, Di Raimondo et al.11 y Berezin et al.12.
El análisis de los datos presentados en la figura 2 muestra que la mayoría de las miocinas con expresión reducida en la IC son aquellas que fisiológicamente ejercen efectos beneficiosos en tolerancia al ejercicio o metabolismo sistémico. En cambio, entre las miocinas aumentadas en la IC, algunas son perjudiciales y otras son beneficiosas por sus efectos descritos en la tolerancia del músculo esquelético y el metabolismo sistémico en condiciones fisiológicas. Además, la respuesta del músculo esquelético que secreta miocinas específicas puede variar dependiendo tanto de la modalidad como de la dosis de ejercicio físico.
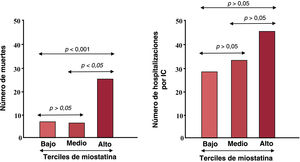
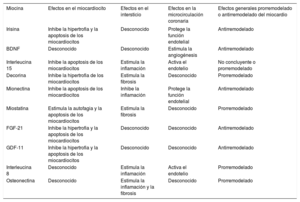
El análisis de los datos que se muestran en la tabla 1 indica que las miocinas pueden ejercer efectos que favorecen o inhiben el remodelado en el miocardio, lo que abre la posibilidad de una potencial contribución a la gravedad y la progresión clínica de la IC. Por ejemplo, se ha comunicado que hay una asociación entre la irisina plasmática y la fracción de eyección del ventrículo izquierdo y que no existe esa asociación en mujeres con IC13. Además, se ha demostrado que el aumento de las concentraciones séricas de miostatina se asocia con la gravedad de la IC (según la evaluación de la clase de la New York Heart Association y la concentración plasmática de la fracción aminoterminal del propéptido natriurético cerebral)15. Además, los pacientes del grupo de miostatina de tercil alto tuvieron menor tasa de supervivencia y mayor número de hospitalizaciones por IC que los del grupo de tercil bajo (figura 3), y el análisis de regresión de Cox mostró que la miostatina sérica era un predictor independiente de mortalidad15.
Efectos miocárdicos de la alteración de algunas miocinas en pacientes con insuficiencia cardiaca
| Miocina | Efectos en el miocardiocito | Efectos en el intersticio | Efectos en la microcirculación coronaria | Efectos generales prorremodelado o antirremodelado del miocardio |
|---|---|---|---|---|
| Irisina | Inhibe la hipertrofia y la apoptosis de los miocardiocitos | Desconocido | Protege la función endotelial | Antirremodelado |
| BDNF | Desconocido | Desconocido | Estimula la angiogénesis | Antirremodelado |
| Interleucina 15 | Inhibe la apoptosis de los miocardiocitos | Estimula la inflamación | Activa el endotelio | No concluyente o prorremodelado |
| Decorina | Inhibe la hipertrofia de los miocardiocitos | Estimula la fibrosis | Desconocido | Prorremodelado |
| Mionectina | Inhibe la apoptosis de los miocardiocitos | Inhibe la inflamación | Protege la función endotelial | Antirremodelado |
| Miostatina | Estimula la autofagia y la apoptosis de los miocardiocitos | Estimula la fibrosis | Desconocido | Prorremodelado |
| FGF-21 | Inhibe la hipertrofia y la apoptosis de los miocardiocitos | Desconocido | Desconocido | Antirremodelado |
| GDF-11 | Inhibe la hipertrofia y la apoptosis de los miocardiocitos | Desconocido | Desconocido | Antirremodelado |
| Interleucina 8 | Desconocido | Estimula la inflamación | Activa el endotelio | Prorremodelado |
| Osteonectina | Desconocido | Estimula la inflamación y la fibrosis | Desconocido | Prorremodelado |
Asociación de terciles de miostatina sérica con número de no supervivientes y hospitalizaciones relacionadas con insuficiencia cardiaca. La media±desviación estándar del seguimiento fue de 51,40±15,01 meses. IC: insuficiencia cardiaca. Adaptado con autorización de Chen et al.15.
La mayor parte de la evidencia sobre el ejercicio físico en la IC deriva de estudios que implementan programas de entrenamiento físico que se consideran seguros y muy recomendados para pacientes estables en tratamiento médico óptimo17. Aunque los metanálisis de estos estudios han demostrado mejoras considerables, pero discretas, en la tolerancia al ejercicio y la calidad de vida, no han podido demostrar efectos beneficiosos importantes en la mortalidad por todas las causas y específica de la IC, y en la hospitalización14. Llama la atención que la prescripción de ejercicio físico para pacientes con IC no se base en criterios objetivos para la individualización de su modalidad (ya sea aeróbica o de resistencia) o su dosis (frecuencia, intensidad, duración, modalidad y progresión)17.
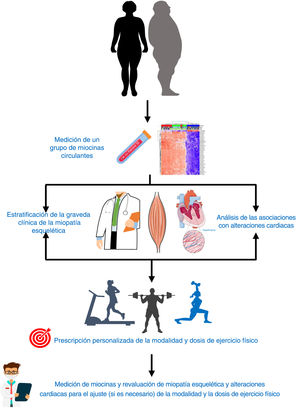
Las miocinas, al menos las actualmente medibles en sangre, ofrecen la posibilidad de servir como biomarcadores útiles para personalizar la prescripción del ejercicio físico de los pacientes con IC (figura 4). De hecho, disponer de un grupo de medidas de las miocinas más representativas ayudaría a individualizar la modalidad y la dosis de ejercicio físico para cada paciente con IC con el triple objetivo de incrementar la tolerancia al ejercicio, mejorar el metabolismo lipídico y glucídico y proteger el miocardio del remodelado.
Como ejemplo hipotético de este enfoque, en un paciente con IC con factor neurotrófico derivado del cerebro bajo y miostatina alta, un programa de ejercicio cardiovascular o, más específicamente, de fortalecimiento muscular (ya sea agudo o normal) estaría indicado tanto para estimular el factor neurotrófico derivado del cerebro como para inhibir la miostatina y así lograr mayor tolerancia al ejercicio y protección del miocardio (tabla 1 y figura 2).
CONCLUSIONES Y PERSPECTIVASHasta la fecha, se ha propuesto que las miocinas podrían ser biomarcadores útiles para supervisar la prescripción de ejercicio a personas, por ejemplo, con cáncer, diabetes o enfermedades neurodegenerativas7. Los datos que se ofrecen en este artículo también indican que su evaluación podría proporcionar nuevos conocimientos sobre la fisiopatología de la miopatía esquelética relacionada con la IC y servir como biomarcadores para la estratificación de esta enfermedad en pacientes con IC. Además, podrían ser útiles para personalizar la modalidad y la dosis de ejercicio físico que debe prescribirse a pacientes con IC.
Por lo tanto, no es de extrañar que la farmacología de las miocinas sea un campo activo. Sin embargo, existen varios retos y limitaciones a los cuales se enfrenta actualmente el desarrollo terapéutico de las miocinas o secretagogos o análogos de miocinas. En primer lugar, las miocinas, por su propia definición, son proteínas o péptidos y, por ello, deben superarse los obstáculos importantes con que se encuentra el uso de productos biológicos como tratamiento. Los biofármacos proteínicos se han vuelto ampliamente disponibles después del rápido desarrollo de la tecnología del ADN recombinante durante las últimas décadas. Entre los problemas más importantes que debe superar el desarrollo de proteínas para su administración terapéutica se encuentran su inestabilidad fisicoquímica (en particular, agregación), solubilidad limitada, inestabilidad proteolítica, semivida plasmática corta, inmunogenicidad y toxicidad. No obstante, es importante mencionar que actualmente hay varios ensayos en curso que realizan pruebas con moléculas derivadas de la miostatina (véase ClinicalTrials.gov), con la hipótesis de que la inhibición de la miostatina podría ofrecer una alternativa terapéutica que contrarrestase la atrofia del músculo esquelético y, a su vez, aumentase la tolerancia al ejercicio en condiciones clínicas distintas de la IC. Esta oportunidad podría ofrecerse a los pacientes con IC en el futuro, pero se necesita una investigación más precisa.
Por ello los autores de este editorial creen firmemente que más investigación sobre las miocinas y una mejor comprensión de su síntesis y secreción, funciones, mecanismos de acción y vías posteriores en la IC experimental y clínica probablemente conducirían a la identificación de nuevos enfoques terapéuticos basados en el ejercicio físico para pacientes con IC, en particular para aquellos con IC-FEc que suelen presentar trastornos metabólicos y para los cuales los programas de ejercicio son la piedra angular de su tratamiento integral18. Es importante destacar que el establecimiento de vínculos moleculares entre el ejercicio y la mejora del tratamiento de la IC solo puede fortalecer el objetivo científico del tratamiento de la IC basado en medicamentos de precisión, así como el mensaje público de que el ejercicio físico guiado por miocinas ofrece como resultado mejor calidad de vida y, probablemente, una mejora del pronóstico de los pacientes con IC, y contribuye a una mayor sostenibilidad del sistema sanitario por su rentabilidad.
FINANCIACIÓNEl presente artículo no recibió financiación.
CONFLICTO DE INTERESESNinguno de los autores declara ningún conflicto de intereses en relación con este artículo.