Hay poca información para el desarrollo de modelos de predicción del riesgo de mortalidad hospitalaria para pacientes con infarto agudo de miocardio (IAM) tratados con oxigenador extracorpóreo de membrana (ECMO) venoarterial (VA). El objetivo es desarrollar un modelo de predicción del riesgo de mortalidad hospitalaria para pacientes con IAM tratados con ECMO-VA.
MétodosEntre mayo de 2004 y abril de 2016, se trató con ECMO-VA a un total de 145 pacientes con IAM incluidos en el registro de ECMO del Samsung Medical Center. El objetivo primario fue la mortalidad hospitalaria. Para el desarrollo del nuevo modelo predictivo, llamado puntuación AMI-ECMO, se usó el método de eliminación por pasos hacia atrás y la puntuación basada en el coeficiente β en el análisis de regresión logística. El método de validación cruzada dejando uno fuera se usó para la validación interna.
ResultadosSe produjo la muerte hospitalaria de 69 pacientes (47,6%). Para el análisis de regresión logística multiple, la puntuación AMI-ECMO incluyó 6 parámetros previos al ECMO o angiográficos: edad> 65 años, índice de masa corporal> 25, escala de coma de Glasgow <6, ácido láctico> 8 mmol/l, infarto de miocardio anterior y la ausencia o fallo de revascularización. El valor del estadístico C de la puntuación AMI-ECMO para la predicción de la mortalidad hospitalaria fue 0,880 (IC95%, 0,820-0,940). La mortalidad hospitalaria tras la inserción del ECMO-VA fue del 6,2, el 28,1, el 51,6 y el 93,8% (p <0,001 para análisis de tendencias) en cada cuartil de AMI-ECMO (0 a 16, 17 a 19, 20 a 26 y> 26). La puntuación AMI-ECMO se asoció también significativamente con la tasa estimada de mortalidad por todas las causas durante el seguimiento (por cada incremento de 1 punto, HR=1,11; IC95%, 1,08-1,14; p <0,001).
ConclusionesLa puntuación AMI-ECMO puede ayudar en la predicción del pronóstico temprano de pacientes con IAM tratados con ECMO-VA.
Palabras clave
A pesar de los avances en el conocimiento y las técnicas terapéuticas para el infarto agudo de miocardio (IAM), el IAM complicado por shock cardiogénico (SC) sigue siendo una de las primeras causas de muerte en todo el mundo y un reto para los cardiólogos intervencionistas1–3. El oxigenador extracorpóreo de membrana (ECMO) venoarterial (VA) proporciona asistencia cardiopulmonar hemodinámica y mecánica temporal hasta la recuperación de la función cardiaca de los pacientes con SC resistente al tratamiento médico convencional4–8. Según varios estudios observacionales9–14, el ECMO-VA tiene una recomendación de clase IIb para los pacientes con IAM y SC resistente; sin embargo, no se han realizado ensayos clínicos aleatorizados con muestras de gran tamaño sobre la eficacia del ECMO-VA y los factores pronósticos no se han aclarado por completo15,16. Un estudio reciente ha propuesto un modelo de predicción del riesgo, llamado puntuación ENCOURAGE, para pacientes con IAM tratados con el ECMO-VA17. No obstante, esa puntuación se basa únicamente en factores previos al ECMO, no en hallazgos angiográficos ni en factores relacionados con el ECMO que constituyan un factor pronóstico para pacientes con IAM. En consecuencia, el objetivo de este estudio es identificar predictores de la mortalidad hospitalaria de los pacientes con IAM tratados con ECMO-VA y elaborar un modelo comprehensivo de predicción del riesgo que incluya datos angiográficos.
MÉTODOSPoblación en estudioEste es un estudio observacional retrospectivo, realizado con pacientes consecutivos con IAM que recibieron tratamiento con ECMO-VA tras sufrir un SC resistente o una parada cardiaca entre mayo de 2004 y abril de 2016 en el Samsung Medical Center. En el análisis se incluyó a pacientes de 18 años o mayores. Se indicó ECMO-VA a pacientes con IAM que sufrieron una parada cardiaca o insuficiencia cardiovascular aguda resistente, definida como indicio de hipoperfusión orgánica (moteado epidérmico extenso, acidosis láctica progresiva, oliguria o alteración del estado mental), a pesar de un tratamiento apropiado del volumen intravascular y tratamiento clínico máximo con fármacos vasopresores o inotrópicos. Se esperaba que todos los pacientes se sometieran a revascularización temprana y recibieran el tratamiento clínico óptimo según las recomendaciones actuales15,16. Al final, se eligió para el estudio a un total de 145 pacientes con IAM tratados con ECMO-VA. Un equipo de expertos determinó la decisión final de implantar el ECMO-VA, y cirujanos cardiovasculares o cardiólogos intervencionistas implantaron el dispositivo a pie de cama del paciente o en un laboratorio de cateterismo. El comité de ética del Samsung Medical Center eximió del requisito para el consentimiento informado a causa de la naturaleza retrospectiva del estudio.
Implante del dispositivo de oxigenación extracorpórea de membrana venoarterial y tratamientoLos detalles del tratamiento con el ECMO-VA en pacientes con IAM ya se han mencionado anteriormente18. En resumen, se insertó un dispositivo ECMO-VA mediante canulación percutánea utilizando la técnica de Seldinger o mediante canulación quirúrgica utilizando el método de reducción (cut-down). Se utilizó una cánula arterial de diámetro entre 14 y 17 Fr y una cánula venosa de entre 20 y 24 Fr. Los vasos femorales se utilizaron como vías de acceso vascular. En el momento del estudio el hospital disponía del sistema de derivación de urgencia Capiox (Capiox EBS, Terumo Inc.; Tokio, Japón) y el de asistencia permanente (PLS, MAQUET; Rastatt, Alemania). En caso de isquemia distal de la extremidad tras la canulación arterial, se insertaba un catéter en posición distal respecto del sitio de inserción de la canulación para perfundir la extremidad. Se ajustó la velocidad de la bomba para obtener un índice cardiaco> 2,2 l/min/área de superficie corporal (m2), una presión arterial media> 65mmHg y una saturación venosa central mixta> 70%. Se inyectó heparina por vía intravenosa para mantener un tiempo de coagulación activado de entre 150 y 180 s, a no ser que se observara hemorragia potencialmente mortal. Se definió destete satisfactorio como la desconexión del paciente del ECMO sin reinserción o fallecimiento en las 24 h posteriores.
Obtención de los datos y resultadosLa siguiente información se obtuvo de manera retrospectiva tras revisar la historia clínica: edad, sexo, resultados de la exploración física, comorbolidad subyacente, datos angiográficos, datos de laboratorio, datos ecocardiográficos, tratamiento hospitalario y datos previos y posteriores al ECMO. Cuando se determinaron varias veces los mismos datos de los análisis clínicos antes de insertar el ECMO, se registró el valor analítico determinado en el momento más cercano al de inserción del ECMO. Si se disponía de evaluación neurológica previa a la inserción del ECMO, se obtenía una puntuación en la escala de coma de Glasgow en el momento más cercano al de inserción del ECMO. No obstante, si el paciente no había sido capaz de realizar una evaluación neurológica debido a parada cardiaca inesperado u ocurrida fuera del hospital, la puntuación en la escala de coma de Glasgow se calculaba tras la inserción del ECMO. Las puntuaciones de SAVE y ENCOURAGE, que son sistemas de puntuación previamente validados para evaluar la supervivencia al alta de pacientes sometidos a ECMO-VA, se calcularon comparando con el nuevo modelo de predicción del riesgo17,19. Cuando fue necesario, se obtuvo información clínica adicional, incluidos los datos del seguimiento, a partir de las historias clínicas y las entrevistas telefónicas realizadas por los coordinadores del estudio. La duración media del seguimiento fue de 33,0 [intervalo intercuartílico, 4,0-373,0] días. El resultado primario fue la mortalidad hospitalaria y el secundario, la mortalidad por cualquier causa durante el periodo de seguimiento.
Análisis estadísticoLas variables categóricas se presentan como números y frecuencias relativas y las diferencias entre grupos se compararon utilizando la prueba de la χ2 o el test exacto de Fisher, según fuera apropiado. Las variables continuas se presentan como media± desviación estándar o mediana [intervalo intercuartílico], y las diferencias entre grupos se compararon con el test de la t de Student. Se recurrió al análisis multivariable de regresión logística para identificar predictores de la mortalidad hospitalaria de los pacientes con IAM sometidos a implante de ECMO-VA. A efectos prácticos, las variables continuas se transformaron en categóricas, que se evaluaron frente a valores del intervalo normal o los mejores valores de corte siguiendo el método de valores de p mínimos seleccionados. Las covariables que se consideraron clínicamente relevantes o las que mostraron una relación univariable con el resultado (p ≤ 0,2) se introdujeron en el modelo de regresión logística multivariable. Las variables clínicamente interrelacionadas se excluyeron del modelo. A continuación, se llevó a cabo un análisis de eliminación por pasos hacia atrás para identificar un subconjunto de predictores útiles. Posteriormente se estableció la puntuación de riesgo AMI-ECMO para predecir la mortalidad hospitalaria utilizando un método de puntuación basado en el coeficiente de regresión. Para generar una puntuación simple, basada en el valor entero de cada variable predictiva, se dividió cada coeficiente β por el valor absoluto del coeficiente menor, multiplicado por 5, y se redondeó al entero más cercano. La potencia estadística que discrimina la puntuación establecida a la hora de predecir la mortalidad hospitalaria se evaluó considerando el área bajo la curva del análisis de receiver operating characteristic (ROC). La idoneidad del modelo se comprobó con la prueba de la bondad de ajuste de Hosmer-Lemeshow y la validación cruzada dejando uno fuera se utilizó en la validación interna para obtener la tasa de clasificación errónea. Para evaluar la asociación entre la puntuación AMI-ECMO y el riesgo estimado de mortalidad por cualquier causa, se calculó la probabilidad de muerte utilizando el modelo de riesgos proporcionales de Cox. El riesgo estimado de mortalidad por cualquier causa se representó con una línea de regresión local. A continuación se compararon las propiedades de la puntuación AMI-ECMO con las de las puntuaciones ENCOURAGE y SAVE. Se evaluó la supervivencia libre de eventos según los cuartiles de la puntuación AMI-ECMO mediante análisis de Kaplan-Meier, y se evaluó el nivel de significación con una prueba de rangos logarítmicos. Se evaluó la correlación entre las puntuaciones AMI-ECMO, ENCOURAGE y SAVE con el coeficiente de correlación de Spearman. Los análisis estadísticos se realizaron con el software R Statistical (versión 3.2.5, R Foundation for Statistical Computing; Viena, Austria) y se consideró estadísticamente significativo un valor de p <0,05.
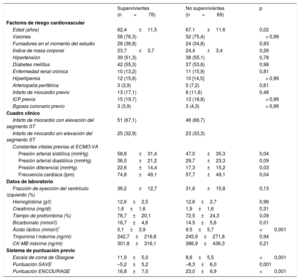
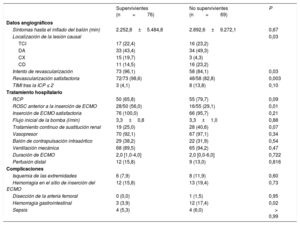
RESULTADOSPoblaciones en estudioDe los 145 pacientes con IAM tratados con ECMO-VA, 97 (66,9%) acudieron a la consulta por infarto de miocardio con elevación del segmento ST. El destete satisfactorio del ECMO se alcanzó en 91 pacientes (62,8%), y 76 (52,4%) sobrevivieron al alta. La duración media del sistema de asistencia mecánica fue de 2,0 [1,0-4,0] días. La tabla 1 muestra las características basales clínicas y de laboratorio de los participantes y la tabla 2, los hallazgos angiográficos e información sobre el tratamiento hospitalario. Comparados con los supervivientes, los que no sobrevivieron eran de más edad y con valores inferiores de presión arterial sistólica, presión diferencial, frecuencia cardiaca, escala de coma de Glasgow, proporción de revascularización satisfactoria y retorno de la circulación espontánea antes de la inserción del ECMO. La incidencia de hemorragia gastrointestinal y los valores de ácido láctico fueron considerablemente más altos en los que no sobrevivieron que en los supervivientes. Entre la población en estudio, solo 1 paciente recibió un trasplante de corazón durante el mantenimiento con ECMO-VA. Sin embargo, durante el seguimiento se realizaron 6 trasplantes de corazón a 6 pacientes debido a agravamiento de la miocardiopatía isquémica posterior al IAM.
Características basales
| Supervivientes (n=76) | No supervivientes (n=69) | p | |
|---|---|---|---|
| Factores de riesgo cardiovascular | |||
| Edad (años) | 62,4±11,5 | 67.1±11.6 | 0,02 |
| Varones | 58 (76,3) | 52 (75,4) | > 0,99 |
| Fumadores en el momento del estudio | 28 (36,8) | 24 (34,8) | 0,93 |
| Índice de masa corporal | 23,7±3,7 | 24,4±3,4 | 0,26 |
| Hipertensión | 39 (51,3) | 38 (55,1) | 0,78 |
| Diabetes mellitus | 42 (55,3) | 37 (53,6) | 0,98 |
| Enfermedad renal crónica | 10 (13,2) | 11 (15,9) | 0,81 |
| Hiperlipemia | 12 (15,8) | 10 [14,5] | > 0,99 |
| Arteriopatía periférica | 3 (3,9) | 5 (7,2) | 0,61 |
| Infarto de miocardio previo | 13 (17,1) | 8 (11,6) | 0,48 |
| ICP previa | 15 (19,7) | 13 (18,8) | > 0,99 |
| Bypass coronario previo | 3 (3,9) | 3 (4,3) | > 0,99 |
| Cuadro clínico | |||
| Infarto de miocardio con elevación del segmento ST | 51 (67,1) | 46 (66,7) | |
| Infarto de miocardio sin elevación del segmento ST | 25 (32,9) | 23 (33,3) | |
| Constantes vitales previas al ECMO-VA | |||
| Presión arterial sistólica (mmHg) | 58,6±31,4 | 47,0±35,3 | 0,04 |
| Presión arterial diastólica (mmHg) | 36,0±21,2 | 29,7±23,3 | 0,09 |
| Presión diferencial (mmHg) | 22,6±14,4 | 17,3±15,2 | 0,03 |
| Frecuencia cardiaca (lpm) | 74,8±49,1 | 57,7±49,1 | 0,04 |
| Datos de laboratorio | |||
| Fracción de eyección del ventrículo izquierdo (%) | 36,2±12,7 | 31,6±15,8 | 0,13 |
| Hemoglobina (g/l) | 12,6±2,5 | 12,6±2,7 | 0,96 |
| Creatinina (mg/dl) | 1,6±1,6 | 1,9±1,6 | 0,31 |
| Tiempo de protrombina (%) | 78,7±20,1 | 72,5±24,3 | 0,09 |
| Bicarbonato (mmol/l) | 16,7±4,6 | 14.5±5,6 | 0,01 |
| Ácido láctico (mmol/l)* | 5,1±3,9 | 9.5±5,7 | <0,001 |
| Troponina I máxima (ng/ml) | 242,7±216,8 | 245,9±271,8 | 0,94 |
| CK-MB máxima (ng/ml) | 301,8±316,1 | 386,9±436,3 | 0,21 |
| Sistema de puntuación previo | |||
| Escala de coma de Glasgow | 11,9±5,0 | 8,6±5,5 | <0,001 |
| Puntuación SAVE | –5,2±5,2 | –8,3±6,0 | 0,001 |
| Puntuación ENCOURAGE | 16,8±7,0 | 23,0±6,9 | <0,001 |
CK-MB: isoenzima MB de la creatincinasa; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; ICP: intervención coronaria percutánea.
Datos angiográficos basales y tratamiento hospitalario
| Supervivientes (n=76) | No supervivientes (n=69) | P | |
|---|---|---|---|
| Datos angiográficos | |||
| Síntomas hasta el inflado del balón (min) | 2.252,8±5.484,8 | 2.892,6±9.272,1 | 0,67 |
| Localización de la lesión causal | 0,03 | ||
| TCI | 17 (22,4) | 16 (23,2) | |
| DA | 33 (43,4) | 34 (49,3) | |
| CX | 15 (19,7) | 3 (4,3) | |
| CD | 11 (14,5) | 16 (23,2) | |
| Intento de revascularización | 73 (96,1) | 58 (84,1) | 0,03 |
| Revascularización satisfactoria | 72/73 (98,6) | 48/58 (82,8) | 0,003 |
| TIMI tras la ICP ≤ 2 | 3 (4,1) | 8 (13,8) | 0,10 |
| Tratamiento hospitalario | |||
| RCP | 50 (65,8) | 55 (79,7) | 0,09 |
| ROSC anterior a la inserción de ECMO | 28/50 (56,0) | 16/55 (29,1) | 0,01 |
| Inserción de ECMO satisfactoria | 76 (100,0) | 66 (95,7) | 0,21 |
| Flujo inicial de la bomba (l/min) | 3,3±0,8 | 3,3±1,0 | 0,88 |
| Tratamiento continuo de sustitución renal | 19 (25,0) | 28 (40,6) | 0,07 |
| Vasopresor | 70 (92,1) | 67 (97,1) | 0,34 |
| Balón de contrapulsación intraaórtico | 29 (38,2) | 22 (31,9) | 0,54 |
| Ventilación mecánica | 68 (89,5) | 65 (94,2) | 0,47 |
| Duración de ECMO | 2,0 [1,0-4,0] | 2,0 [0,0-6,0] | 0,722 |
| Perfusión distal | 12 (15,8) | 9 (13,0) | 0,816 |
| Complicaciones | |||
| Isquemia de las extremidades | 6 (7,9) | 8 (11,9) | 0,60 |
| Hemorragia en el sitio de inserción del ECMO | 12 (15,8) | 13 (19,4) | 0,73 |
| Disección de la arteria femoral | 0 (0,0) | 1 (1,5) | 0,95 |
| Hemorragia gastrointestinal | 3 (3,9) | 12 (17,4) | 0,02 |
| Sepsis | 4 (5,3) | 4 (6,0) | > 0,99 |
CD: coronaria derecha; CX: arteria circunfleja; DA: descendente anterior; ECMO: oxigenador extracorpóreo de membrana; ICP: intervención coronaria percutánea; RCP: reanimación cardiopulmonar; ROSC: retorno a la circulación espontánea; TCI: tronco común izquierdo; TIMI: trombolisis en el infarto de miocardio.
Los valores expresan media±desviación estándar, n (%) o mediana [intervalo intercuartílico].
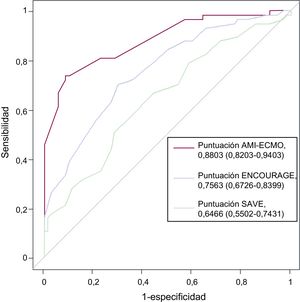
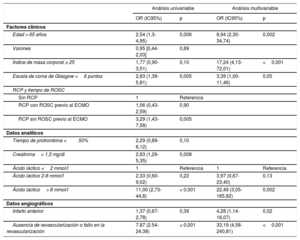
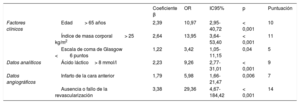
Después de convertir las variables continuas en categóricas, los predictores independientes de la mortalidad hospitalaria fueron la edad> 65 años, el índice de masa corporal> 25, la puntuación en la escala de coma de Glasgow <6, el ácido láctico> 8 mmol/l, el infarto de la cara anterior y la ausencia de revascularización o el fallo de esta, según un análisis multivariable con ajuste de las covariables pronósticas (tabla 3). La puntuación AMI-ECMO se generó para predecir la mortalidad hospitalaria de los pacientes con IAM tratados con ECMO-VA. En la tabla 4 se proporciona una descripción completa del modelo. La mortalidad hospitalaria tras la inserción de ECMO-VA fue del 6,2, el 28,1, el 51,6 y el 93,8% respectivamente para cada cuartil de puntuación AMI-ECMO (0 a 16, 17 a 19, 20 a 26 y> 26) (p de tendencia <0,001). Además, la puntuación AMI-ECMO tenía gran utilidad predictiva según lo evaluado por el área bajo la curva ROC (estadístico C=0,880; intervalo de confianza del 95% [IC95%], 0,820-0,940), con calibración satisfactoria (χ2 de Hosmer-Lemeshow=7,484; df=8; p=0,485) (figura 1). Respecto a los sistemas anteriormente validados, como el ENCOURAGE o el SAVE, la puntuación AMI-ECMO es la más útil como herramienta de predicción en la población de estudio (estadístico C para la puntuación AMI-ECMO frente a puntuación ENCOURAGE, 0,880 frente a 0,756; p=0,003; ROC y puntuación AMI-ECMO frente a puntuación SAVE, 0,880 frente a 0,647; p <0,001). Las correlaciones entre los sistemas de puntuación se muestran en la y las diferencias demográficas entre AMI-ECMO y ENCOURAGE, en la . En la validación cruzada dejando uno fuera (análisis de la puntuación AMI-ECMO para la validación interna), se observó la más baja tasa de clasificación errónea de la mortalidad hospitalaria (el 14%, frente al 26 y el 38% de ENCOURAGE y SAVE respectivamente).
Análisis univariable y multivariable de los factores asociados con la mortalidad hospitalaria
| Análisis univariable | Análisis multivariable | |||
|---|---|---|---|---|
| OR (IC95%) | p | OR (IC95%) | p | |
| Factores clínicos | ||||
| Edad > 65 años | 2,54 (1,3-4,95) | 0,006 | 8,94 (2,30-34,74) | 0,002 |
| Varones | 0,95 [0,44-2,03] | 0,89 | ||
| Índice de masa corporal ≥ 25 | 1,77 (0,90-3,51) | 0,10 | 17,24 (4,13-72,01) | <0,001 |
| Escala de coma de Glasgow <6 puntos | 2,83 (1,38-5,81) | 0,005 | 3,39 (1,00-11,46) | 0,05 |
| RCP y tiempo de ROSC | ||||
| Sin RCP | 1 | Referencia | ||
| RCP con ROSC previo al ECMO | 1,06 (0,43-2,59) | 0,90 | ||
| RCP sin ROSC previo al ECMO | 3,29 (1,43-7,58) | 0,005 | ||
| Datos analíticos | ||||
| Tiempo de protrombina <50% | 2,29 (0,89-6,12) | 0,10 | ||
| Creatinina> 1,5 mg/dl | 2,63 (1,29-5,35) | 0,008 | ||
| Ácido láctico <2 mmol/l | 1 | Referencia | 1 | Referencia |
| Ácido láctico 2-8 mmol/l | 2,33 (0,60-9,02) | 0,22 | 3,97 (0,67-23,40) | 0,13 |
| Ácido láctico> 8 mmol/l | 11,00 (2,73-44,8) | < 0,001 | 22,49 (3,05-165,82) | 0,002 |
| Datos angiográficos | ||||
| Infarto anterior | 1,37 (0,67-2,78) | 0,39 | 4,28 (1,14-16,07) | 0,02 |
| Ausencia de revascularización o fallo en la revascularización | 7.87 (2.54-24.38) | < 0,001 | 33,19 (4,58-240,81) | <0,001 |
ECMO: oxigenador extracorpóreo de membrana; IC95%: intervalo de confianza del 95%; OR: odds ratio; RCP: reanimación cardiopulmonar; ROSC: retorno a la circulación espontánea.
Sistema de puntuación para predecir la mortalidad hospitalaria
| Coeficiente β | OR | IC95% | p | Puntuación | ||
|---|---|---|---|---|---|---|
| Factores clínicos | Edad> 65 años | 2,39 | 10,97 | 2,95-40,72 | < 0,001 | 10 |
| Índice de masa corporal> 25 kg/m2 | 2,64 | 13,95 | 3,64-53,40 | < 0,001 | 11 | |
| Escala de coma de Glasgow <6 puntos | 1,22 | 3,42 | 1,05-11,15 | 0,04 | 5 | |
| Datos analíticos | Ácido láctico> 8 mmol/l | 2,23 | 9,26 | 2,77-31,01 | < 0,001 | 9 |
| Datos angiográficos | Infarto de la cara anterior | 1,79 | 5,98 | 1,66-21,47 | 0,006 | 7 |
| Ausencia o fallo de la revascularización | 3,38 | 29,36 | 4,67-184,42 | < 0,001 | 14 |
IC95%: intervalo de confianza del 95%; OR: odds ratio.
Ácido láctico introducido como variable binaria en el modelo multivariable.
Curvas de las características operativas del receptor de las puntuaciones AMI-ECMO, ENCOURAGE y SAVE para predecir la mortalidad hospitalaria. Entre los modelos, la puntuación AMI-ECMO mostró el valor estadístico C más alto. ECMO: oxigenador extracorpóreo de membrana; IAM: infarto agudo de miocardio.
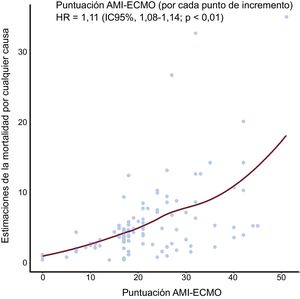
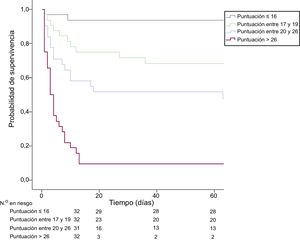
Entre los que sobrevivieron al alta (76 pacientes), 8 fallecieron, 1 se perdió durante el seguimiento y 68 seguían vivos durante el periodo de seguimiento. Las puntuaciones AMI-ECMO como valores continuos mostraron una asociación significativa con la tasa estimada de mortalidad por cualquier causa (por cada incremento de 1 punto, hazard ratio=1,11; IC95%, 1,08-1,14; p <0,001) (figura 2). En la figura 3 se comparan las distintas tasas de mortalidad por cualquier causa a 60 días entre los 4 grupos, clasificados según los cuartiles de puntuación AMI-ECMO. Se observaron diferencias significativas en la mortalidad por cualquier causa en los 4 grupos (test de log rank, p <0,001).
Estimación de la mortalidad por cualquier causa según la puntuación AMI-ECMO. La curva de regresión local representa la correlación entre la probabilidad de muerte por cualquier causa, que se calculó utilizando un modelo de regresión de riesgos proporcionales de Cox y la puntuación AMI-ECMO. La puntuación AMI-ECMO se correlaciona significativamente con la mortalidad por cualquier causa estimada. ECMO: oxigenador extracorpóreo de membrana; HR: hazard ratio; IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%.
Comparación de la mortalidad por cualquier causa según los cuartiles de puntuación AMI-ECMO. Representación de la curva de Kaplan-Meier de la probabilidad de supervivencia a 60 días según los cuartiles de puntuación AMI-ECMO (≤ 16, entre 17 y 19, entre 20 y 26 y> 26). ECMO: oxigenador extracorpóreo de membrana; IAM: infarto agudo de miocardio.
En el presente estudio se identificaron predictores independientes de la mortalidad hospitalaria y se creó un sistema de puntuación predictivo de la mortalidad hospitalaria que incluía 6 características del paciente: la edad, el índice de masa corporal, la puntuación en la escala de coma de Glasgow, el lactato, la existencia de infarto de cara anterior y la revascularización de pacientes con IAM asistidos con ECMO-VA debido a SC resistente. La nueva puntuación AMI-ECMO no solo es buena a la hora de discriminar la mortalidad hospitalaria, sino que también muestra un índice C para predecir la mortalidad hospitalaria más alto que las puntuaciones de riesgo del ECMO-VA validadas anteriormente. Además, los cuartiles de la puntuación AMI-ECMO se correlacionan positivamente y de manera significativa con la mortalidad por cualquier causa durante el seguimiento.
El uso extendido de la revascularización temprana y la mejora del tratamiento clínico basado en la evidencia han llevado a una disminución notable de la mortalidad debida a complicación del IAM por SC en las últimas 2 décadas20–23. Sin embargo, el SC resistente sigue siendo la primera causa de muerte; se constató una supervivencia general de aproximadamente el 50% de los pacientes hospitalizados con IAM complicado por SC asistidos con ECMO-VA24. Acorde con estudios anteriores, el 47,6% de los pacientes de este estudio fallecieron en el hospital. Además, la inserción inapropiada del dispositivo de ECMO-VA puede asociarse con una alta tasa de complicaciones, aumento de los costes hospitalarios y extensión innecesaria del tratamiento sin beneficio suficiente en mortalidad25. En este sentido, la decisión de iniciar y mantener el ECMO-VA debería llevarse a cabo con prudencia y en función de un análisis de riesgos y beneficios realizado por expertos. Hasta la fecha, se han llevado a cabo 2 estudios representativos, el SAVE y el ENCOURAGE, para elaborar modelos de predicción de la mortalidad de los pacientes asistidos con ECMO-VA17,19. Sin embargo, en la práctica real ha habido muchas limitaciones para la aplicación de estos modelos a pacientes con IAM. La puntuación SAVE es muy compleja para utilizarla con rapidez y es difícil de aplicar a una población específica de IAM porque la puntuación se creó basándose en pacientes con SC de cualquier causa. Aunque la puntuación ENCOURAGE se diseñó para poblaciones específicas con IAM tratadas con ECMO-VA y comprende 6 variables simples, datos angiográficos como la revascularización satisfactoria o la localización de la lesión causal, que es una de las estrategias terapéuticas más importantes para el IAM, no están incluidos en el modelo. Aunque la gravedad de la enfermedad de la población en estudio puede haber sido ligeramente distinta de la del estudio actual, en el subestudio documentado recientemente del ensayo IABP-SHOCK II se vio que hallazgos angiográficos tales como un flujo TIMI (Thrombolysis In Myocardial Infarction) <3 tras la intervención coronaria percutánea eran predictores independientes de la mortalidad hospitalaria de lospacientes con SC relacionado con el IAM26. En consecuencia, se elaboró y se analizó un modelo de predicción simple que incluye variables angiográficas y previas al ECMO para predecir la mortalidad hospitalaria de los pacientes con IAM tratados con ECMO-VA.
Numerosos estudios observacionales previos han identificado predictores independientes de la mortalidad hospitalaria en pacientes con IAM y SC tratados con ECMO-VA27–31. En el presente estudio, los predictores independientes de la mortalidad hospitalaria fueron la edad avanzada, la obesidad, una puntuación baja en la escala de coma de Glasgow, una concentración de lactato sérico alta, el infarto de la pared anterior y la revascularización insatisfactoria. Las variables clínicas y analíticas previas al ECMO, como la edad avanzada, la obesidad, una puntuación baja en la escala de coma de Glasgow y una concentración de lactato alta, son predictores independientes tanto en el presente estudio como en el ENCOURAGE, cuyos diseño y población eran los mismos. No obstante, a diferencia del ENCOURAGE, las variables angiográficas, como localización anterior de la lesión causal y revascularización insatisfactoria, predijeron de manera significativa la mortalidad hospitalaria del presente estudio. Esto corrobora el hallazgo de estudios previos de que el infarto de la cara anterior se relaciona con mal pronóstico y subraya la importancia de la revascularización temprana en pacientes con IAM y SC29–32. Además, la utilidad para predecir la mortalidad hospitalaria era numéricamente superior en la puntuación AMI-ECMO (estadístico C=0,880) que en la puntuación ENCOURAGE (estadístico C=0,840). No obstante, ninguno de estos estudios se ha validado en otras cohortes. En consecuencia, se requieren futuros estudios para la validación externa y para comparar el desempeño de estas puntuaciones.
LimitacionesEste estudio tiene varias limitaciones. En primer lugar, dada la naturaleza retrospectiva de la base de datos, algunas variables como la concentración de ácido láctico, parámetros ecocardiográficos, parámetros hemodinámicos y datos neurológicos no se registraron de todos los pacientes. En particular, solo se dispuso de datos relativos al lactato sérico del 87,6% de los pacientes (127/145). Por lo tanto, los casos sin valores de lactato sérico se excluyeron del modelo de regresión logística multivariable. En segundo lugar, la puntuación AMI-ECMO tiene que confirmarse prospectivamente en otras poblaciones de pacientes con IAM complicado por SC y tratados con ECMO-VA, porque se solo se realizó una validación interna de la puntuación AMI-ECMO. Por último, este estudio se basa en una experiencia llevada a cabo en un único centro, lo que puede limitar la generalización de estos resultados y ha originado sesgo de selección en el subgrupo de pacientes. Asimismo, el tamaño relativamente pequeño de la muestra podría haber limitado la precisión de las estimaciones.
CONCLUSIONESCon la edad, el índice de masa corporal, la puntuación de la escala de coma de Glasgow, el lactato, el infarto de la cara anterior y la revascularización insatisfactoria, se ha creado un buen modelo de predicción del riesgo en la supervivencia al alta de los pacientes con IAM tratados con ECMO-VA. La puntuación AMI-ECMO contribuirá a la toma de decisiones en el IAM complicado por SC asistido con ECMO-VA.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
El inicio y mantenimiento del ECMO-VA en pacientes con IAM y SC resistente debería decidirse cuidadosamente en función del análisis de riesgos y beneficios evaluado por expertos.
- –
Hay pocos datos para elaborar un modelo de predicción del riesgo de muerte hospitalaria de los pacientes con IAM tratados con ECMO-VA.
- –
La puntuación ECMO-VA, que incorpora la edad, el índice de masa corporal, la puntuación en la escala de coma de Glasgow, la concentración de lactato, la existencia de infarto en la cara anterior y la revascularización, puede contribuir a la toma de decisiones en el IAM complicado por SC asistido con ECMO-VA y discrimina bien la mortalidad hospitalaria.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2018.05.047.