Los eventos no cardiovasculares son una importante causa de morbimortalidad en pacientes con insuficiencia cardiaca (IC), pero parece que su riesgo difiere en función de la fracción de eyección del ventrículo izquierdo (FEVI). Nuestro objetivo es evaluar el riesgo de mortalidad y hospitalizaciones no cardiovasculares totales en función de la FEVI tras una hospitalización por IC.
MétodosSe evaluó en retrospectiva a una cohorte multicéntrica de 4.595 pacientes tras una hospitalización por IC. Se evaluó la FEVI como variable continua y estratificada en 4 categorías (FEVI ≤ 40%, 41%-49%, 50-59% y ≥ 60%). Los objetivos fueron los riesgos de muerte no cardiovascular y de hospitalizaciones recurrentes por causas no cardiovasculares según la FEVI.
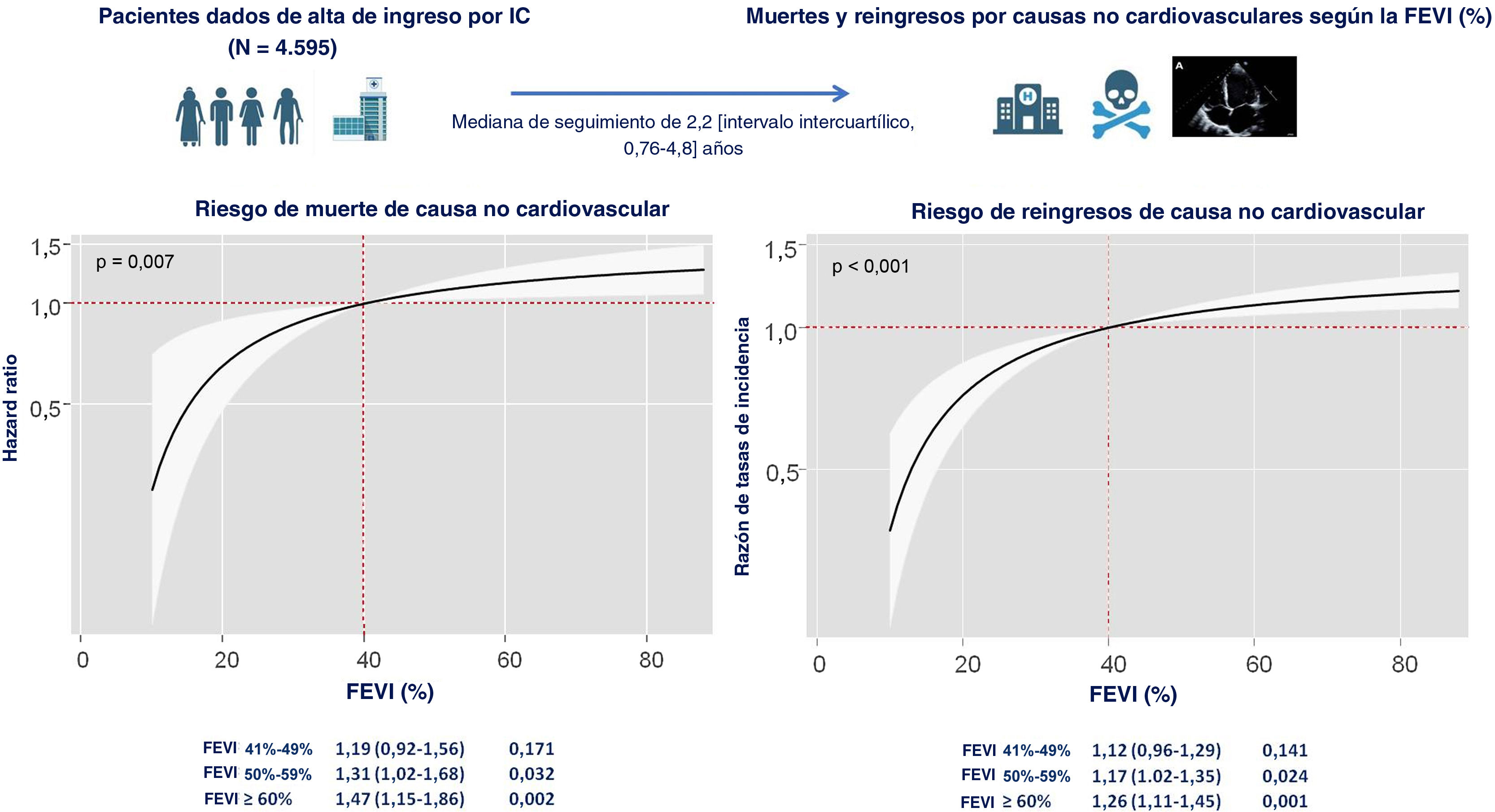
ResultadosTras una mediana de seguimiento de 2,2 [intervalo intercuartílico, 0,76-4,8] años, se registraron 646 muertes y 4.014 episodios de rehospitalización por causas no cardiovasculares. En el análisis multivariante, que incluía el riesgo de evento cardiovascular como evento adverso competitivo, se halló relación directa entre la FEVI y el riesgo de muerte o rehospitalización no cardiovascular (p<0,001). En comparación con la FEVI ≤ 40%, la FEVI del 51-59% y especialmente la ≥ 60% se asociaron de manera significativa con un mayor riesgo de muerte no cardiovascular (respectivamente, HR=1,31; IC95%, 1,02-1,68; p=0,032; y HR=1,47; IC95%, 1,15-1,86; p=0,002) y de rehospitalizaciones no cardiovasculares (IRR=1,17; IC95%, 1,02-1,35; p=0,024; IRR=1,26; IC95%, 1,11-1,45; p=0,001).
ConclusionesTras una hospitalización por IC, la FEVI tiene relación directa con el riesgo de morbimortalidad no cardiovascular. Los pacientes con FEVI conservada tienen un riesgo significativamente mayor de muerte y hospitalizaciones por causas no cardiovasculares, fundamentalmente si la FEVI es ≥ 60%.
Palabras clave
La fracción de eyección del ventrículo izquierdo (FEVI) es la piedra angular para la clasificación y la determinación del fenotipo en la insuficiencia cardiaca (IC), ya que existen diferencias clínicas, fisiopatológicas y terapéuticas sustanciales entre los pacientes en IC con FE reducida (IC-FEr), levemente reducida (IC-FElr) o conservada (IC-FEc)1,2.
A pesar de los avances terapéuticos, los pacientes con IC siguen estando en alto riesgo de muerte y tienen una enorme carga de reingresos, sea cual sea su FEVI1,3,4. Las muertes de causa cardiovascular, principalmente muerte súbita cardiaca o insuficiencia de bombeo, son las prevalentes en los pacientes con IC, y el agravamiento de esta es la primera causa de reingreso hospitalario1,5,6. Sin embargo, el riesgo de eventos cardiovasculares y eventos relacionados con la IC parece disminuir a medida que aumenta la FEVI4, y hay datos recientes de ensayos clínicos aleatorizados que indican un menor riesgo de eventos cardiovasculares en los pacientes con IC-FEc7,8.
Los pacientes con IC-FEc suelen ser de más edad, presentan una carga de comorbilidad diferente y muestran diferencias fisiopatológicas con los pacientes con IC-FEr1,2,9,10. En esta población, históricamente, los antagonistas neurohormonales y otros tratamientos cardiovasculares no han mostrado un beneficio clínico robusto1, excepto por algunos ensayos recientes llevados a cabo con inhibidores del cotransportador 2 de sodio y gucosa (SGLT2)11,12. En la IC-FEc, la contribución de las muertes de causa no cardiovascular y los reingresos por motivos no cardiovasculares a la carga de morbilidad y mortalidad parece ser especialmente importante4,13–16. Los eventos no cardiovasculares son factores contribuyentes clave en la mortalidad de los pacientes con IC-FEc8,15, y parece que los reingresos no cardiovasculares afectan al pronóstico de manera similar que los eventos cardiovasculares17,18, pero son pocos los estudios que se han centrado en determinar su impacto.
El objetivo del presente estudio es determinar la carga de morbilidad y mortalidad no cardiovasculares en una población con IC no seleccionada y evaluar si la modificación de este riesgo difiere en todo el espectro y las categorías de FEVI.
MÉTODOSGrupo de estudio y protocoloSe llevó a cabo un análisis retrospectivo de un registro prospectivo multicéntrico de 4.812 pacientes consecutivos ingresados por IC aguda en 3 hospitales académicos de la Comunidad Valenciana entre enero de 2008 y octubre de 2019. Dos de los hospitales son centros terciarios con 582 y 574 camas respectivamente, mientras que el tercero es un hospital local de 325 camas. En la hospitalización índice que cualificó a los pacientes para la inclusión en el estudio, fallecieron 217 pacientes, con lo que el tamaño final de la muestra fue de 4.595 pacientes dados de alta con vida. Se registró de manera sistemática un conjunto detallado de datos de parámetros demográficos, antecedentes patológicos, parámetros analíticos y ecocardiográficos estándares y tratamientos al alta, para lo cual durante la hospitalización índice se utilizaron cuestionarios de registro preestablecidos. Se incluyó en el registro a los pacientes con IC de nueva aparición o agravamiento de la IC ya existente. La IC aguda se definió según la guía de práctica clínica de la Sociedad Europea de Cardiología. Las estrategias de tratamiento se individualizaron siguiendo lo indicado por la guía vigente a la inclusión de los pacientes en el registro.
EcocardiografíaDurante la hospitalización índice se realizó a todos los pacientes una ecocardiografía transtorácica bidimensional en decúbito lateral izquierdo (96 ± 24h después del ingreso) a cargo de ecografistas experimentados. Durante todo el estudio se utilizaron sistemas comercializados. Los pacientes ingresaron en la sala de hospitalización y estaban clínicamente estables cuando se llevó a cabo la exploración. Todas las imágenes se grabaron con el segundo armónico en teleespiración. La FEVI se determinó con el método de biplano de Simpson.
Seguimiento, objetivos y consideraciones éticasLos objetivos del estudio fueron la incidencia de mortalidad de causa no cardiovascular y los ingresos recurrentes por causas no cardiovasculares. Las muertes de causa cardiovascular se consideraron secundarias a agravamiento de la IC, infarto agudo de miocardio, ictus o accidente isquémico transitorio, arritmias cardiacas, enfermedad arterial periférica, muerte súbita cardiaca o causa de muerte desconocida19. La causa de la muerte se consideró no cardiovascular si se identificaba una causa no cardiovascular específica. Por lo que respecta a los objetivos de reingreso, solamente se registraron los reingresos no programados. Todos los reingresos que se produjeron durante el seguimiento se clasificaron como de causa cardiovascular (incluidos los debidos a agravamiento de la IC, infarto agudo de miocardio, angina inestable, ictus o accidente isquémico transitorio, arritmias cardiacas o enfermedad arterial periférica). En los demás casos se consideró una etiología no cardiovascular, como las de causa oncológica, infecciosa, gastrointestinal, renal, pulmonar, endocrina, urológica-ginecológica o reumática. Los ingresos no cardiovasculares se clasificaron como de causa infecciosa, oncológica, renal u otras en función del diagnóstico principal indicado en el informe clínico. Los reingresos debidos a insuficiencia renal aguda en el contexto de un agravamiento de la IC se clasificaron como relacionados con la IC. Los debidos a otras causas se consideraron no cardiovasculares.
El seguimiento y la evaluación de los objetivos se llevaron a cabo mediante el examen de la historia clínica electrónica del sistema público de atención de salud. La validación («adjudicación») de los objetivos la llevaron a cabo por pares de investigadores que no conocían los valores de la FEVI de los pacientes.
El estudio se atuvo a los principios establecidos en la Declaración de Helsinki de 1975 y fue aprobado por el comité de ética local de cada centro. Todos los pacientes dieron su consentimiento informado.
Análisis estadísticoLas variables continuas se expresan en forma de media ± desviación estándar o mediana [intervalo intercuartílico], cuando proceda. Las variables discretas se resumen en forma de porcentajes. Se compararon las características iniciales de los pacientes de las distintas categorías mediante la prueba de la χ2 de Pearson o pruebas de ANOVA para las variables cualitativas y continuas respectivamente. La FEVI se evaluó como variable continua y se la estratificó en 4 categorías (FEVI ≤ 40%, 41%-49%, 50%-59% y ≥ 60%). La asociación entre la categoría de FEVI y la muerte de causa no cardiovascular se evaluó mediante un análisis de regresión de Cox, y los resultados se expresan en forma de hazard ratio (HR) junto con los intervalos de confianza del 95% (IC95%). Las estimaciones de la regresión de Cox se ajustaron respecto a la muerte de causa cardiovascular como evento competitivo. En cuanto al objetivo del reingreso, se llevó a cabo un análisis descriptivo de los eventos recurrentes mediante el recuento del número de hospitalizaciones durante el periodo de seguimiento. Se calcularon las tasas de incidencia brutas (expresadas mediante el número de reingresos/100 años-persona) para cada resultado de reingreso. Se utilizaron modelos de regresión binomial negativa bivariantes que modelizaban simultáneamente el número de reingresos de causa no cardiovascular (en forma de recuentos) y la mortalidad por cualquier causa (como evento terminal). Las estimaciones de la regresión correspondientes a ambos objetivos se ajustaron mutuamente con las medias de fragilidad compartida (que tienen en cuenta la correlación positiva entre los 2 objetivos)20. Las estimaciones del riesgo se presentan en forma de razón de tasas de incidencia (RTI).
Las variables incluidas en los modelos multivariables finales fueron: edad, sexo, primer ingreso por IC, clase III/IV de la New York Heart Association (NYHA) previa, presión arterial sistólica al ingreso, frecuencia cardiaca al ingreso, índice de comorbilidad de Charlson, fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) en plasma, nitrógeno de urea en sangre, tasa de filtrado glomerular estimada, antígeno carbohidrato 125, hemoglobina, dosis de diurético del asa al alta, inhibidores del sistema renina-angiotensina-aldosterona al alta, bloqueadores beta al alta y antagonistas del receptor de mineralocorticoides al alta, teniendo en cuenta la mortalidad de causa cardiovascular y los reingresos de causa cardiovascular como evento competidor. Para ambos modelos multivariables, las covariables candidatas se eligieron en función del conocimiento médico previo, y a continuación se aplicó una selección escalonada retrógrada. Durante este proceso de selección, se evaluó simultáneamente el supuesto de linealidad para todas las variables continuas y se transformaron las variables con polinomios fraccionales si procedía. Todas las variables enumeradas en la tabla 1 se evaluaron como posibles covariables en los modelos multivariables, con independencia de su valor de p. Se realizaron imputaciones múltiples para las covariables de las que faltaban datos. En todos los casos, las tasas fueron <5%.
Características basales de los pacientes por categorías de fracción de eyección del ventrículo izquierdo
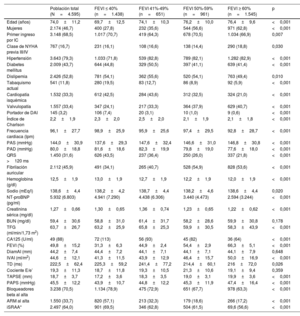
| Población total (N=4.595) | FEVI ≤ 40% (n=1.438) | FEVI 41%-49% (n=651) | FEVI 50%-59% (n=961) | FEVI ≥ 60% (n=1.545) | p | |
|---|---|---|---|---|---|---|
| Edad (años) | 74,0±11,2 | 69,7±12,5 | 74,1±10,3 | 76,2±10,0 | 76,4±9,6 | <0,001 |
| Mujeres | 2.174 (46,7) | 400 (27,8) | 232 (35,6) | 544 (56,6) | 971 (62,8) | <0,001 |
| Primer ingreso por IC | 3.148 (68,5) | 1.017 (70,7) | 419 (64,3) | 678 (70,5) | 1.034 (66,9) | 0,007 |
| Clase de NYHA previa III/IV | 767 (16,7) | 231 (16,1) | 108 (16,6) | 138 (14,4) | 290 (18,8) | 0,030 |
| Hipertensión | 3.643 (79,3) | 1.033 (71,8) | 539 (82,8) | 789 (82,1) | 1.282 (82,9) | <0,001 |
| Diabetes mellitus | 2.009 (43,7) | 644 (44,8) | 329 (50,5) | 397 (41,1) | 639 (41,4) | <0,001 |
| Dislipemia | 2.426 (52,8) | 781 (54,1) | 362 (55,6) | 520 (54,1) | 763 (49,4) | 0,010 |
| Tabaquismo actual | 541 (11,8) | 280 (19,5) | 83 (12,7) | 86 (8,9) | 92 (5,9) | <0,001 |
| Cardiopatía isquémica | 1.532 (33,3) | 612 (42,5) | 284 (43,6) | 312 (32,5) | 324 (21,0) | <0,001 |
| Valvulopatía | 1.557 (33,4) | 347 (24,1) | 217 (33,3) | 364 (37,9) | 629 (40,7) | <0,001 |
| Portador de DAI | 145 (3,2) | 106 (7,4) | 20 (3,1) | 10 (1,0) | 9 (0,6) | <0,001 |
| Índice de Charlson | 2,2±1,9 | 2,3±2,0 | 2,5±2,0 | 2,1±1,9 | 2,1±1,8 | <0,001 |
| Frecuencia cardiaca (lpm) | 96,1±27,7 | 98,9±25,9 | 95,9±25,6 | 97,4±29,5 | 92,8±28,7 | <0,001 |
| PAS (mmHg) | 144,0±30,9 | 137,6±29,3 | 147,6±32,4 | 146,6±31,0 | 146,8±30,8 | <0,001 |
| PAD (mmHg) | 80,0±18,8 | 81,6±18,6 | 82,3±19,9 | 79,8±19,0 | 77,6±18,0 | <0,001 |
| QRS >120 ms | 1.450 (31,6) | 626 (43,5) | 237 (36,4) | 250 (26,0) | 337 (21,8) | <0,001 |
| Fibrilación auricular | 2.112 (45,9) | 491 (34,1) | 265 (40,7) | 528 (54,9) | 828 (53,6) | <0,001 |
| Hemoglobina (g/dl) | 12,5±1,9 | 13,0±1,9 | 12,7±1,9 | 12,2±1,9 | 12,0±1,9 | <0,001 |
| Sodio (mEq/l) | 138,6±4,4 | 138,2±4,2 | 138,7±4,4 | 138,2±4,6 | 138,6±4,4 | 0,020 |
| NT-proBNP (pg/ml) | 5.932 (6.803) | 4.941 (7.290) | 4.438 (6.306) | 3.440 (4.473) | 2.594 (3.244) | <0,001 |
| Creatinina sérica (mg/dl) | 1,27±0,66 | 1,30±0,65 | 1,36±0,74 | 1,23±0,65 | 1,22±0,62 | <0,001 |
| BUN (mg/dl) | 59,4±30,6 | 58,8±31,0 | 61,4±31,7 | 58,2±28,6 | 59,9±30,8 | 0,178 |
| TFG (ml/min/1,73 m2) | 63,7±26,7 | 63,2±25,9 | 65,8±25,3 | 59,9±30,5 | 58,3±43,9 | <0,001 |
| CA125 (U/ml) | 49 (88) | 72 (113) | 56 (93) | 45 (82) | 36 (64) | <0,001 |
| FEVI (%) | 49,8±15,2 | 31,3±6,3 | 44,9±2,4 | 54,4±2,9 | 66,3±5,1 | <0,001 |
| DiamAI (mm) | 44,2±7,4 | 44,4±7,2 | 44,1±7,1 | 44,1±7,1 | 44,1±7,9 | 0,648 |
| IVAI (ml/m2) | 44,6±12,1 | 41,3±11,5 | 43,9±12,9 | 46,4±15,7 | 50,0±16,9 | <0,001 |
| TD (ms) | 222,5±62,4 | 225,3±59,2 | 241,4±77,2 | 214,4±60,1 | 216±72,0 | 0,026 |
| Cociente E/e’ | 19,3±11,3 | 18,7±11,8 | 19,3±10,5 | 21,3±10,6 | 19,1±9,4 | 0,359 |
| TAPSE (mm) | 18,7±3,7 | 17,2±3,6 | 18,3±3,5 | 19,0±3,1 | 19,9±3,6 | <0,001 |
| PAPS (mmHg) | 45,5±12,2 | 43,9±10,7 | 44,8±12,2 | 45,3±11,9 | 47,4±16,4 | <0,001 |
| Bloqueadores beta al alta | 3.238 (70,5) | 1.134 (78,9) | 475 (72,9) | 651 (67,7) | 978 (63,3) | <0,001 |
| ARM al alta | 1.550 (33,7) | 820 (57,1) | 213 (32,3) | 179 (18,6) | 266 (17,2) | <0,001 |
| iSRAA* | 2.497 (64,0) | 901 (69,5) | 346 (62,8) | 504 (61,5) | 69,6 (56,6) | <0,001 |
ARM: antagonistas del receptor de mineralocorticoides; BUN: nitrógeno de urea en sangre; CA125: antígeno carbohidrato 125; DAI: desfibrilador automático implantable; DiamAI: diámetro de la aurícula izquierda; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; IVAI: índice de volumen de la aurícula izquierda; NT-proBNP: porción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAD: presión arterial diastólica; PAPS: presión arterial pulmonar sistólica; PAS: presión arterial sistólica; TAPSE: excursión sistólica del anillo tricuspídeo; TD: tiempo de desaceleración; TFG: tasa de filtrado glomerular.
Los valores expresan n (%) o media ± desviación estándar.
Para todos los análisis estadísticos se consideró estadísticamente significativo un valor de p bilateral <0,05. Todos los análisis de la supervivencia se llevaron a cabo con el programa STATA 15.1 (StataCorp. 2015, Stata Statistical Software: versión 14.1, Estados Unidos).
RESULTADOSLa media de edad de la cohorte fue 74,0 ± 11,2 años; 2.147 (47%) pacientes eran mujeres y 1.447 (31%) habían sido hospitalizados anteriormente por IC. Los pacientes con valores de FEVI ≤ 40%, 41%-49%, 50%-59% y ≥ 60% fueron 1.438 (31,3%), 651 (14,2%), 961 (20,9%) y 1.545 (33,6%) respectivamente. En la tabla 1 se muestran las características basales por categorías de FEVI en la cohorte completa. A medida que aumentaba la FEVI, los pacientes eran de más edad, en mayor proporción mujeres y con más antecedentes de hipertensión, fibrilación auricular o valvulopatía. Los pacientes con IC-FEc presentaban peores función renal y clase funcional de la NYHA basales antes del ingreso. Del mismo modo, estos presentaron mayor proporción de ingresos previos por IC. Los pacientes con FEVI reducida mostraron una mayor proporción de diabetes, cardiopatía isquémica y un índice de comorbilidad de Charlson más alto. Los valores del NT-proBNP y del antígeno carbohidrato 125 eran más bajos a medida que aumentaba la FEVI. Los tratamientos con antagonistas neurohormonales eran más frecuentes a medida que se reducía la FEVI, y su empleo máximo se daba en los pacientes con IC-FEr (tabla 1).
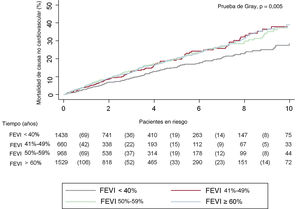
Riesgo de mortalidad de causa no cardiovascular según la categoría de FEVITras una mediana de seguimiento de 2,2 [0,76-4,80] años, habían fallecido 2.257 pacientes (49%). De ellos, 1.611 (35%) murieron por causas cardiovasculares y 646 (14,2%), por causas no cardiovasculares, lo cual indica que un 29% de las muertes de la cohorte total se debieron a causas no cardiovasculares. Los gráficos de la incidencia acumulada mostraron que los pacientes con IC-FEr eran los que tenían la incidencia más baja de mortalidad no cardiovascular (prueba de Gray, p=0,005), sin que hubiera diferencias manfiestas en los pacientes con FEVI >40% (figura 1).
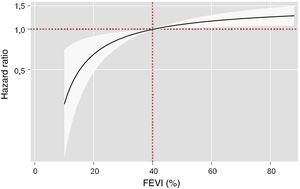
En el análisis multivariable teniendo en cuenta el riesgo de muerte de causa cardiovascular como evento competitivo, la FEVI tomada como variable continua mostró una asociación directa con el riesgo de mortalidad de causa no cardiovascular (p=0,007) (figura 2). En comparación con los pacientes con IC-FEr, los que tenían una FEVI 51%-59% y sobre todo aquellos con FEVI ≥ 60% mostraron un riesgo significativamente mayor de mortalidad de causa no cardiovascular (respectivamente, HR = 1,31; IC95%, 1,02-1,68; p=0,032; y HR = 1,47; IC95%, 1,15-1,86; p=0,002). Los pacientes con IC-FElr no presentaron mayor riesgo de eventos no cardiovasculares (HR = 1,19; IC95%, 0,92-1,56; p=0,171) (tabla 2).
Estimaciones del riesgo de mortalidad no cardiovascular y reingresos de causa no cardiovascular en las diversas categorías de fracción de eyección del ventrículo izquierdo en los modelos multivariables
| Mortalidad no cardiovascular | HR (IC95%) | p |
|---|---|---|
| IC-FEr (referencia) | ||
| FEVI 41%-49% | 1,19 (0,92-1,56) | 0,171 |
| FEVI 50%-59% | 1,31 (1,02-1,68) | 0,032 |
| FEVI ≥ 60% | 1,47 (1,15-1,86) | 0,002 |
| Reingresos de causa no cardiovascular | RTI (IC95%) | p |
|---|---|---|
| IC-FEr (referencia) | ||
| FEVI 41%-49% | 1,12 (0,96-1,29) | 0,141 |
| FEVI 50%-59% | 1,17 (1,02-1,35) | 0,024 |
| FEVI ≥ 60% | 1,26 (1,11-1,45) | 0,001 |
FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; RTI: razón de tasas de incidencia.
Los modelos se ajustaron por edad, sexo, primer ingreso por IC, clase de NYHA III/IV previa, presión arterial sistólica al ingreso, frecuencia cardiaca al ingreso, índice de comorbilidad de Charlson, fracción aminoterminal del propéptido natriurético cerebral en plasma, nitrógeno de urea en sangre, tasa de filtrado glomerular estimada, antígeno carbohidrato 125, hemoglobina, dosis de diurético del asa al alta, inhibidores del sistema renina-angiotensina-aldosterona al alta, bloqueadores beta al alta, antagonistas del receptor de mineralocorticoides al alta y riesgo de muerte de causa CV o reingresos CV como eventos competidores.
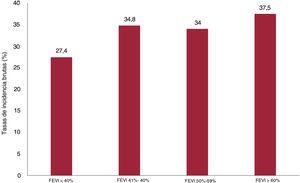
Durante el seguimiento se registraron 9.281 reingresos por cualquier causa de 3.145 pacientes (68,4%). De ellos, 4.014 reingresos de 1.902 pacientes (41,4%) se debieron a causas no cardiovasculares. Hubo un número sustancial de pacientes que presentaron eventos recurrentes no cardiovasculares durante el seguimiento. Hubo 435, 225, 103, 265 y 722 pacientes con 2, 3, 4, 5 y más de 5 rehospitalizaciones respectivamente. Las tasas de reingreso de causa no cardiovascular (cada 100 personas-años) aumentaron significativamente de las categorías de FEVI más bajas a las más altas (figura 3). Las más frecuentes de reingresos no cardiovasculares fueron otras causas (2.134 hospitalizaciones), seguidas de las infecciones (975), las causas oncológicas (578) y las renales (327).
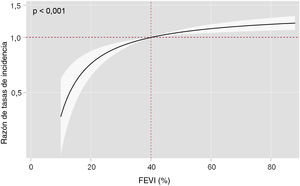
Un ajuste multivariable que incluía los reingresos de causa cardiovascular como evento competitivo mostró que la FEVI como variable continua estaba directamente asociada con el riesgo de ingresos recurrentes de causa no cardiovascular (p<0,001). Se observó un aumento gradual significativo del riesgo de hospitalizaciones recurrentes de causa no cardiovascular en los pacientes con valores más altos de FEVI (figura 4). Se infirieron resultados similares en el análisis de las categorías de FEVI. En comparación con la IC-FEr, la categoría de FEVI 51%-59% y sobre todo la de FEVI ≥ 60% se asociaron de manera independiente con un mayor riesgo de ingresos recurrentes de causa no cardiovascular (respectivamente, RTI = 1,17; IC95%, 1,02-1,35; p=0,024; y RTI = 1,26; IC95%, 1,11-1,45; p=0,001). Esta asociación no se observó en la categoría de IC-FElr (RTI = 1,12; IC95%, 0,96-1,29; p=0,141) (tabla 2).
En las tablas 1 y 2 del material adicional se presentan los modelos multivariables detallados, incluidas todas las covariables y sus estimaciones de riesgo para la mortalidad de causa no cardiovascular y los ingresos recurrentes de causa no cardiovascular.
DISCUSIÓNEn el presente estudio se evaluó la carga de eventos no cardiovasculares a largo plazo en un registro multicéntrico de pacientes incluidos tras un ingreso por IC aguda. Se confirma la elevada carga de morbimortalidad de causa no cardiovascular en esta población en la práctica clínica diaria. Y lo que tiene más interés, se observó que el riesgo de eventos no cardiovasculares se asocia con los valores de FEVI (figura 5). Este riesgo fue sustancialmente superior en la IC-FEc, en especial en los pacientes con FEVI ≥ 60%.
Figura central. Resumen del protocolo del estudio y las estimaciones de riesgos (valores de HR y RTI), de muerte de causa no cardiovascular y de ingresos recurrentes respectivamente, en todo el espectro de valores de FEVI en los modelos multivariables y con estratificación por subgrupos tomando el de IC con fracción de eyección reducida como grupo de referencia. CV: cardiovascular; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: insuficiencia cardiaca; RTI: razón de tasas de incidencia.
Los pacientes con IC presentan una carga de eventos sustancial con independencia de cuál sea su valor de FEVI1,3–6. Esto es especialmente así después de un ingreso por IC aguda, que constituye un punto de inflexión en la evolución natural de la enfermedad1,3. Los eventos cardiovasculares, como la muerte de causa cardiovascular o el agravamiento de la IC, son las principales causas de muerte y de reingreso en la IC respectivamente, y se consideran los objetivos tradicionales en la IC21. Sin embargo, tal como se ha observado recientemente en ensayos clínicos y estudios de observación, la carga de eventos no cardiovasculares es también sustancial y aumenta progresivamente8,15,22. A pesar de los estudios de la práctica clínica real contemporáneos que muestran una edad avanzada y una comorbilidad creciente en la IC, no se han evaluado suficientemente la importancia y la repercusión de los eventos no cardiovasculares en la práctica clínica diaria. Históricamente estos eventos no se han tenido en cuenta, ya que no se consideraban directamente relacionados con la enfermedad, son difíciles de prevenir y tratar y no parece que los tratamientos cardiovasculares les afecten14–18.
Los estudios de observación y los datos de ensayos clínicos aleatorizados han puesto de manifiesto que los eventos no cardiovasculares son frecuentes en los pacientes con IC-FEc8,10,14,16,18. La IC-FEc es un síndrome que plantea un verdadero reto, ya que los pacientes son de edad avanzada y su carga de comorbilidad difiere de la que presentan los pacientes con IC-FEr1,6,10. Un reciente estudio observacional de Italia ha indicado que la mortalidad de causa no cardiovascular supuso un 62% de las muertes de los pacientes con IC-FEc, pero solo un 35% de las de los pacientes con IC-FEr23. En un estudio previo, los pacientes con IC-FEc mostraron menos riesgo de muerte relacionada con la IC4. Los datos obtenidos en ensayos clínicos aleatorizados han respaldado la magnitud de la morbilidad y la mortalidad de causa no cardiovascular de los pacientes con IC-FEc. En un análisis combinado de los estudios DAPA-HF y DELIVER en el que se incluyó a pacientes con IC de todo el espectro de valores de la FEVI, el 53% de las muertes se atribuyeron a causas cardiovasculares, pero la proporción de muertes atribuidas a trastornos cardiacos mostró una correlación inversa con la FEVI, de tal manera que representaron menos del 40% de las muertes de pacientes con FEVI ≥ 60%8. Los datos relativos al riesgo de reingreso son más escasos. En un reciente análisis de la cohorte TOPCAT-Americas, la mitad de los reingresos que se produjeron durante el ensayo se debieron a una causa no cardiovascular y hasta un 44% del total de reingresos de los pacientes incluidos en el ensayo I-PRESERVE se debieron a causas no cardiovasculares14,18. En concordancia con estos resultados, en un gran estudio observacional en el que participaron 40.239 pacientes con IC crónica, se observó que aquellos con IC-FEc presentaban un aumento significativo del riesgo de reingresos de causa no cardiovascular en comparación con los pacientes con IC-FEr13. Nuestros resultados concuerdan con los datos previos que muestran en la práctica clínica diaria una tasa de eventos superior y un mayor riesgo de morbilidad y mortalidad de causa no cardiovascular en los pacientes con IC-FEc que en aquellos con FEVI reducida.
No debe desdeñarse la importancia de estos eventos no cardiovasculares en la IC. Los análisis tanto del ensayo CHARM como del ensayo TOPCAT indicaron que las hospitalizaciones de causa no cardiovascular se asociaban con un riesgo de mortalidad posterior comparable al asociado con un evento cardiovascular17,18.
Mayor riesgo de eventos no cardiovasculares en los pacientes con FEVI supranormalHay evidencia sustancial de que existen diferencias entre los distintos fenotipos de IC establecidos, pero son pocos los estudios que se han centrado en las posibles diferencias en los eventos no cardiovasculares en el espectro de valores de la FEVI. Recientemente, Desai et al.8 han mostrado que las tasas de muerte de causa no cardiovascular presentan una relación inversa con los valores de FEVI evaluados como variable continua en un análisis combinado de las cohortes de los ensayos DAPA-HF y DELIVER. Nuestros datos amplían estos resultados a la «práctica clínica real» al mostrar no solo un aumento significativo de la mortalidad de causa no cardiovascular, sino también un mayor riesgo de reingreso por causas no cardiovasculares a medida que aumenta la FEVI.
Los pacientes con IC en la franja alta de la FEVI tienen unas características distintas de las de otros pacientes con IC y se considera que tienen una FEVI «supranormal». El valor de corte utilizado para establecer la FEVI supranormal es bastante arbitrario. En la actualidad no hay una definición estándar, pero se suele tomar como tal un valor superior al 60-65%24–26. En nuestro estudio estos pacientes eran predominantemente mujeres y de edad avanzada (mediana, 76 años) y tenían valores bajos de péptidos natriuréticos y altas prevalencias de hipertensión y fibrilación auricular; solo el 21% de los pacientes presentaban cardiopatía isquémica. Estas características concuerdan con los datos de los ensayos clínicos7,27. Rosch et al.28 han descrito recientemente diferencias morfológicas y fisiopatológicas significativas entre los pacientes con IC-FEc y FEVI del 50%-60% y aquuellos con FEVI >60%. Los pacientes con FEVI del 50%-60% tenían importantes características en común con los pacientes con IC-FElr o IC-FEr y mostraron contractilidad reducida, deterioro del acoplamiento ventriculoauricular y mayor fracción de volumen extracelular. En cambio, los pacientes con FEVI >60% mostraron un estado de hipercontractilidad con sobrecarga del VI excesiva y reserva de precarga reducida28.
Estas características clínicas y fisiopatológicas distintivas de los pacientes con IC y FE supranormal pueden tener consecuencias importantes. Por ejemplo, los subestudios de ensayos clínicos aleatorizados que han evaluado el efecto de los inhibidores del sistema renina-angiotensina-aldosterona en la IC-FEc han mostrado un posible efecto beneficioso de los tratamientos en el extremo inferior de la FEVI (incluso con resultados positivos en pacientes con FEVI del 50-60%, sobre todo mujeres)29–31. En cambio, estos análisis no han podido demostrar resultados clínicos positivos en los pacientes con FEVI supranormal27. En un análisis de subgrupos del ensayo PARAGON-HF, el tratamiento con sacubitrilo-valsartán redujo el objetivo principal del estudio en los pacientes con FEVI <57%, pero no en los pacientes en la franja alta de la FEVI, y el efecto beneficioso de la empagliflozina en el programa de ensayos clínicos EMPEROR se atenuó en los pacientes con FEVI >65%7,15. Los autores de un reciente análisis de la dapagliflozina en todo el intervalo de valores de la FEVI en un análisis conjunto de los ensayos DAPA-HF y DELIVER no observaron una atenuación significativa del beneficio aportado por los inhibidores de SGTL2 en los pacientes de la franja alta de la FEVI. Sin embargo, las tasas de incidencia brutas de eventos cardiovasculares fueron bajas y el intervalo de confianza fue más amplio cuando el valor de FEVI era >60%-65%32. La mayor contribución proporcional de los eventos no cardiovasculares a la carga de morbilidad y mortalidad de los pacientes de la franja alta de la FEVI puede ser en parte la causa del escaso beneficio que aportan los tratamientos cardiovasculares. Dado que estos eventos apenas se ven afectados por los fármacos cardiovasculares, resulta difícil que cualquier tratamiento cardiovascular muestre beneficios trascendentes en los pacientes con gran carga de eventos no cardiovasculares.
Nuestro estudio observacional no permite aclarar los mecanismos subyacentes que explican el mayor riesgo de eventos no cardiovasculares en los pacientes con IC y FEVI en la parte alta del intervalo de valores. Como ya se ha indicado, cabe argumentar que la mayor proporción de morbilidad y mortalidad de causa no cardiovascular en una población anciana y con comorbilidades puede minimizar comparativamente la incidencia de los eventos cardiovasculares. En un amplio registro de ámbito nacional de Australia que incluyó a casi medio millón de participantes remitidos para ecocardiografía, el riesgo de muerte de causa cardiovascular empezó a disminuir a valores altos de FEVI (> 60-65%)25. Sin embargo, una FEVI supranormal puede reflejar también un estado hiperdinámico o una respuesta cardiaca mal adaptada a algunos fenómenos fisiopatológicos sistémicos ligados a eventos no cardiovasculares, como la anemia, la hipoxia tisular o la inflamación sistémica, ya que los pacientes con un corazón pequeño y rígido tienen que aumentar la FEVI para mantener un gasto cardiaco suficiente33. Esta hipótesis está respaldada por los resultados recientes del ensayo clínico HOMAGE, en el que los pacientes con FEVI en la parte alta del intervalo presentaron cifras más altas de citocinas y proteínas proinflamatorias circulantes34. Otras comorbilidades, como las infecciones y el cáncer, se han asociado también con los valores de FEVI en la parte alta del intervalo35.
En la IC-FEc con FEVI en la parte alta del intervalo, en la que los eventos no cardiovasculares desempeñan un papel tan importante, nuestros datos respaldan la idea de desarrollar programas de tratamiento multidisciplinario más allá de las estrategias cardiacas específicas, con objeto de reducir esta carga de hospitalizaciones y muerte de causa no cardiovascular.
LimitacionesEn primer lugar, este es un estudio observacional que puede verse afectado por sesgos ocultos y factores de confusión residuales. En segundo lugar, la atribución de las causas de los eventos en los estudios observacionales continúa siendo difícil y puede mostrar inexactitudes; en nuestro estudio no hubo un comité externo de validación («adjudicación») de los eventos. De hecho, simplemente se registraron algunas causas específicas de eventos no cardiovasculares y, en la mayoría de los casos, no se registró la causa específica del reingreso. En tercer lugar, el valor de corte de la FEVI del 60% puede parecer arbitrario, ya que en otros estudios se han utilizado otros valores de corte (como el 65%). Sin embargo, esta clasificación se ha usado en estudios recientes importantes, como el análisis combinado de las cohortes de los estudios DAPA-HF y DELIVER, y tiene un fundamento fisiopatológico8,23. En cuarto lugar, la etiología de la IC no se verificó en todos los pacientes y no se pudo examinar la contribución específica de etiologías emergentes concretas, como la amiloidosis. En quinto lugar, no se dispuso de datos relativos al índice de masa corporal, lo cual impide evaluar las posibles consecuencias de la obesidad en la incidencia de los eventos no cardiovasculares y el fenotipo de FEVI supranormal. Por último, los mecanismos fisiopatológicos que subyacen a nuestros resultados quedan fuera del ámbito de nuestro estudio y serán necesarios nuevos trabajos para confirmar estos resultados y explorar las causas subyacentes.
CONCLUSIONESDespués del ingreso por IC aguda, la FEVI mostró asociación con el riesgo de morbilidad y mortalidad de causa no cardiovascular. Los pacientes con IC-FEc y en especial aquellos con FEVI ≥ 60% presentaron mayor riesgo de muerte de causa no cardiovascular y de reingresos totales no cardiovasculares.
- –
Los eventos no cardiovasculares representan una proporción significativa y creciente de la carga de morbilidad y mortalidad de los pacientes con IC.
- –
Sin embargo, parece que el riesgo de eventos no cardiovasculares difiere en función de los valores de FEVI.
- –
La FEVI mostró una asociación directa con el riesgo de morbilidad y mortalidad no cardiovasculares.
- –
Los pacientes con IC-FEc presentaron mayor riesgo de muerte de causa no cardiovascular y de reingresos totales no cardiovasculares, en especial aquellos con FEVI ≥ 60%.
- –
Los programas de tratamiento de la IC deben tener en cuenta el alto riesgo de eventos no cardiovasculares, en especial en los pacientes con FEVI en la parte alta del intervalo.
Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares, España (números de subvención 16/11/00420 y 16/11/00403).
CONTRIBUCIÓN DE LOS AUTORESE. Santas, P. Llácer y J. Núñez: concepto, diseño, obtención de los datos, análisis estadístico, elaboración del manuscrito, revisión del manuscrito. P. Palau, R. de la Espriella y G. Miñana: concepto, diseño, obtención de los datos, revisión del manuscrito. Ò. Miró, F. J. Chorro, A. Bayés-Genís y J. Sanchis: concepto, diseño, revisión del manuscrito. M. Lorenzo y G. Núñez-Marín: obtención de los datos, revisión del manuscrito.
CONFLICTO DE INTERESESJ. Sanchis es editor jefe de Rev Esp Cardiol. Se ha seguido el procedimiento editorial establecido por la Revista para garantizar un tratamiento imparcial del manuscrito; también declara pagos por conferencias de Astra Zeneca, Abbott y Edwards Lifesciences (pequeño monto). J. Núñez ha recibido pagos por conferencias y gastos de viaje de Novartis, Roche Diagnostics, Abbott, Rovi, Vifor Pharma, Daiichi Sankyo, Boehringer Ingelheim y Astra Zeneca (pequeño monto). A. Bayés-Genís ha recibido pagos por formar parte de consejos asesores y gastos de viaje de Novartis, Roche Diagnostics, Vifor Pharma y Critical Diagnostics (pequeño monto). Los demás autores no tienen nada que declarar.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en doi:10.1016/j.recesp.2023.05.006.