El síndrome inflamatorio multisistémico pediátrico (SIMS-Ped) es una entidad, descrita recientemente, que aparece 2-6 semanas después de la infección por el coronavirus de tipo 2 causante del síndrome respiratorio agudo grave (SARS-CoV-2) en niños1.
Se presenta el caso de una mujer de 17 años con SIMS-Ped y afección miocárdica grave que acudió a urgencias (ella y su tutora legal proporcionaron su consentimiento informado en el que autorizan esta publicación). No tenía antecedentes de interés, salvo infección por SARS-CoV-2 paucisintomática 1 mes antes, tratada ambulatoriamente. La paciente refería cefalea, fiebre de hasta 39° C, odinofagia, dolor abdominal difuso, vómitos y tos seca de una semana de evolución.
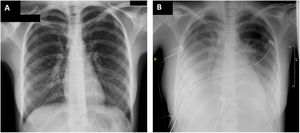
A su llegada a urgencias, la paciente tenía la presión arterial en 105/67 mmHg, la frecuencia cardiaca en 120 lpm, la saturación de oxígeno basal del 94% y temperatura de 37,4° C. En la exploración física resaltaba dolor abdominal difuso a la palpación y exantema cutáneo a nivel hipogástrico. El electrocardiograma y la radiografía de tórax al ingreso no mostraban alteraciones (figura 1A). En los análisis destacaba la elevación de la proteína C reactiva (256 mg/l), el dímero D (4.844 ng/ml), la procalcitonina (4,04 ng/ml), la troponina I ultrasensible (162 ng/l) y la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) (9.140 ng/l). El ecocardiograma mostró función biventricular conservada, sin otros hallazgos patológicos (). Para descartar enfermedad abdominal aguda, se realizaron una ecografía y una tomografía computarizada abdominopélvica, donde se observaron adenopatías mesentéricas subcentimétricas. También se realizó una ecografía ginecológica, que mostró líquido libre en el espacio de Douglas; con guía ecográfica se extrajo una muestra, en la que predominaban polimorfonucleares (85%); el cultivo fue negativo. Se extrajeron hemocultivos que fueron negativos. Se inició antibioterapia empírica con meropenem, clindamicina y vancomicina, y se decidió ingresarla en planta de hospitalización.
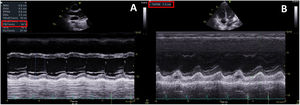
Durante las primeras 24 h de estancia, la paciente evolucionó desfavorablemente con inestabilidad hemodinámica, insuficiencia cardiaca congestiva con insuficiencia respiratoria secundaria y shock cardiogénico, por lo que se la ingresó en la unidad de cuidados intensivos (UCI) (figura 1B). En los análisis persistía la elevación de la proteína C reactiva (278mg/l) y la NT-proBNP (14.484 ng/l). La troponina estaba en descenso. Se repitió el ecocardiograma, que mostró disfunción biventricular grave (fracción de eyección del ventrículo izquierdo del 35%; TAPSE, 12 mm) por hipocontractilidad global, hipertensión pulmonar ligera, derrame pleural bilateral y ausencia de derrame pericárdico (figura 2, ). Se inició soporte vasoactivo con noradrenalina y dobutamina, así como anticoagulación a dosis terapéuticas (enoxaparina 60 mg/12 h). La paciente cumplía criterios diagnósticos de SIMS-Ped1, por lo que se administraron inmunoglobulinas intravenosas 2 g/kg y corticoterapia 2 mg/kg/día durante 5 días, con lo que disminuyeron los reactantes de fase aguda y se obtuvo mejoría clínica. Tras 5 días se retiró el soporte vasoactivo. El ecocardiograma posterior mostró recuperación completa de la función biventricular. La insuficiencia cardiaca se resolvió con diurético intravenoso y oxigenoterapia con gafas nasales de bajo flujo. Se mantuvo el tratamiento antibiótico durante su estancia en la UCI.
Se realizó cribado etiológico, y la serología descartó infección activa por virus de Epstein-Barr, Coxiella burnetii, virus de la hepatitis A, B, C, toxoplasmosis, Treponema pallidum, Adenovirus, Parvovirus B19 y virus de la inmunodeficiencia humana. El test antigénico rápido para Streptococcus pyogenes resultó negativo. El estudio inmunológico fue normal (complemento, anticoagulante lúpico, ANCA, IgA, IgM, IgG, factor reumatoide…). La reacción en cadena de la polimerasa con transcriptasa inversa (PCR-RT) para SARS-CoV-2 fue negativa y los anticuerpos IgG frente a espícula, positivos.
La infección por SARS-CoV-2 en la población pediátrica suele cursar con afección clínica leve, por lo que el SIMS-Ped es una complicación infrecuente1. Puede evolucionar hacia formas graves como el shock cardiogénico2. La franja de edad más afectada es la de 7-10 años1, aunque con menor frecuencia se presenta en edades tardías y es posible diagnosticarlo hasta los 19 e incluso 21 años2,3.
El origen parece ser la respuesta inmunológica retardada tras la infección por SARS-CoV-2, que resulta en una respuesta inflamatoria excesiva tras semanas de la infección aguda, cuando la RT-PCR para SARS-CoV-2 es negativa y la serología, positiva4.
En la mayoría de los casos cursa con fiebre persistente 3 o más días junto con un cuadro clínico de hipotensión o shock, signos de disfunción miocárdica (elevación de troponinas o NT-proBNP), evidencia de coagulopatía (elevación de dímero D), enfermedad gastrointestinal aguda o una forma completa o incompleta de la enfermedad de Kawasaki (EK) (exantema cutáneo, conjuntivitis bilateral no purulenta o signos inflamatorios mucocutáneos en boca, manos y pies)1. A todo esto se suma la elevación de marcadores inflamatorios en los análisis (proteína C reactiva, procalcitonina, VSG)1.
El diagnóstico diferencial del SIMS-Ped incluye el shock séptico, el síndrome de shock tóxico estreptocócico o estafilocócico, la EK y el abdomen agudo2. En nuestro caso concreto, el rápido deterioro hemodinámico y la disfunción biventricular grave fueron determinantes para el diagnóstico de SIMS-Ped. Hay publicaciones que relacionan la infección por coronavirus como posible etiología de la EK5. Como ya se ha mencionado, el SIMS-Ped tiene una semiología similar a la EK2,6, por lo que ambas enfermedades podrían formar parte del espectro de una misma enfermedad con un origen común en la infección por coronavirus.
En una serie de casos recogidos entre febrero de 2020 y marzo de 2021, se describe una mayor mortalidad entre los 10 y los 16 años3. Sin embargo, la evolución de la paciente fue favorable y recuperó por completo la función cardiaca a los 5 días de ingreso en la UCI.
Como conclusión, en el entorno epidemiológico actual es importante conocer el SIMS-Ped, dado su amplio espectro semiológico, que cobra sentido cuando se piensa en esta enfermedad. Por último, hay que destacar que esta entidad no solo afecta a la edad pediátrica, sino que también se puede encontrar en adultos jóvenes y requiere de un pronto diagnóstico, dada su naturaleza eventualmente agresiva.
FINANCIACIÓNEl presente estudio no ha recibido ninguna beca específica de agencias de los sectores público, comercial o sin ánimo de lucro.
CONTRIBUCIÓN DE LOS AUTORESC. Jiménez Martínez, V.M. Heras Hernando y P. Gaite de Vicente concibieron la idea y contribuyeron a la redacción del manuscrito. M.V. Godoy Tundidor, D. Afonso Rivero y A. Gabán Diez realizaron una revisión crítica del manuscrito.
CONFLICTO DE INTERESESNinguno.