Palabras clave
INTRODUCCIÓN
Siguiendo el objetivo fundamental de estos suplementos, hemos seleccionado varios temas dentro del campo de la estimulación cardiaca que, siendo abordados en las reuniones científicas de nuestra sección, nos han parecido de mayor interés. En primer lugar se repasará un aspecto laboral básico, frecuentemente olvidado, para los especialistas dedicados a la implantación de los dispositivos de estimulación cardiaca definitiva: los efectos de la radiación.
Revisaremos seguidamente dos técnicas de estimulación que hemos juzgado que merecen consideración de novedad, la estimulación cardiaca permanente en el haz de His y la modulación de la contractilidad cardiaca.
Por último, durante este año se ha publicado un gran número de artículos científicos dentro del ámbito de la estimulación cardiaca. Dada la calidad de un gran porcentaje de ellos, hemos decidido mantener, como en años anteriores, un pequeño apartado de revisión bibliográfica de nuestra especialidad para resaltar los aspectos que nos parecen más relevantes.
DOSIS Y EFECTOS DE LA RADIACIÓN EN EL IMPLANTADOR DE DISPOSITIVOS
La implantación de marcapasos y desfibriladores (DAI) proporciona al paciente que los requiere beneficios probados en lo que se refiere a morbimortalidad. Sin embargo, estas técnicas llevan consigo riesgos, no despreciables, para el que las realiza. Estos riesgos se relacionan con la técnica de punción (hepatitis, VIH, etc.), la bipedestación prolongada, el uso de delantales plomados (insuficiencia venosa, trastornos osteomusculares, etc.), con el estrés y con la utilización de radiaciones ionizantes (rayos X). En este artículo se intentará resumir de manera sencilla y práctica los efectos nocivos de los rayos X (Rx) y la forma de prevenirlos en los implantadores de estos dispositivos.
La emisión de Rx durante el implante de un marcapaso o un DAI, a diferencia por ejemplo de una punción inadvertida, no la detectan nuestros sentidos y únicamente vemos sus efectos, no deseados en el operador, cuando ya pueden ser irreversibles. Por ello es importante conocer y recordar como se producen dichos efectos y cómo se pueden minimizar.
Efectos biológicos de los Rx
Los efectos biológicos de los Rx1,2 se derivan del daño directo o indirecto en el ADN y se clasifican en dos grandes grupos: efectos deterministas y efectos estocásticos (tabla 1).
Los efectos deterministas pueden afectar a todo el organismo; pero en los implantadores (dosis bajas de Rx y utilizando medidas de protección) los órganos más frecuentemente afectados son la piel (depilación, eritema e incluso necrosis) y los ojos (cataratas).
Los efectos estocásticos se relacionan con la aparición de neoplasias o alteraciones genéticas hereditarias, pero en el caso que nos ocupa es difícil establecer una clara relación causa-efecto.
Métodos para minimizar la dosis de Rx
Los implantadores de marcapasos y DAI reciben, por lo tanto, radiaciones ocupacionales2,3. Estas radiaciones pueden ser de dos tipos:
- Primaria: emitida directamente por la fuente de radiación.
- Dispersa: reflejada por algún material que interactúa con el haz primario (fig. 1).
Fig. 1. Esquema gráfico de los dos tipos de radiaciones ocupacionales: radiación primaria y radiación dispersa.
Para evitar o minimizar al máximo los efectos no deseados de los Rx en el operador (deterministas o estocásticos), aplicaremos tres reglas:
- Tiempo: someternos a la radiación el menor tiempo posible.
- Distancia: posicionarnos lo más alejados posible del foco emisor de Rx.
- Blindaje: interponer material protector entre el foco emisor y el operador.
De forma más especifica, se pueden reducir dosis innecesarias de radiación en la práctica diaria si aplicamos algunas medidas tan sencillas como las siguientes:
1. Posición del tubo de Rx: la radiación dispersa se reduce si el tubo se coloca bajo la mesa quirúrgica.
2. Posición del operador: lo más alejado posible del paciente y del tubo de Rx.
3. Distancia intensificador-paciente: cuanto más próximo esté el paciente al intensificador, menor radiación recibirán el operador y el propio paciente.
4. Tamaño del campo: los colimadores disminuyen la radiación dispersa.
5. Parámetros de la operación: la utilización de escopia pulsada, de potencia de radiación calculada automáticamente por el equipo radiológico y la reducción de los tiempos de exposición contribuyen a minimizar dosis de radiación. 6. Equipos de protección radiológica personal: el empleo de protectores plomados —tiroideos, delantales, gafas, guantes, pantallas y faldillas de mesa quirúrgica— minimiza las dosis de radiación recibidas por el operador.
Dosis de radiación en implantadores
Kim et al4 han analizado recientemente todos los artículos publicados en inglés sobre las dosis de radiación recibidas por el primer operador en procedimientos de cateterización cardiaca. Entre estas técnicas se incluyen ablación e implantes de marcapasos y desfibriladores.
Todas las medidas dosimétricas evaluadas, las dosis efectivas de radiación y los tiempos de escopia son lo que permitió extraer conclusiones prácticas sobre la cantidad de Rx recibida por el operador, que de manera resumida son las siguientes:
1. La dosis de radiación que recibía el operador era proporcional a la recibida por el paciente; pero entre operadores era muy variable. Esto fundamentalmente se debía a que, por un lado, no todos los implantadores utilizaban el mismo tipo de protección radiológica ni de la misma calidad, y por otro, que la radiación dispersa variaba de forma importante según las características del equipo radiológico, la posición del operador y la posición del propio paciente con respecto al haz de Rx.
2. Las dosis de radiación más elevadas se recibían en las manos, después en el tronco, en el cuello y en los ojos, aunque con pequeñas variaciones absolutas.
3. En el caso concreto de los implantes de dispositivos, la posición del operador era muy próxima al haz de Rx, por lo que la intensidad de radiación era mayor que en otras técnicas. A esto también contribuía la imposibilidad de interponer pantallas plomadas entre el implantador y el equipo radiológico, ya que imposibilitaría la manipulación de los electrodos.
En el implante de marcapasos y desfibriladores, también es importante señalar que la dosis de radiación recibida es tanto mayor cuanto mayor es la complejidad del procedimiento5. Así, la colocación de un dispositivo bicameral supone una dosis de radiación significativamente superior a la de uno monocameral, e inferior, a su vez, a la de un resincronizador.
En el caso de los resincronizadores, hemos de saber que los tiempos de escopia y las dosis de radiación son 4 veces superiores a las de los dispositivos convencionales6.
Conclusiones
El implante de marcapasos y desfibriladores se acompaña de daños colaterales en el operador, que se olvidan con frecuencia. Uno de estos efectos indeseados son los que se derivan del manejo inadecuado de los equipos de Rx, así como de la infrautilización de las barreras de protección radiológica.
Las dosis de radiación son tanto más elevadas cuanto mayor es la complejidad del procedimiento. La aplicación correcta de las medidas de protección reduce drásticamente las dosis de radiación en el operador y en el propio paciente.
PUBLICACIONES MÁS RELEVANTES DEL ÚLTIMO AÑO
En los últimos doce meses se han publicado 1.853 artículos que incluyen como palabra clave pacing. Los hemos agrupado en varios apartados atendiendo a la frecuencia y la innovación del tema central. Expondremos seguidamente un resumen de los, a nuestro juicio, más interesantes.
Fibrilación auricular
No se ha demostrado disminución de la carga arrítmica mediante algoritmos de sobreestimulación permanente7-9. Los algoritmos activados por el inicio de la arritmia, tanto aislados como con sobreestimulación temporal tras la detección, especialmente con estimulación auricular septal10,11 han demostrado su utilidad en la disminución de la incidencia de fibrilación auricular (FA).
Los diseños de numerosos estudios deberían ser revisados, ya que la utilización de la estimulación doble cámara con modo DDD induce deterioro de la contractilidad ventricular, lo que facilita la aparición de FA. Si estos ensayos se hubieran realizado utilizando sistemas con mínima estimulación ventricular (MVP) o modo AAI, probablemente los resultados fueran diferentes12,13.
La estimulación en septo auricular o en orejuela es accesible y segura, pero no cambia la carga arrítmica14. La estimulación orejuela-ostium de seno coronario no se ha demostrado efectiva y presenta un riesgo de dislocación considerable15.
Resincronización cardiaca
Herweg et al16 evalúan el uso del tratamiento de resincronización cardiaca (TRC) en pacientes seleccionados con soporte inotrópico intravenoso. Si bien no se modifica la mortalidad, la respuesta clínica es positiva, incluso en presencia de FA.
Chalil et al17 observan un descenso significativo de respondedores del 83 al 47% si se realiza el implante en una escara posterolateral, y consideran imprescindible un estudio de imagen previo al implante. Piepoli et al18 evalúan la respuesta al TRC en 89 pacientes comprobando que la mejora funcional, de la fracción de eyección ventricular izquierda (FEVI) y de los diámetros ventriculares se acompañan de una normalización del reflejo neurohormonal, de la concentración de BNP, de la variabilidad cardiaca y del pico máximo de oxígeno. Además, los respondedores tenían FEVI menos deprimida y pico de oxígeno mayor. Se propone una selección precoz de candidatos.
Se recomienda la implantación sistemática del cable auricular en los pacientes en FA para asegurar la sincronía auriculoventricular (AV) en caso de reversión a ritmo sinusal19 o tras cardioversión eléctrica al año del TRC, ya que el remodelado inverso auricular puede facilitar la estabilización del ritmo sinusal20.
En un 30% de los implantes el electrodo queda ubicado en vena anterior o anterolateral, y no se conoce la evolución de estos pacientes21,22.
Sharifkazemi et al23 describen la utilización del estilete como sistema definitivo para incrementar el soporte en implantes inestables. La maniobra se describe como segura a 1 año. Utilizaríamos un elemento no chequeado soportando la fatiga de materiales que supone la contractilidad cardiaca. Se han descrito fracturas de estiletes, con resultados catastróficos por perforación del electrodo y laceraciones cardiacas. No recomendamos este uso hasta que las empresas fabricantes nos informen sobre su resistencia.
La estimulación bifocal derecha es inferior a la biventricular24 utilizable en los pacientes con fracaso en el implante transvenoso coronario y no candidatos al implante mediante minitoracotomía o toracoscopia25.
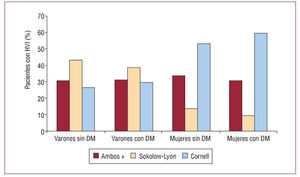
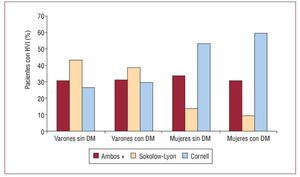
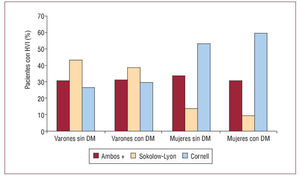
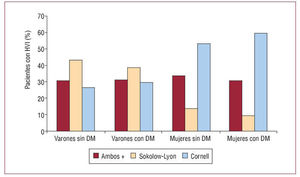
El sexo femenino presenta una incidencia menor de insuficiencia cardiaca, pero con una tasa de ingresos hospitalarios y de mortalidad mayor. A pesar de que el TRC proporciona una eficacia similar, en mujeres su utilización es aproximadamente un tercio que en los varones. No habiendo datos que justifiquen este hecho, es preciso realizar estudios prospectivos26-28.
La evaluación del gasto cardiaco mediante la medición del pico de aceleración endocárdica29, el cálculo de la programación mediante la señal intracavitaria del electrocardiograma o la duración de los periodos auriculares y ventriculares detectados y estimulados son tres opciones de optimización automática de TRC30,31.
Infecciones del sistema de estimulación
La incidencia de infecciones en el sistema de marcapasos varía según las series entre el 0,13 y el 19,9%32. Estos márgenes se justifican porque no se refieren a la misma entidad. La endocarditis producida por infección del marcapasos debe establecerse aplicando los criterios diagnósticos modificados de Duke. Con estos criterios se considera indicación de clase I la extracción completa del sistema. Si la infección se limita a la bolsa del generador, no deberemos hablar de endocarditis, y la extracción se recomienda como de clase II33.
Se propone tratamiento antibiótico previo a la extracción unas 2-6 semanas. Si es posible, confirmando hemocultivos negativos, 2-3 días entre la extracción y el reimplante y un nuevo periodo de tratamiento antibióticos 2-6 semanas tras el reimplante32. Nuestra estrategia deberá adaptarse al tipo de germen34.
Está admitido que, ante el diagnóstico de endocarditis, el tratamiento debe incluir la extracción completa del sistema. Smith et al35 repasan las técnicas con las que contamos en la actualidad. Según Silvetti et al36, un electrodo abandonado sin infección no plantea complicaciones en los siguientes 10-15 años. Dado que el plazo desde el implante es directamente proporcional a la dificultad de extracción, plantearemos abandonar electrodos en pacientes de edad avanzada.
Programación
La utilización de los sistemas de MVP se demuestran superiores a los de prolongación del intervalo AV37.
La estimulación VDD frente a DDD en el bloqueo AV y la AAI frente a DDD-MVP en la enfermedad del nodo sinusal (ENS) son similares con costes significativamente menores38.
La utilización de la variación de la impedancia torácica en el seguimiento de pacientes con insuficiencia cardiaca se consolida como una herramienta de utilidad clínica39.
Guías de actuación clínica
La Sociedad Americana de Cardiología ha publicado en junio de 2008 las nuevas guías de actuación clínica sobre estimulación cardiaca40, actualizando las publicadas en 2002. La mayor parte de las aportaciones quedaron recogidas en las de la Sociedad Europea de Cardiología de 2007. Ambos documentos están disponibles a través de la página web de la Sección de Estimulación Cardiaca (http://www. marcapasossec.org/).
Registro Nacional de Marcapasos
Como cada año, se han publicado los datos del Registro Nacional de Marcapasos de 200641. Se han implantado 668,31 marcapasos por millón de habitantes. Las indicaciones de recambio fueron un 91% por agotamiento de batería y un 2,4% por exteriorización o infección del sistema. En la ENS y en el bloqueo AV en ritmo sinusal se han implantado marcapasos VVI en el 25 y el 28% respectivamente, llegando al 40 y el 47% en pacientes mayores de 80 años. Han aumentado en número y porcentaje los marcapasos tricamerales.
La práctica totalidad de los electrodos son bipolares y la fijación activa aumenta notablemente hasta el 35% del total, el 52% de los implantes auriculares.
Revisión de ensayos clínicos
Como representación de los 179 estudios actualmente en marcha relacionados con la estimulación cardiaca, destacamos seis, con final previsto en 2008.
El FOLLOWPACE analiza 1.198 primoimplantes con 111 complicaciones relevantes intrahospitalarias, y define seis variables predictoras independientes. El mismo grupo ha publicado la rutina de seguimiento durante 4 años de 1.526 pacientes con 4.914 consultas. Constituye un documento único para reflexionar sobre la planificación ambulatoria en pacientes con marcapasos42.
El SAVEPACe (Search AV Extension and Managed Ventricular Pacing for Promoting Atrioventricular Conduction trial) evalúa durante 5 años en 1.070 pacientes con ENS la incidencia de FA o insuficiencia cardiaca en estimulación DDD con y sin MVP.
El PreFER MVP (Managed ventricular pacing vs conventional dual-chamber pacing for elective replacements) estudia la utilidad del MVP en 600 pacientes con recambio de marcapasos y su influencia en ingresos hospitalarios43.
El PREFER (Pacemaker REmote Follow-up Evaluation and Review) y el VIRTUE (Virtual Clinic Pacemaker Follow-up), con 900 y 120 pacientes, analizan la utilidad del seguimiento a distancia por teléfono.
Por último, pueden ser especialmente útiles los resultados del estudio de la universidad Johns Hopkins sobre el uso de warfarina durante la implantación de marcapasos, dado que es un tema asistencial de primer orden (Henrikson ChA, Cheng A. Randomized study of the use of warfarin during pacemaker or ICG implantation in patients requiring long term anticoagulation. Clinical Trials gov Identifier: NCT00721136).
ESTIMULACIÓN PERMANENTE EN EL HAZ DE HIS
La estimulación del ápex ventricular derecho provoca un cierre anómalo de la válvula mitral44,45 y asincronía ventricular izquierda45,46, lo que tiene efectos indeseables en la función ventricular47,48 e incrementa la morbimortalidad en determinados pacientes48-50. Por otra parte, la estimulación DDD no es superior a la VVI en calidad de vida, complicaciones vasculares o supervivencia cuando se estimula el ápex derecho51-53.
Las ventajas de la estimulación en el tracto de salida frente al ápex no están determinadas54 y no pasan de ser modestas55.
La estimulación del haz de His (StH) provoca una contracción ventricular vía sistema específico de conducción, pero no origina asincronía interventricular ni intraventricular56. Con marcapasos DDD, la sincronía AV es verdaderamente fisiológica.
Sabemos que la StH es segura, no deteriora la función ventricular, incluso puede recuperarse57-60.
Lo sorprendente es que la StH puede corregir no pocos trastornos de la conducción considerados infrahisianos, y se puede utilizar en casos seleccionados de estos supuestos61,62.
Objetivos y fundamentos de la estimulación permanente en el haz de His
Un primer objetivo de la StH es evitar asincronías interventriculares e intraventriculares produciendo una sincronía AV fisiológica.
También se puede utilizar para recuperar la sincronía interventricular e intraventricular perdida en presencia de bloqueos de ramas. La teoría de la disociación longitudinal del haz de His63-65 mantiene que el citado haz contiene fibras ya diferenciadas, aisladas y disociadas longitudinalmente para las ramas derecha e izquierda, y que éstas pueden lesionarse en el propio tronco hisiano. En estos casos, la estimulación distal al área lesionada provoca una conducción fisiológica a través del sistema His-Purkinje. De este modo el QRS se normaliza66 y se recupera la sincronía ventricular perdida por el trastorno de conducción61,62. Según lo anterior, los teóricos bloqueos infrahisianos podrían clasificarse en centrales (haz de His) o periféricos (en las ramas o más allá), corregibles o no con StH.
Técnica de implante del electrodo en His
Para implantar el electrodo actuaremos de forma convencional contando con electrocardiograma de 12 derivaciones. En posición radiológica oblicua anterior derecha e introduciendo al electrodo la guía preformada en J cerrada de unos 3 cm de brazo, conectaremos los terminales al polígrafo de electrofisiología. Cartografiamos la zona del anillo tricuspídeo superior, hasta obtener actividad eléctrica de His. Deberemos obtener captura del tronco con umbral máximo de 2,5 V para 1 ms, y una conducción AV 1:1 por encima de 120 lat/min; fijaremos el electrodo extrayendo la hélice a la par que, mediante rotación antihoraria, mantenemos la presión sobre la pared miocárdica. Descartadas dislocaciones tras extraer la guía y manteniéndose la estimulación hisiana, fijaremos el electrodo a plano muscular.
Se recomienda utilizar el electrodo Tendril 1788 TC (St. Jude); de baja polarización, permite registrar adecuadamente las señales intracavitarias al mismo tiempo que estimulamos.
Características electrocardiográficas de la estimulación en His
Podemos obtener dos tipos de capturas. La captura pura del His producida por estimulación directa, selectiva y exclusiva del tronco hisiano. Existe sólo un frente de despolarización, que llega a través del sistema específico de conducción a los ventrículos, similar a un impulso propio. En presencia de bloqueos nodales se caracteriza porque hay latencia entre la espiga de estimulación y QRS que tiene las mismas morfología y repolarización que el propio (fig. 2). En presencia de bloqueo infrahisiano AV completo central o de rama, la captura pura del His, si se produce distal a la zona de bloqueo, crea también un solo frente de despolarización, llegando a los ventrículos a través del sistema específico, y muestra latencia con normalización de los QRS y repolarización (fig. 3). En presencia de bloqueo de rama periférico, la captura pura del His sigue mostrando latencia, con persistencia de los trastornos de conducción (fig. 4).
Fig. 2. Electrocardiograma con bloqueo auriculoventricular completo suprahisiano, mostrando varias morfologías de QRS. Los marcados con * son complejos de ritmo de escape propio. Los QRS marcados con ** son estimulaciones puras de His. Los QRS marcados con *** son de fusión.
Fig. 3. Electrocardiograma mostrando un bloqueo completo de rama izquierda. A partir de *, se ha activado un marcapasos DDD de estimulación y captura pura en His. El bloqueo de rama izquierda desaparece y los QRS se normalizan.
Fig. 4. Electrocardiograma en fibrilación auricular con bloqueo de rama derecha (BRD). A partir de *, se ha activado un marcapasos VVI, los QRS tienen latencia y las mismas morfología y repolarización que los propios por estimulación y captura pura de His. A partir de **, el aspecto de los QRS cambia y muestra pérdida de latencia y del BRD, pero no se normalizan, pues aparecen preexcitados. Se trata entonces de una captura fusionada His con miocardio adyacente.
La captura fusionada es la producida por la captura del tronco de His y del miocardio adyacente. Tiene dos frentes de despolarización, el primero —procedente de la captura del His— alcanza ambos ventrículos vía sistema específico de conducción, y el segundo —nacido de la captura del miocardio adyacente al His— preexcita el ventrículo derecho. Cuando hay bloqueo de rama derecha (BRD) o bloqueo de rama izquierda (BRI) central, la captura fusionada los hace desaparecer, pero el QRS no se normaliza y toma un aspecto preexcitado y sin latencia (fig. 4). Es frecuente que en un mismo trazado concurran capturas fusionadas y puras (figs. 2 y 4).
Existe una experiencia bibliográfica56-60, que avala la seguridad de la StH en presencia de bloqueos del nodo AV. Nosotros la consideramos primera opción para bloqueos AV congénitos o adquiridos, incluidos los ocasionados por aplicación de radiofrecuencia.
La StH puede utilizarse en presencia de bloqueo de BRD, BRI o AV completo infrahisiano. La experiencia en estos casos es muy limitada. Se ha empleado la StH en presencia de bloqueo BRI para TRC cuando no fue posible por seno coronario (fig. 3)61,62.
Limitaciones a la estimulación permanente del haz de His
Limitaciones por carencia de material específico. El electrodo
Los electrodos que actualmente se emplean para el implante en His no están diseñados para estimularlo ni para ser ubicados en zona hisiana.
Más de una tercera parte de los candidatos presentan un umbral agudo inasumible, lo que supone un riesgo de pérdida de captura real si aquél es > 2,5 V/ms. Hay que asumir que la StH conlleva, a día de hoy, un mayor gasto energético. Con captura pura no se recomienda el uso de sistemas de seguimiento automático de umbral, ya que la respuesta evocada es muy baja y produce frecuentemente situaciones de derroche de energía. Con captura fusionada el sistema automático puede adaptar la salida a la respuesta evocada del miocardio adyacente, y puede perderse la captura hisiana.
La principal limitación actual de la StH es la fijación del electrodo; ha de fijarse de forma paralela, conforme lo hace su plano de contacto al septo AV, para lo que no está diseñado. Los desplazamientos de la válvula tricúspide contribuyen a su inestabilidad.
En nuestro grupo, casi todos los bloqueos suprahisianos y la mayoría de los considerados infrahisianos (67%) se corrigen con la StH, y se logra un implante exitoso en un tercio de los pacientes.
Limitaciones en relación con la naturaleza de los bloqueos que se va a tratar
El umbral y la estabilidad constituyen las únicas limitaciones reales en los bloqueos suprahisianos.
Los bloqueos infrahisianos son tratables mediante StH en un 67% (tipo central). El bloqueo periférico no es abordable con esta técnica.
En pacientes longevos, quizá por un mayor grado de fibrosis hisiana, es más frecuente limitaciones por fijación o umbral alto.
Conclusiones
La StH provoca una contracción ventricular fisiológica. Puede emplearse en presencia de bloqueos suprahisianos y bloqueos «infrahisianos» seleccionados. Puede ser una alternativa al TRC.
La fabricación de electrodos específicos facilitaría su utilización e incrementaría el porcentaje beneficiario de este sistema cuasifisiológico de estimulación cardiaca.
MODULACIÓN DE LA CONTRACTILIDAD CARDIACA
La insuficiencia cardiaca continúa causando un número elevado de muertes a pesar de los grandes avances alcanzados en el tratamiento médico. Los agentes inotrópicos, útiles para el tratamiento agudo, aumentan la mortalidad a medio plazo.
El TRC en la insuficiencia cardiaca avanzada ha alcanzado gran popularidad en los últimos 10 años, si bien sólo se ha demostrado utilidad en pacientes con trastorno de la conducción intraventricular y duración del QRS > 120 ms, y puede beneficiar como máximo a un 50% de estos pacientes.
La modulación de la contractilidad cardiaca (MCC) es otra forma de terapia eléctrica de la insuficiencia cardiaca que consiste en la liberación de impulsos eléctricos al miocardio, no excitantes, de alta energía, durante el periodo refractario. Estos impulsos son bifásicos cuadrados y de duración, amplitud y retraso tras la detección de la actividad eléctrica local ajustables. No inician un nuevo potencial de acción, pero estudios en músculo papilar aislado y perfundido de conejo han demostrado que modifican la entrada de calcio en el cardiomiocito y su contractilidad67. Posteriormente se han realizado otros estudios experimentales y clínicos. Revisaremos la literatura en este campo.
Brunckhorst et al68, aplicando corrientes de MCC al músculo papilar aislado de conejo y músculo cardiaco humano, demuestran la modulación de la duración del potencial de acción, con alteración en el flujo de calcio a través del sarcolema y cambios en el contenido de calcio del retículo sarcoplásmico.
Morhi et al69 realizan estimulación en la pared posterior, la anterior y ambas paredes del ventrículo izquierdo (VI) de 6 perros mediante MCC, midiendo los volúmenes ventriculares y la contractilidad. Practican las mediciones tras estimular en las paredes anterior y posterior del VI y de forma simultánea en ambas. Observaron un aumento significativo del índice de contractilidad general del VI con la estimulación anterior y posterior, y superior con la simultánea. Aumenta la contractilidad solamente en zonas cercanas a la liberación de la corriente. La relajación no se modificó, aumentó la presión aórtica y no cambiaron las resistencias periféricas.
Morita et al70 comprueban los efectos de la MCC en el VI, durante 6 h, en 7 perros con insuficiencia cardiaca desencadenada por microembolizaciones coronarias. La FEVI pasó del 31 al 44% (p < 0,05) y el gasto cardiaco, de 26 a 34 ml (p < 0,05). Mantuvieron el protocolo durante 3 meses comparándolo con grupo control sin MCC71. En el grupo control el volumen telediastólico del VI (VTDVI) aumentó de 64 a 75 ml (p = 0,003) y el volumen telesistólico del VI (VTSVI), de 46 a 57 ml (p = 0,003). La FEVI disminuyó del 28 al 23% (p = 0,001). En los perros tratados, el VTDVI se incrementó de 66 a 73 ml (p = 0,01), el VTSVI no mostró cambios y la FEVI aumentó del 31 al 34% (p = 0,004). Concluyen que el tratamiento a largo plazo con MCC previene la progresión de la disfunción del VI y atenúa su remodelado general.
Imai et al72, con un protocolo similar, incluyen un grupo con tratamiento con bloqueadores beta. Observaron un aumento significativo de la FEVI del 27 al 33% (p < 0,001) en el grupo de MCC en monoterapia, frente a un descenso del 27 al 23% en el grupo control. La mejoría de la FEVI se acompañó de disminución de los volúmenes de VI, mejoría de la estructura miocárdica y reversión de la mala adaptación génica y mejoría en las proteínas ligadas al calcio del retículo sarcoplásmico. Estos efectos fueron más manifiestos en los perros con terapia combinada (MCC y metoprolol), que en los tratados únicamente con bloqueadores beta. Afirman que la MCC en insuficiencia cardiaca mejora la función sistólica del VI con efecto aditivo al de los bloqueadores beta, con el beneficio concomitante de la MCC en el remodelado general, celular y bioquímico del VI.
En 2002, Pappone et al73 publicaron los primeros resultados de la aplicación de la MCC durante 15 min a corto plazo en un grupo reducido de pacientes con insuficiencia cardiaca. Tanto la estimulación con MCC en VI como en VD aumentó el incremento máximo de presión con respecto al tiempo de VI (dP/dtmáx) de forma similar (el 9,1 y el 7,1% respectivamente; p < 0,001 frente a los controles), con cambios asociados en la presión de pulso aórtica del 10,3 y el 10,8% respectivamente (p < 0,001 frente a los controles). La motilidad regional de pared aumentó marcadamente cerca del electrodo de MCC, afectando a una media de 4,6 segmentos por paciente. En 6 pacientes con insuficiencia cardiaca y bloqueo de rama izquierda a los que se aplicó MCC durante TRC, se obtuvo un incremento adicional significativo de la dP/dtmáx. Los mismos autores publican su experiencia con la aplicación a largo plazo de MCC en 23 pacientes con insuficiencia cardiaca, estadio funcional (EF) de la New York Heart Association (NYHA) III, FEVI del 22% y QRS > 120 ms, seguidos durante 2 meses, y no encuentran efectos adversos o proarritmia74.
En un estudio mixto clínico y experimental Butter et al75 demuestran en 6 perros y 9 pacientes con insuficiencia cardiaca que la mejoría de la función del VI que se obtiene con la aplicación de 2 h (en perros) o 30 min (en pacientes) de estímulos de MCC no se acompaña de incremento del consumo miocárdico de oxígeno.
El mismo grupo ha comparado los resultados obtenidos en 11 pacientes con insuficiencia cardiaca tratados durante 3 meses con MCC frente a otros 3 meses sin tratamiento, de forma aleatorizada. Concluyen que la MCC es capaz de invertir el remodelado molecular del VI insuficiente76.
Stix et al77 comprobaron los efectos beneficiosos a 8 semanas de la MCC, aplicada 3 h diarias en ventrículo derecho a 23 pacientes con insuficiencia cardiaca en EF III de la NYHA sobre la calidad de vida, la FEVI, el EF y la distancia recorrida en 6 min. Observan efectos adversos ligeros en 9 pacientes y 2 muertes no relacionadas con el dispositivo.
En 2006, Neelagaru et al78 publicaron los resultados de un estudio piloto, aleatorizado y doble ciego de la aplicación MCC en 49 pacientes con insuficiencia cardiaca en EF III-IV a pesar de tratamiento médico, QRS estrecho y FEVI < 35%, a los que se implantó un generador de MCC. Se comparó el resultado en 25 pacientes tratados con MCC frente a 24 pacientes con dispositivo no activo (grupo control) durante 6 meses. Un mayor número de pacientes se mantuvo libre de hospitalización por cualquier causa en el grupo que recibió tratamiento (el 85 frente al 62%), mientras que no hubo cambios en cuanto al número de extrasístoles en el Holter. La distancia recorrida en 6 min, el consumo máximo de oxígeno y el umbral anaeróbico mejoraron más en el grupo que recibió tratamiento, aunque esta diferencia no alcanzó significación estadística. El EF y la calidad de vida cambiaron de forma similar en ambos grupos. Sólo hubo 1 muerte en el grupo control.
Por último, en el presente año se han publicado los resultados de un estudio multicéntrico, aleatorizado, de diseño cruzado, doble ciego y con un número importante de pacientes (n = 164)79. El trabajo incluyó a pacientes con insuficiencia cardiaca en EF > II de la NYHA a pesar de tratamiento médico óptimo, FEVI < 35% y consumo máximo de oxígeno entre 10 y 20 ml/kg/min. Se implantó a todos ellos un dispositivo de MCC. Los pacientes fueron asignados aleatoriamente 12 semanas a tratamiento con MCC durante 7 h/día (7 periodos de 1 h), seguidas de otras 12 semanas sin tratamiento (grupo 1) o a la inversa (grupo 2). El consumo máximo de oxígeno fue mayor y la calidad de vida fue significativamente mejor en ambos grupos tras las 12 semanas de tratamiento, frente a las 12 semanas sin MCC. Concluyen que el MCC en pacientes con insuficiencia cardiaca y disfunción del VI es seguro y mejora la tolerancia al ejercicio y la calidad de vida a 3 meses.
Conclusiones preliminares
Parece ser que la terapia de MCC modifica la entrada de calcio y la contractilidad en el cardiomiocito (6 h diarias de MCC) y aumenta la FEVI y el gasto cardiaco disminuyendo la presión telediastólica del VI sin aumentar el consumo de oxígeno. A los 3 meses atenúa el remodelado celular, molecular y general del VI. Experiencias clínicas preliminares proponen que la MCC de forma aguda mejora la función regional y general del VI. A mayor plazo, mejora la calidad de vida, el consumo máximo de oxígeno, el estado funcional y la distancia recorrida en 6 min, sin efectos adversos graves ni proarritmia.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
ABREVIATURAS
AV: auriculoventricular.
BRD: bloqueo de rama derecha.
BRI: bloqueo de rama izquierda.
DAI: desfibrilador automático implantable.
DP/dtmáx: incremento máximo de presión con respecto al tiempo.
FA: fibrilación auricular.
FEVI: fracción de eyección del ventrículo izquierdo.
MCC: modulación de la contractilidad cardiaca.
StH: estimulación en haz de His.
TRC: tratamiento de resincronización cardiaca.
VI: ventrículo izquierdo.
Correspondencia: Dr. J. Martínez Ferrer.
Servicio de Cardiología. Hospital Txagorritxu José Achótegui, s/n. 01009 Vitoria. Álava. España.
Correo electrónico: martinez-ferrer@telefonica.net