Palabras clave
INTRODUCCIÓN
Los bloqueos bifasciculares (BBF) son una forma específica de trastornos del sistema de conducción. Su prevalencia es de un 1-1,5% en la población adulta según datos del estudio de Framingham1. Los pacientes con BBF tienen mayor probabilidad de progresión a bloqueo auriculoventricular (BAV) avanzado y mayor riesgo de arritmias ventriculares, lo que comporta un aumento de la mortalidad respecto a la población general2.
El síncope en pacientes con BBF es a menudo consecuencia de BAV avanzado o de arritmias ventriculares, y se presenta entre un 10-15% a los 3 años, con una incidencia anual de BAV que oscila entre un 5 y un 11% según distintas series3-5. En pacientes asintomáticos, ésta es menor, de un 0,6-0,8%6. Las recurrencias sincopales se pueden suprimir con éxito mediante la implantación de un marcapasos (MP) permanente, aunque esta terapia no mejora la supervivencia2.
En los pacientes con BBF, el síncope y un intervalo HV prolongado en el estudio electrofisiológico (EEF) son predictores independientes de BAV avanzado4,6. No obstante, la sensibilidad y la especificidad del EEF se han puesto en entredicho en algunos estudios, y actualmente hay un difícil consenso sobre el valor límite del intervalo HV necesario para indicar la implantación de un marcapasos, desde los 45 ms en los estudios iniciales de Narula et al7, pasando por los 55 ms en los estudios de Dhingra et al3, hasta llegar a los 70 ms en la serie de Scheinman et al5. El valor aceptado actualmente es ≥ 70 ms en pacientes sintomáticos y ≥ 100 ms en pacientes asintomáticos8,9.
Por todo lo expuesto, el objetivo de nuestro estudio es valorar cuál es el punto de corte del intervalo HV que mejor predice la necesidad de MP y evaluar además si otros parámetros clínicos no invasivos pueden ayudar en la estratificación del riesgo de progresión a BAV en pacientes con BBF en un seguimiento a medio-largo plazo.
MÉTODOS
Pacientes
De marzo de 1998 hasta diciembre de 2006, hemos estudiado prospectivamente a 263 pacientes consecutivos con BBF. Los bloqueos de rama izquierda (BRIHH) y derecha (BRDHH) se definieron por criterios estándar10. Los criterios de hemibloqueo anterior (HBSA) y hemibloqueo posterior (HBSP) se establecieron según están descritos en la literatura11. Los criterios de inclusión fueron la presencia de BBF en el ECG, ya fuera en pacientes sintomáticos (síncope o presíncope) o asintomáticos. Se definió síncope como la pérdida brusca y completa de la conciencia acompañada de pérdida de tono postural, con reversión rápida y espontánea. Se definió presíncope como una situación de casi síncope, pero sin llegar a la pérdida completa de la conciencia.
Los criterios de exclusión fueron insuficiencia cardiaca avanzada con indicación de terapia de resincronización cardiaca, una expectativa de vida < 1 año (básicamente pacientes con neoplasias en estado avanzado), la observación de BAV de segundo o tercer grado transitorio previo al EEF y la presencia asociada de hipersensibilidad del seno carotídeo. Se explicó en detalle el protocolo de estudio a cada paciente y se obtuvo de todos ellos la autorización firmada para su realización.
Antes de la realización del EEF, se realizó una historia clínica completa de todos los pacientes. Asimismo se realizó ecocardiograma para descartar cardiopatía estructural y valorar la fracción de eyección (FE) mediante la fórmula de Simpson. La función renal se calculó mediante la estimación del filtrado glomerular renal (eFGR) con la fórmula de MDRD (Modification of Diet in Renal Disease)12,13.
Se analizaron las siguientes variables clínicas: hipertensión arterial, dislipemia, diabetes mellitus y tabaquismo, clase funcional NYHA para insuficiencia cardiaca, presencia de cardiopatía estructural y/o FE < 35% y un eFGR < 60 ml/min/1,73 m2.
Estudio electrofisiológico
Se realizó en ayunas de al menos 8 h y con el paciente consciente, después de retirar cualquier medicación antiarrítmica durante al menos 5 vidas medias. Se colocaron dos electrocatéteres tetrapolares (Bard Inc.; Boston, Massachusetts, Estados Unidos) de 6 Fr, con una distancia entre electrodos de 5 mm, por punción percutánea a través de la vena femoral derecha. Los catéteres se posicionaron en la aurícula derecha alta y el otro en posición de His. El protocolo de estudio incluyó la medida de los intervalos basales (AH y HV), el punto de Wenckebach anterógrado y retrógrado, los tiempos de recuperación del nodo sinusal con ciclos de 600, 500 y 430 ms, así como los periodos refractarios efectivos anterógrado y retrógrado del nodo auriculoventricular. Se realizó estimulación programada auricular y ventricular estándar para la inducción de arritmias, siguiendo el protocolo de investigación.
El resultado del EEF se consideró positivo cuando se documentó la existencia de un HV superior a 60 ms en pacientes sintomáticos. A raíz de la publicación de las guías clínicas de síncope en 20048, se cambió el punto de corte a 70 ms. También se consideró EEF positivo la determinación de un HV > 100 ms en pacientes asintomáticos. En los pacientes con EEF no diagnóstico, se realizó test farmacológico con fármacos estresantes infrahisianos (ajmalina 1 mg/kg hasta un máximo de 50 mg o procainamida 10 mg/kg hasta un máximo de 1.000 mg). La prolongación del intervalo HV por encima de 100 ms se consideró como un test positivo. Los registros intracavitarios se registraron y se midieron con un polígrafo Lab System Duo (Bard Inc.), a una velocidad de papel de 100 mm/s. Se realizó masaje del seno carotídeo a todos los pacientes para descartar hipersensibilidad de éste.
Tratamiento y seguimiento
A los pacientes con un EEF positivo por prolongación del HV se les implantó un MP. A los pacientes en quienes se indujo una taquicardia ventricular sostenida se les implantó un desfibrilador automático implantable (DAI), siguiendo las guías de actuación de la Sociedad Europea de Cardiología. Todos los pacientes con dispositivos fueron seguidos en la unidad de marcapasos 1, 3, 6 y 12 meses después, y luego cada 6-12 meses. Los pacientes sintomáticos con EEF negativo fueron sometidos a test de basculación y/o implantación de Holter insertable. En marzo de 2007 se hizo un seguimiento telefónico transversal a todos los pacientes para conocer si se habían producido recurrencias sincopales, hospitalización por cualquier causa y muerte.
Todos los dispositivos fueron programados en modo VVI con frecuencia mínima de 40 lat/min. En caso de documentarse BAV significativo (definido como BAV de tercer grado, BAV 2:1 o BAV de segundo grado sintomático), se reprogramaron a la frecuencia adecuada. Los DAI de pacientes con disfunción sinusal asociada eran programados a frecuencias mínimas de 60 lat/min en modo DDD con intervalos AV de 300 ms para favorecer el ritmo ventricular intrínseco.
Se consideró necesidad de MP la verificación mediante registro electrocardiográfico de BAV avanzado o la demostración de un porcentaje de estimulación ventricular > 10%. Se escogió este punto de corte puesto que cifras inferiores pueden deberse a estimulación vagal nocturna.
Análisis estadístico
Las variables continuas se expresan con la media ± desviación estándar y las cualitativas, con la frecuencia absoluta y el porcentaje. Las variables que no se ajustaron a la distribución normal se muestran con la mediana [intervalo intercuartílico]. Para comparar las variables continuas se utilizó la prueba de la t de Student para muestras independientes y el test de ANOVA o la U de Mann-Whitney y la prueba de Kruskal-Wallis en el caso de no ajustarse a la distribución normal. Las diferencias entre porcentajes se compararon con la prueba de la χ2 de Pearson y la corrección de Fisher cuando el número de valores esperados fue < 5.
El análisis de la necesidad de MP se llevó a cabo en un modelo clínico no invasivo que incluía variables clínicas y electrocardiográficas (análisis clínico) y en un modelo electrofisiológico (análisis electrofisiológico) separadamente mediante un análisis descriptivo y bivariable de Cox. Las variables que se relacionaron con un nivel de significación p ≤ 0,1 en el análisis bivariable de Cox en ambos modelos se incorporaron al modelo final (análisis mixto), y se llevó a cabo una regresión multivariable de Cox (backward stepwise) para confirmar el valor predictivo independiente de cada parámetro con un valor significativo de p < 0,05. Los resultados se expresan con la hazard ratio (HR) y el intervalo de confianza (IC) del 95%. Finalmente, con estas variables predictoras independientes se determinó la probabilidad de necesitar MP para cada variable por separado y todas combinadas.
Para determinar el punto de corte del HV que mejor predice la necesidad de MP, se analizó el área bajo la curva ROC (receiver operating characteristic), la sensibilidad y la especificidad en los pacientes que alcanzaron como mínimo 12 meses de seguimiento.
RESULTADOS
Características clínicas y electrocardiográficas
De los 263 pacientes inicialmente incluidos, se descartó a 12 por hipersensibilidad del seno carotídeo asociada. Otros 2 pacientes fueron excluidos del análisis final por fallecer antes del primer control del MP. Así pues, finalmente se analizó a 249 pacientes (tabla 1).
En total se estudió a 170 casos por síncope, con una mediana de 3,8 [1-6] síncopes por paciente. En 39 pacientes el EEF se indicó por clínica presincopal y los 40 restantes estaban asintomáticos. De ellos, 22 fueron remitidos para ablación de un sustrato arrítmico (12 con aleteo auricular y 10 con taquicardia por reentrada nodal) y los restantes 18 para valoración preoperatoria del riesgo quirúrgico.
Del total de pacientes, 116 (47%) presentaban cardiopatía estructural: isquémica (44 pacientes), hipertensiva (44), miocardiopatía dilatada idiopática (18), valvulopatía (9) y miocardiopatía hipertrófica obstructiva (1). La mediana de FE fue del 63% [54%-66%], y en 24 (10%) fue ≤ 35%.
El intervalo PR medio fue de 215 ± 48 ms, sin diferencias estadísticas entre los tres tipos de BBF. La duración media del intervalo QRS fue 144 ± 15 ms. Los pacientes con BRIHH presentaron un QRS más ancho (152 ± 15 ms) que los pacientes con HBSA + BRDHH (138 ± 11 ms) o HBSP + BRDHH (142 ± 11 ms) (p < 0,001).
Características electrofisiológicas
La mediana del AH fue 116 [98-144] ms y la del intervalo HV, 64 [56-74] ms. No hubo diferencias en el intervalo HV entre los diferentes tipos de BBF. Se observó BAV infrahisiano mediante estimulación auricular en 7 (3%) pacientes. Se realizó test farmacológico con antiarrítmicos de clase I en 99 pacientes (40%), que resultó positivo (HV ≥ 100 ms) en 6 casos.
La prolongación del HV se correlacionó con una mayor anchura del QRS (r = 0,3; p = 0,01). Asimismo se observó que el intervalo HV fue superior en los pacientes con cardiopatía estructural —68 [60-81] ms— que en los pacientes sin cardiopatía —64 [57-73] ms— (p = 0,03). Los pacientes en CF ≥ II tenían un intervalo HV significativamente superior —71 [61-83] ms— que los pacientes en CF I —64 [57-73] ms— (p = 0,01).
La estimulación ventricular programada indujo en 6 pacientes episodios de taquicardia ventricular monomórfica sostenida, todos ellos con cardiopatía estructural y función sistólica deprimida (en 5 cardiopatía isquémica y en 1 miocardiopatía dilatada). En los pacientes sin cardiopatía no se indujo ninguna taquicardia ventricular sostenida.
De los 249 pacientes incluidos, el EEF fue positivo en 154 (62%) pacientes, la mayoría de ellos sintomáticos (118 con síncope y 19 con presíncope), y se implantó a todos ellos un dispositivo de estimulación ventricular permanente (7 DAI y 147 MP).
De todos los pacientes estudiados, en 132 el EEF se realizó antes de la publicación de las guías de síncope de 2004, por lo que el punto de corte del HV para paciente sintomático fue de 60 ms. Desde 2004 hasta el final de la inclusión del estudio se estudió a otros 117 pacientes.
Seguimiento
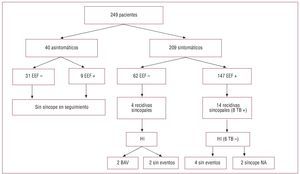
Tras una mediana de seguimiento de 4,5 [2,16-6,41] años, se determinó necesidad de MP en 102 (66%) de los 154 pacientes con EEF positivo. De ellos, en 45 pacientes fue por porcentaje de estimulación ≥ 10% y en 57 por documentarse BAV significativo. De los 102 pacientes, 77 habían sufrido síncope; 16, presíncope, y 9 estaban asintomáticos. La figura 1 resume la evolución de los pacientes con síncopes durante el seguimiento en función de la clínica inicial y de los resultados del EEF.
Fig. 1. Evolución de los pacientes en función de los síntomas y del resultado del estudio electrofisiológico. BAV: bloque auriculoventricular; EEF: estudio electrofisiológico; HI: Holter insertable; NA: no arrítmico; TB: test de basculación.
Sensibilidad y especificidad del intervalo HV
Para determinar el punto de corte del intervalo HV que mejor predice la necesidad de MP, se seleccionó a los pacientes que tuvieran un seguimiento > 1 año, es decir 227 pacientes. Para ellos, el punto de corte de 70 ms recomendado por las guías de la Sociedad Europea de Cardiología mostró una sensibilidad del 74% y una especificidad del 78%. Para estos mismos pacientes, un punto de corte de HV > 64 ms presentó un aumento de la sensibilidad hasta el 83% y un descenso de la especificidad a un 70%, con un valor predictivo positivo (VPP) del 54% y un valor predictivo negativo (VPN) del 91%, y un área bajo la curva ROC de 0,856 (IC del 95%, 0,81-0,91). Este mismo punto de corte obtiene la mejor relación sensibilidad/especificidad si sólo se considera a los pacientes con síncope o presíncope (sensibilidad/especificidad, VPP y VPN del 83%/70%, el 55 y el 90% respectivamente), con un área bajo la curva ROC de 0,844 (IC del 95%, 0,79-0,90).
El análisis del HV estresado bajo efecto de fármacos antiarrítmicos en un punto de corte de 100 ms mostró un área bajo la curva ROC de 0,836 (IC del 95%, 0,69-0,98), una sensibilidad del 40% y una especificidad del 94%.
Predicción de necesidad de marcapasos
Análisis clínico
Las variables clínicas que se asociaron a un mayor riesgo de necesitar un MP en los análisis bivariable y multivariable de Cox fueron la clínica sincopal o presincopal, el intervalo PR > 200 ms y una anchura del QRS > 140 ms (tablas 1 y 2).
Análisis electrofisiológico
Las variables electrofisiológicas que aumentaron el riesgo en la necesidad de MP fueron un intervalo HV > 64 ms y la prolongación del HV > 100 ms con fármacos estresantes infrahisianos. La existencia de conducción retrógrada se demostró como un factor protector (tabla 3). En el análisis multivariable mediante regresión de Cox, sólo el intervalo HV > 64 ms se observó como factor de riesgo, con HR = 7,17 (IC del 95%, 4,44-11,60; p < 0,001).
Análisis mixto (clínico y electrofisiológico)
En la regresión múltiple de Cox, las variables que aumentaron el riesgo de necesitar MP fueron la presencia de clínica sincopal o presincopal, la insuficiencia renal, un QRS > ms y un intervalo HV > 64 ms (tabla 4).
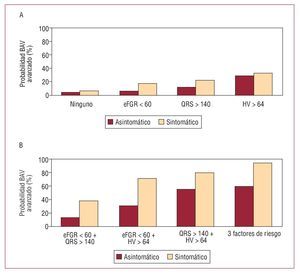
Con estas cuatro variables se obtuvo la probabilidad anual de BAV en función del número de variables presentes (fig. 2). Hay que destacar que el factor predictor más importante fue el intervalo HV, aunque éste sólo es capaz de predecir la necesidad de MP en el 33% de los pacientes sintomáticos, mientras que agregando una anchura de QRS > 140 ms y la insuficiencia renal la probabilidad aumenta hasta el 95% en pacientes sintomáticos y al 59% en asintomáticos.
Fig. 2. Gráficos que muestran la probabilidad anual de necesitar un marcapasos en pacientes sintomáticos y asintomáticos, según el factor de riesgo que se asocia (A) o los diversos factores de riesgo (B) en pacientes sintomáticos y asintomáticos. BAV: bloqueo auriculoventricular.
DISCUSIÓN
El presente estudio incluye la serie más larga y con un mayor seguimiento de pacientes con BBF, en su mayoría sintomáticos, en nuestro país. Nuestro análisis confirma que la presencia de síntomas y la anchura del intervalo HV basal durante el EEF son los factores predictores más importantes de riesgo de necesitar un MP en estos pacientes. Además, una anchura de QRS > 140 ms y la presencia de disfunción renal (eFGR < 60 ml/ min/1,73 m2) también son variables que predicen la necesidad de estimulación ventricular permanente en pacientes con BBF y, por consiguiente, refuerzan la indicación de MP definitivo. Hay que destacar que en nuestro análisis el punto de corte del intervalo HV basal que recomendamos > 64 ms es más sensible aunque menos específico que el recomendado por las guías8,9 (70 ms). En otras palabras, con este punto de corte tal vez se implantarían más MP de los necesarios, pero dejaríamos sin estimulación a menos pacientes que lo necesitaran, con riesgo de recidiva sincopal y con la morbimortalidad que ello comporta, especialmente en la población anciana.
Llama la atención que más de un tercio (35%) de los pacientes con BBF y EEF positivo aparentemente no tienen necesidad de MP durante el seguimiento. Sin embargo, el hecho de que quedaran asintomáticos indica que porcentajes de estimulación < 10% pueden ser suficientes para evitar el síncope en pacientes con probable BAV paroxístico.
En consonancia con series previas, la presencia de síncope/presíncope es el principal síntoma que predice la necesidad de MP en pacientes con BBF4,6.
Sin embargo, queda demostrado que el intervalo HV prolongado (> 64 ms) es el predictor más potente de necesidad de MP (HR = 6,6), por ello creemos que la realización de un EEF en pacientes con BBF y síncope sigue siendo de importante utilidad5,14.
Nuestro estudio confirma que en los pacientes con BBF de cualquier tipo hay una correlación significativa entre la duración del intervalo HV y la duración del intervalo QRS (r = 0,3; p = 0,01). Esto se había demostrado previamente sólo en pacientes con BRIHH o en relación con la anchura del QRS estimulado15,16. Destaca que dicha correlación aparece a partir de puntos de corte del intervalo HV más prolongados (> 65 ms), puesto que series anteriores con puntos de corte inferiores no consiguieron correlacionar anchura del QRS con el intervalo HV3,17.
La disfunción renal es un factor relevante en la necesidad de MP. En la población estudiada en presencia de BBF e insuficiencia renal, con un HV > 64 ms en ausencia de síntomas, la probabilidad de necesitar MP es inferior al 30%, pero aumenta a un 71% si se asocia a síncope o presíncope (fig. 2). Se sabe que a mayor grado de disfunción renal mayor es el porcentaje de pacientes con QRS ancho, BBF (especialmente BRIHH) y BAV avanzado18,19. Sin embargo, hasta el momento no había datos en la literatura que relacionaran la disfunción renal con la progresión a BAV significativo, salvo en presencia de diselectrolitemia asociada20.
En relación con los demás parámetros electrofisiológicos: bloqueo infrahisiano durante estimulación auricular, prolongación del intervalo HV > 100 ms bajo el efecto de fármacos estresantes infrahisianos y presencia de bloqueo intrahisano, éstos tienen un valor predictivo negativo elevado pero un valor predictivo positivo excesivamente bajo. El punto de corte de 100 ms con fármacos estresantes infrahisianos demuestra en nuestro análisis una buena especificidad pero una baja sensibilidad (el 94 y el 40% respectivamente) en la predicción de necesidad de MP respecto a otras series publicadas21,22, si bien analizar este dato no fue el objetivo inicial de nuestro estudio. De hecho, sólo se realizó el test en el 40% de los pacientes (en riesgo intermedio), lo que permite obtener sólo conclusiones parciales.
Limitaciones del estudio
Incluir a pacientes con una estimulación > 10% en la variable necesidad de MP podría sobrestimar el número de pacientes que realmente evolucionaron a BAV significativo. Sin embargo, creemos que los pacientes que requieren una estimulación > 10% cuando el MP está programado en modo VVI a 40 lat/min probablemente sufran BAV paroxístico y no únicamente estimulación por hipervagotonía nocturna. Además, la desaparición de los síntomas en estos pacientes respalda esta hipótesis.
Nuestra serie califica de sintomáticos a pacientes con BBF y clínica presincopal, y las series previas incluyen sólo a pacientes con síncope. Sin embargo, en nuestro análisis se incluyó a pacientes con evidente clínica presincopal («casi-síncope»), que además fueron sólo el 16% de la población en estudio (39 pacientes). En este subgrupo de pacientes, además, la incidencia de necesidad de MP no fue significativamente menor que en los pacientes con síncope (el 41 y el 45%). Consideramos, por lo tanto, que la inclusión de pacientes con claro presíncope no influye en los resultados obtenidos en el presente estudio.
En la evolución a BAV significativo pudo influir que estos pacientes tomaran fármacos antiarrítmicos para prevención, por ejemplo, de fibrilación auricular, lo que podría favorecer un BAV significativo en el seguimiento. No se han recogido estos datos y este hecho es especulativo; no obstante, la proporción de pacientes de nuestra serie que evoluciona a BAV significativo es relativamente baja (< 50% a 4,5 años de seguimiento), lo que va a favor de que, más que influencia de fármacos, debió de ser la evolución natural y la degeneración del sistema de conducción lo que influyó en la aparición de BAV significativo. Por otro lado, es difícil entender que pacientes con EEF negativo a pesar de fármacos estresantes infrahisianos en la evolución pudieran ser susceptibles a otros fármacos antiarrítmicos que no afectan tanto al sistema de conducción distal.
Finalmente, el comportamiento de los pacientes asintomáticos en nuestra serie puede no ser representativo del comportamiento general de los asintomáticos, dado que eran pocos pacientes.
CONCLUSIONES
Los pacientes con BBF presentan mayor riesgo de evolución a BAV significativo en presencia de clínica sincopal o presincopal evidente, intervalo HV basal > 64 ms, disfunción renal (eFGR < 60 ml/ min/1,73 m2) y/o anchura de QRS > 140 ms. La prolongación del intervalo HV por encima de 100 ms bajo efecto de fármacos estresantes infrahisianos y el bloqueo infrahisiano durante estimulación auricular o el bloqueo intrahisano documentados son variables predictoras adicionales.
ABREVIATURAS
BAV: bloqueo auriculoventricular.
BBF: bloqueo bifascicular.
BRDHH: bloqueo de rama derecha del haz de His.
BRIHH: bloqueo de rama izquierda del haz de His.
HBSA: hemibloqueo subdivisión anterior.
HBSP: hemibloqueo subdivisión posterior.
Full English text available from: www.revespcardiol.org
VÉASEEDITORIALENPÁGS. 385-6
Correspondencia: Dr. J. Martí-Almor.
Pg. Marítim, 25-29. 08003 Barcelona. España.
Correo electrónico: jmarti@imas.imim.es
Recibido el 12 de febrero de 2009.
Aceptado para su publicación el 19 de octubre de 2009.