La llegada de los stents a la cardiología intervencionista permitió que pudiéramos garantizar unos excelentes resultados angiográficos iniciales en todas las lesiones, evitar el problema de la oclusión aguda/subaguda del vaso y reducir significativamente la aparición de reestenosis angiográfica y clínica1. Aunque podría parecer paradójico, en realidad los stents inducen mayor proliferación neointimal que la angioplastia con balón. De hecho, sus mejores resultados se basan en que virtualmente eliminan el fenómeno de retroceso elástico precoz y la aparición de disecciones (lo que garantiza un excelente resultado inmediato) y evitan el retroceso elástico tardío del vaso. Todo ello permite no sólo «acomodar» el mayor crecimiento neointimal generado por la agresión del metal contra la pared vascular, sino también garantizar una mayor luz coronaria a largo plazo. Los stents farmacoactivos (STF), introducidos hace ya más de una década, han supuesto una nueva revolución en nuestra especialidad, al reducir de manera drástica la aparición de hiperplasia neointimal y la necesidad de reintervenciones1. Los resultados sin precedentes obtenidos con los STF han permitido que podamos ofrecer la posibilidad de revascularización percutánea a pacientes con características clínicas y anatómicas cada vez más desfavorables1. Algunos pacientes tratados con STF sufren reestenosis, pero este problema es muy poco frecuente. Sin embargo, el entusiasmo inicial despertado por los STF se vio parcialmente empañado al confirmarse que estos dispositivos no lograban reducir el riesgo de trombosis del stent. En realidad, simplemente desplazaban el momento de su aparición, con lo que el riesgo de trombosis muy tardías (tras el primer año) podía ser incluso superior al de los stents convencionales2. Aunque la aparición de esta complicación es excepcional, sus implicaciones clínicas son muy importantes. Ante este problema, la comunidad científica internacional reaccionó de manera unánime, inicialmente con preocupación y cautela y después impulsando nuevos esfuerzos de investigación. Se revisó de forma crítica la optimización del tratamiento antiplaquetario coadyuvante y su duración y se estimuló el desarrollo de nuevos STF2.
La trombosis del stent es un fenómeno multifactorial2–5. Actualmente sabemos que los problemas mecánicos en la plataforma metálica (infraexpansión, aposición incompleta, deformación o incluso rotura)3 y las reacciones adversas al fármaco (inicialmente sólo sirolimus [inmunosupresor] o paclitaxel [antiproliferativo]) manifestadas por toxicidad en la pared vascular, remodelado excesivo, retraso o falta de endotelización y disfunción endotelial5 pueden estar implicadas en la patogenia de esta complicación (figura). Sin embargo, ha sido la presencia del polímero de forma indefinida en la pared arterial lo que ha suscitado una especial preocupación, ya que hay evidencias, tanto experimentales como clínicas, de que en algunos pacientes puede ser la causa de toxicidad vascular tardía, con inflamación crónica, depósitos de fibrina e incluso fenómenos alérgicos locales5. Más recientemente también hemos aprendido que ocasionalmente la «neoaterosclerosis» (más frecuente y precoz tras implantación de STF) puede representar el nexo (hasta ahora no bien reconocido en la clínica) entre la reestenosis y la trombosis muy tardía del stent3. Todos estos problemas favorecen el desarrollo de un sustrato anatómico adverso, que nosotros hemos denominado el «stent vulnerable»2, que mantiene el riesgo de trombosis a muy largo plazo.
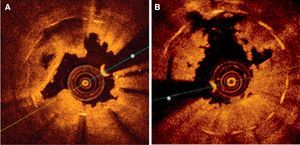
Imágenes de tomografía de coherencia óptica obtenidas tras una tromboaspiración inicial en pacientes con trombosis de stents farmacoactivos. A: trombosis subaguda asociada a interrupción precoz del doble tratamiento antiagregante; la sombra del trombo dificulta la visualización de algunos elementos metálicos; en otras zonas, este stent mostraba clara infraexpansión y struts todavía no endotelizados. B: trombosis muy tardía; se aprecia el carácter irregular del trombo residual que deja muy poca sombra y áreas con aposición incompleta (a las 11 horas); en otras zonas de este stent, se apreciaba infraexpansión y también falta de recubrimiento de algunos elementos metálicos. *Artefacto producido por la guía de angioplastia.
Los STF constan básicamente de una plataforma metálica, el polímero y el fármaco6. El polímero no sólo facilita la incorporación estable del fármaco que se quiere administrar, sino que permite dosificarlo en la pared arterial de manera programada. Sin duda, este paso ha sido uno de los retos más importantes en el desarrollo de los STF. La preocupación por mejorar la capacidad antiproliferativa de los STF, pero sobre todo por evitar la presencia de «stents vulnerables», ha estimulado el avance del conocimiento y los nuevos desarrollos tecnológicos. Afortunadamente, en los últimos años hemos asistido a importantes mejoras en cada uno de los componentes de los STF6. Así, los llamados STF de segunda generación incorporan nuevas plataformas con aleaciones avanzadas (cromo-cobalto, cromo-platino) que proporcionan mayor fuerza radial y estructuras mucho más finas y flexibles6. Además, disponemos de fármacos más evolucionados, muy lipofílicos y potentes (everolimus, zotarolimus, biolimus) y hemos adquirido nuevos conocimientos sobre su dosificación ideal según las necesidades de biodisponibilidad en la pared arterial6. Finalmente, los nuevos polímeros permanentes también han mejorado mucho, y no sólo se utilizan en menores cantidades (ultrafinos), sino que ahora se comportan de manera mucho más «amigable» con la pared vascular (polímeros «biocompatibles»)6.
Datos recientes de estudios clínicos aleatorizados (poblaciones seleccionadas), pero también de amplios registros generales de actividad (población mundo real), indican que algunos de los nuevos STF de segunda generación son más seguros y eficaces que los de primera generación7. Hay trabajos que señalan que el riesgo de trombosis con STF de segunda generación podría ser incluso menor que el de los stents metálicos convencionales8. En ciertos escenarios, la sensación de «confianza recuperada» es tan prevalente que incluso se sugiere acortar de forma drástica la duración del tratamiento antiplaquetario combinado. No obstante, la eficacia obtenida con los STF de primera generación ya era excelente (mejor con STF de sirolimus que de paclitaxel), por lo que demostrar mejorías clínicamente significativas es realmente muy difícil7. Además, en cuanto a la seguridad, para reducir de forma significativa la aparición de una complicación tan rara como la trombosis tardía del stent se requerirían estudios con miles de pacientes seguidos durante periodos de tiempo muy largos. Por estos motivos, el acercamiento a esta cuestión ha sido necesariamente pragmático y, habitualmente, los diseños de los nuevos ensayos clínicos con STF no han sido de superioridad, sino de no inferioridad7. Como luego veremos, otra forma de abordar este problema es realizar metanálisis de los nuevos estudios que se van generando. Finalmente, también podemos apoyarnos en objetivos de valoración subrogados (análisis intracoronario del crecimiento neointimal o de la endotelización) para resaltar las propiedades superiores de los nuevos STF. Aunque estos estudios son de indudable interés, tanto desde un punto de vista mecanicista como fisiopatológico, es obvio que no tienen las mismas implicaciones prácticas que las derivadas de los ensayos con diseño de superioridad y con objetivos primarios de valoración clínicos.
Paralelamente a la intensa línea de trabajo que se está desarrollando con los STF de segunda generación, otra estrategia diferente ha sido centrarse, directamente, en evitar los problemas derivados de la presencia de un polímero permanente en la pared arterial. Algunos investigadores han señalado que esta iniciativa supondría una nueva (tercera) generación de STF, aunque esta clasificación sigue siendo objeto de controversia. A su vez, esta estrategia incluye dos vías claramente diferenciadas. Una opción es incorporar el fármaco directamente (sin polímero) a la plataforma metálica del stent apoyándose en los nuevos avances tecnológicos9–11. De esta forma se logran superar las limitaciones encontradas (fundamentalmente falta de efectividad) en algunos prototipos iniciales de STF sin polímero. Actualmente hay plataformas metálicas microporosas que permiten retener en su superficie el fármaco a la concentración deseada9,11. Otras plataformas ofrecen sofisticados diseños con microrreceptáculos para almacenar el fármaco10. Los resultados de estos nuevos STF que incorporan el fármaco directamente en la plataforma (sin polímero) son muy interesantes9–11, pero muchos de ellos todavía deben ser considerados como preliminares o simples pruebas de concepto.
La otra opción que ha suscitado un enorme interés es desarrollar polímeros biodegradables12. Estos nuevos polímeros cumplirían su función inicial de liberar de manera programada el fármaco para luego desaparecer por completo de la pared arterial. En ella finalmente quedaría únicamente un stent metálico convencional que ayudaría a mantener la arquitectura vascular y evitaría el remodelado negativo tardío. Uno de los retos más importantes con los polímeros biodegradables es sincronizar su degradación con el final de la programación de la liberación del fármaco. Los compuestos de ácido poliláctico constituyen la base de muchos de los nuevos polímeros biodegradables. Este material se hidroliza y se degrada a ácido láctico, que finalmente se metaboliza por el ciclo de Krebs y genera CO2 y H2O. Además, la versatilidad ofrecida por algunos de estos nuevos STF es muy amplia. Algunos permiten administrar varios fármacos con efectos sinérgicos o complementarios. Existen STF con polímeros biodegradables que únicamente liberan el fármaco antiproliferativo por su superficie abluminal (en contacto con la pared), mientras que en su cara adluminal incorporan anticuerpos capaces de capturar células progenitoras endoteliales. Se pretende así combinar estrategias antirreestenóticas (eficacia) con las que estimulan la endotelización (seguridad). Actualmente tenemos datos muy interesantes de STF con polímeros biodegradables. Desde un punto de vista mecanicista, estudios con tomografía de coherencia óptica han demostrado una endotelización precoz de estos dispositivos en comparación con STF de primera generación. Más importante, desde un punto de vista clínico, datos recientes de seguimiento a muy largo plazo (4 años) han permitido demostrar una menor incidencia de trombosis muy tardía en comparación con los STF de primera generación con polímero permanente12.
Por último, también disponemos para uso clínico de dispositivos implantables completamente bioabsorbibles13. En estos sistemas, no sólo el polímero, sino la plataforma entera, termina por desaparecer. Algunos metales (magnesio) se degradan totalmente por biocorrosión, pero, una vez más, las plataformas más avanzadas se basan en estructuras de ácido poliláctico. Estos dispositivos tienen el incomparable atractivo teórico de que al «disolverse» permitirían una restauración completa de todas las funciones de la pared vascular, lo que incluye tanto cambios vasomotores agudos como fenómenos más progresivos de remodelado vascular. Además de evitar el «fenómeno corsé», eliminan los problemas mecánicos tardíos asociados a plataformas mal adosadas, protruyentes o que enjaulan ramas laterales. No menos importante es que facilitan la visualización y la valoración no invasiva durante el seguimiento de los segmentos coronarios tratados. Los resultados de algunos estudios observacionales en pacientes seleccionados con lesiones favorables han sido, sencillamente, espectaculares13. Con los diseños estructurales más recientes, sus hallazgos angiográficos tardíos rivalizan con los obtenidos con STF de segunda generación. Finalmente, las técnicas de diagnóstico intracoronario han confirmado la desaparición completa del dispositivo a partir de los 2 años13. Aunque el perfil actual de estos sistemas y sus características mecánicas (plásticas) podrían representar limitaciones para su utilización generalizada en la clínica, ya están en marcha diferentes estudios para conocer sus resultados, y posibles indicaciones, en diferentes contextos clínicos y anatómicos.
ESTUDIO ACTUALEn Revista Española de Cardiología, Cassese el al14 presentan un interesante metanálisis de dos estudios aleatorizados que compararon STF sin polímero y STF con un polímero permanente. El STF sin polímero tenía una plataforma metálica microporosa que se cargaba de sirolimus a una concentración del 2% por medio de un dispositivo especial en la propia sala de hemodinámica. Los investigadores de estos estudios, realizados en cinco centros alemanes, han agrupado sus bases de datos para poder analizar toda la información con datos del paciente individual, lo que sin duda aumenta el valor del metanálisis. Aunque uno de los estudios incluía a todo tipo de pacientes y el otro se centraba exclusivamente en pacientes diabéticos, el test de heterogeneidad permitió confirmar la validez del análisis conjunto. Este estudio no sólo es la mayor experiencia actualmente disponible sobre los resultados proporcionados por STF sin polímero, sino que incorpora un seguimiento clínico adicional de todos los pacientes para conocer mejor su evolución clínica a largo plazo14. Los dos estudios aleatorizados originales tenían un diseño de no inferioridad, incluían un número de pacientes relativamente reducido y aportaban un seguimiento clínico corto. En el actual metanálisis se incluye un total de 686 pacientes (con 751 lesiones tratadas) seguidos (100% de seguimiento clínico) durante 3 años. En general, los pacientes tenían características clínicas y angiográficas complejas (el 53% de pacientes diabéticos, 2/3 lesiones B2-C). En este estudio, tanto los resultados angiográficos tardíos como la evolución clínica final de los pacientes fueron similares con ambos tipos de STF. Además, los resultados concuerdan en los diferentes subgrupos de interés, lo que añade consistencia y robustez a los hallazgos. Todavía de mayor relevancia es que durante todo el seguimiento sólo se produjo 1 único episodio de trombosis definitiva entre los 345 pacientes tratados con STF sin polímero14. Estos resultados son de gran interés, pero también suscitan algunas reflexiones. En primer lugar, el STF con polímero permanente utilizado como comparador fue un STF de paclitaxel de primera generación. Como los autores reconocen, actualmente este STF no se puede considerar un comparador ideal, ya que sus resultados angiográficos tardíos son inferiores a los de los STF con sirolimus de primera generación. En segundo lugar, una pérdida angiográfica tardía de 0,53 mm (análisis en el stent) es muy alta para un STF con un fármaco de tipo -limus a pesar de haberse obtenido en una población desfavorable (diabéticos y lesiones complejas). En este sentido, los autores discuten adecuadamente las posibles implicaciones del tipo de droga en los pacientes diabéticos. Además, aunque las diferencias angiográficas no fueron estadísticamente significativas con respecto a los resultados del STF de paclitaxel (pérdida tardía, 0,46 mm; p=0,15), los márgenes de confianza eran relativamente amplios, con lo que los resultados podrían haber sido diferentes si se hubiera analizado un número de pacientes mayor. Debemos recordar que un estudio previo que comparó estos mismos STF obtuvo peores resultados con el STF sin polímero15. Sin embargo, ese estudio era observacional y retrospectivo, y los autores admitieron que, debido a su mayor flexibilidad, se pudo haber utilizado preferentemente el STF sin polímero en los pacientes con lesiones más complejas. Otros estudios previos también habían cuestionado el valor relativo de los STF sin polímero, tanto con paclitaxel16 como con sirolimus17. Sin embargo, el estudio actual sugiere que los STF sin polímero son al menos tan eficaces como los STF con polímero de primera generación y proporciona datos muy interesantes sobre su seguridad a largo plazo. Además, estudios previos realizados por estos mismos investigadores indican que la presencia del polímero podría condicionar significativas pérdidas luminales muy tardías (pasados los 9 meses, fenómeno de catch-up), que no parece que se produzcan con los STF sin polímero9. A su vez, estudios con coherencia óptica indican una endotelización de los STF sin polímero mejor que con los STF con polímero. Finalmente, datos muy recientes señalan que las nuevas generaciones de STF sin polímeros que incorporan nuevos fármacos (amfilimus o sirolimus/probucol) son más eficaces que los STF de primera generación10 y de similar eficacia que los STF de segunda generación11. Todo ello ilustra que esta línea de investigación sigue abierta y muy activa pero también que se necesitan nuevos estudios para analizar los resultados de las nuevas generaciones de STF sin polímero y confirmar las ventajas potenciales de esta estrategia terapéutica.
CONSIDERACIONES FINALESAlgunos investigadores critican los esfuerzos realizados por los cardiólogos intervencionistas, siempre ufanos por comparar los resultados obtenidos con los nuevos stents. Se reprocha que este tipo de investigación (comparación de stent A frente a stent B) es demasiado simple, refleja falta de creatividad y, sobre todo, que está estrechamente relacionada con los intereses de la industria. Nosotros no podemos compartir dicha opinión. El intervencionismo percutáneo es la estrategia de revascularización coronaria más utilizada actualmente1. Nuestra responsabilidad conlleva ofrecer a nuestros pacientes el mejor tratamiento disponible en cada momento. Sólo las comparaciones rigurosas y críticas, realizadas desde contextos clínicos con análisis tanto de resultados de eficacia como de efectividad y utilizando un número adecuado de pacientes seguidos durante el tiempo necesario, permiten conocer las aportaciones reales de los nuevos dispositivos. En cardiología intervencionista hemos aprendido —tras sufrir múltiples decepciones— que dispositivos increíblemente atractivos desde el punto de vista fisiopatológico pueden no ser capaces de obtener los resultados apetecidos en la clínica. En realidad, este tipo de estudios representa el necesario paso final de un estimulante ejercicio de investigación traslacional que permite consolidar la innovación biotecnológica en beneficio de nuestros pacientes. El grupo de Múnich que ha liderado el actual metanálisis14 es un verdadero ejemplo de coherencia y perseverancia en este espíritu. Durante más de una década estos investigadores han realizado infinidad de estudios aleatorizados de máxima calidad (estudios ISAR), que han permitido avanzar nuestro conocimiento sobre la utilidad clínica de los nuevos STF.
Actualmente, podemos administrar medicamentos directamente en la pared arterial, de modo sencillo y eficaz, utilizando tecnologías muy diferentes. Los balones con fármaco (sin necesidad de implantar un stent) son muy eficaces en el tratamiento de la reestenosis del stent, pero recientemente su uso en lesiones de novo también está siendo objeto de intenso estudio18. Como hemos señalado, disponemos de nuevas generaciones de STF con polímeros biocompatibles8, STF con polímeros biodegradables12 y también dispositivos completamente bioabsorbibles13. Finalmente, contamos con STF capaces de administrar eficazmente el fármaco a nivel local sin necesidad de ningún polímero9-11. Todas estas estrategias terapéuticas están en continua evolución, pero al mismo tiempo deben competir entre sí para que podamos identificar cuál se consolidará finalmente como «terapia dominante» en diferentes grupos de pacientes, atendiendo a sus características clínicas y anatómicas. El estudio de Cassese et al14 es una nueva pieza en el puzzle, fascinante y dinámico, que representan los continuos avances que disfrutamos en el intervencionismo coronario.
CONFLICTO DE INTERESESNinguno.