La ablación es un procedimiento efectivo como tratamiento de la taquicardia ventricular (TV) y se ha demostrado mejoría tanto de la supervivencia como del tiempo libre de nuevos eventos arrítmicos1.
Los pacientes con disfunción ventricular e insuficiencia cardiaca tienen riesgo de descompensación hemodinámica aguda y fallo multiorgánico durante el procedimiento. Este riesgo es especialmente elevado en caso de múltiples TV mal toleradas con necesidad de cardioversión o desfibrilación, o en caso de tormenta arrítmica2.
La ablación del sustrato arrítmico, realizada en ritmo sinusal, es una técnica eficaz para el tratamiento de las TV. La modificación del sustrato, en caso de TV con mala tolerancia hemodinámica durante el procedimiento, resulta una tarea ardua, ya que puede haber dificultades en la identificación de los potenciales patológicos, imposibilidad de realizar un mapeo exhaustivo del sustrato y limitaciones a la hora de comprobar la eficacia. Además, después de una modificación del sustrato en principio efectiva, la TV aún puede ser inducible3.
En la literatura se ha comunicado el uso de diferentes dispositivos de asistencia hemodinámica4. Entre ellos, la asistencia mediante oxigenador extracorpóreo de membrana (ECMO) es el único capaz de proporcionar al paciente asistencia circulatoria y respiratoria completa. El implante de ECMO se ha descrito como asistencia circulatoria de rescate y profiláctica, pero no hay consenso sobre la mejor estrategia a seguir5. En el subgrupo de pacientes con tormenta arrítmica, la asistencia circulatoria proporcionada por el ECMO en la ablación parece haber mostrado buenos resultados6.
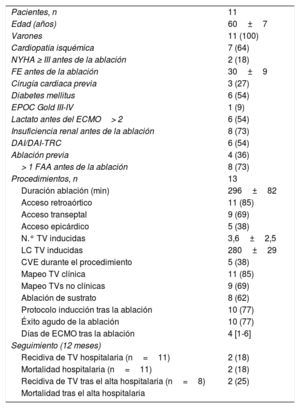
En este trabajo se presenta una serie prospectiva de todos los pacientes consecutivos sometidos a ablación de TV con asistencia hemodinámica mediante ECMO en 2 centros españoles. Entre enero de 2016 y diciembre de 2018 se incluyeron 13 procedimientos de ablación de TV en 11 pacientes (tabla 1). La media de edad era 60±7 años, el 64% presentaba cardiomiopatía isquémica y el 73%, disfunción ventricular grave. El 55% de los pacientes eran portadores de desfibrilador automático implantable y el 36% se había sometido previamente a al menos una ablación de TV.
Características de los pacientes y procedimientos
| Pacientes, n | 11 |
| Edad (años) | 60±7 |
| Varones | 11 (100) |
| Cardiopatía isquémica | 7 (64) |
| NYHA ≥ III antes de la ablación | 2 (18) |
| FE antes de la ablación | 30±9 |
| Cirugía cardiaca previa | 3 (27) |
| Diabetes mellitus | 6 (54) |
| EPOC Gold III-IV | 1 (9) |
| Lactato antes del ECMO> 2 | 6 (54) |
| Insuficiencia renal antes de la ablación | 8 (73) |
| DAI/DAI-TRC | 6 (54) |
| Ablación previa | 4 (36) |
| > 1 FAA antes de la ablación | 8 (73) |
| Procedimientos, n | 13 |
| Duración ablación (min) | 296±82 |
| Acceso retroaórtico | 11 (85) |
| Acceso transeptal | 9 (69) |
| Acceso epicárdico | 5 (38) |
| N.° TV inducidas | 3,6±2,5 |
| LC TV inducidas | 280±29 |
| CVE durante el procedimiento | 5 (38) |
| Mapeo TV clínica | 11 (85) |
| Mapeo TVs no clínicas | 9 (69) |
| Ablación de sustrato | 8 (62) |
| Protocolo inducción tras la ablación | 10 (77) |
| Éxito agudo de la ablación | 10 (77) |
| Días de ECMO tras la ablación | 4 [1-6] |
| Seguimiento (12 meses) | |
| Recidiva de TV hospitalaria (n=11) | 2 (18) |
| Mortalidad hospitalaria (n=11) | 2 (18) |
| Recidiva de TV tras el alta hospitalaria (n=8) | 2 (25) |
| Mortalidad tras el alta hospitalaria | |
CVE: cardioversión eléctrica; DAI: desfibrilador automático implantable; ECMO: oxigenador extracorpóreo de membrana; EPOC: enfermedad pulmonar obstructiva crónica; FAA: fármaco antiarrítmico; FE: fracción de eyección; LC: longitud de ciclo; NYHA: clase funcional de la New York Heart Association; TRC: terapia de resincronización cardiaca; TV: taquicardia ventricular.
Salvo otra indicación, los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
En el 91% de los casos se cumplían los criterios de tormenta arrítmica, en 3 de ellos secundaria a un infarto agudo de miocardio reciente y en el resto secundaria a la miocardiopatía de base.
El ECMO se implantó como asistencia para la ablación en el 64% de los pacientes; en el resto se implantó por shock cardiogénico en el contexto de tormenta arrítmica. El ECMO se implantó predominantemente en quirófano (64%) una mediana de 1 [intervalo intercuartílico, 1-3] día antes de la ablación, y se mantuvo una mediana de 4 [1-6] días tras la ablación.
Se realizó abordaje endocárdico y epicárdico en el 38% de los casos. En el 85% de los procedimientos se realizó mapa de activación de la TV clínica y en el 62% se completó con ablación de sustrato. En el 77% de los casos se realizó protocolo de inducción y el procedimiento se consideró exitoso en un 77% de los casos. No hubo ninguna complicación directamente relacionada con la ablación, en 1 caso fue necesario retirar el ECMO por isquemia aguda de extremidad inferior.
Tras un seguimiento medio de 12 meses, 6 pacientes se encontraban libres de eventos arrítmicos, 1 paciente recibió un trasplante cardiaco y 2 presentaron recidivas de TV, tratadas eficazmente mediante estimulación antitaquicardia y optimización del tratamiento antiarrítmico. En el seguimiento, 3 pacientes recibían tratamiento con amiodarona, 1 con mexiletina y 1 con sotalol+mexiletina. Dos pacientes fallecieron durante el ingreso, en ambos casos se trató de pacientes sometidos de nuevo a ablación tras un primer procedimiento no exitoso y que evolucionaron hacia fallo multiorgánico en el contexto de insuficiencia cardiaca refractaria, sin posibilidad de recurrir a terapias más avanzadas.
En esta serie prospectiva de 2 centros españoles, la asistencia hemodinámica mediante ECMO se ha mostrado como una herramienta fundamental para aumentar las probabilidades de éxito de la ablación en 13 procedimientos de riesgo especialmente elevado en el contexto de tormenta arrítmica e inestabilidad hemodinámica.
En pacientes con TV y cardiopatía estructural, la ablación es un procedimiento complejo y plantea un desafío único, debido a la presencia concomitante de insuficiencia cardiaca congestiva grave, episodios de TV recurrentes, descargas frecuentes del desfibrilador automático implantable, tormenta arrítmica y presencia de comorbilidad significativa, como diabetes y enfermedad renal crónica, entre otras. Por lo tanto, son necesarias una cuidadosa selección de los pacientes y una planificación detallada del procedimiento para mejorar la eficacia y la seguridad.
Los resultados, tanto de nuestra serie como de las publicadas previamente, indican que el ECMO puede ser útil como asistencia hemodinámica para la ablación de TV en pacientes con inestabilidad hemodinámica previa al procedimiento o alto riesgo de deterioro hemodinámico durante su curso, como es el caso de los pacientes con diagnóstico de tormenta arrítmica.
El ECMO ayuda a mantener correctas la presión arterial y la oxigenación pese a que el paciente se encuentre en TV sostenida, lo que facilita una adecuada perfusión de los órganos. Esto permite realizar mapas de activación más detallados y con mayor seguridad, lo que podría mejorar tanto los resultados del procedimiento como la morbimortalidad a largo plazo. En comparación con otros dispositivos como el Impella o el Tandem Heart, las ventajas del ECMO son que aporta una mayor asistencia circulatoria, además de dar asistencia pulmonar y no dificultar el movimiento de los catéteres durante el procedimiento, ya que se trata de un dispositivo extracardiaco.
Pese al carácter observacional de nuestra serie y a la ausencia de un grupo de control, se trata de una cohorte procedente de 2 centros experimentados en la ablación de TV. En ausencia de ensayos clínicos que hayan evaluado el real beneficio del ECMO como asistencia hemodinámica para la ablación de la TV, nuestra opinión es que este dispositivo se configura como una herramienta que considerar para pacientes seleccionados.