La fibrilación auricular (FA) es el trastorno del ritmo cardiaco más frecuente en los pacientes con y sin cardiopatía estructural1-3. Entre los factores de riesgo conocidos están la edad avanzada, la hipertensión, la diabetes mellitus, la enfermedad coronaria (EC) y la insuficiencia cardiaca preexistente, por mencionar solo los más frecuentes4,5.
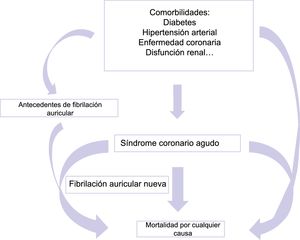
De los pacientes con EC que necesitan una intervención coronaria percutánea (ICP), aproximadamente a un 5-8% se les ha diagnosticado una FA y, debido al aumento de la puntuación CHA2DS2-VASc, necesitan anticoagulación oral6. Por lo que respecta al tratamiento del paciente, esta situación es extraordinariamente complicada y pueden aparecer múltiples problemas (figura 1).
El primer problema es que la estrategia de combinar un tratamiento antiagregante plaquetario doble (TAPD) que incluya inhibidores del P2Y12 con anticoagulación oral (antagonistas de la vitamina K [AVK] o no antagonistas de la vitamina K [NACO]) no solo carece de datos, sino que aumenta también el riesgo de hemorragia mayor7. Hace muy poco se han publicado 2 ensayos prospectivos multicéntricos que han intentado determinar el riesgo de hemorragia mayor. Ambos estudios han puesto de manifiesto que la anticoagulación oral en combinación con un inhibidor del P2Y12 es un abordaje viable, que proporciona un resultado mejor que el obtenido con el «tratamiento triple» consistente en un tratamiento antiagregante plaquetario doble o un inhibidor del P2Y12 y ácido acetilsalicílico junto con un anticoagulante oral adicional, ya sea un AVK o un NACO. Esta estrategia garantiza que se reduzca el riesgo de trombosis del stent y de estenosis temprana en el stent, así como el riesgo de eventos cardioembólicos en los pacientes con una EC estable6,8.
El segundo problema es que, debido al aumento del riesgo de hemorragia, en especial si se trata a los pacientes con un AVK, aumenta el riesgo de sangrado periintervención y de complicaciones graves durante la ICP, lo cual hace más difícil decantarse por esta. Concretamente, el sangrado en la zona de punción arterial es una complicación temida, que requiere un acceso seguro con una buena posibilidad de compresión manual en el caso de que haya complicaciones, lo cual lleva a que se prefiera la vía radial en vez de la femoral para realizar la coronariografía o la ICP4.
La situación puede ser peor aún si aparece FA durante un infarto agudo de miocardio (IAM), lo cual implica un mal pronóstico que dobla el riesgo de muerte, insuficiencia cardiaca congestiva e ictus9. La FA de nueva aparición durante un síndrome coronario agudo (SCA) se produce la mayoría de las veces en los primeros 4 días tras el IAM. Esto podría estar relacionado con trastornos que coinciden a menudo, como la insuficiencia cardiaca, la insuficiencia mitral o la respuesta general de fase aguda/inflamatoria causada por el infarto de miocardio10. En los pacientes con FA de la población general, el riesgo de muerte debida a un SCA es del 5,9% y supera al riesgo de ictus isquémico (5,1%)11.
Hay varios aspectos que conviene comentar en lo relativo al IAM y la FA por lo que respecta a los resultados del trabajo de Biasco et al.12 recientemente publicado en Revista Española de Cardiología. En el análisis, se incluyó en total a 35.958 pacientes. Los pacientes estudiados habían sido tratados en Suiza entre 2004 y 2015 a causa de un SCA y se los había incluido con carácter voluntario en el registro Acute Myocardial Infarction in Switzerland (AMIS) Plus. En el análisis, se dividió primero a los pacientes en grupos en función de sus antecedentes de FA conocidos al ingreso en el hospital: ausencia de antecedentes de FA conocidos (sin FA), antecedentes de FA (FA previa) e ingreso en ritmo sinusal y primer diagnóstico de FA durante la hospitalización (FA nueva). Tiene interés señalar que en este análisis había 1.644 pacientes (4,7%) con FA previa y 309 (0,8%) con un primer diagnóstico de FA durante la hospitalización a causa del IAM. Esto resulta sorprendente, ya que en otros ensayos y registros se ha descrito una incidencia de FA en estos grupos de pacientes de un 6 y un 8% respectivamente9,10. Esto podría explicarse por el empleo de definiciones de la FA nueva y la FA previa diferentes en este registro retrospectivo, que por lo tanto difieren de las cohortes de pacientes de otras investigaciones clínicas.
En la comparación de los pacientes con FA previa y los pacientes con FA nueva, hay algunas diferencias interesantes por lo que respecta a sus comorbilidades. En cuanto a los factores de riesgo de FA y EC conocidos, la hipertensión preexistente tuvo significativamente mayor frecuencia en los pacientes con FA previa; sin embargo, la prevalencia de la EC previa e infarto de miocardio con elevación del segmento ST fue aproximadamente el doble en los pacientes con FA de nueva aparición. Además, la necesidad de usar un balón de contrapulsación intraaórtico fue superior. En cambio, la frecuencia de insuficiencia cardiaca al ingreso fue el doble en los pacientes con FA previa que en los pacientes con FA de nueva aparición. Durante la hospitalización, no hubo diferencias en cuanto al shock cardiogénico o la mortalidad entre los grupos de FA en el presente estudio.
Una observación clave en este enorme conjunto de datos y con un periodo de inclusión de una década es la siguiente: se realizó coronariografía a solo el 56,5% de los pacientes de este registro que sufrieron un SCA y tenían FA preexistente. Respecto a las razones de ello, solo puede especularse: podría ser que los pacientes con una FA conocida estén siendo tratados con AVK o NACO ya al ingreso en el hospital por el SCA, por lo que el riesgo de una complicación hemorrágica durante la coronariografía o la ICP está elevado. Además, al inicio del análisis de los datos de este registro, el uso de la vía de acceso femoral para la coronariografía y la ICP fue más frecuente que el de la vía radial. Se sabe que la vía femoral puede causar mayores tasas de complicaciones.
La siguiente observación de interés es los síntomas referidos por los pacientes al ingreso. En el grupo de FA previa, solo el 75,4% de los pacientes refirieron inicialmente dolor torácico, pero el 49,6% tenía disnea, que fue el motivo principal de ingreso en el hospital. En cambio, en el grupo sin FA, se realizó una coronariografía a más del 80% de los pacientes y se identificaron síntomas típicos (el 87,6% con dolor torácico y solo el 29,6% con disnea).
La disminución de la tasa de mortalidad por cualquier causa observada en el grupo con FA previa concuerda con el aumento de la frecuencia de uso de coronariografía e ICP en este grupo de pacientes. Este fenómeno no se observó en el grupo de FA de nueva aparición, en el que los porcentajes de EC y de ICP aumentaron, pero sin una disminución de la mortalidad.
Como ya se ha mencionado, los pacientes tratados con AVK tienen mayor riesgo de complicaciones hemorrágicas durante la ICP. Las guías resaltan que el acceso por vía radial es superior al de la vía femoral4.
Tiene interés señalar que, en el trabajo de Biasco et al.12, el acceso radial se utilizó solo en el 24,2% de los pacientes con FA preexistente, en comparación con más del 30% en los demás grupos.
Las complicaciones hemorrágicas fueron también superiores en los grupos de FA, tal como se preveía; sin embargo, los pacientes con FA de nueva aparición sufrieron con mayor frecuencia eventos cerebrovasculares y hemorragias clínicamente importantes que los pacientes con FA previa. Esto tiene especial interés, puesto que después de la intervención se trata a estos pacientes con un TAPD, que incluiría pasugrel y ticagrelor, en vez de clopidogrel, que es el único inhibidor del P2Y12 apto para combinarlo con un anticoagulante oral6,8. Y esto podría ser un factor de confusión.
En resumen, el análisis de este registro muestra la situación complicada y a veces contradictoria que se da en los pacientes con FA que presentan un SCA en la práctica clínica real. Los pacientes fueron analizados durante una década en la que se publicaron estudios importantes y se introdujeron cambios trascendentes en las guías. En este contexto concreto, con una clasificación de los pacientes en casos con FA nueva y casos con FA previa y con una división según el momento de inclusión en el registro, hubo 2 observaciones muy importantes. En primer lugar, el pronóstico de los pacientes con FA previa mejoró notablemente durante el periodo de 10 años. En segundo lugar, hasta ahora los pacientes con FA preexistente o aparecida durante el IAM tenían un pronóstico peor, a pesar de que los pacientes con FA nueva tuvieran menos comorbilidades y factores de riesgo. Para terminar, la importancia del «infratratamiento» con menos intervenciones debe tenerse en cuenta como factor de confusión adicional respecto a las tasas de mortalidad más elevadas.
En consonancia con lo indicado por estudios previos, el registro pone de manifiesto que los pacientes con un SCA y comorbilidades graves, como la FA, tienen gran riesgo de aumento de la mortalidad, y se debe tener especialmente en cuenta en la toma de decisiones respecto a las ulteriores estrategias de tratamiento. Por lo que respecta a la anticoagulación y el TAPD, es esencial un abordaje personalizado.
CONFLICTO DE INTERESESV. Johnson: conferenciante honorario de BMS/Pfizer y Biotronik. J. Schmitt: consejo asesor de Biotronik y BMS/Pfizer; panel de conferenciantes de Abbott, Biotronik, BMS/Pfizer, CVRx, Daiichy Sankyo, Medtronic y Zoll. Subvenciones a la investigación de Abbott, CVRx y Zoll.