Hemos estudiado la exactitud diagnóstica de la gammagrafía cardiaca con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD) para la diferenciación de la amiloidosis cardiaca por depósito de cadenas ligeras de inmunoglobulina monoclonal y la relacionada con el depósito de transtiretina.
MétodosSe incluyó en el estudio a 19 pacientes con amiloidosis cardiaca demostrada: 8 con amiloidosis cardiaca relacionada con la transtiretina (grupo A) y 11 con amiloidosis cardiaca por depósito de cadenas ligeras de inmunoglobulina monoclonal (grupo B). A todos los pacientes se les realizó gammagrafía cardiaca con 99mTc-DPD y con 99mTc-metilendifosfonato (99mTc-MDP).
ResultadosEn la valoración visual, la captación cardiaca de 99mTc-DPD tenía intensidad moderada o intensa (grados 2-3) y distribución biventricular o ventricular en todos los pacientes del grupo A y era de nula a ligera (grados 0-1) y de distribución difusa en todos los del grupo B. La captación de 99mTc-DPD también estaba ausente (grado 0) en los controles normales y en 2 familiares sanos de pacientes con amiloidosis hereditaria relacionada con la transtiretina que eran portadores de una mutación patogénica en el gen TTR. Todos los pacientes mostraron ausencia de captación miocárdica en la gammagrafía con 99mTc-MDP (grado 0-1). En nuestro estudio, la captación selectiva de 99mTc-DPD proporcionó una exactitud del 100% (intervalo de confianza del 95%, 97,37-100%) para la diferenciación de la etiología relacionada con la transtiretina frente a amiloidosis cardiaca por depósito de cadenas ligeras de inmunoglobulina monoclonal.
ConclusionesLa gammagrafía cardiaca con 99mTc-DPD es una herramienta para el diagnóstico diferencial entre la amiloidosis relacionada con la transtiretina y la amiloidosis cardiaca por depósito de cadenas ligeras de inmunoglobulina monoclonal en pacientes con amiloidosis cardiaca.
Palabras clave
La amiloidosis cardiaca (AC) la provoca el depósito de un material proteináceo insoluble, la sustancia amiloide, en el intersticio del corazón. Esta proteína anómala puede tener diferentes orígenes y composición molecular, y así da lugar a los distintos tipos de amiloidosis. La AC puede formar parte de una enfermedad sistémica y coexistir con la afección de otros órganos o, más raramente, puede afectar fundamentalmente al corazón. Cuando afecta al corazón, suele presentarse como una miocardiopatía restrictiva que lleva a la muerte por insuficiencia cardiaca en la mayoría de los pacientes.
Actualmente se considera que los distintos tipos de AC representan entidades diferentes y su distinción tiene gran relevancia clínica1.
Este estudio se inició por un hallazgo incidental de depósito miocárdico en un paciente gravemente afectado de AC en el contexto de una amiloidosis sistémica2. Como consecuencia de ello, decidimos evaluar la gammagrafía con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD) como técnica útil en la amiloidosis. Este trabajo muestra nuestros hallazgos.
MétodosHemos estudiado la utilidad de la gammagrafía con 99mTc-DPD en el diagnóstico y el conocimiento del subtipo de amiloidosis con afección cardiaca.
PacientesSe ha estudiado a 19 pacientes atendidos por AC desde 1996 hasta octubre de 2011 en la Sección de insuficiencia cardiaca y trasplante del servicio de cardiología de nuestro centro. Todos los pacientes siguieron evaluación cardiológica que incluía electrocardiograma y ecocardiograma. Los pacientes evaluados en los últimos años también se sometieron a la realización de resonancia magnética cardiaca cuando no presentaban contraindicaciones para ello.
En todos los casos el diagnóstico final de amiloidosis se realizó mediante biopsia. Si la biopsia de otros tejidos distintos del cardiaco era negativa y la sospecha clínica persistía, la biopsia cardiaca (biopsia endomiocárdica) se hacía necesaria. En 5 casos el diagnóstico de AC se confirmó sobre la pieza del corazón explantado tras la realización del trasplante cardiaco. Se diagnósticó de amiloidosis cardiaca relacionada con la transtiretina (AC-TTR) a 8 pacientes (en 3, hereditaria y en 5, senil) y 11 pacientes de amiloidosis cardiaca por depósito de cadenas ligeras de inmunoglobulina monoclonal (AC-AL).
También se estudió a 2 sujetos portadores de mutaciones patogénicas en el gen TTR (Glu89Lys y Val122del, respectivamente) que eran familiares de primer orden de pacientes con AC demostrada y que en el momento del estudio no presentaban síntomas ni sospecha de AC.
Como controles externos, se utilizó a los pacientes que acudieron al servicio de medicina nuclear para la realización de una gammagrafía ósea por otros motivos (predominantemente oncológicos, incluidos pacientes con mieloma múltiple; representan un volumen de más de 4.000 pacientes anuales), a los que se realizó el estudio aleatoriamente con 99mTc-DPD o 99mTc-metilendifosfonato (99mTc-MDP).
Protocolo gammagráficoLa preparación del 99mTc-DPD y su control de calidad se llevaron a cabo según las instrucciones descritas por el fabricante (Teceos®, CIS Bio International; Gif-sur-Yvette, France). La pureza radioquímica de la preparación fue del 98 ± 1% (97-99,1%).
A todos los pacientes se les administró 740 MBq de 99mTc-DPD por vía intravenosa, y a las 3 h se obtuvieron imágenes de cuerpo completo en proyecciones anterior y posterior y selectivas del área cardiaca en proyecciones anterior, oblicua anterior izquierda de 45° y lateral izquierda. A todos los pacientes se les practicó una tomografía por emisión monofotónica (SPECT) de tórax pero, dado que estas se obtuvieron con distintas tomogammacámaras SPECT (4 en total) y con distintos protocolos de adquisición y procesado, preferimos no valorar estas imágenes en el presente estudio. Las imágenes se obtuvieron con los siguientes parámetros: a) imagen de cuerpo completo, colimador LEHR, matriz 512 × 256, 3.000 Kc, y b) imágenes selectivas cardiacas, colimador LEHR, matriz 256 × 256, 1.000 Kc, zoom 1,3.
Dos observadores médicos nucleares con amplia experiencia en la evaluación de estudios cardiológicos analizaron visualmente las imágenes, en escala de grises. Las discrepancias se resolvieron por consenso.
En cada una de las exploraciones se valoró, por un lado, la existencia y la intensidad del depósito en el miocardio y, por otro, su distribución. Además, se valoró la relación en la distribución del radiotrazador entre las estructuras óseas y las partes blandas como índice de su adecuado aclaramiento y de la calidad de la imagen.
La intensidad del depósito se graduó según una escala visual de puntuación de 0 a 3, en la que la ausencia de captación se valoró con puntuación 0; la captación menor que hueso (referido como la costilla adyacente), con 1; similar a hueso, 2 y mayor captación que el hueso, 3. La distribución del depósito en el miocardio se valoró como depósito focal, depósito difuso, depósito en un segmento de la pared ventricular, depósito difuso ventricular o depósito difuso biventricular. La relación de captación entre el hueso y el fondo se graduó en 0 cuando el fondo y hueso eran muy similares y 1 cuando el hueso era más o mucho más captante que el fondo.
Todos los pacientes fueron invitados a repetir el estudio utilizando 99mTc-MDP y se obtuvieron imágenes según los mismos protocolo y criterios de interpretación.
Estudio anatomopatológico y genéticoLos fragmentos de biopsia o del corazón explantado se estudiaron mediante tinción con rojo Congo y tioflavina para determinar la presencia de amiloide y con técnicas inmunohistoquímicas para determinar el componente P, amiloide A, amiloide B, transtiretina y cadenas kappa y lambda de inmunoglobulina humana.
Todos los pacientes con AC-TTR, excepto la paciente número 13, fueron sometidos a estudio genético para diferenciar entre la amiloidosis TTR hereditaria y la senil.
Análisis estadísticoLa validez diagnóstica de la prueba se determinó a partir del diseño de una tabla 2 × 2 estableciendo la proporción de verdaderos positivos, falsos positivos, verdaderos negativos y falsos negativos, con los estimadores de validez diagnóstica (sensibilidad, especificidad, valor predictivo positivo y negativo) y sus respectivos intervalos de confianza utilizando el software informático adecuado (Epidat v. 3.1)
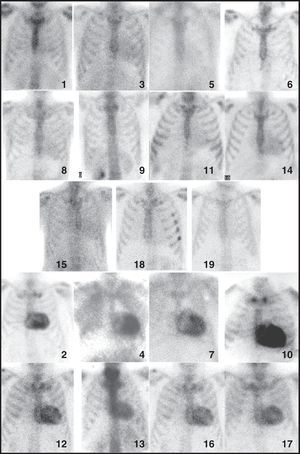
ResultadosLos hallazgos se resumen en la Tabla 1 y la Figura 1.
Tabla 1. Resultados
| Paciente | Sexo | Edad (años al diagnóstico) | Tipo de amiloidosis | Lugar de la biopsia | 99mTc-DPD | 99mTc-MDP | Paraproteína monoclonal |
| 1 | Mujer | 53 | AC-AL | BEM | 0 | 0 | IgM κ |
| 2 | Varón | 94 | AC-TTR s | BEM | 3, BV | 0 | IgG κ * |
| 3 | Mujer | 81 | AC-AL | COR, SAL, HIG, REN | 1, DIF | 0 | IgG λ |
| 4 | Varón | 61 | AC-TTR h | COR, PUL, C-R | 3, BV | 0 | No |
| 5 | Mujer | 46 | AC-AL | COR, BEM | 1, DIF | 0 | IgG κ |
| 6 | Mujer | 66 | AC-AL | C-R | 0 | 0 | IgG λ |
| 7 | Varón | 83 | AC-TTR s | SAL | 3, BV | 0 | No |
| 8 | Varón | 42 | AC-AL | BEM, C-R, PUL | 0 | 0 | IgG λ |
| 9 | Mujer | 61 | AC-AL | ABDOM | 0 | 0 | IgG λ |
| 10 | Varón | 53 | AC-TTR h | COR, HIG | 3, BV | 0 | No |
| 11 | Varón | 55 | AC-AL | COR, HIG | 1, DIF | 0 | IgG λ |
| 12 | Varón | 82 | AC-TTR s | BEM | 3, BV | 0 | No |
| 13 | Mujer | 52 | AC-TTR h | BEM, REN | 3, BV | 0 | No |
| 14 | Varón | 53 | AC-AL | MO | 1, DIF | 1, DIF | IgG λ |
| 15 | Mujer | 59 | AC-AL | BEM | 1, DIF | 1, DIF | IgG λ |
| 16 | Varón | 82 | AC-TTR s | BEM | 3, BV | 0 | No |
| 17 | Varón | 82 | AC-TTR s | BEM | 3, BV | 0 | No |
| 18 | Varón | 53 | AC-AL | BEM | 0 | 0 | IgG λ |
| 19 | Mujer | 66 | AC-AL | REN | 0 | 0 | IgG λ |
ABDOM: abdomen-peritoneo; AC-AL: amiloidosis cardiaca por depósito de cadenas ligeras de inmunoglobulina monoclonal; AC-TTR: amiloidosis cardiaca relacionada con depósito de transtiretina (h: hereditaria; s: senil); BEM: biopsia endomiocárdica; BV: biventricular; COR: corazón explantado; C-R: colorrectal; DIF: difuso; DPD: ácido 3,3-difosfono-1,2-propanodicarboxílico; HIG: hígado; MDP: metilendifosfonato; MO: médula ósea; PUL: pulmón; REN: renal; SAL: glándula salival menor.
La intensidad del depósito se graduó según una escala visual de puntuación de 0 a 3, en que la ausencia de captación se valoró con 0; la captación menor que hueso (referido como la costilla adyacente), 1; similar a hueso, 2 y mayor captación que el hueso, 3.
* Se trataba de un pico monoclonal de significado incierto y la biopsia de medula ósea descartó discrasia sanguínea.
Figura 1. Imágenes gammagráficas de la proyección anterior del tórax obtenidas con 99mTc-DPD de todos los pacientes del estudio. El número indica el paciente según la tabla.
Ninguno de los pacientes que sirvieron como controles externos mostraron depósito (grado 0) apreciable en el área cardiaca, tanto con 99mTc-DPD como con 99mTc-MDP.
Todos (8) los pacientes del grupo A (AC-TTR) presentaron un intenso depósito (grado 2-3) de 99mTc-DPD en el área cardiaca y su distribución siguió en todos los casos un patrón de distribución biventricular (Figura 1, Figura 2). En ninguno de ellos se evidenció depósito cardiaco con 99mTc-MDP (Figura 3).
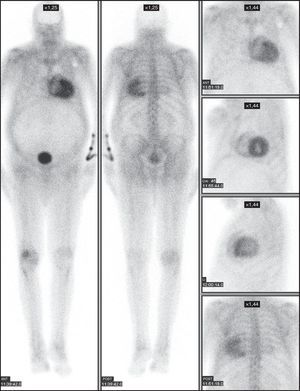
Figura 2. Paciente n.o 7. Varón de 83 años con amiloidosis cardiaca relacionada con la transtiretina diagnosticado por biopsia salival que muestra el característico depósito biventricular. Obsérvese la distribución del depósito tanto en la pared miocárdica del ventrículo izquierdo como en la del derecho. ANT: anterior; Li: lateral izquierda; OAI: oblicua anterior izquierda; POST: posterior.
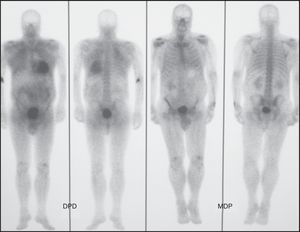
Figura 3. Paciente n.o 4. Varón de 61 años con amiloidosis cardiaca relacionada con la transtiretina diagnosticada por biopsia endomiocárdica que presenta intenso depósito cardiaco (grado 3) con 99mTc-DPD y ausencia (grado 0) con 99mTc-MDP. DPD: ácido 3,3-difosfono-1,2-propanodicarboxílico; MDP: metilendifosfonato.
En el grupo B (AC-AL), 6 pacientes no mostraron depósito apreciable (grado 0) en el área cardiaca con 99mTc-DPD, mientras que 5 mostraron depósito difuso de grado 1 (Figura 1). Sólo en un caso (paciente 14) se obtuvo depósito en el área cardiaca con 99mTc-MDP, que era de distribución difusa, similar a lo observado con 99mTc-DPD pero claramente de menor intensidad.
Ninguno de los 2 sujetos sin signos de AC pero portadores de mutaciones patogénicas en el gen TTR (familiares de pacientes con AC hereditaria por TTR) mostraron captación miocárdica con 99mTc-DPD.
Al analizar los resultados obtenidos, se observa que, para la existencia de depósito de 99mTc-DPD de intensidad moderada-intensa (grados 2-3) y de distribución biventricular, se obtienen valores de sensibilidad del 100% (intervalo de confianza del 95% [IC95%], 93,75-100%), especificidad del 100% (IC95%, 95,45-100%), valor predictivo positivo del 100% (IC95%, 93,75-100%), valor predictivo negativo del 100% (IC95%, 95,45-100%), y exactitud diagnóstica (valor general de la prueba) de 1 (100%) (IC95%, 97,37-100%) en la detección de los pacientes con AC-TTR, y además se obtiene una concordancia observada del 100% y un valor del coeficiente kappa de +1.
Las concordancias interonbservador e intraobservador entre los dos expertos en medicina nuclear que evaluaron los estudios (FJHM y ASL) fueron del 100%.
DiscusiónLas amiloidosis constituyen un grupo heterogéneo de enfermedades en las que hay depósito extracelular de fibrillas anormales insolubles compuestas por diferentes subunidades de bajo peso molecular (entre 5 y 25 kDa). Al examen anatomopatológico, los depósitos amiloides aparecen como material hialino que se tiñe con distintos colorantes como el rojo Congo (da refringencia verde bajo luz polarizada), tioflavina T (produce una intensa fluorescencia amarillo-verdosa) y con azul alcián (da una tinción verde).
Las amiloidosis se pueden clasificar en formas sistémicas o localizadas según se produzcan los depósitos en múltiples órganos, paredes vasculares y tejido conectivo o el depósito se circunscriba a un solo órgano o tejido3.
Aunque varios tipos de amiloide pueden infiltrar el corazón, sólo algunas proteínas amiloidóticas, de las más de 20 conocidas, producen afección cardiaca. Estas se corresponden con las variedades senil, la secundaria tipo AA, la primaria tipo AL y algunas formas hereditarias (como la ATTR, AApoA-I y AFib); las más frecuentes son las debidas a las formas AL y TTR (ya sea la forma hereditaria, ya la senil)4.
Las características clínicas de la afección cardiaca son similares en todas ellas y están determinadas por el patrón infiltrativo que afecta tanto a la función contráctil como al flujo vascular y la conducción. Por lo tanto, la clínica cardiaca está dominada por la aparición de insuficiencia cardiaca diastólica, angina, síncopes o presíncopes y arritmias5.
Se considera que cada tipo de amiloidosis con afección cardiaca representa una entidad diferente, ya que suponen evolución, tratamiento y pronóstico diferentes y, en el caso de las amiloidosis debidas a un defecto genético, tiene gran trascendencia para los familiares6, 7. Por ello es fundamental conocer el subtipo de amiloidosis de cada paciente concreto.
Tradicionalmente la ecocardiografía se ha considerado el método de elección para el diagnóstico no invasivo de la cardiomiopatía amiloidótica8, 9. En los últimos años, la resonancia magnética cardiaca se emplea cada vez más para la evaluación de la afección cardiaca de estos pacientes10, 11, 12, 13. Sin embargo, ninguna de estas técnicas de imagen permite determinar la composición de los depósitos amiloides, que sólo se puede distinguir en el estudio histopatológico10.
La confirmación diagnóstica de AC requiere la demostración de depósito amiloide en una biopsia, si bien esta no tiene que ser necesariamente cardiaca si hay otros órganos distintos del corazón afectados (siempre y cuando existan datos típicos de afección cardiaca en las pruebas de imagen), aunque es la biopsia cardiaca lo que asegura una sensibilidad del 100% para la detección de la enfermedad14.
La detección no invasiva de la afección cardiaca en el curso de una amiloidosis se ha investigado con numerosos radiotrazadores15 con base en la detección de distintos mecanismos fisiológicos alterados por la infiltración miocárdica, como la alteración de la inervación, del metabolismo o de la perfusión miocárdicas, la lesión de la membrana del miocito o la alteración de la función ventricular.
Sin embargo, para detectar el depósito amiloide se han usado fundamentalmente tres grupos de radiotrazadores: componente P de amiloide sérico (SAP) marcado con 123I, aprotinina marcada con 99mTc y los trazadores óseos marcados con 99mTc; los más utilizados son 99mTc-pirofosfato (99mTc-PYP) y 99mTc-MDP.
Dado que el marcador del SAP no está disponible comercialmente (sólo lo está en algunos centros de todo el mundo), que tiene poca sensibilidad en los pacientes con amiloidosis TTR y que, además, no permite caracterizar los depósitos en estructuras dinámicas como el corazón, su utilidad en la AC es muy limitada16, 17, 18.
Con aprotinina marcada con 99mTc los resultados han sido prometedores, pero la experiencia es escasa y, como importante limitación, no es posible realizar un seguimiento de la cantidad de depósito presente, especialmente en el miocardio15, 19, 20, 21.
La utilización de la gammagrafía con compuestos fosfonados para la detección del daño miocárdico se conoce desde hace tiempo. En las últimas tres décadas, se ha descrito ampliamente la captación de radiotrazadores óseos marcados con 99mTc en la AC, tanto en la AL como en la TTR22, 23, 24, 25, 26, 27, con unos resultados bastante heterogéneos y sensibilidad y especificidad sujetas a un amplio debate.
Se puede afirmar que con la aparición del artículo de Puille et al en 200228 se inicia un nuevo periodo en la detección gammagráfica del depósito amiloide con la utilización de 99mTc-DPD en pacientes con AC-TTR. Desde este pionero trabajo, han sido diversas las publicaciones en relación con el tema, y Perugini et al29 incluso llegan a proponer la gammagrafía con 99mTc-DPD como una técnica interesante para distinguir entre los depósitos cardiacos de AC-TTR frente a los de AC-AL. Según estos autores, los corazones de los pacientes con AC-TTR (ya sea hereditaria, ya senil) captarían 99mTc-DPD, mientras que los de aquellos con AC-AL no lo captarían. Otros autores, como Selvanayagam et al30 no comparten esta propuesta, y señalan la escasez de casos publicados y la falta de evidencia en la existencia de un mecanismo molecular que posibilite la unión entre los trazadores óseos y el depósito amiloide lo que conlleva cierto grado de inconsistencia a la luz de lo conocido hasta el presente31, 32.
Tras varios años aplicando esta técnica, en el presente trabajo encontramos que la captación miocárdica selectiva de 99mTc-DPD tiene una exactitud del 100% para la diferenciación entre la AC-TTR y la AC-AL, lo que corrobora lo propuesto por Peruggini et al29. Nuestro trabajo también muestra que, cuando la captación es intensa o nula, nos permite discriminar efectivamente las dos etiologías, pero que casi la mitad (el 45%, 5 de 11 pacientes) de los sujetos con amiloidosis AL presentan ligera (grado 1) captación cardiaca. Esta ligera captación podría explicarse por la persistencia del radiotrazador en la circulación sanguínea (pool vascular) secundaria al escaso aclaramiento producido por la insuficiencia cardiaca y la retención de líquidos, y no por un verdadero depósito en el miocardio. La aparición de similares hallazgos, aunque de menor intensidad, en la imagen obtenida con 99mTc-MDP en uno de nuestros pacientes (Figura 3, paciente 4) y la desaparición del depósito trascurrido más tiempo desde su administración (Figura 4, paciente 14) nos permitiría afirmar la inespecificidad de dicho depósito.
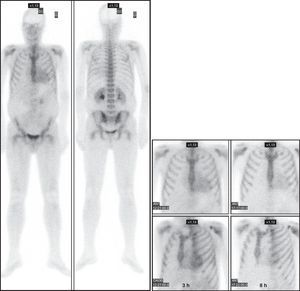
Figura 4. Paciente n.o 14. Varón de 46 años con amiloidosis cardiaca por depósito de cadenas ligeras de inmunoglobulina monoclonal que muestra ligero depósito difuso cardiaco (grado 1). Obsérvese su desaparición (grado 0) al trascurrir más tiempo tras la administración del radiotrazador. ANT: anterior; OAI: oblicua anterior izquierda.
Por otro lado, es importante destacar que la mera existencia de depósito cardiaco con 99mTc-DPD no es el dato de valor diagnóstico, sino la intensidad y su distribución en la pared cardiaca, es decir, que es la existencia de un intenso depósito biventricular (Figura 1) o al menos ventricular lo que tiene valor diagnóstico.
El mecanismo íntimo de la unión del bisfosfonato al amiloide no ha sido dilucidado. Los primeros trabajos indicaban la existencia de altas concentraciones de calcio en el tejido amiloide y se planteó la posibilidad de que el radiotrazador, con gran avidez por el calcio, se depositara en el amiloide de forma similar a como ocurre en las calcificaciones33. También se ha postulado la cantidad de depósito amiloide presente en el miocardio como causa de que haya o no depósito de los bisfosfonatos. Esta idea quedó refutada al observarse ausencia de relación entre la masa miocárdica y la presencia de depósito tanto en estudios ecocardiográficos como con radiotrazadores29.
La aparente preferencia del 99mTc-DPD por la AC-TTR frente a la AC-AL en la afección cardiaca es todavía un misterio. Nuestro estudio muestra como en todos los pacientes con AC-TTR hay depósito de 99mTc- DPD y no hay depósito de 99mTc-MDP. Diversos investigadores abogan por la posibilidad de que se deba a una concentración de calcio particularmente alta en el miocardio en este subgrupo de amiloidosis, secundaria a la diferente composición de las fibrillas amiloideas, y que estas tengan diferentes afinidades a los bisfosfonatos34. Esta hipótesis explicaría los heterogéneos resultados obtenidos históricamente con los distintos fosfonatos empleados (MDP, HDP, PYP) tanto para diagnóstico de la enfermedad como para diferenciar entre los tipos de amiloidosis.
Un detalle que queremos destacar y nos parece interesante es que los dos sujetos estudiados que eran familiares de pacientes con AC hereditaria por TTR demostrada no presentaban depósito miocárdico, aun siendo portadores de mutaciones patogénicas en el gen TTR. Dado que los dos sujetos no tenían datos de afección cardiaca, este detalle puede indicar que, para que se produzca el depósito gammagráfico, debe haber un depósito significativo de amiloide en el miocardio.
Como la AC es una enfermedad poco frecuente y difícil de reconocer, la mayor parte de los trabajos publicados presentan un número de casos pequeño. Nuestro trabajo también tiene esta limitación, ya que el número de casos de AC recogidos en un solo centro es siempre escaso, aunque su recogida se prolongue en el tiempo. Tan sólo el trabajo recientemente publicado por Rapezzi et al34 recoge un número de casos importante, y no casos únicos como la mayor parte de lo publicado. A diferencia de otros trabajos, en el nuestro, el tipo de amiloidosis queda claramente documentado anatomopatológicamente, y creemos que sumando más casos a la literatura ayudamos a clarificar los escenarios de confusión a los que han contribuido trabajos que muestran casos únicos y/o no especifican el tipo de AC presente y que es la base sobre la que se sustentan, y con razón, las críticas señaladas, entre otros, por Selvanayagam et al32.
ConclusionesLa gammagrafía cardiaca con 99mTc-DPD es una útil herramienta para el diagnóstico diferencial entre la AC-TTR y la AC-AL en pacientes con AC documentada. En pacientes con AC, una gammagrafía con 99mTc-DPD que muestra un intenso depósito cardiaco y este es biventricular indica el diagnóstico de AC-TTR, mientras que una gammagrafía con 99mTc-DPD negativa lo descarta.
Conflicto de interesesNinguno.
Recibido 18 Octubre 2011
Aceptado 11 Diciembre 2011
Autor para correspondencia: Servicio de Medicina Nuclear, Hospital Universitario Puerta de Hierro, Manuel de Falla 2, 28222 Majadahonda, Madrid, España. fjdeharo.hpth@salud.madrid.org