El objetivo lipídico principal de tratamiento es el control del colesterol unido a lipoproteínas de baja densidad. Para los pacientes de muy alto riesgo, el objetivo terapéutico es < 70mg/dl y para los de alto riesgo, < 100mg/dl. Aunque hay evidencia de que el colesterol no unido a lipoproteínas de alta densidad o la determinación de apolipoproteína B ofrecen mayor valor predictivo de la incidencia de cardiopatía isquémica, las guías actuales no los consideran objetivos terapéuticos principales porque no se cuenta con ensayos clínicos específicamente diseñados con este fin. Las lipoproteínas ricas en apolipoproteína A, que son fundamentalmente las lipoproteínas de alta densidad, tienen un papel protector contra la aterosclerosis. Se considera que valores de colesterol unido a lipoproteínas de alta densidad < 40mg/dl son un potente factor de riesgo cardiovascular, pero son un objetivo terapéutico secundario.
Palabras clave
Las enfermedades cardiovasculares siguen siendo la primera causa de muerte en el mundo, especialmente la cardiopatía isquémica1. Aunque los factores de riesgo de las enfermedades cardiovasculares están claramente descritos, también se ha observado que existe un claro efecto diferencial en relación con la aparición de complicaciones clínicas en los diferentes territorios vasculares. Así, la hipertensión arterial es el principal factor de riesgo en la incidencia de accidente cerebrovascular2, pero tiene menor impacto en la enfermedad arterial periférica o la cardiopatía isquémica. Sin embargo, la dislipemia se ha identificado como el factor de riesgo que conlleva mayor riesgo de sufrir cardiopatía isquémica3,4. Es más, se ha observado que la mortalidad por cardiopatía isquémica se relaciona directamente con los valores séricos de colesterol unido a lipoproteínas de baja densidad (cLDL)5,6. Es llamativo que esta relación no parece tener un umbral inferior a partir del cual deje de haber beneficio y aparezca un aumento del riesgo cardiovascular, el denominado efecto de «curva en J», como se ha descrito ampliamente para la mayoría de las variables biológicas como la glucemia7,8, la presión arterial9,10 o el índice de masa corporal11,12.
Estos hallazgos han llevado a que en las últimas décadas se haya ido rebajando progresivamente el valor de cLDL que se recomienda alcanzar, que es el objetivo terapéutico principal en el tratamiento de los lípidos13–16. Las guías actuales también reconocen que la hipertrigliceridemia y el colesterol unido a lipoproteínas de alta densidad (cHDL) son factores de riesgo independientes, pero se los considera un objetivo terapéutico secundario16,17. El cHDL parece tener un papel decisivo en la prevención cardiovascular primaria, pero no parece tan relevante en la prevención secundaria18.
Lipoproteínas y aterosclerosisLDL y lipoproteínas ricas en apolipoproteína BEl concepto clásico de la iniciación, progresión e inestabilización de la aterosclerosis se basa en el desequilibrio entre las lipoproteínas ricas en apolipoproteína B (apoB) y las ricas en apolipoproteína A (apoA)19,20. Las lipoproteínas que contienen apoB son principalmente las LDL, los quilomicrones y las lipoproteínas de muy baja densidad (VLDL); por el contrario, la apoA se encuentra fundamentalmente en las HDL. Por lo tanto, el cálculo del cociente apoB/apoA supone un análisis bastante completo y lógico del poder aterogénico del perfil lipídico y, además, se ha demostrado como uno de los principales predictores de la incidencia de infarto agudo de miocardio3. Sin embargo, la medición directa de apoB tiene dos problemas fundamentales: a) su disponibilidad es muy reducida actualmente en la práctica clínica, y b) no se ha diseñado ningún ensayo directamente para analizar el efecto de su reducción en la prevención cardiovascular. Por estos motivos, las guías de 2011 de la Sociedad Europea de Cardiología y la Sociedad Europea de Aterosclerosis16 otorgaron una recomendación tipo IIa (nivel de evidencia B) a la determinación de apoB y las guías de prevención cardiovascular de la Sociedad Europea de Cardiología de 201217 no recomiendan su determinación sistemática.
Los valores plasmáticos de cLDL y cHDL intervienen con acciones opuestas en la iniciación, progresión e inestabilización de las placas ateroscleróticas, de tal forma que el desequilibrio a favor de los primeros promueve el desarrollo de aterosclerosis, mientras que los segundos actúan como factor protector21,22. Hay ensayos prospectivos aleatorizados con estatinas y registros observacionales que han demostrado la relación directa de las cifras de cLDL con la enfermedad coronaria, así como la relación entre los valores alcanzados con el tratamiento y la recurrencia de eventos23,24. Sin embargo, algunos estudios han puesto de manifiesto que los valores de cHDL pueden modificar el efecto del cLDL en la incidencia de las enfermedades cardiovasculares incluso con valores de cLDL bajos24,25; estos datos indican que la ausencia del efecto protector del cHDL, incluso en ausencia de factores de riesgo, puede tener un papel fundamental en la aparición de complicaciones aterotrombóticas, lo que aumenta el interés pronóstico y terapéutico del cHDL.
El mecanismo por el cual las lipoproteínas ricas en apoB promueven la aterosclerosis se inicia por su penetración en la pared arterial, promovido por las concentraciones séricas elevadas. Una vez dentro de la íntima arterial, sufren un proceso de oxidación que supone el inicio de la mayoría de los procesos implicados con la disfunción endotelial, base de la aterosclerosis, que se potencia por la presencia de otros factores de riesgo cardiovascular y facilita que diferentes agentes inflamatorios y aterogénicos atraviesen el endotelio. Los macrófagos son los principales agentes encargados de fagocitar las LDL oxidadas, y posteriormente se convierten en células espumosas mediante mecanismos de apoptosis al ser incapaces de metabolizar el colesterol que contienen; como consecuencia se producen dos fenómenos fisiopatológicos muy relevantes: a) la liberación de colesterol dentro de la pared arterial que se incorpora al core lipídico de la placa, y b) la quimiotaxis de moléculas inflamatorias y trombóticas19,26.
Además de los valores séricos de cLDL elevados, existen también características cualitativas de estas partículas que son facilitadoras del proceso aterotrombótico. Concretamente, las partículas más pequeñas y densas, claramente relacionadas con la resistencia insulínica y la diabetes mellitus27, tienen un poder de penetración superior a través del endotelio vascular y son más susceptibles a la oxidación28. La resistencia insulínica y los valores séricos elevados de cLDL o triglicéridos (TG) activan la enzima colesteriltransferasa, encargada de transferir el contenido de TG de las HDL hacia lipoproteínas ricas en apoB, lo que conlleva que las LDL adquieran mayor densidad y menor tamaño, el denominado fenotipo B. Este fenotipo de partículas LDL tiene mayor capacidad aterogénica y se ha demostrado que tiene una asociación independiente con mayor afección vascular y complicaciones cardiovasculares27,29.
Ante estos datos, la relevancia cuantitativa y cualitativa de las lipoproteínas ricas en apoB parece determinante en el inicio y la progresión de la aterosclerosis. De hecho, estudios poblacionales han demostrado que la determinación directa de la concentración de apoB o de colesterol no-HDL, que se obtiene restando al colesterol total los valores de cHDL y estima el total de lipoproteínas ricas en apoB, son tan buenos predictores de la incidencia de enfermedad cardiovascular como los valores de cLDL o incluso mejores30. De hecho, la correlación de los valores de apoB es con los de colesterol no-HDL, más que con los de cLDL31. El colesterol no-HDL refleja la carga de lipoproteínas aterogénicas y además sigue una distribución interesante, puesto que se ha descrito que, cuanto mayores son los valores séricos de colesterol total, no se produce una elevación paralela de LDL, pero sí del resto de lipoproteínas ricas en apoB, como las VLDL y otras lipoproteínas ricas en triglicéridos; este cambio porcentual es más marcado aún en situaciones de resistencia insulínica, diabetes mellitus u obesidad32. Además, asociado al aumento de lipoproteínas ricas en apoB, se observan valores progresivamente menores de cHDL, la denominada hipercolesterolemia combinada.
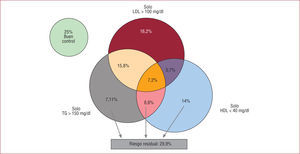
La importancia del colesterol no-HDL ha ido en incremento gracias a la constatación de que su valor predictivo de enfermedad cardiovascular es superior al del cLDL. Un metaanálisis que incluyó a más de 60.000 pacientes tratados con estatinas en estudios de prevención primaria y secundaria demuestra que la reducción de los valores de cLDL por debajo de 100mg/dl, que era el objetivo recomendado por las guías en el momento de diseñarse los estudios incluidos, no se acompaña de reducción de la incidencia de enfermedad cardiovascular si no se acompaña de reducciones del colesterol no-HDL por debajo de 130mg/dl6; estos resultados se observaron analizando por separado los estudios de prevención primaria y secundaria, en los pacientes diabéticos y en los demás subgrupos. Otro hallazgo importante de este metaanálisis es que solo cerca del 60% de los pacientes que recibieron estatinas alcanzaron valores de cLDL<100mg/dl y de colesterol no-HDL<130mg/dl, lo que refleja las carencias de los tratamientos actualmente disponibles para el completo control del perfil lipídico y explica la incidencia de complicaciones cardiovasculares a pesar del estricto control del cLDL. Este concepto se ha denominado riesgo residual lipídico33 y se ha observado que es especialmente elevado en los pacientes de alto riesgo cardiovascular34. En un registro de pacientes con cardiopatía isquémica realizado en España, en el que el 94,1% estaba en tratamiento intensivo con estatinas, se observó que únicamente el 55% tenía cLDL<100mg/dl y, de estos, un elevado porcentaje tenía cHDL<40mg/dl y/o TG>150mg/dl, es decir, riesgo residual lipídico (fig. 1)35. En total, el 30% de los pacientes tenían este riesgo residual que se asociaba de manera independiente al sexo masculino y el diagnóstico de diabetes mellitus.
HDL y lipoproteínas ricas en apoALas HDL desempeñan un claro papel protector contra la aterosclerosis mediante la inhibición de algunos mecanismos patogénicos de las LDL36 u otros agentes inflamatorios37, pero especialmente mediante el transporte inverso de colesterol16,17,19. Estos efectos son tan relevantes que diversos estudios han puesto de manifiesto que los valores de cHDL pueden modificar el consabido efecto de las LDL en la incidencia de las enfermedades cardiovasculares24,25,38 o ser incluso mejor predictor en el caso de la prevención primaria4,39. A diferencia de las LDL, las HDL son partículas complejas y con diferentes fenotipos no conocidos del todo, lo cual las convierte en un objetivo creciente para la investigación lipidológica.
El transporte inverso de colesterol ejercido por las HDL se basa en la capacidad de captar el colesterol intravascular, especialmente desde los macrófagos, y los tejidos periféricos para conducirlo al hígado para su posterior eliminación por vía biliar. Dentro de las vías metabólicas implicadas en la captación de colesterol por las partículas de HDL, parece ser determinante la denominada capacidad de transferencia (efflux capacity); esta actividad se ha medido en sujetos sanos y controles con enfermedad cardiovascular manifiesta y se asocia de manera independiente y muy negativa con la presencia de enfermedad cardiovascular40. Estos hallazgos, añadidos a la ausencia de beneficio cardiovascular asociado al aumento de HDL con algunos fármacos41,42, reflejan el papel crítico que desempeña la funcionalidad de las HDL más allá de sus concentraciones séricas36; sin embargo, hasta el momento, estos datos se limitan a la investigación y reflejan la necesidad de mejorar el conocimiento sobre estas lipoproteínas. Igualmente, se han identificado determinadas mutaciones genéticas que conducen a valores más elevados de HDL pero no se asocian a menor riesgo de enfermedad cardiovascular43. Lo que sí está claramente descrito es que las cifras de apoA y cHDL se correlacionan de forma muy positiva31.
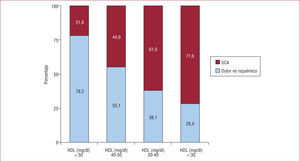
La presencia de cHDL bajo es muy frecuente en los pacientes que sufren una complicación cardiovascular aguda. En el análisis de las diferencias en el perfil lipídico de los pacientes ingresados en un único centro por dolor torácico, se observó que los dados de alta con diagnóstico de dolor torácico no coronario tras descartarse isquemia miocárdica aguda tenían cHDL un 22% más elevado (44,5 frente a 36,1mg/dl; p<0,01) que los pacientes diagnosticados de síndrome coronario agudo4; este hecho se reflejó en una prevalencia mucho menor de cHDL bajo (< 40mg/dl): el 30,6 frente al 69,4% (p<0,01). Por el contrario, no se observaron diferencias en los valores séricos de cLDL entre ambos grupos. El análisis multivariable demostró una asociación independiente y robusta entre cHDL bajo y diagnóstico de síndrome coronario agudo. Además, se observó que cuanto menor era el valor medio de cHDL, mayor era la prevalencia de síndrome coronario agudo (fig. 2).
Respecto al metabolismo de las HDL, hay evidencia clara de que, tras la captación de colesterol y antes de unirse a su receptor hepático, sufren un proceso de maduración y estabilización posterior que puede variar ampliamente en función de las señales metabólicas y las necesidades energéticas periféricas19. En primer lugar, la estabilidad intracelular se consigue por la acción de la enzima lecitina-colesterol aciltransferasa (LCAT), que cataboliza las moléculas de colesterol intracelular y las hace más estables. Por otra parte, la proteína de transferencia de ésteres de colesterol (CETP) facilita la transferencia de estos hacia lipoproteínas ricas en apoB en caso de que se precise mayor aporte tisular de colesterol; por lo tanto, la acción de esta enzima iría en contra del transporte inverso de colesterol, motivo por el cual se han desarrollado fármacos que inhiben directamente esta enzima y producen elevaciones muy importantes de cHDL41.
Es importante destacar que existe una relación clara e inversa entre los valores séricos de cHDL y TG32. La concomitancia de valores bajos de cHDL y elevados de TG se explica por la activación de diferentes vías metabólicas hepáticas, adipocitarias y tisulares claramente desencadenadas por resistencia insulínica, diabetes mellitus y patrones dietéticos ricos en grasas44–46. Esta relación entre ambas lipoproteínas refleja tantas alteraciones metabólicas y de una forma tan accesible que el cociente TG/HDL se ha propuesto como el mejor marcador de resistencia insulínica47. Además, los valores de cHDL no se correlacionan con los de cLDL, pero sí con el tamaño de estas lipoproteínas48, y la correlación es mayor aún cuando se evalúa con el cociente TG/HDL49.
En sujetos sin enfermedad cardiovascular, se ha observado que el cociente TG/HDL presenta valores muy superiores, en torno al doble, en quienes tienen obesidad u otros componentes del síndrome metabólico46, y esto revelaría que también poseen partículas más pequeñas y densas de cLDL. Además, el análisis de esta amplia muestra de trabajadores sin enfermedad cardiovascular, más de 19.000, permitió aportar puntos de corte específicos para cada sexo a partir de los cuales el diagnóstico de síndrome metabólico es muy elevado, concretamente 2,75 en varones y 1,65 en mujeres. Respecto a la distribución de los valores lipídicos en función de la cantidad de tejido adiposo, también se observó que el cociente TG/HDL era la determinación que mejor definía las diferencias entre los sujetos con peso normal, sobrepeso u obesidad50.
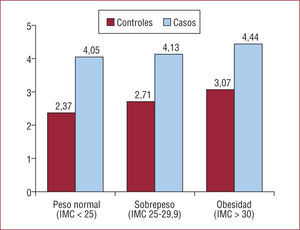
Con el objetivo de analizar el valor pronóstico del cociente TG/HDL, se realizó un estudio de casos y controles analizando la incidencia de un primer infarto agudo de miocardio en varones, recopilando las revisiones de salud laboral de todos los casos registrados en una única empresa y emparejándolos con controles sanos. Con este diseño se pudo demostrar que los sujetos que sufrieron esta complicación tenían valores significativamente superiores en el cociente TG/HDL (4,22 frente a 2,72; p<0,001) independientemente de su índice de masa corporal (fig. 3)51. El análisis multivariable mostró que el cociente TG/HDL aumentaba en un 50% el riesgo de un primer infarto de miocardio (odds ratio [OR]=1,47; intervalo de confianza del 95% [IC95%], 1,26–1,71), mientras que los valores de cLDL obtuvieron un riesgo mucho menor (OR =1,01; IC95%, 1,005–1,012); por cada aumento en una desviación estándar en el cociente TG/HDL, se observó un incremento de 1,75 (IC95%, 1,55–1,97) en el riesgo de un primer infarto agudo de miocardio.
Objetivos terapéuticosPese a toda la complejidad de lipoproteínas presentada, el control de los valores de cLDL es el objetivo fundamental para el tratamiento de la dislipemia. Un gran acierto de las guías de 2011 de la Sociedad Europea de Cardiología y la Sociedad Europea de Aterosclerosis16 fue la consideración del valor recomendado de cLDL en función del riesgo cardiovascular total, recomendación claramente consolidada por el Quinto Grupo de Trabajo sobre Prevención Cardiovascular de la Sociedad Europea de Cardiología de 201217. Como se puede observar en la tabla 1, todas las sociedades científicas reconocen al cLDL como el objetivo terapéutico principal13–17,52,53 y la mayoría de ellas ha reconocido el valor < 70mg/dl para los pacientes de muy alto riesgo16,17.
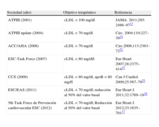
Evolución del objetivo terapéutico en pacientes de muy alto riesgo respecto al tratamiento de los lípidos de las principales sociedades científicas.
| Sociedad (año) | Objetivo terapéutico | Referencia |
| ATPIII (2001) | cLDL<100mg/dl | JAMA. 2011;285: 2486–9713 |
| ATPIII update (2004) | cLDL<70mg/dl | Circ. 2004;110:227–3914 |
| ACC/AHA (2006) | cLDL<70mg/dl | Circ.2006;113:2363–7252 |
| ESC-Task Force (2007) | cLDL<80mg/dlJ. | Eur Heart 2007;28:2375–41415 |
| CCS (2009) | cLDL<80mg/dl, apoB<80mg/fl | Can J Cardiol. 2009;25:567–7953 |
| ESC/EAS (2011) | cLDL<70mg/dl; reducción al 50% del valor basal | Eur Heart J. 2011;32:1769–1816 |
| 5th Task Force de Prevención cardiovascular ESC (2012) | cLDL<70mg/dl; Reducción al 50% del valor basal | Eur Heart J. 2012;33:1635–70117 |
ACC/AHA: American College of Cardiology/American Heart Association; ATPIII: Adult Treatment Panel-III; CCS: Canadian Cardiovascular Society; cLDL: colesterol unido a lipoproteínas de baja densidad; ESC/EAS: European Society of Cardiology/European Atherosclerosis Society.
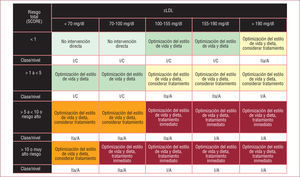
Siguiendo la filosofía tan acertada de otras guías como las de hipertensión arterial54, las guías europeas enfatizan la necesidad de adaptar el objetivo terapéutico de cLDL en función del riesgo cardiovascular total del paciente. En la tabla 2 se presenta la definición de cada categoría de riesgo; merece una mención especial que se incluya la disfunción renal en la categoría de muy alto riesgo. Para los pacientes de muy alto riesgo cardiovascular, se recomienda el objetivo de cLDL < 70mg/dl y para los de alto riesgo, < 100mg/dl; estos objetivos terapéuticos son exigentes, y en función de los valores basales, se recomienda iniciar directamente con tratamiento farmacológico más precozmente que en guías anteriores; en la figura 1 se muestra el esquema básico para el tratamiento en función del riesgo cardiovascular total y los valores de cLDL.
Categorías de riesgo para la elección del objetivo terapéutico.
| Muy alto riesgo | 1. Enfermedad cardiovascular establecida, documentada por técnicas invasivas o no invasivas (angiografía por tomografía, radiología nuclear, ecocardiograma de estrés, placas ateromatosas en ecografía carotídea), infarto de miocardio previo, síndrome coronario agudo, revascularización coronaria o periférica, accidente cerebrovascular isquémico o enfermedad arterial periférica |
| 2. Diabetes mellitus (tipo 1 o 2) con uno o más factores de riesgo cardiovascular y/o lesiones de órgano diana (como la microalbuminuria: 30300mg/24h) | |
| 3. Disfunción renal (filtrado glomerular < 60ml/ min/1,73 m2) | |
| 4. SCORE de riesgo calculado≥10% | |
| Alto riesgo | 1. Elevación marcada de un factor de riesgo cardiovascular, como la hipercolesterolemia familiar o hipertensión |
| 2. SCORE de riesgo calculado≥5 y<10% | |
| Riesgo moderado | 1. SCORE de riesgo calculado≥1 y<5% Esta categoría modifica su riesgo por los antecedentes familiares de enfermedad coronaria, obesidad abdominal, sedentarismo, colesterol unido a lipoproteínas de alta densidad bajo, proteína C reactiva o lipoproteína (a) |
| Riesgo bajo | 1. SCORE de riesgo calculado≥5 y<10% |
En caso de medirse, el objetivo de tratamiento de la apoB es 80mg/ dl en los pacientes de muy alto riesgo y 100mg/dl en los de alto riesgo cardiovascular. Para el colesterol no-HDL, el objetivo terapéutico se establece sumando 30mg/dl al objetivo de cLDL establecido para cada categoría de riesgo; es decir, 100mg/dl para los pacientes de muy alto riesgo y 130mg/dl para los de alto riesgo.
Un punto importante es reconocer que las cifras bajas de cHDL son un factor de riesgo independiente, pero no recomendar su tratamiento específicamente; aunque se reconoce que elevar el cHDL o mantener valores altos es un objetivo secundario, no se establece un objetivo concreto, y la recomendación de valores > 40mg/dl resulta poco precisa. De forma similar ocurre con los triglicéridos, para los que no se establece una recomendación clara y se propone controlar por debajo de 150mg/dl.
Conflicto De InteresesNinguno.