Varios tipos de lipoproteínas, aparte de las lipoproteínas de baja densidad (LDL), tienen relación causal con la enfermedad cardiovascular. Se analizó el perfil lipoproteico avanzado de individuos con metabolismo glucémico normal y alterado provenientes de una región mediterránea.
MétodosEstudio transversal en 929 participantes (463 normoglucémicos, 250 prediabéticos y 216 con diabetes tipo 2) sin insuficiencia renal, enfermedad cardiovascular ni tratamiento hipolipemiante. Se analizaron los perfiles lipoproteicos convencional y avanzado (resonancia magnética [RM] espectroscópica).
ResultadosEn comparación con los varones, las mujeres normoglucémicas mostraron menores concentraciones de triglicéridos y cLDL, menos partículas (P) de LDL y todas sus subclases y menos contenido en colesterol y triglicéridos, mayor concentración de P de lipoproteínas de alta densidad (HDL) y de todas sus variables relacionadas (p ≤ 0,05 para todas las comparaciones). En comparación con los normoglucémicos, los diabéticos mostraron una mayor concentración de P-VLDL grandes y pequeñas (p <0,05), además de una menor concentración de P-HDL totales y medianas (p <0,05). Se halló relación directa del perímetro de la cintura y el fatty liver index con un perfil proaterogénico.
ConclusionesLas mujeres mostraron un mejor perfil lipoproteico avanzado que los varones. Se halló relación directa de los índices de adiposidad relacionados con resistencia insulínica con un perfil lipídico proaterogénico. La RM mostró alteraciones en partículas lipoproteicas distintas de las LDL en los diabéticos, a menudo asociadas con mayor riesgo cardiovascular. Nuestros hallazgos confirman la utilidad del análisis lipoproteico avanzado mediante RM espectroscópica para descubrir nuevas dianas terapéuticas con que prevenir eventos cardiovasculares en los individuos en riesgo.
Palabras clave
La enfermedad cardiovascular (ECV) ateroesclerótica y sus manifestaciones clínicas son la causa principal de morbilidad y mortalidad en el mundo1. Diversos estudios clínicos y genéticos han establecido inequívocamente que las lipoproteínas de baja densidad (LDL) son un factor etiopatogénico en la fisiopatología de la ECV ateroesclerótica2. Se ha demostrado que el tratamiento reductor del colesterol unido a LDL (cLDL) reduce la tasa de eventos de ECV en los pacientes con o sin riesgo cardiometabólico3. Sin embargo, los eventos de ECV siguen teniendo una gran prevalencia en las personas con cLDL bajo o normal, fenómeno conocido como riesgo residual4. En este sentido, estudios recientes han descrito una asociación entre las concentraciones de partículas de diferentes subclases de lipoproteínas, distintas de las LDL, con el riesgo de nuevos eventos de ECV5,6. Así pues, se ha propuesto que el riesgo de ECV puede estar asociado también con mayores concentraciones de lipoproteínas aterogénicas que pueden no ser fácilmente apreciables a través de las concentraciones de cLDL.
Los triglicéridos (TG) son los principales componentes de las lipoproteínas ricas en TG y sus remantentes. Los TG se transportan predominantemente por las lipoproteínas de muy baja densidad (VLDL) y, en menor medida, por sus remanentes durante el ayuno. En el estado posprandial, los TG circulantes se encuentran principalmente en los quilomicrones y sus remanentes (definidos también como lipoproteínas ricas en TG). Hay evidencia concluyente de que los quilomicrones y los remanentes de VLDL tienen gran capacidad proaterógena en virtud de su progresivo enriquecimiento en colesterol7. Hay intensas asociaciones epidemiológicas entre la hipertrigliceridemia y las lipoproteínas ricas en TG y la aparición de nuevos eventos de ECV8. La hipertrigliceridemia de leve a moderada es especialmente frecuente en las personas con trastornos de resistencia insulínica, tales como la obesidad visceral, la diabetes mellitus tipo 2 (DM2) y la enfermedad renal crónica, todas ellas asociadas a su vez con un aumento del riesgo de ECV9. En estas circunstancias, al igual que cuando hay concentraciones de cLDL muy bajas en presencia de TG elevados, la concentración de cLDL calculada o determinada directamente puede subestimar la concentración total de colesterol transportado por las LDL y, lo que es aún más importante, la concentración total de lipoproteínas aterogénicas, con lo cual por lo tanto se subestima el riesgo de ECV ateroesclerótica10. En estos individuos, el fenotipo lipídico característico es un trastorno denominado dislipemia aterogénica, caracterizada por hipertrigliceridemia, aumento en la concentración de partículas de LDL pequeñas y densas, así como concentraciones bajas de colesterol unido a las lipoproteínas de alta densidad (cHDL)11. Este mismo patrón lipídico se da también en otro trastorno clínico asociado con un aumento del riesgo de ECV, la enfermedad de hígado graso no alcohólico (HGNA). Los pacientes con HGNA muestran múltiples alteraciones proaterogénicas en su perfil lipoproteico12. En consecuencia, una evaluación del perfil de lipoproteínas que vaya más allá del actualmente utilizado en la práctica clínica puede ser importante para determinar el riesgo de ECV de las personas con trastornos clínicos como los mencionados, en los que el cLDL no suele estar elevado, y muestra únicamente sutiles defectos en el panel de análisis lipídico ordinario.
Hasta donde sabemos, hay pocos datos en la literatura sobre el perfil lipoproteico de personas con diferentes grados de alteración del metabolismo glucémico (prediabetes o DM2) y de normoglucémicos que vivan en la misma zona geográfica.
El objetivo del presente estudio es analizar las subclases de lipoproteínas séricas y su contenido en colesterol y triglicéridos en personas con metabolismo glucémico normal y alterado de una misma área mediterránea del sur de Europa.
MÉTODOSPoblación del estudioSe identificó a un total de 1.217 participantes, 510 con normoglucemia, 318 con prediabetes y 389 con DM2, de diferentes cohortes de 4 centros participantes pertenecientes a la misma institución sanitaria del norte-nordeste de España. Después de excluir a los participantes que estaban en tratamiento hipolipemiante, se analizó a un total de 929 participantes (463 con normoglucemia, 250 con prediabetes y 216 con DM2). Los grupos de normoglucemia y prediabetes se seleccionaron a partir de 3 estudios transversales publicados con anterioridad13–15 (2 cohortes de hospitales universitarios y 1 cohorte de atención primaria de España). Se seleccionó a los participantes con DM2 de los mismos 2 estudios transversales llevados a cabo en los hospitales universitarios que reclutaron a los participantes con normoglucemia y prediabetes. A los participantes con DM2 se los preseleccionó desde la consulta ambulatoria de uno de los centros participantes y entre los identificados mediante el cribado de pacientes incluidos en el programa de oftalmopatía diabética16. Asimismo, algunos de ellos eran pacientes con DM2 de reciente diagnóstico preseleccionados desde la consulta ambulatoria del servicio de endocrinología14.
Los criterios de inclusión para los 3 grupos (normoglucémico, prediabético y DM2) fueron: ausencia de insuficiencia renal crónica (definida como una tasa de filtrado glomerular estimada [TFGe] <60ml/min/1,73 m2) y ausencia de cardiopatía conocida (definida como cualquier tipo de enfermedad arterial periférica, ictus, insuficiencia cardiaca o enfermedad coronaria, incluidos el infarto de miocardio previo y la angina o los antecedentes de revascularización coronaria percutánea o mediante cirugía de derivación). Los criterios de exclusión fueron el tratamiento hipolipemiante activo (definido como prescripción de estatinas o fibratos) o un diagnóstico de diabetes mellitus tipo 1 (DM1) o la sospecha de cualquier otro tipo específico de diabetes secundaria a defectos genéticos, endocrinopatías, disfunción pancreática exocrina o diabetes inducida por productos químicos.
Se registraron las características de los participantes y los parámetros antropométricos y analíticos (glucosa, HbA1c, TG, cHDL y cLDL, creatinina, TFGe, alanina transaminasa [ALT], aspartato transaminasa [ASTA], gamma-glutamiltransferasa [GGT], insulina y evaluación de modelo homeostático de resistencia insulínica [HOMA-IR]). Para evaluar la posible presencia de HGNA, se calculó también el índice de hígado graso (FLI) de todos los participantes en el estudio. Se consideró que un FLI>60 indica HGNA.
Este estudio se llevó a cabo cumpliendo lo establecido en la Declaración de Helsinki y fue aprobado por los comités de ética y de investigación clínica locales. Todos los participantes firmaron un consentimiento informado por escrito.
Diagnóstico de la diabetes y la prediabetesEn el presente estudio el diagnóstico de diabetes se estableció aplicando los criterios de la American Diabetes Association. La prediabetes se definió también según los criterios establecidos por la American Diabetes Association17. Se consideró prediabético a cualquier participante que cumpliera 1 de los 2 criterios siguientes: a) alteración de la glucosa plasmática en ayunas, definida como un valor entre 100 y <126mg/dl (5,55-6,99 mmol/l), o b) concentraciones de HbA1c del 5,7-<6,5% (39-48 mmol/mol). Todos los participantes del grupo normoglucémico tenían unos valores de glucosa en ayunas y HbA1c < 100mg/dl y el 5,7% respectivamente.
Parámetros antropométricos y presión arterialSe determinaron con métodos estandarizados el peso, la talla, el perímetro de cintura y la presión arterial de los participantes (media de 2 determinaciones separadas 5min) con un monitor de presión arterial (HEM-7001E, Omron; España) después de permanecer 10min en sedestación. Se calculó el índice de masa corporal (IMC) mediante la fórmula peso (kg) / estatura (m2).
Bioquímica y métodos analíticosSe obtuvieron muestras de suero y de orina en ayunas, y todos los análisis de suero y orina se llevaron a cabo mediante los métodos analíticos estandarizados. El cLDL se calculó mediante la fórmula de Friedewald, mientras que la TFGe se estimó a partir de la fórmula Modification of Diet in Renal Disease-418. La tasa de HbA1c se determinó mediante HPLC (Variant, Bio-Rad Laboratories SA, España), y las concentraciones se expresaron en unidades del National Glycohemoglobin Standardization Program/Diabetes Control and Complications Trial. La albuminuria se determinó mediante un método inmunoturbidimétrico y un analizador Roche/Hitachi Modular P (Roche Diagnostics, España). La resistencia insulínica se determinó con una evaluación de modelo homeostático (HOMA)-IR.
Análisis de las lipoproteínas mediante resonanciaLas muestras de suero hemático se transportaron en hielo seco a las instalaciones de Biosfer Teslab (Reus, España) para un análisis lipoproteico avanzado mediante Liposcale, un test lipoproteico avanzado (CE) basado en espectroscopia de RM de difusión 2D, que permite un análisis exhaustivo de las partículas de lipoproteínas19. Se determinaron la composición de los lípidos y el tamaño medio (nm) de cada clase de partículas, así como la concentración de partículas de 9 subclases de lipoproteínas, a saber: P-HDL, LDL y VLDL grandes, medianas y pequeñas. Tal y como se ha descrito con anterioridad, la precisión intraanalítica del método para determinar las concentraciones de colesterol y TG y el número de partículas de la clase LDL y de sus subclases de partículas pequeñas, medianas y grandes es ≤ 5%. La precisión interanalítica para esos mismos parámetros es ≤ 8%. De igual modo, la precisión intraanalítica e interanalítica para las concentraciones de colesterol y TG y las VLDL y P-HDL es ≤ 6%. Por último, tanto la precisión intraanalítica como la interanalítica para el tamaño medio de las partículas de cada clase de lipoproteínas es ≤ 1%19.
Análisis estadísticoLa gestión y el análisis de los datos se llevaron a cabo con el software estadístico R, versión 3.6.0. La estadística descriptiva se resume mediante mediana [intervalo intercuartílico] y media±desviación estándar para las variables continuas o la frecuencia y el porcentaje para las variables cualitativas. Se utilizaron la prueba de la t de Student o la de la χ2 para explorar las diferencias entre los diferentes grupos. Se calcularon los valores de p correspondientes a las comparaciones de datos emparejados mediante pruebas múltiples con el método de Tukey. Se calcularon los coeficientes de correlación de Pearson entre los perfiles avanzados de lipoproteínas basados en RM y los parámetros clínicos y analíticos del grupo de control normoglucémico. Para evaluar las diferencias ajustadas entre los grupos para cada subclase de lipoproteínas, se utilizaron modelos de regresión multivariantes. Las covariables incluidas en el análisis ajustado fueron la edad, el sexo y el IMC. Además, se aplicó una corrección mediante pruebas de comparaciones múltiples con el método de Bonferroni para introducir un control para una tasa de error agrupada prefijada de 0,05.
Se clasificó a los participantes según su concentración sérica de partículas P-LDL y P-HDL y su contenido lipídico como normal o anormal aplicando puntos de corte publicados con anterioridad en relación con el riesgo de ECV ya establecidos en estudios previos20,21. Los valores de corte para concentraciones anormales de partículas lipoproteicas en el grupo normoglucémico fueron: P-LDL totales>1.300 nmol/l y P-HDL <24 μmol/l; las concentraciones de cLDL se consideraron elevadas si eran>130mg/dl, mientras que el cHDL se consideró bajo si era < 40mg/dl en los varones y < 50mg/dl en las mujeres.
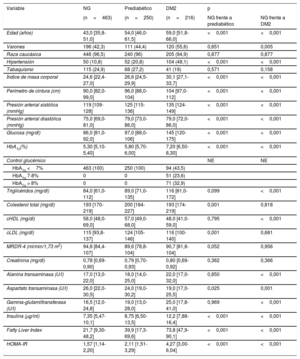
RESULTADOSCaracterísticas de la poblaciónSe analizaron las concentraciones de partículas lipoproteicas en el suero de 929 participantes. Esta cohorte incluía a 463 (49,8%) normoglucémicos, 250 (26,9%) prediabéticos y 216 (23,3%) con DM2. En la tabla 1 se presenta un análisis descriptivo de las variables clínicas y analíticas de cada grupo. En comparación con el grupo normoglucémico, los participantes de los grupos con prediabetes y DM2 eran de más edad, tenían un IMC y un perímetro de cintura mayores e incluían un mayor porcentaje de individuos con hipertensión. De igual modo, también tenían valores más altos de glucemia en ayunas, insulina y HbA1c y una mediana de HOMA-IR superior. Por lo que respecta al perfil lipídico, se observaron algunas diferencias en las subclases del colesterol en ayunas entre los 3 grupos, con unas concentraciones de cHDL en suero de los participantes con DM2 mayor que la de los normoglucémicos y de cLDL en suero más alto en el grupo de prediabetes que en el de normoglucémicos.
Análisis descriptivo de las variables clínicas según el grupo
| Variable | NG | Prediabético | DM2 | p | |
|---|---|---|---|---|---|
| (n=463) | (n=250) | (n=216) | NG frente a prediabético | NG frente a DM2 | |
| Edad (años) | 43,0 [35,8-51,0] | 54,0 [46,0-61,5] | 59,0 [51,8-66,0] | <0,001 | <0,001 |
| Varones | 196 (42,3) | 111 (44,4) | 120 (55,6) | 0,651 | 0,005 |
| Raza caucásica | 446 (96,5) | 240 (96) | 205 (94,9) | 0,877 | 0,877 |
| Hipertensión | 50 (10,8) | 52 (20,8) | 104 (48,1) | <0,001 | <0,001 |
| Tabaquismo | 115 (24,9) | 68 (27,2) | 41 (19) | 0,571 | 0,158 |
| Índice de masa corporal | 24,6 [22,4-27,0] | 26,6 [24,5-29,9] | 30,1 [27,1-33,7] | <0,001 | <0,001 |
| Perímetro de cintura (cm) | 90,0 [82,0-99,0] | 96,0 [88,0-104] | 104 [97,0-112] | <0,001 | <0,001 |
| Presión arterial sistólica (mmHg) | 119 [109-128] | 125 [115-136] | 135 [124-149] | <0,001 | <0,001 |
| Presión arterial diastólica (mmHg) | 75,0 [69,0-81,0] | 79,0 [73,0-86,0] | 79,0 [72,0-86,0] | <0,001 | <0,001 |
| Glucosa (mg/dl) | 86,0 [81,0-92,0] | 97,0 [88,0-106] | 145 [120-175] | <0,001 | <0,001 |
| HbA1c(%) | 5,30 [5,10-5,40] | 5,80 [5,70-6,00] | 7,20 [6,50-8,30] | <0,001 | <0,001 |
| Control glucémico | NE | NE | |||
| HbA1c <7% | 463 (100) | 250 (100) | 94 (43,5) | ||
| HbA1c 7-8% | 0 | 0 | 51 (23,6) | ||
| HbA1c > 8% | 0 | 0 | 71 (32,9) | ||
| Triglicéridos (mg/dl) | 84,0 [61,0-112] | 89,0 [71,0-135] | 116 [81,0-172] | 0,099 | <0,001 |
| Colesterol total (mg/dl) | 193 [170-219] | 200 [184-227] | 193 [174-219] | 0,001 | 0,818 |
| cHDL (mg/dl) | 58,0 [48,0-69,0] | 57,0 [49,0-68,0] | 48,0 [41,0-59,0] | 0,795 | <0,001 |
| cLDL (mg/dl) | 115 [93,8-137] | 124 [105-146] | 116 [100-140] | 0,001 | 0,681 |
| MRDR-4 (ml/min/1,73 m2) | 94,8 [84,4-107] | 89,6 [78,8-104] | 90,7 [81,8-104] | 0,052 | 0,956 |
| Creatinina (mg/dl) | 0,78 [0,69-0,90] | 0,79 [0,70-0,93] | 0,80 [0,69-0,92] | 0,362 | 0,366 |
| Alanina transaminasa (U/l) | 17,0 [13,0-22,0] | 18,0 [14,0-25,0] | 22,0 [17,0-32,0] | 0,850 | <0,001 |
| Aspartato transaminasa (U/l) | 26,0 [22,0-30,5] | 24,0 [19,0-30,2] | 19,0 [17,0-25,5] | 0,025 | 0,001 |
| Gamma-glutamiltransferasa (U/l) | 16,5 [12,0-24,8] | 19,0 [13,0-28,0] | 25,0 [17,8-41,0] | 0,969 | <0,001 |
| Insulina (μg/ml) | 7,35 [5,47-10,1] | 8,75 [6,50-13,5] | 12,2 [7,88-16,4] | <0,001 | <0,001 |
| Fatty Liver Index | 21,7 [9,30-48,2] | 39,9 [17,3-69,6] | 73,8 [47,9-90,1] | <0,001 | <0,001 |
| HOMA-IR | 1,57 [1,14-2,20] | 2,11 [1,51-3,29] | 4,27 [3,00-6,04] | <0,001 | <0,001 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM2: diabetes mellitus tipo 2; HbA1c: glucohemoglobina; HOMA-IR: evaluación de modelo homeostático de la resistencia a la insulina; NE: no evaluado; NG: normoglucémico.
Los valores expresan mediana [intervalo intercuartílico] en las variables continuas y n (%) en las cualitativas.
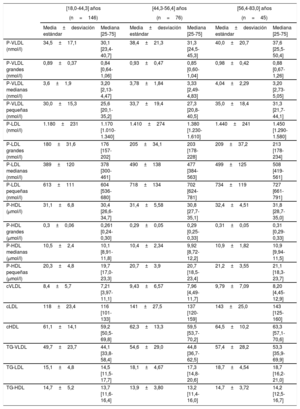
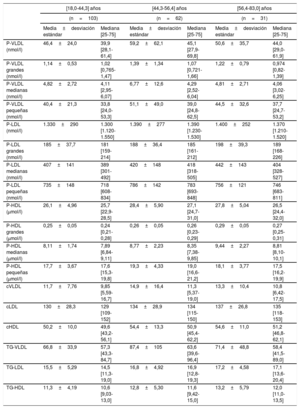
En la tabla 2 y la tabla 3 se describen los valores de las lipoproteínas según la edad en ambos sexos. El análisis del conjunto del grupo normoglucémico mostró un aumento significativo de varios parámetros lipídicos conforme aumenta la edad, con una tendencia a p <0,001 para el colesterol total, p <0,01 para el cLDL, p <0,001 para las P-LDL totales, p <0,001 para las P-LDL grandes, p <0,001 para las P-LDL medianas y p <0,001 para las P-LDL pequeñas. Las partículas de HDL aumentaron también con la edad: p=0,03 para las P-HDL totales y p <0,001 para las P-HDL medianas. Es interesante señalar que el aumento en relación con la edad fue más marcado entre los grupos de edad temprana y mediana que en los de edad mediana y avanzada.
Valores de lipoproteínas según los terciles de edad de las mujeres
| [18,0-44,3] años | [44,3-56,4] años | [56,4-83,0] años | ||||
|---|---|---|---|---|---|---|
| (n=146) | (n=76) | (n=45) | ||||
| Media±desviación estándar | Mediana [25-75] | Media±desviación estándar | Mediana [25-75] | Media±desviación estándar | Mediana [25-75] | |
| P-VLDL (nmol/l) | 34,5±17,1 | 30,1 [23,4-40,7] | 38,4±21,3 | 31,3 [24,5-45,3] | 40,0±20,7 | 37,6 [25,5-50,4] |
| P-VLDL grandes (nmol/l) | 0,89±0,37 | 0,84 [0,64-1,06] | 0,93±0,47 | 0,85 [0,60-1,04] | 0,98±0,42 | 0,88 [0,67-1,26] |
| P-VLDL medianas (nmol/l) | 3,6±1,9 | 3,20 [2,13-4,47] | 3,78±1,84 | 3,33 [2,49-4,83] | 4,04±2,29 | 3,20 [2,73-5,05] |
| P-VLDL pequeñas (nmol/l) | 30,0±15,3 | 25,6 [20,1-35,2] | 33,7±19,4 | 27,3 [20,8-40,5] | 35,0±18,4 | 31,3 [21,7-44,1] |
| P-LDL (nmol/l) | 1.180±231 | 1.170 [1.010-1.340] | 1.410±274 | 1.380 [1.230-1.610] | 1.440±241 | 1.450 [1.290-1.580] |
| P-LDL grandes (nmol/l) | 180±31,6 | 176 [157-202] | 205±34,1 | 203 [178-228] | 209±37,2 | 213 [178-234] |
| P-LDL medianas (nmol/l) | 389±120 | 378 [300-461] | 490±138 | 477 [384-563] | 499±125 | 508 [419-561] |
| P-LDL pequeñas (nmol/l) | 613±111 | 604 [536-680] | 718±134 | 702 [624-781] | 734±119 | 727 [661-791] |
| P-HDL (μmol/l) | 31,1±6,8 | 30,4 [26,6-34,7] | 31,4±5,58 | 30,8 [27,7-35,1] | 32,4±4,51 | 31,8 [28,7-35,0] |
| P-HDL grandes (μmol/l) | 0,3±0,06 | 0,261 [0,24-0,30] | 0,29±0,05 | 0,29 [0,25-0,33] | 0,31±0,05 | 0,31 [0,29-0,33] |
| P-HDL medianas (μmol/l) | 10,5±2,4 | 10,1 [8,91-11,8] | 10,4±2,34 | 9,92 [8,72-12,2] | 10,9±1,82 | 10,9 [9,94-11,5] |
| P-HDL pequeñas (μmol/l) | 20,3±4,8 | 19,7 [17,0-23,3] | 20,7±3,9 | 20,7 [18,5-23,4] | 21,2±3,55 | 21,1 [18,3-23,7] |
| cVLDL | 8,4±5,7 | 7,21 [3,97-11,1] | 9,43±6,57 | 7,96 [4,49-11,7] | 9,79±7,09 | 8,20 [4,45-12,9] |
| cLDL | 118±23,4 | 116 [101-133] | 141±27,5 | 137 [120-159] | 143±25,0 | 143 [125-160] |
| cHDL | 61,1±14,1 | 59,2 [50,5-69,8] | 62,3±13,3 | 59,5 [53,7-70,2] | 64,5±10,2 | 63,3 [57,1-70,6] |
| TG-VLDL | 49,7±23,7 | 44,1 [33,8-58,4] | 54,6±29,0 | 44,8 [36,7-62,5] | 57,4±28,2 | 53,3 [35,9-69,9] |
| TG-LDL | 15,1±4,8 | 14,5 [11,5-17,7] | 18,1±4,67 | 17,3 [14,8-20,6] | 18,7±4,54 | 18,7 [16,2-21,0] |
| TG-HDL | 14,7±5,2 | 13,7 [11,6-16,4] | 13,9±3,80 | 13,2 [11,4-16,0] | 14,7±3,72 | 14,2 [12,5-16,7] |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; VLDL: lipoproteínas de muy baja densidad.
Valores de lipoproteínas según los terciles de edad de los varones
| [18,0-44,3] años | [44,3-56,4] años | [56,4-83,0] años | ||||
|---|---|---|---|---|---|---|
| (n=103) | (n=62) | (n=31) | ||||
| Media±desviación estándar | Mediana [25-75] | Media±desviación estándar | Mediana [25-75] | Media±desviación estándar | Mediana [25-75] | |
| P-VLDL (nmol/l) | 46,4±24,0 | 39,9 [28,1-61,4] | 59,2±62,1 | 45,1 [27,9-69,8] | 50,6±35,7 | 44,0 [29,0-61,9] |
| P-VLDL grandes (nmol/l) | 1,14±0,53 | 1,02 [0,765-1,47] | 1,39±1,34 | 1,07 [0,721-1,66] | 1,22±0,79 | 0,974 [0,82-1,39] |
| P-VLDL medianas (nmol/l) | 4,82±2,72 | 4,11 [2,95-6,07] | 6,77±12,6 | 4,29 [2,52-6,04] | 4,81±2,71 | 4,06 [3,02-6,25] |
| P-VLDL pequeñas (nmol/l) | 40,4±21,3 | 33,8 [24,0-53,3] | 51,1±49,0 | 39,0 [24,8-62,5] | 44,5±32,6 | 37,7 [24,7-53,2] |
| P-LDL (nmol/l) | 1.330±290 | 1.300 [1.120-1.550] | 1.390±277 | 1.390 [1.230-1.530] | 1.400±252 | 1.370 [1.210-1.520] |
| P-LDL grandes (nmol/l) | 185±37,7 | 181 [159-214] | 188±36,4 | 185 [161-212] | 198±39,3 | 189 [168-226] |
| P-LDL medianas (nmol/l) | 407±141 | 389 [301-492] | 420±148 | 418 [318-505] | 442±143 | 404 [328-527] |
| P-LDL pequeñas (nmol/l) | 735±148 | 718 [608-834] | 786±142 | 783 [693-848] | 756±121 | 746 [683-811] |
| P-HDL (μmol/l) | 26,1±4,96 | 25,7 [22,9-28,5] | 28,4±5,90 | 27,1 [24,7-31,0] | 27,8±5,04 | 26,5 [24,4-32,0] |
| P-HDL grandes (μmol/l) | 0,25±0,05 | 0,24 [0,21-0,28] | 0,26±0,05 | 0,26 [0,23-0,29] | 0,29±0,05 | 0,27 [0,25-0,31] |
| P-HDL medianas (μmol/l) | 8,11±1,74 | 7,89 [6,84-9,11] | 8,77±2,23 | 8,35 [7,38-9,85] | 9,44±2,27 | 8,81 [8,10-10,1] |
| P-HDL pequeñas (μmol/l) | 17,7±3,67 | 17,6 [15,3-19,8] | 19,3±4,33 | 19,0 [16,6-21,2] | 18,1±3,77 | 17,5 [16,2-19,9] |
| cVLDL | 11,7±7,76 | 9,85 [5,59-16,7] | 14,9±16,4 | 11,3 [5,37-19,0] | 13,3±10,4 | 10,8 [6,42-17,5] |
| cLDL | 130±28,3 | 129 [109-152] | 134±28,9 | 134 [115-150] | 137±26,8 | 135 [118-153] |
| cHDL | 50,2±10,0 | 49,6 [43,2-56,1] | 54,4±13,3 | 50,9 [45,4-62,2] | 54,6±11,0 | 51,2 [46,8-62,1] |
| TG-VLDL | 66,8±33,9 | 57,3 [43,3-84,7] | 87,4±105 | 63,6 [39,6-96,4] | 71,4±48,8 | 58,4 [41,5-89,0] |
| TG-LDL | 15,5±5,29 | 14,5 [11,3-19,0] | 16,8±4,92 | 16,9 [12,8-19,3] | 17,2±4,58 | 17,1 [13,6-20,4] |
| TG-HDL | 11,3±4,19 | 10,6 [9,03-13,0] | 12,8±5,30 | 11,6 [9,42-15,0] | 13,2±5,79 | 12,0 [11,0-13,5] |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; VLDL: lipoproteínas de muy baja densidad.
El perfil de lipoproteínas mostró marcadas diferencias en función del sexo de los participantes. En comparación con los varones, las mujeres mostraron menores concentraciones séricas medias de TG y cLDL (82,5 frente a 114mg/dl; p=0,001, y 110 frente a 118mg/dl; p=0,010). En concordancia con lo observado en las concentraciones séricas de TG, las mujeres mostraron al mismo tiempo menores concentraciones de P-VLDL y lípidos junto con altas concentraciones de P-HDL y lípidos (p <0,001 para todas las comparaciones excepto la de las P-VLDL medianas, con p=0,010). Las características de las LDL mostraron también diferencias en función del sexo. En comparación con los varones, las concentraciones totales de P-LDL y P-LDL pequeñas fueron significativamente inferiores en las mujeres (1.256 [697-11.981] frente a 1.319 [572-12.179] nmol/l; p=0,014; 638 [324-1.047] frente a 735 [401-1.171] nmol/l; p <0,001). De modo análogo, las concentraciones séricas de P-no-HDL, que incluían las P-VLDL y las P-LDL, fueron significativamente inferiores en las mujeres que en los varones (p=0,001). Las mujeres mostraron también un contenido de colesterol y TG inferior en las partículas de VLDL y un contenido superior de colesterol y TG en las partículas de HDL ().
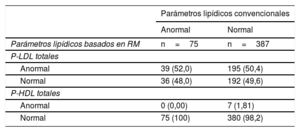
Solo 75 de los 462 participantes normoglucémicos (16%) presentaron valores anormales tanto de cHDL (<40mg/dl los varones y <50mg/dl las mujeres) como de cLDL (> 130mg/dl), mientras que el resto de los participantes (84%) presentaron valores normales de ambos parámetros. Tiene interés señalar que, de los participantes normoglucémicos con valores normales de cLDL y cHDL, casi un 50% mostraba unas concentraciones de P-LDL superiores a las recomendadas (el 50,4% con valores altos de P-LDL totales). En cambio, solo el 1,8% de los participantes normoglucémicos presentaron concentraciones de P-HDL inferiores a las recomendadas (tabla 4).
Comparación entre el perfil lipídico convencional y las concentraciones de partículas lipoproteicas basadas en RM en el grupo normoglucémico
| Parámetros lipídicos convencionales | ||
|---|---|---|
| Anormal | Normal | |
| Parámetros lipídicos basados en RM | n=75 | n=387 |
| P-LDL totales | ||
| Anormal | 39 (52,0) | 195 (50,4) |
| Normal | 36 (48,0) | 192 (49,6) |
| P-HDL totales | ||
| Anormal | 0 (0,00) | 7 (1,81) |
| Normal | 75 (100) | 380 (98,2) |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
Los valores expresan n (%).
Faltan los datos relativos a partículas lipoproteicas de 1 participante a causa de la ausencia de valores de cLDL y cHDL.
Parámetros lipídicos basados en RM anormales: P-LDL totales > 1.300 nmol/l y < 24 μmol/l para la concentración de P-HDL total.
Parámetros lipídicos convencionales anormales: cLDL > 130mg/dl, cHDL < 40mg/dl los varones y < 50mg/dl las mujeres.
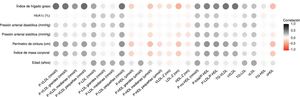
En la figura 1 se muestra la correlación entre las diferentes características de las lipoproteínas obtenidas en el análisis basado en RM y las diferentes variables clínicas. Las observaciones más notables fueron que el FLI, el perímetro de cintura y el IMC mostraron una correlación positiva con las variables relacionadas con las VLDL (número total, tamaño y contenido de colesterol y TG), la subclase de las P-LDL pequeñas y las P-no-HDL. Las mismas variables clínicas mostraron una correlación inversa con las P-HDL totales, así como con sus subclases de partículas medianas y pequeñas y con su contenido en colesterol.
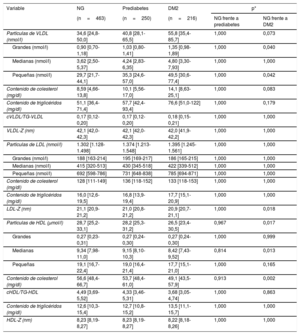
Valores de partículas lipoproteicas en la DM2 y la prediabetes y comparación con el grupo de control normoglucémicoEn la tabla 5 se presenta la comparación de los diferentes tamaños de subclases de lipoproteínas entre los grupos normoglucémico, prediabético y con DM2. Un análisis multivariante (ajustado por edad, sexo e IMC) puso de manifiesto que casi todas las subclases de VLDL eran significativamente superiores en los participantes con DM2 que en los normoglucémicos, con unas concentraciones séricas más altas de P-VLDL grandes y pequeñas (p=0,040 y p=0,042 respectivamente). No se observaron diferencias significativas en la distribución de las P-LDL al comparar los 3 grupos. Además, se puso de manifiesto una reducción estadísticamente significativa del tamaño de las LDL (LDL-Z) en los participantes con DM2 en comparación con los normoglucémicos (p=0,018). Hubo una tendencia a un mayor contenido de colesterol en las partículas VLDL de los participantes con DM2 en comparación con los normoglucémicos (p=0,083). En cuanto a las características relativas a las HDL, las concentraciones de P-HDL totales en el grupo de DM2 fueron menores que las del grupo normoglucémico (p=0,017), en especial de partículas medianas (p=0,013). Al mismo tiempo, la mediana de contenido de colesterol en las P-HDL fue inferior en los participantes con DM2 que en los controles (p=0,002).
Comparación del tamaño de las subclases de lipoproteínas entre los grupos normoglucémico, prediabético y con DM2
| Variable | NG | Prediabetes | DM2 | p* | |
|---|---|---|---|---|---|
| (n=463) | (n=250) | (n=216) | NG frente a prediabetes | NG frente a DM2 | |
| Partículas de VLDL (nmol/l) | 34,6 [24,8-50,0] | 40,8 [28,1-65,5] | 55,8 [35,4-85,7] | 1,000 | 0,073 |
| Grandes (nmol/l) | 0,90 [0,70-1,18] | 1,03 [0,80-1,41] | 1,35 [0,98-1,89] | 1,000 | 0,040 |
| Medianas (nmol/l) | 3,62 [2,50-5,37] | 4,24 [2,83-6,35] | 4,80 [3,30-7,93] | 1,000 | 1,000 |
| Pequeñas (nmol/l) | 29,7 [21,7-44,1] | 35,3 [24,6-57,0] | 49,5 [30,6-77,4] | 1,000 | 0,042 |
| Contenido de colesterol (mg/dl) | 8,59 [4,66-13,8] | 10,1 [5,56-17,0] | 14,1 [8,63-25,1] | 1,000 | 0,083 |
| Contenido de triglicéridos (mg/dl) | 51,1 [36,4-71,4] | 57,7 [42,4-93,4] | 76,6 [51,0-122] | 1,000 | 0,179 |
| cVLDL/TG-VLDL | 0,17 [0,12-0,20] | 0,17 [0,12-0,20] | 0,18 [0,15-0,21] | 1,000 | 1,000 |
| VLDL-Z (nm) | 42,1 [42,0-42,3] | 42,1 [42,0-42,3] | 42,0 [41,9-42,2] | 1,000 | 1,000 |
| Partículas de LDL (nmol/l) | 1.302 [1.128-1.498] | 1.374 [1.213-1.548] | 1.395 [1.245-1.561] | 1,000 | 1,000 |
| Grandes (nmol/l) | 188 [163-214] | 195 [169-217] | 186 [165-215] | 1,000 | 1,000 |
| Medianas (nmol/l) | 415 [320-513] | 430 [345-518] | 422 [339-512] | 1,000 | 1,000 |
| Pequeñas (nmol/l) | 692 [598-786] | 731 [648-838] | 785 [694-871] | 1,000 | 1,000 |
| Contenido de colesterol (mg/dl) | 128 [111-149] | 136 [118-152] | 133 [118-153] | 1,000 | 1,000 |
| Contenido de triglicéridos (mg/dl) | 16,0 [12,6-19,5] | 16,8 [13,9-19,4] | 17,7 [15,1-20,9] | 1,000 | 1,000 |
| LDL-Z (nm) | 21,1 [20,9-21,2] | 21,0 [20,8-21,2] | 20,9 [20,7-21,1] | 1,000 | 0,018 |
| Partículas de HDL (μmol/l) | 28,7 [25,2-33,1] | 28,2 [25,3-31,2] | 26,5 [23,4-30,5] | 0,967 | 0,017 |
| Grandes | 0,27 [0,23-0,31] | 0,27 [0,24-0,30] | 0,27 [0,24-0,30] | 1,000 | 0,999 |
| Medianas | 9,34 [7,98-11,0] | 9,15 [8,10-10,3] | 8,42 [7,43-9,52] | 0,814 | 0,013 |
| Pequeñas | 19,1 [16,7-22,4] | 19,0 [16,4-21,4] | 17,7 [15,1-21,0] | 1,000 | 0,165 |
| Contenido de colesterol (mg/dl) | 56,6 [48,4-66,7] | 53,7 [48,4-61,0] | 49,1 [43,5-57,9] | 0,913 | 0,002 |
| cHDL/TG-HDL | 4,49 [3,69-5,52] | 4,33 [3,46-5,31] | 3,68 [3,05-4,74] | 1,000 | 0,863 |
| Contenido de triglicéridos (mg/dl) | 12,6 [10,3-15,4] | 12,7 [10,8-15,2] | 13,5 [11,1-15,7] | 1,000 | 1,000 |
| HDL-Z (nm) | 8,23 [8,19-8,27] | 8,23 [8,19-8,27] | 8,22 [8,18-8,26] | 1,000 | 1,000 |
cHDL: colesterol unido a lipoproteínas de alta densidad; DM2: diabetes mellitus tipo 2; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; NG: normoglucémico; VLDL: lipoproteínas de muy baja densidad.
Los valores expresan mediana [intervalo intercuartílico].
En el presente estudio se muestran las características avanzadas de las lipoproteínas circulantes, evaluadas mediante espectroscopia por RM en un gran número de participantes con diferentes grados de alteración del metabolismo de la glucosa, sin eventos previos de ECV y que además no estaban en tratamiento con medicación hipolipemiante. Los principales resultados fueron que, en los participantes normoglucémicos, el sexo femenino mostró una intensa asociación con un perfil lipoproteico más favorable. Las mujeres tenían, además, un contenido de colesterol en las partículas VLDL menor que el de los varones. Es interesante señalar que casi un 50% de los participantes normoglucémicos con unos valores lípidicos convencionales aparentemente dentro de la normalidad mostraron concentraciones anormales de P-LDL. Además, en comparación con los normoglucémicos, aquellos con DM2 tenían cifras anormales de las partículas lipoproteicas aparte de las LDL, tales como las concentraciones de P-HDL y de P-VLDL, las cuales se han visto asociadas con un aumento del riesgo CV. También destaca que los participantes con DM2 mostraron una tendencia marginal a tener mayor contenido de colesterol en las partículas de VLDL.
Hasta donde sabemos, son pocos los estudios que han descrito las concentraciones de subclases de partículas lipoproteicas y su contenido en colesterol y TG en una muestra amplia de participantes provenientes de la misma área geográfica. Cabe señalar además que ninguno de ellos se ha llevado a cabo en una región mediterránea representativa. En el presente estudio, las concentraciones de P-LDL y P-HDL aumentaron con la edad de los participantes, y dicho incremento fue más pronunciado en las mujeres. Este resultado está en concordancia con los de estudios publicados anteriormente, que han mostrado que las concentraciones de P-LDL presentan una correlación con la edad más intensa en las mujeres que en los varones22. Por el contrario, en coherencia con lo reportado por estudios publicados con anterioridad, el aumento de las concentraciones de P-LDL observado conforme aumenta la edad fue más manifiesto entre los participantes de edades temprana y mediana que entre los de edad mediana y avanzada23. Por último, de manera similar a lo observado en un estudio recientemente publicado, las P-HDL totales aumentaron con la edad en las mujeres24. Dicho estudio indicó que, si bien el número absoluto de P-HDL aumenta con la edad en las mujeres, su capacidad de fomentar el flujo de colesterol desde los macrófagos se ve comprometida al avanzar la edad24. Esto último está en completa concordancia con el concepto actual de que la diana para los futuros tratamientos basados en las HDL para el abordaje de la ECV debería basarse más en la funcionalidad de las HDL que en la cantidad de cHDL. Por otro lado, en consonancia con lo indicado por estudios previos22, nuestros datos respaldan el concepto de que el sexo femenino muestra una intensa asociación con un perfil lipoproteico avanzado más favorable que el de los varones. De hecho, las mujeres presentaron una cantidad inferior de partículas aterogénicas totales (es decir, P-VLDL y P-LDL) y un aumento significativo de las concentraciones de partículas antiaterogénicas (es decir, P-HDL). De manera coherente con lo indicado por estudios previos25, se observó que tanto el IMC como el perímetro de cintura presentaron una correlación positiva con alteraciones proaterógenas del perfil de subclases de lipoproteínas evaluado mediante RM, con una correlación positiva con las variables relacionadas con las P-VLDL y las P-LDL, en especial las partículas pequeñas. Tiene interés señalar que casi un 50% de los participantes normoglucémicos con parámetros lipídicos convencionales normales y sin ECV previa mostraron unas concentraciones anormales de subclases de lipoproteínas, atribuibles en su mayor parte a las subclases de las LDL. Estos resultados son similares a los descritos en un estudio reciente21. Es destacable que un fenotipo similar se ha asociado con un aumento del riesgo de ECV26.
Con frecuencia se observa un perfil de lipoproteínas aterógeno en los individuos con obesidad abdominal25 y con HGNA12. De igual modo, en el presente estudio, tanto el IMC como el perímetro de cintura, así como el FLI, mostraron una correlación positiva con las lipoproteínas proaterógenas, en especial con las variables relacionadas con las P-VLDL y las P-LDL, sobre todo en lo que respecta a las partículas de menor tamaño, mientras que hubo una correlación negativa con las P-HDL antiaterogénicas.
En nuestro estudio, los resultados obtenidos en los participantes normoglucémicos se compararon con los obtenidos de los participantes con alteraciones del metabolismo glucémico. En la DM2, el aumento de la secreción hepática de VLDL grandes y enriquecidas en triglicéricos y el deterioro en la eliminación de las VLDL parecen tener una importancia crucial en la fisiopatología de la dislipemia aterogénica27. De hecho, se ha descrito que las alteraciones en las subclases de lipoproteínas pueden atribuirse principalmente a la resistencia insulínica subyacente28. Nuestros resultados concuerdan en general con los de estudios previos29, puesto que también se identificó que en los participantes con DM2 las concentraciones séricas de P-HDL, en especial las de la subclase mediana, estaban reducidas en comparación con las del grupo de control, mientras que las P-VLDL, tanto partículas grandes como pequeñas, se encontraban aumentadas. Las reducciones de las HDL pequeñas y medianas podrían explicarse, al menos en parte, por una biogénesis inadecuada y un aumento inicial del tamaño de las P-HDL en sujetos diabéticos. Por otra parte, tal y como se ha descrito anteriormente en otros estudios30, en el nuestro se observó tendencia a un mayor contenido de colesterol en las P-VLDL de los participantes con DM2 en comparación con los normoglucémicos. Esto concuerda con el aumento de actividad de la proteína de transferencia de ésteres de colesterol descrito en individuos con DM231. No se observaron diferencias en las concentraciones de TG-HDL ni en el cociente cHDL/TG-HDL entre los participantes con DM2 y normoglucémicos. Sin embargo, debe señalarse que en el grupo con DM2 el correspondiente cHDL/TG-HDL fue inferior al observado en los normoglucémicos tras un análisis ajustado por edad, sexo e IMC (p <0,001). Estas diferencias desaparecieron al aplicar un ajuste por comparaciones múltiples. Es probable que, con un mayor número de participantes, las diferencias en el contenido de TG-HDL y el cociente cHDL/TG-HDL hubieran resultado más manifiestas. Dado que no se observaron diferencias en el perfil lipoproteico entre los individuos con prediabetes y los normoglucémicos, esto puede atribuirse al menor grado de resistencia insulínica observado en los participantes prediabéticos de nuestro estudio, lo cual quedó reflejado en sus bajos valores en el índice HOMA-IR. Por último, este estudio incluyó una proporción clínicamente relevante de participantes con concentraciones de cLDL que habrían justificado iniciar un tratamiento con estatinas. Sin embargo, algunos de estos pacientes no reciben tratamiento estatínico porque los participantes en el estudio pertenecen a diferentes cohortes transversales de distintos niveles asistenciales, y ya se ha puesto de manifiesto que no se les aplica un tratamiento óptimo en la práctica clínica diaria32.
LimitacionesNuestros resultados deben interpretarse en el contexto de ciertas limitaciones. En primer lugar, en el grupo de prediabetes no se pudo diferenciar entre los pacientes con una alteración de la glucemia en ayunas y los que tenían intolerancia a la glucosa (ITG), ya que no se les realizó una prueba de sobrecarga oral de glucosa. Este aspecto puede ser importante, ya que se han descrito distintas alteraciones en las lipoproteínas y apolipoproteínas de individuos con una alteración de la glucemia en ayunas en comparación con una ITG, de tal manera que estos últimos muestran unos cambios en las lipoproteínas similares a los descritos anteriormente en la resistencia insulínica33. Los autores plantearon la hipótesis de que estas diferencias podrían ser consecuencia de diferentes mecanismos fisiopatológicos en los diferentes estados de tolerancia a la glucosa, y que esto podría estar relacionado con el lugar donde se produce la resistencia insulínica (músculo esquelético o hígado). Otra limitación es que los participantes con DM2 fueron reclutados principalmente en consulta ambulatoria, y es posible que ello implicara un sesgo de selección por favorecerse la inclusión de pacientes con un mejor estado de salud y menos complicaciones que la población general con DM2.
CONCLUSIONESNuestros resultados muestran un perfil de lipoproteínas antiaterogénicas más favorable en las mujeres que en los varones. El IMC y el FLI son factores importantes que muestran una correlación positiva con un perfil proaterogénico en los participantes normoglucémicos. Los participantes con DM2 mostraron unas concentraciones inferiores de P-HDL totales y P-HDL medianas y un aumento de las concentraciones de P-VLDL, debido principalmente a la subclase de partículas más pequeñas, en comparación con el grupo normoglucémico. Los cambios de estas subclases de lipoproteínas resaltan la potencial importancia de ese subtipo de lipoproteínas, asociadas con mayor riesgo de ECV pero que en la actualidad no son objeto de ningún tipo de intervención terapéutica ni se tienen en cuenta en ningún instrumento de predicción del riesgo de ECV. Estas cuestiones resaltan la necesidad de nuevos instrumentos, como un perfil lipoproteico basado en la RM, para una mejor caracterización del riesgo de ECV. Este enfoque proporciona un abordaje más detallado y en profundidad de las anomalías lipídicas. Por consiguiente, es posible que esta herramienta sea útil para una mejor caracterización del perfil de riesgo de ECV, en especial de poblaciones con mayor riesgo de ECV, como las que presentan DM2 y obesidad visceral, en las que el cLDL parece ser un marcador poco fiable para orientar completamente en el tratamiento de prevención de la ateroesclerosis.
FINANCIACIÓNEste trabajo fue financiado con subvenciones del Instituto Nacional de Salud Carlos III (ISCIII) (PI11/1723, PI15/0625 y PI18/0328), de la Fundación de la Marató de TV3 (303/C/2016) y del Fondo Europeo de Desarrollo Regional (FEDER). CIBERDEM y CIBEROBN son una iniciativa del ISCIII, España.
CONTRIBUCIÓN DE LOS AUTORESD. Mauricio y N. Alonso concibieron, diseñaron y supervisaron el estudio. M. Falguera, M. Hernández, M. Barranco-Altirriba y B. Soldevila participaron en la inclusión de pacientes y la obtención de materiales. C. Puig-Jové, A. Teis, J. Julve y N. Alonso interpretaron los resultados. C. Puig-Jové y E. Castelblanco elaboraron la versión inicial del manuscrito y contribuyeron por igual en este estudio. D. Mauricio, N. Alonso, N. Amigó, J. Franch-Nadal y E. Ortega revisaron y corrigieron el manuscrito. Todos los autores revisaron el manuscrito y dieron su aprobación final a la versión presentada para publicación.
CONFLICTO DE INTERESESN. Amigó posee acciones y forma parte del consejo de dirección de Biosfer Teslab, laboratorio de diagnóstico que llevó a cabo el análisis lipoproteico descrito. Los demás autores indican no tener nada que declarar con respecto a conflictos de intereses en relación con el presente manuscrito.
- –
Aparte del cLDL, hay varios tipos de lipoproteínas que tienen una relación causal con la ECV.
- –
Los valores convencionales de cLDL subestiman la concentración total de colesterol transportado por las LDL y, lo que es más importante, la concentración total de lipoproteínas aterogénicas, con la consiguiente subestimación del riesgo de ECV ateroesclerótica.
- –
La hiperglucemia y la resistencia insulínica son la causa de las alteraciones proaterogénicas que se producen en el perfil lipoproteico.
- –
Los participantes con DM2 muestran una alteración de partículas lipoproteicas más allá de las LDL.
- –
Cerca del 50% de los participantes con valores normales de cLDL y cHDL muestran un perfil lipoproteico alterado, principalmente en referencia a las partículas de LDL.
- –
Las mujeres presentan en general un perfil lipoproteico avanzado más favorable que el observado en los varones.
- –
El perímetro de cintura y el FLI muestran una correlación positiva con un perfil lipoproteico proaterógeno.
Queremos dar las gracias en especial a los pacientes y a los biobancos del IGTP-HUGTP y del IRBLleida (B.0000682) integrados en la Red Nacional de Biobancos de España del ISCIII (PT17/0015/0045 y PT17/0015/0027, respectivamente).