La patogenia de la enfermedad ateromatosa es multifactorial. En el desarrollo de las lesiones vasculares, intervienen mecanismos bioquímicos y celulares diversos como la inflamación, la oxidación, la fibrosis o la proliferación y migración celular, entre otros. Estas alteraciones se activan en respuesta a diversos daños producidos en la capa íntima arterial. De ellos, el principal factor etiológico es la acumulación de colesterol. El exceso de colesterol circulante incrementa su depósito en la pared arterial al superar la capacidad de extracción de este mediada por las lipoproteínas de alta densidad (HDL). Dado que nuestro organismo carece de herramientas enzimáticas para degradar el colesterol, la respuesta del organismo a esta agresión vascular se articula como una reacción a cuerpo extraño que pretende amortiguar la presencia ectópica de colesterol en una zona funcionalmente tan importante como la pared arterial. El papel etiológico del colesterol en la arteriosclerosis está ampliamente demostrado con base en datos clínicos y de experimentación básica, y hay excelentes revisiones recientes1.
PARTÍCULAS LIPOPROTEICAS, ELEMENTO CLAVE EN LA PATOGENIA DE LA ARTERIOSCLEROSISUno de los puntos clave en el estudio de la patogenia de la arteriosclerosis es la llegada del exceso de colesterol a la pared arterial. El colesterol se transporta en el plasma por el sistema de lipoproteínas. Todas las partículas lipoproteicas transportan colesterol. En el caso de las lipoproteínas ricas en triglicéridos (LRT) —como las lipoproteínas de muy baja densidad (VLDL), de densidad intermedia (IDL) y remanentes—, la cantidad de colesterol es porcentualmente inferior a los triglicéridos que contienen; sin embargo, cada una de las partículas es capaz de transportar tantas o más moléculas de colesterol que las lipoproteínas de baja densidad (LDL)2. Teniendo en cuenta que todas las partículas lipoproteicas de diámetro <70nm pueden cruzar la barrera endotelial vascular, las LRT deben considerarse un vehículo aterógeno y, si bien no suelen quedar retenidas en la íntima arterial como ocurre con las LDL, sí que interactúan con los macrófagos depositando el colesterol en su interior y exacerbando los mecanismos inflamatorios con el aporte masivo de triglicéridos/ácidos grasos3. Se ha comunicado que el colesterol que contienen, al que se denomina colesterol remanente (cRem), tiene un valor predictivo del riesgo cardiovascular incluso superior al del cLDL4,5.
Las LDL son las partículas aterógenas que transportan la mayor cantidad de colesterol plasmático. Su exceso incrementa la infiltración subendotelial, que es la vía fundamental de entrada de colesterol a la pared arterial. Una vez en la íntima arterial, las retienen componentes de la matriz extracelular, donde son objeto de modificaciones diversas como la peroxidación lipídica, que activa mecanismos celulares, inflamatorios y proliferativos que conducen a la formación de la lesión ateromatosa1.
De entre las partículas de LDL, las de menor tamaño y mayor densidad en contenido de colesterol son las que tiene una mayor facilidad para infiltrar la pared arterial y pegarse a los proteoglicanos de la matriz extracelular. Es decir, las LDL más pequeñas y densas son más aterógenas que las LDL de mayor tamaño6.
Por lo tanto, el contexto aterógeno está bien definido. Un factor etiológico principal, el colesterol, que no puede alcanzar la pared arterial por sí mismo, sino formando parte de las partículas lipoproteicas. Las LRT depositan colesterol introduciéndolo en los macrófagos y activando los mecanismos inflamatorios, las LDL penetrando en la pared y siendo retenidas con mayor o menor afinidad según su tamaño. Es decir, el factor determinante del potencial aterógeno son las partículas lipoproteicas, su número, su tamaño y su composición.
¿CÓMO SE EVALÚA CLÍNICAMENTE EL COMPLEJO PROCESO ATERÓGENO?A pesar de que el 75% de todas las moléculas que circulan por el plasma son lípidos, del importante número de moléculas que participan en la regulación del metabolismo lipídico, apoproteínas, enzimas, proteínas transportadoras, receptores y de la variabilidad en la composición, el tamaño y el número de partículas lipoproteicas, los clínicos evaluamos la situación del metabolismo lipídico determinando directamente 3 parámetros, el colesterol total, el cHDL y los triglicéridos. Incluso el cLDL, que es el parámetro clínico fundamental en la toma de decisiones, es un valor calculado. Obviamente este denominado perfil lipídico clásico es insuficiente para dibujar la situación metabólica proaterógena de nuestros pacientes. Uno de los principales déficits de esta evaluación lipídica básica es que no ofrece una aproximación a las auténticas protagonistas de la aterogenicidad, las partículas lipoproteicas. Una aproximación indirecta a estas es la determinación de la concentración plasmática de la apolipoproteína B (apoB). La apoB-100 es la principal apolipoproteína de las lipoproteínas aterógenas. Es la proteína humana de mayor tamaño (500 kD), y hay una sola molécula en cada partícula lipoproteica, desde los quilomicrones y las VLDL hasta las LDL. Por ello, una concentración plasmática de apoB elevada refleja un mayor número de partículas aterógenas que unos valores bajos. Las últimas guías sobre dislipemias y prevención cardiovascular de la Sociedad Europea de Cardiología y la European Atherosclerosis Society (ESC/EAS) reconocen que el cLDL es un valor subrogado al de las partículas aterógenas y que los beneficios terapéuticos de los fármacos hipolipemiantes están mediados por la reducción del número partículas7. Estas guías proponen la determinación de la apoB como un marcador indirecto, pero más cercano al número de partículas, y establecen ciertas concentraciones de apoB como objetivos terapéuticos secundarios.
A pesar de ello, la concentración de apoB no distingue si las partículas acumuladas son LRT, LDL grandes o LDL pequeñas, por ejemplo.
ES TIEMPO PARA LA IRRUPCIÓN DE LA METABOLÓMICA EN LA CLÍNICAEn la era de las ciencias ómicas, de la metabolómica y la lipidómica, la aproximación clínica al estudio del metabolismo lipídico es, como poco, irrisoria.
El trabajo realizado por Puig-Jové et al.8 recientemente publicado en Revista Española de Cardiología, ofrece una visión clínica de la utilización de la técnica lipidómica basada en la resonancia magnética (1H-NMR) del suero para evaluar directamente el número y el tamaño de las diferentes partículas lipoproteicas. La utilización de la 1H-NMR para el estudio lipoproteico se desarrolló hace unas décadas y se ha empleado para adquirir conocimientos sobre la implicación de las partículas en el riesgo cardiovascular. En los últimos años, una empresa española (Biosferteslab) derivada de la universidad ha desarrollado una segunda generación de la técnica y ha puesto a punto un test avanzado de lipoproteínas basado en la 1H-NMR en 2 dimensiones para su aplicación clínica, el test Liposcale9. Este test evalúa el número de partículas lipoproteicas de las 3 principales clases de lipoproteínas, VLDL, LDL y HDL, y 3 subclases de cada una de ellas (grandes, medianas y pequeñas). Determina además el tamaño medio de cada clase lipoproteica, así como el contenido en colesterol y triglicéridos de cada fracción, incluido el cRem. Esta técnica abre un nuevo horizonte en la evaluación del metabolismo lipídico y su asociación con el riesgo cardiovascular que permite avanzar hacia una medicina de precisión.
Un ejemplo de ello son los resultados del trabajo de Puig-Jové et al.8. Este estudio incluye a pacientes de diversos centros catalogados como normoglucémicos, prediabéticos y diabéticos, no tratados con hipolipemiantes en el momento del estudio. Sus valores lipídicos basales podrían considerarse dentro de la normalidad, independientemente de la necesidad de tratamiento en el caso de los diabéticos, dado su riesgo cardiovascular total, y muy similares entre los grupos. Sí hay un claro gradiente en el índice de masa corporal, con una media de 30 en el grupo con diabetes. A pesar de la escasa variabilidad en los parámetros lipídicos convencionales, el perfil determinado mediante resonancia magnética (RM) mostró un gradiente asociado con la alteración del metabolismo hidrocarbonado hacia un incremento de partículas de VLDL, grandes y pequeñas, una mayor concentración de partículas de LDL, especialmente de las de menor tamaño, y un menor diámetro de las LDL en los pacientes diabéticos. También, es interesante la detección de un menor número de partículas de HDL, con una clara tendencia a tener un menor contenido en colesterol y mayor en triglicéridos. En general, los autores observaron que en el 50% de los pacientes con una evaluación normal de las LDL basada en parámetros clásicos, se detectan anomalías en el estudio por RM. Estas observaciones se realizaron en un grupo de pacientes con diabetes relativamente jóvenes y con triglicéridos normales. En situaciones de mayor alteración metabólica, las anormalidades detectadas por RM son mucho más sustanciales.
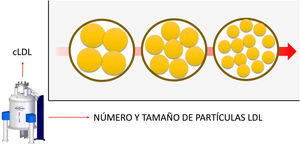
Además de aportar una descripción detallada del número de partículas y su tamaño, la RM permite detectar situaciones metabólicas discordantes. Entiéndase por discordancia la situación en que el parámetro clínico por excelencia para la toma de decisiones terapéuticas, el cLDL, no se correlaciona con el número de partículas de LDL6. En otras palabras, el cLDL es un marcador de las partículas de LDL. A más cLDL, más partículas de LDL. Sin embargo, hay situaciones metabólicas en las que esta correlación se debilita y hay personas que necesitan un mayor número de partículas para transportar la misma cantidad de colesterol (discordantes) (figura 1). La diabetes, el síndrome metabólico o la obesidad, situaciones que comparten la resistencia a la insulina como base patogénica, son un claro ejemplo de discordancia metabólica. Estos pacientes tienden a fabricar LDL más pequeñas, como se detecta en el artículo de referencia8, y por lo tanto pobres en colesterol. Por ello una misma concentración de cLDL basada en partículas pequeñas implica un mayor número de estas. Este hecho no es una mera curiosidad metabólica, sino que implica diferencias en la evaluación del riesgo cardiovascular. El número de partículas es un indicador de riesgo cardiovascular más potente que el cLDL. Un paciente con más cLDL pero menor número de partículas (por lo tanto, sus LDL son mayores) tiene menor riego que otro con un cLDL similar o algo inferior pero con más partículas (partículas de LDL pequeñas)10.
Discordancia entre el colesterol unido a lipoproteínas de baja densidad (cLDL) y el número de partículas de LDL. Una misma cantidad de cLDL, representada en la figura por el círculo exterior, puede ser transportada por un número de partículas de LDL distinto. Si estas son de menor tamaño, se requerirán más partículas y su aterogenicidad será mayor. La resonancia magnética permite evaluar esta situación. La flecha señala el incremento de riesgo.
Además, entran en juego otros parámetros. Como ya se ha comentado, en los últimos años se ha establecido el valor del denominado cRem11. Este es el colesterol transportado por las partículas VLDL, remanentes e IDL. Su determinación clínica es sencilla pero muy inexacta, ya que se basa en la sustracción del cHDL y el cLDL del colesterol total. Dado que el cLDL ya es fruto de un cálculo previo y además incluye el colesterol unido a IDL, el método es inexacto. En general, en situaciones de normotrigliceridemia el cRem se aproxima a la quinta parte de la concentración de triglicéridos. A pesar de su inexactitud en la medida, estudios recientes han mostrado una gran capacidad predictiva del riesgo cardiovascular tanto en la cohorte del estudio PREDIMED4, como en la del Copenhagen City Study5. En ambos su capacidad de predecir el riesgo cardiovascular fue superior a la del propio cLDL. En este sentido la RM aporta una técnica precisa para determinar dicho parámetro, incluyendo el colesterol de todas las subfracciones de VLDL e IDL.
En definitiva, el estudio del metabolismo lipoproteico mediante RM aporta información adicional para el abordaje de los pacientes con alteraciones metabólicas o enfermedades cardiovasculares establecidas. En los pacientes en quienes persiste un riesgo residual a pesar de un abordaje óptimo, la RM aporta datos adicionales, dado que, más allá de las variables lipídicas convencionales, suelen persistir modificaciones cualitativas que impactan en el pronóstico de estos pacientes12.
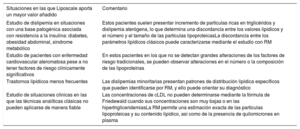
La información que aporta el estudio del metabolismo lipoproteico mediante RM es robusta y útil, por lo que no se puede seguir obviándola en la valoración clínica de nuestros pacientes. Recientemente un grupo de expertos de la Sociedad Española de Arteriosclerosis publicó un documento de consenso sobre la utilidad y las indicaciones del uso clínico del test Liposcale para el estudio de pacientes con alteraciones del metabolismo de las lipoproteínas y riesgo cardiovascular, que se sintetiza en la tabla 113.
Principales indicaciones para el uso clínico de la determinación de las partículas lipoproteicas mediante resonancia magnética
| Situaciones en las que Liposcale aporta un mayor valor añadido | Comentario |
|---|---|
| Estudio de dislipemia en situaciones con una base patogénica asociada con resistencia a la insulina: diabetes, obesidad abdominal, síndrome metabólico | Estos pacientes suelen presentar incremento de partículas ricas en triglicéridos y dislipemia aterógena, lo que determina una discordancia entre los valores lipídicos y el número y el tamaño de las partículas lipoproteicasLa discordancia entre los parámetros lipídicos clásicos puede caracterizarse mediante el estudio con RM |
| Estudio de pacientes con enfermedad cardiovascular ateromatosa pese a no tener factores de riesgo clínicamente significativos | En estos pacientes en los que no se detectan grandes alteraciones de los factores de riesgo tradicionales, se pueden observar alteraciones en el número o la composición de las lipoproteínas |
| Trastornos lipídicos menos frecuentes | Las dislipemias minoritarias presentan patrones de distribución lipídica específicos que pueden identificarse por RM, y ello puede orientar su diagnóstico |
| Estudio de situaciones clínicas en las que las técnicas analíticas clásicas no pueden aplicarse de manera fiable | Las concentraciones de cLDL no pueden determinarse mediante la fórmula de Friedewald cuando sus concentraciones son muy bajas o en las hipertrigliceridemiasLa RM permite una estimación exacta de las partículas lipoproteicas y su contenido lipídico, así como de la presencia de quilomicrones en plasma |
cLDL: colesterol unido a lipoproteínas de baja densidad; RM: resonancia magnética.
Modificado con permiso de Pintó et al.13.
El momento de implementar las técnicas metabolómicas a la clínica ha llegado, el estudio lipoproteico mediante RM es un claro ejemplo.
FINANCIACIÓNNo se ha recibido ningún tipo de financiación para realizar este trabajo.
CONFLICTO DE INTERESESL. Masana ha recibido pagos por conferencias o asesoría de Amgen, Amryt, Amarin, Mylan, Novartis, Sanofi y Servier y es miembro del consejo de administración de Biosferteslab. D. Ibarretxe ha recibido pagos por conferencias de Sanofi y Rubió.