El fenotipado avanzado de lipoproteínas es mejor predictor del riesgo aterosclerótico que el colesterol. El perfil de lipoproteínas en la insuficiencia cardiaca (IC) no está completamente caracterizado. Nuestro objetivo fue describir el perfil de lipoproteínas en IC crónica en comparación con una población de control emparejada.
MétodosEstudio transversal entre mayo 2006 y abril 2014, que incluyó pacientes ambulatorios con IC crónica. Las concentraciones de lípidos y el tamaño de las principales fracciones de lipoproteínas (lipoproteínas de alta densidad [HDL], lipoproteínas de baja densidad [LDL] y lipoproteínas de muy alta densidad) y concentración de sus subfracciones (grandes, medianas y pequeñas) se evaluaron mediante espectroscopia de resonancia magnética.
Resultados429 pacientes con IC crónica se compararon con 428 controles. Los pacientes con IC crónica presentaron menor colesterol total y menor concentración de partículas de LDL (1.115 frente a 1.352 nmol/L; p <0,001) y HDL (25,7 frente a 27,9μmol/L; p <0,001), esta última mediada principalmente por la reducción de la subfracción pequeña de HDL (15,2 frente a 18,6μmol/L; p <0,001). El tamaño medio de las partículas lipoproteínas de muy alta densidad, LDL y HDL fue significativamente mayor en los pacientes con IC. Todas las diferencias relacionadas con la partícula HDL persistieron después del ajuste por clase funcional o índice de masa corporal. Encontramos fuertes correlaciones negativas entre biomarcadores cardiacos (fracción aminoterminal del propéptido natriurético cerebral y interleucina-1 tipo de receptor 1) con concentraciones de LDL y HDL, sus subfracciones pequeñas y el tamaño de la partícula HDL.
ConclusionesLos pacientes con IC crónica difieren significativamente en su perfil de lipoproteínas en comparación con controles emparejados. Se necesitan más investigaciones para comprender mejor la relevancia patogénica de esta diferencia.
Palabras clave
La enfermedad cardiovascular es la primera causa de morbilidad y mortalidad en los países desarrollados. Los eventos ateroescleróticos como el infarto de miocardio y el ictus isquémico aumentan anualmente en todo el mundo1 y la insuficiencia cardiaca (IC) es también una causa de morbilidad y mortalidad cardiovascular en aumento. En algunas regiones, se cree que la prevalencia de la IC habrá aumentado más del 50% hacia 20302.
Por consiguiente, se recomienda estratificar el riesgo cardiovascular individual, que normalmente se evalúa por los valores del perfil lipídico clásico, como colesterol total, triglicéridos, colesterol de las lipoproteínas de baja densidad (LDL) (cLDL) y colesterol de las lipoproteínas de alta densidad (HDL) (cHDL)3. No obstante, esta estratificación clásica del riesgo explica las enfermedades de origen ateroesclerótico, pero no la IC. Además, aunque se sabe que las altas concentraciones de cLDL y las bajas concentraciones de cHDL son factores de riesgo de futuros eventos cardiovasculares, el tratamiento con estatinas no elimina el riesgo cardiovascular total, ni tan siquiera cuando el cLDL es normal. Además, los esfuerzos por reducir el riesgo cardiovascular aumentando la concentración de cHDL circulante han sido poco satisfactorios4–7, por lo que ha habido mayor interés en estudiar el perfil lipoproteico detallado que los valores de colesterol total, triglicéridos o cLDL y cHDL. Las pruebas lipoproteicas basadas en la espectroscopia de resonancia magnética (RM) ordenada por difusión bidimensional (2D) se han convertido en las nuevas pruebas para analizar parámetros lipoproteicos distintos del cLDL, como la concentración, la composición y el tamaño de las partículas lipoproteicas8,9. De hecho, se ha hecho referencia a las concentraciones de partículas de LDL (pLDL), de HDL (pHDL) y sus subfracciones como mejores predictores del riesgo cardiovascular que el cLDL o el cHDL10–13. No obstante, hasta la fecha los estudios se han centrado principalmente en el riesgo ateroesclerótico y no en la población con IC, y los pocos que han examinado los cambios en el perfil lipoproteico en la IC se han centrado mayormente en las pHDL y las subfracciones de las HDL, lo que en conjunto corrobora su intervención en el riesgo de IC, sobre todo cuando se observa una disminución de la subfracción pequeña de las partículas de HDL14–17. Hasta la fecha, se desconoce cómo se afecta el perfil lipoproteico completo en los pacientes ambulatorios con IC crónica.
El objetivo de este estudio esdescribir el perfil lipoproteico completo mediante análisis con espectroscopia de RM ordenada por difusión 2D en una población con IC crónica y comparar los resultados con los de una cohorte sin IC emparejada clínicamente. Para determinar si también se puede detectar las diferencias con la evolución de la enfermedad, se analizó la correlación entre los resultados observados y la clase funcional de la New York Heart Association (NYHA) y entre los biomarcadores cardiacos clásicos de inflamación, fibrosis y remodelado (receptor de tipo 1 de la interleucina 1 [ST2]), lesión (troponina T de alta sensibilidad [hs-TnT]) y distensibilidad cardiaca (fracción aminoterminal del propéptido natriurético cerebral [NT-proBNP]).
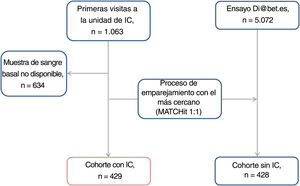
MÉTODOSDiseño del estudio y poblaciónEstudio comparativo y observacional retrospectivo, realizado entre mayo de 2006 y abril de 2014, con pacientes ambulatorios con IC crónica remitidos a una unidad de IC multidisciplinaria en un hospital universitario terciario del área metropolitana noroccidental de Barcelona (Cataluña, España). La remisión de los pacientes a la unidad de IC se llevó a cabo principalmente desde los servicios de Cardiología o Medicina Interna, y en menor grado desde urgencias u otros servicios del hospital. Los criterios para remitir a la unidad de IC fueron IC acorde con la guía de la Sociedad Europea de Cardiología, al menos 1 hospitalización previa por IC o fracción de eyección del ventrículo izquierdo reducida18. Se consideró a los pacientes independientemente de la etiología de la IC, y se los incluyó si tenían 18 años o más y se disponía de una muestra de sangre basal.
Cohorte de controles emparejadosSe compararon los datos de los pacientes con IC con los de los sujetos de control seleccionados del estudio Dia@bet.es19, un estudio poblacional nacional y transversal llevado a cabo entre 2008 y 2010, concebido para examinar la prevalencia de diabetes y alteraciones en la regulación de la glucosa en España. En este estudio de muestras agrupadas, se incluyó a 5.072 participantes seleccionados de manera aleatoria y procedentes de toda España. Se aplicó un proceso de emparejamiento con los más cercanos (técnica MATCHit20) para seleccionar los mejores emparejamientos entre los controles de la cohorte Dia@bet.es y cada uno de los individuos del grupo de pacientes según el sexo, la edad, el índice de masa corporal (IMC), la presencia de diabetes y el tratamiento simultáneo con estatinas, y se optimizó la distancia global entre los pacientes y los controles emparejados. Ninguno de los participantes del grupo de control había sufrido una enfermedad cardiovascular con anterioridad. Para que las cohortes fueran más comparables, la hipertensión o la dislipemia no fueron criterios de exclusión.
Durante la visita inicial, los pacientes de ambas cohortes dieron su consentimiento escrito para utilizar sus datos clínicos con intención de investigar. El comité de ética local aprobó el estudio (código: EO 10-076 y PI 13-095). El estudio se llevó a cabo de conformidad con la ley de protección de datos personales y las reglamentaciones internacionales sobre investigaciones clínicas de la Declaración de Helsinki de la Asociación Médica Mundial21.
Análisis lipoproteico por espectroscopia de resonancia magnéticaLas muestras sanguíneas basales en ayunas se obtuvieron entre las 9.00 y las 12.00 y se almacenaron a –80°C sin ciclos de congelación y descongelación previos. Se envió una muestra de 250μl de suero de cada paciente con hielo seco a Biosfer Teslab (Reus, España) para analizar las lipoproteínas con la prueba Liposcale8. Este avanzado análisis del perfil lipoproteico incluye la caracterización del contenido lipídico (es decir, colesterol y triglicéridos) y el tamaño medio normalizado (z) de cada clase de lipoproteína y la concentración de las partículas (p) y las subfracciones grandes, medianas y pequeñas de cada lipoproteína. Los valores límite fueron los siguientes: > 60nm para las lipoproteínas de muy baja densidad (VLDL) grandes, 45-60nm para las medianas y 35-45nm para las pequeñas; 22,5-27nm para las LDL grandes, 20-22,5nm para las medianas y 18-20nm para las pequeñas; y 9-13nm para las HDL grandes, 8,2-9nm para las medianas y <8,2nm paralas pequeñas. Los coeficientes de variación de las concentraciones de partículas oscilaban entre el 2 y el 4% y fueron inferiores al 0,3% en lo que al tamaño de las partículas se refiere. Se calculó el cociente cHDL/pHDL como una estimación del contenido en colesterol de las partículas de HDL17,22. Para calcular el cociente, se transformaron las unidades del cHDL a μmol/l.
Análisis de biomarcadoresLa concentración de NT-proBNP se determinó con un método de inmunoelectroquimioluminiscencia (Elecsys; Roche Diagnostics, Suiza), que tenía coeficientes de variación entre ejecuciones entre el 0,9 y el 5,5%. Se determinaron las concentraciones de hs-TnT mediante inmunoelectroquimioluminiscencia con el módulo E170 de Modular Analytics (Roche Diagnostics, España). La prueba de hs-TnT tenía un intervalo analítico de 3 a 10.000 ng/l, y los coeficientes de variación fueron del 9% en el percentil 99 de 13 ng/l. La concentración de ST2 en las muestras plasmáticas se determinó mediante inmunoanálisis monoclonal no competitivo de alta sensibilidad (Presage ST2; Critical Diagnostics, Estados Unidos), que tenía un coeficiente dentro de la ejecución inferior al 2,5% y un coeficiente total de variación del 4%.
Análisis estadísticoLas variables continuas expresan media ± desviación estándar o mediana [intervalo intercuartílico] para las distribuciones normal y no normal respectivamente. La normalidad de las variables continuas se evaluó mediante gráficos Q-Q. Las diferencias entre grupos se evaluaron con la prueba de la t de Student, el análisis de la variancia, la prueba de la U de Mann-Whitney o la prueba de Kruskal-Wallis, según el número de comparaciones y las distribuciones de las variables cuantitativas. La significación de las diferencias en las variables cualitativas se evaluó con la prueba de la χ2 o la prueba exacta de Fisher. Puesto que el perfil lipoproteico puede variar con la situación clínica, también se compararon entre sí el colesterol, los triglicéridos y el perfil lipoproteico de los pacientes con IC y los controles utilizando el IMC y la clase funcional de la NYHA. Se hizo un ajuste para múltiples comparaciones con la técnica de Bonferroni. Se utilizaron las correlaciones ordinales de Spearman para probar la correlación entre los parámetros de las HDL y las LDL y los datos demográficos y clínicos, y con el ST2, la hs-TnT y el NT-proBNP. Se consideró significativo un valor de p < 0,05 en la prueba bilateral. Todos los análisis estadísticos se hicieron con la versión 13.0 de STATA (College Station, Estados Unidos).
RESULTADOSCaracterísticas de la poblaciónLa cohorte final del estudio consistió en 429 pacientes con IC crónica; las etiologías más frecuentes fueron cardiopatía isquémica (47,8%), miocardiopatía dilatada (16,3%) y miocardiopatía hipertensiva (10%). Los resultados se compararon con los de 428 sujetos de control (figura 1). En la tabla 1 se describen las características basales de ambas cohortes. Ambas cohortes estaban formadas principalmente por personas de raza blanca (99,6%), adultos mayores (67,2 frente a 66,3 años) y en gran proporción varones (el 72,7 frente al 68,5%). En la cohorte con IC crónica, la media de fracción de eyección del ventrículo izquierdo fue del 35,5% ± 14,4%, y el 22% se clasificó en NYHA III-IV. En la cohorte de pacientes, el ST2 medio fue de 51,2±39,9 ng/ml, la hs-TnT media fue de 44,6±62,3 ng/l y el NT-proBNP medio fue de 5.393,1±18.040,0 ng/l. En la cohorte con IC crónica también fue mayor la proporción de pacientes con hipertensión (el 67,1 frente al 46,9% en la cohorte de control; p < 0,001), mientras que en la cohorte de control fue mayor la proporción de participantes con dislipemia (el 81,3 frente al 65,0% en la cohorte con IC; p < 0,001). En los pacientes con IC crónica fue menor el IMC promedio (27,3 frente a 28,1; p=0,011) y peor la función renal global (tasa de filtrado glomerular estimada, 54,0 frente a 86,9ml/min/1,73 m2; p < 0,001).
Características basales de los pacientes
| Insuficiencia cardiaca | Controles | p | |
|---|---|---|---|
| n=429 | n=428 | ||
| Edad (años) | 67,2±13,4 | 66,3±12,4 | 0,316 |
| Varones | 312 (72,7) | 293 (68,5) | 0,170 |
| Diabetes | 194 (45,2) | 165 (38,5) | 0,051 |
| Hipertensión | 288 (67,1) | 195 (46,9) | <0,001 |
| Dislipemia | 279 (65,0) | 348 (81,3) | <0,001 |
| Estatinas | 335 (78,1) | 338 (79,0) | 0,753 |
| IMC | 27,3±4,8 | 28,1±4,3 | 0,011 |
| TFGe (ml/min/1,73 m2) | 54,0 [36,4-81,1] | 86,9 [68,8-108,3] | <0,001 |
IMC: índice de masa corporal; TFGe: tasa de filtrado glomerular estimada mediante la fórmula de Cockroft-Gault.
Salvo otra indicación, los resultados expresan n (%) —variables categóricas—, media ± desviación estándar o mediana [intervalo intercuartílico] —variables cuantitativas—.
En la tabla 2 se detallan el colesterol total, los triglicéridos totales y un perfil lipoproteico completo para cada cohorte. En los pacientes con IC crónica fue significativamente menor el colesterol sérico total (195,3 frente a 215,4mg/dl en los controles; p <0,001), principalmente por valores más bajos de cLDL (110,6 frente a 129,9mg/dl; p <0,001) y cHDL (48,6 frente a 51,9mg/dl; p <0,001). El cVLDL fue significativamente mayor en los pacientes con IC que en los controles (19,0 frente a 18,1mg/dl; p=0,022). Los triglicéridos totales no fueron distintos entre los 2 grupos.
Comparación entre el colesterol, los triglicéridos y las subclases de lipoproteínas de los sujetos con insuficiencia cardiaca y los controles
| Insuficiencia cardiaca | Controles | p | |
|---|---|---|---|
| n=429 | n=428 | ||
| Colesterol total (mg/dl) | 195,29±37,86 | 215,39±34,59 | <0,001 |
| Triglicéridos totales (mg/dl) | 115,62 [92,67-149,05] | 115,66 [89,76-145,64] | 0,941 |
| Número de partículas de VLDL (nmol/l) | |||
| Total | 51,75 [38,25-72,06] | 50,08 [34,96-72,27] | 0,735 |
| Grandes | 1,39 [1,09-1,74] | 1,40 [1,03-1,92] | 0,081 |
| Medianas | 5,63 [4,14-7,54] | 4,20 [2,94-5,83] | <0,001 |
| Pequeñas | 44,32 [32,82-62,98] | 43,11 [30,21-65,24) | 0,422 |
| cVLDL (mg/dl) | 19,04 [14,52-26,61] | 18,14 [11,74-24,82] | 0,022 |
| tgVLDL (mg/dl) | 69,58 [50,82-96,21] | 65,32 [46,25-92,24] | 0,935 |
| zVLDL (nm) | 42,17±0,20 | 41,90±0,42 | <0,001 |
| Número de partículas de LDL (nmol/l) | |||
| Total | 1.155±275,7 | 1.352±283,9 | <0,001 |
| Grandes | 179,8±38,0 | 182,3±39,8 | 0,347 |
| Medianas | 339,9±125,2 | 377,6±135,7 | <0,001 |
| Pequeñas | 635,4±137,3 | 792,2±176,0 | <0,001 |
| cLDL (mg/dl) | 110.62±27,87 | 129,92±28,32 | <0,001 |
| tgLDL (mg/dl) | 17,32±5,76 | 17,30±5,13 | 0,585 |
| zLDL (nm) | 21,04±0,24 | 20,92±0,39 | <0,001 |
| Número de partículas de HDL (nmol/l) | |||
| Total | 25,68±5,43 | 27,86±4,84 | <0,001 |
| Grandes | 0,29 [0,26-0,33] | 0,27 [0,25-0,30] | <0,001 |
| Medianas | 10,23±1,99 | 8,99±1,50 | <0,001 |
| Pequeñas | 15,15±4,92 | 18,59±4,20 | <0,001 |
| cHDL (mg/dl) | 48,57±10,41 | 51,91±11,07 | <0,001 |
| tgLDL (mg/dl) | 16,61 [14,41-19,95] | 17,19 [14,28-20,49] | 0,585 |
| zHDL (nm) | 8,32 [8,25-8,51] | 8,24 [8,19-8,31] | <0,001 |
| Cociente cHDL/pHDL | 49,26±5,89 | 47,99±4,00 | <0,001 |
c: colesterol contenido; cHDL/pHDL: cociente entre cHDL y la concentración de partículas de HDL; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; tg: triglicéridos contenidos; VLDL: lipoproteínas de muy baja densidad; z: tamaño medio normalizado de las partículas.
Los valores expresan media±desviación estándar o mediana [intervalo intercuartílico].
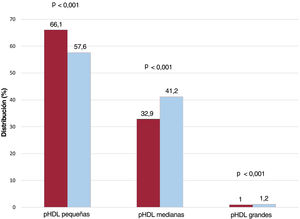
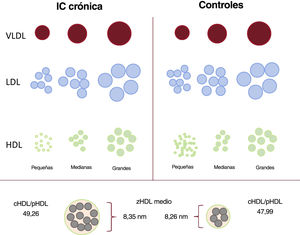
La población con IC crónica comparada con los controles, tenían valores inferiores del total de pLDL (1.155 frente a 1.352 nmol/l) y pHDL (25,7 frente a 27,9μmol/l; ambas, p < 0,001). El análisis detallado de las subfracciones puso de relieve que la menor cifra global de pLDL puede atribuirse a cifras más bajas de las 3 subfracciones. La menor cifra total de pHDL se debió principalmente a la menor concentración de la subfracción pequeña de las HDL (15,2 frente a 18,6μmol/l; p <0,001); no obstante, la concentración de las subfracciones medianas y grandes de las HDL fue significativamente mayor en la cohorte con IC crónica (10,23 frente a 8,99μmol/l las medianas y 0,29 frente a 0,27μmol/l las grandes; p <0,001). Se constató una diferencia relativa negativa del 8,5% en las subfracciones pequeñas de las HDL y diferencias relativas positivas del 8,3% en las subfracciones medianas de las HDL y del 0,2% en las grandes (figura 2). No se observaron diferencias significativas en la concentración de partículas de VLDL. Con respecto al tamaño de las partículas lipoproteicas, los 3 tipos de partículas (VLDL, LDL y HDL) fueron mayores en las muestras de los pacientes con IC que en los controles. Además, el cociente cHDL/pHDL, un estimador del contenido en colesterol de las partículas de HDL, fue mayor en la población con IC crónica (49,26 frente a 47,99; p <0,001) (figura 3). También se evaluaron las diferencias en el perfil lipoproteico según la etiología isquémica en un análisis de sensibilidad; los resultados de este análisis adicional fueron congruentes y estas diferencias fueron más pronunciadas en el grupo isquémico ().
Proporción de las subfracciones lipoproteicas de las HDL en pacientes con IC crónica y controles emparejados. Comparación entre las diferencias en la proporción de las subfracciones de las partículas HDL pequeñas, medianas y grandes entre los pacientes con IC crónica (rojo) y los controles (azul). IC: insuficiencia cardiaca; pHDL: concentración de las partículas de las lipoproteínas de alta densidad. Para las comparaciones, se utilizó la prueba de la χ2.
Perfil lipoproteico de los pacientes con IC crónica frente a los controles emparejados. Visión general esquemática de la alteración lipoproteica observada en la población con IC crónica comparada con los controles emparejados. Reducción generalizada de las cifras de pLDL y pHDL, en el último caso por la considerable disminución de la subfracción de las HDL pequeñas. Aumento generalizado del tamaño de las partículas, con un aumento del contenido en colesterol de las partículas de HDL expresado como un aumento del cociente cHDL/pHDL. cHDL/pHDL: cociente entre el cHDL y las partículas de HDL; HDL: lipoproteínas de alta densidad; IC: insuficiencia cardiaca; LDL: lipoproteínas de baja densidad; VLDL: lipoproteínas de muy baja densidad; z: tamaño medio normalizado de las partículas.
Se observó que la concentración sérica de colesterol total era significativamente menor en los pacientes con IC en NYHA I-II y III-IV que en los controles, con concentraciones incluso menores de colesterol total en aquellos con IC en NYHA III-IV (tabla 3). Se observaron concentraciones de cVLDL inferiores en los pacientes con IC en NYHA clase III-IV y valores de cHDL inferiores en los pacientes con IC en NYHA I-II comparados con los controles. También se observó una tendencia a la disminución del cLDL al empeorar la clase funcional de la NYHA.
Comparación entre el colesterol, los triglicéridos y las subclases de lipoproteínas de los sujetos con insuficiencia cardiaca y los controles según la clase de la NYHA
| Insuficiencia cardiaca | Controles | p | ||
|---|---|---|---|---|
| NYHA III-IV | NYHA I-II | |||
| n=93 | n=336 | n=428 | ||
| Colesterol total (mg/dl) | 191,5±40,3 | 196,3±37,1 | 215,39±34,59 | <0,001a,b |
| Triglicéridos totales (mg/dl) | 103,8 [90,1-135,2] | 118,3 [94,5-151,2] | 115,7 [89,8-145,6] | 0,207 |
| Número de partículas de VLDL (nmol/l) | ||||
| Total | 44,14 [36,23-58,10] | 54,29 [39,37-73,93] | 50,08 [34,96-72,27] | 0,088 |
| Grandes | 1,27 [1,05-1,58] | 1,42 [1,11-1,80] | 1,40 [1,03-1,92] | 0,039 |
| Medianas | 4,53 [3,65-6,57] | 5,90 [4,32-7,74] | 4,20 [2,94-5,84] | <0,001a |
| Pequeñas | 38,33 [31,35-49,88] | 47,33 [33,43-64,51] | 43,11 [30,21-65,24) | 0,078 |
| cVLDL (mg/dl) | 17,13 [13,28-23,84] | 19,96 [15,23-27,76] | 18,14 [11,74-24,82] | 0,007a |
| tgVLDL (mg/dl) | 58,84 [48,29-79,09] | 72,97 [52,73-97,43] | 65,32 [46,25-92,24] | 0,083 |
| zVLDL (nm) | 42,17±0,19 | 42,16±0,20 | 41,90±0,42 | <0,001a,b |
| Número de partículas de LDL (nmol/l) | ||||
| Total | 1.128±280,3 | 1.162±274,4 | 1.352±283,9 | <0,001a,b |
| Grandes | 180,1±38,4 | 179,7±37,9 | 182,3±39,8 | 0,640 |
| Medianas | 345,0±131,3 | 338,5±123,6 | 336,6±135,7 | <0,001a |
| Pequeñas | 603,6±136,2 | 644,1±136,5 | 792,2±176,0 | <0,001a,b |
| cLDL (mg/dl) | 108,40±27,98 | 111,23±27,85 | 129,92±28,32 | <0,001a,b |
| tgLDL (mg/dl) | 17,98±6,59 | 17,14±5,50 | 17,30±5,13 | 0,417 |
| zLDL (nm) | 21,12±0,25 | 21,02±0,24 | 20,92±0,39 | <0,001a,b,c |
| Número de partículas de HDL (nmol/l) | ||||
| Total | 29,94±6,16 | 25,88±5,20 | 27,86±4,84 | <0,001a,b |
| Grandes | 0,31 [0,27-0,35] | 0,30 [0,26-0,32] | 0,27 [0,25-0,30] | <0,001a,b,c |
| Medianas | 11,06±2,35 | 10,00±1,81 | 8,99±1,50 | <0,001a,b,c |
| Pequeñas | 13,57±5,18 | 15,59±4,76 | 18,59±4,20 | <0,001a,b,c |
| cHDL (mg/dl) | 49,04±11,78 | 48,44±10,01 | 51,91±11,07 | <0,001a |
| tgLDL (mg/dl) | 16,29 [14,68-19,96] | 16,77 [14,27-19,87] | 17,19 [14,28-20,49] | 0,751 |
| zHDL (nm) | 8,38 [8,32-8,47] | 8,31 [8,25-8,38] | 8,24 [8,19-8,31] | <0,001a,b,c |
| Cociente cHDL/pHDL | 51,27±5,70 | 48,70±5,83 | 47,99±4,00 | <0,001 a,b,c |
c: colesterol contenido; cHDL/pHDL: cociente entre el cHDL y la concentración de partículas de HDL; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; NYHA: clase funcional de la New York Heart Association; tg: triglicéridos contenidos; VLDL: lipoproteínas de muy baja densidad; z: tamaño medio normalizado de las partículas.
Los valores expresan media ± desviación estándar o mediana [intervalo intercuartílico].
Diferencias significativas con p < 0,05.
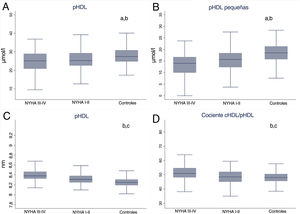
Los valores totales de pLDL y pHDL fueron inferiores en los pacientes con IC que en los controles, con una tendencia significativa a disminuir según empeora la clase funcional de la NYHA (p < 0,001). Como en el conjunto de la cohorte, estas diferencias fueron resultado principalmente de diferencias significativas en las subfracciones pequeñas, con cualquier clase de la NYHA, y seguían el mismo patrón que el observado para el total de la cohorte con IC crónica. El tamaño de las partículas lipoproteicas aumentó al empeorar la clase funcional de la NYHA, y el tamaño de las partículas de VLDL, LDL y HDL fue mayor entre los pacientes con IC en NYHA III-IV (p <0,001).
Al empeorar la clase funcional de la NYHA, se observó una tendencia al aumento del cociente cHDL/pHDL, que fue máximo en los pacientes con IC en NYHA III-IV (p <0,001) (figura 4).
Alteración del perfil lipoproteico de las HDL en las distintas clases funcionales de la NYHA en pacientes con IC crónica comparados con una cohorte de controles emparejados. Gráfico de cajas que compara las pHDL totales (A), las HDL pequeñas (B), el tamaño medio de las partículas de HDL (C) y el cociente cHDL/pHDL estimado (D) en las distintas clases funcionales de la NYHA de los pacientes con IC frente a los controles sin IC emparejados. cHDL/pHDL: cociente entre el colesterol unido a HDL y las partículas HDL; HDL: lipoproteínas de alta densidad; IC: insuficiencia cardiaca; NYHA: clase funcional de la New York Heart Association; p: concentración de partículas.
Diferencias significativas con p < 0,05.
aControles frente a NYHA I-II.
bControles frente a NYHA III-IV.
cNYHA I-II frente a NYHA III-IV.
El IMC no alteró el patrón de diferencias en el perfil lipoproteico entre los pacientes con IC crónica y los controles ().
Correlaciones entre las medidas de las partículas de LDL y HDL y los parámetros clínicos y biológicosSe investigó la correlación entre las partículas de HDL y LDL y otros parámetros clínicos y biológicos en la población con IC (tabla 4). En resumen, la fracción de eyección del ventrículo izquierdo mostró una significativa correlación positiva con la concentración sérica total y la subfracción pequeña de pHDL. Se observaron asociaciones negativas significativas del NT-proBNP, la hs-TnT y el ST2 con las pLDL y las pHDL totales. Se constató una asociación positiva significativa entre los 3 biomarcadores con el tamaño de las HDL, así como una asociación negativa con la subfracción pequeña de las LDL, que en el caso de la subfracción pequeña de las HDL se mantuvo para el NT-proBNP y el ST2. En cambio, se observaron asociaciones positivas entre el NT-proBNP y el ST2 y el cociente cHDL/pHDL y el tamaño de las LDL.
Correlación entre las LDL y HDL obtenidas por espectroscopia de resonancia magnética y los parámetros clínicos y bioquímicos en pacientes con IC
| FEVI (%) | NT-proBNP (ng/l) | hs-TnT (ng/l) | ST2 (ng/ml) | |
|---|---|---|---|---|
| Número de partículas de LDL (nmol/l) | ||||
| Total | 0,09(0,00-0,18) | –0,24(–0,33; –0,14)*** | –0,28(–0,40; –0,16)*** | –0,18(–0,29; –0,07)** |
| Grandes | 0,11(0,01; 0,20)* | –0,11(–0,21; –0,01)* | –0,21(–0,32; –0,09)*** | –0,05(–0,15; 0,05) |
| Medianas | 0,11(0,03; 0,20)* | –0,13(–0,22; –0,03)** | –0,19(–0,31; –0,06)** | –0,05(–0,15; 0,06) |
| Pequeñas | 0,05(–0,04; 0,14) | –0,32(–0,41; –0,24)*** | –0,32(–0,44; –0,20)*** | –0,30(–0,40; –0,19)*** |
| cLDL (mg/dl) | 0,09(–0,01; 0,18) | –0,20(–0,30; –0,11)*** | –0,30(–0,41; –0,19)*** | –0,16(–0,27; –0,05)** |
| zLDL (nm) | 0,08(–0,02; 0,17) | 0,23(0,14; 0,32)*** | 0,10(–0,03; 0,23) | 0,24(0,14; 0,35)*** |
| Número de partículas de HDL (nmol/l) | ||||
| Total | 0,18(0,08; 0,27)*** | –0,21(–0,31; –0,12)*** | –0,27(–0,39; –0,15)*** | –0,19(–0,30; –0,07)** |
| Grandes | 0,12(0,03; 0,22)* | 0,02(–0,07; 0,12) | –0,07(–0,20; 0,06) | –0,02(–0,13; 0,09) |
| Medianas | 0,13(0,03; 0,23)** | 0,26(0,16; 0,35)*** | 0,07(–0,06; 0,20) | 0,19(0,08; 0,30)** |
| Pequeñas | 0,14(0,04; 0,23)** | –0,34(–0,42; –0,25)*** | –0,32(–0,44; 0,21) | –0,28(–0,39; 0,18)*** |
| cHDL (mg/dl) | 0,15(0,06; 3,85)** | –0,08(–0,17; 0,01) | –0,24(–0,36; –0,12)*** | –0,09(–0,20; 0,02) |
| zHDL (nm) | –0,05(–0,14; 0,05) | 0,41(0,33; 0,49)*** | 0,29(0,18; 0,41)*** | 0,35(0,25; 0,45)*** |
| Cociente cHDL/pHDL | –0,01(–0,10; 0,09) | 0,29(0,20; 0,38)*** | 0,05(–0,07; 0,17) | 0,23(0,12; 0,33)*** |
c: colesterol contenido; cHDL/pHDL: cociente entre el colesterol unido a HDL y las partículas de HDL; FEVI: fracción de eyección del ventrículo izquierdo; HDL: lipoproteínas de alta densidad; hs-TnT: troponina T de alta sensibilidad; IC: insuficiencia cardiaca; LDL: lipoproteínas de baja densidad; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; ST2: receptor de tipo 1 de la interleucina 1; z: tamaño medio normalizado de las partículas.
Los valores expresan coeficientes de correlación ordinal de Spearman e intervalos de confianza del 95%.
Este estudio proporciona una descripción detallada del perfil lipoproteico analizado por espectroscopia de RM ordenada por difusión 2D en una cohorte real de pacientes ambulatorios con IC crónica comparada con una cohorte emparejada por edad, sexo, presencia de diabetes y tratamiento con estatinas. El presente estudio indica que existen alteraciones considerables del perfil lipoproteico en la IC crónica. En esta enfermedad, la concentración sérica total de colesterol fue significativamente inferior a la de los controles, principalmente por una reducción del cLDL y cHDL. En los pacientes con IC crónica también fue mayor el tamaño de las partículas de las 3 lipoproteínas (zVLDL, zLDL y zHDL) y menores en conjunto la pLDL y la pHDL, en este último caso por una menor concentración de la subfracción pequeña de las HDL. Por último, la alteración observada fue invariable independientemente de la clase funcional de la NYHA, que tiende a empeorar según aumenta.
Las concentraciones séricas totales de colesterol, cLDL y pLDL fueron inferiores en la cohorte con IC crónica. Una explicación posible es que el colesterol total y las LDL hayan disminuido por la IC crónica avanzada. La disminución progresiva de la concentración de colesterol total con el empeoramiento de la clase funcional de la NYHA podría coincidir con esta hipótesis. Además, las bajas concentraciones de colesterol total y de cLDL se han asociado anteriormente con un peor pronóstico y mayor mortalidad en los pacientes con IC, independientemente de su etiología23. No obstante, esta última explicación, conocida como la «paradoja del colesterol», si bien es plausible, normalmente se relaciona con la caquexia24,25. En cambio, las diferencias observadas en las concentraciones de colesterol entre los pacientes con IC y los controles se produjeron en las franjas de IMC de obesidad y sobrepeso, pero no con IMC < 25. Por otro lado, los estudios in vitro apuntan que las citocinas circulantes, que actúan como sustancias causantes del aumento de la mortalidad, pueden disminuir la concentración de las partículas lipoproteicas y el colesterol al atenuar la producción hepática de lipoproteínas y aumentar la actividad de los receptores de las LDL. Si fuera así, las LDL se considerarían un predictor independiente de la mortalidad y no solo un marcador de la situación nutricional26,27.
Las menores cifras totales de pLDL y pHDL observadas en la cohorte de IC, esta última atribuible a una menor concentración de HDL pequeñas, también las describieron Potočnjak et al. y Hunter et al.14–16. Aunque esos estudios utilizaron distintos métodos para analizar las partículas pequeñas de HDL, relacionaron esta observación con aumento de la mortalidad en pacientes con IC aguda y en una población con IC derivada de un laboratorio de hemodinámica respectivamente. Asimismo, hace poco nuestro grupo ha publicado la existencia de una relación entre la menor concentración de la subfracción pequeña de HDL y la muerte cardiovascular en pacientes con IC17. En el presente estudio, se observa un cambio progresivo en estos parámetros con el empeoramiento de la clase funcional de la NYHA y una relación positiva significativa de la pHDL total y la subfracción pequeña HDL con la fracción de eyección del ventrículo izquierdo. Estas observaciones, junto con una correlación negativa de estas alteraciones con las concentraciones de NT-proBNP y ST2, indican una probable relación no solo con la propia IC, sino también con la gravedad de la enfermedad. Esta observación coincide con informes anteriores15,28. En general, estos resultados explican claramente la importancia de las HDL en la IC. Queda por dilucidar si estas alteraciones en las HDL constituyen simplemente un marcador en la IC o son relevantes en el proceso fisiopatológico de la enfermedad. Debería considerarse que las partículas de HDL pueden tener efectos favorables en la función miocárdica global. En los informes experimentales se demuestra que las HDL pueden evitar la isquemia y reducir el remodelado miocárdico29. Además, las partículas pequeñas y densas de las HDL pueden tener propiedades antiinflamatorias en las células endoteliales e inhibir la apoptosis inducida por las LDL oxidadas30.
Con respecto al tamaño de las partículas lipoproteicas, se observó que las 3 partículas (VLDL, LDL y HDL) en pacientes con IC crónica eran mayores que en los controles. Los triglicéridos suelen conllevar cambios en el diámetro de las lipoproteínas, pero en los 2 grupos los triglicéridos plasmáticos fueron bastante similares, lo que indica que el mayor tamaño es una característica específica de la IC crónica. El tamaño de las partículas lipoproteicas se ha relacionado en conjunto con riesgo cardiovascular ateroesclerótico31, pero depende principalmente de las pHDL grandes y las pLDL pequeñas y densas31,32, lo que no concuerda con nuestras observaciones. En la cohorte con IC crónica de este estudio, el mayor tamaño de zLDL y zHDL se debió a valores menores de las subfracciones pequeñas de las LDL y las HDL. Al igual que lo observado en el número de partículas de HDL, el tamaño de las pHDL se ha relacionado previamente con riesgo cardiovascular total32, mortalidad por cualquier causa16 y muerte cardiovascular en la IC17. Al igual que con las observaciones de este estudio en cuanto a la subfracción pequeña de las HDL, también se observó una gradación positiva de zVLDL, zLDL y zHDL con la clase funcional de la NYHA. Hunter et al.16 informaron de una relación positiva similar entre el zHDL y el grado de disfunción del ventrículo izquierdo, y observaron que el menor zHDL era el de los pacientes sin IC y el mayor el de aquellos con IC y fracción de eyección reducida, mientras que aquellos con IC y fracción de eyección conservada se situaban en medio. Además, en el presente estudio, se observa una asociación positiva entre el zHDL y los biomarcadores cardiacos, lo que enfatiza una probable relación del zHDL con la presencia y la gravedad de la IC.
En estudios anteriores se ha estudiado el cociente cHDL/pHDL como marcador indirecto del contenido en colesterol de las partículas de HDL17,22,33. Las pruebas demuestran que la pHDL con sobrecarga de colesterol se relaciona con la progresión de la ateroesclerosis carotídea en una población sin la enfermedad y con mortalidad cardiovascular en una población con IC crónica. En el presente estudio, se observó que los pacientes con IC crónica presentaban pHDL con sobrecarga de colesterol comparados con los controles. Como con la pHDL total, la subfracción pequeña de las HDL y el zHDL, se constató la importancia del cociente cHDL/pHDL en lo que respecta a la presencia y la gravedad de la IC. La sobrecarga de colesterol de las partículas de HDL en la IC no está muy clara, y hay que investigar si se debe a una alteración en la remodelación de las HDL, el transporte inverso del colesterol de las HDL o una eliminación anómala de la subfracción grande de las HDL. Convendría investigar el mecanismo fisiopatológico detallado de esta observación en la IC.
Hay controversia sobre la influencia del contenido en colesterol de las partículas de HDL y el número de cHDL con riesgo cardiovascular a largo plazo, y podría explicarse por los complejos mecanismos fisiopatológicos que intervienen en su metabolismo34. En futuras investigaciones hay que prestar más atención a la cuestión de si todas las diferencias observadas en este estudio en relación con la población con IC tienen un impacto real en los resultados cardiovasculares a largo plazo.
LimitacionesEste estudio tiene algunas limitaciones. Con el diseño observacional pueden describirse las diferencias entre los perfiles lipoproteicos de los pacientes con IC crónica y los controles no afectados, pero no se puede extraer conclusiones definitivas de los resultados, que solo pueden servir para generar hipótesis. Puesto que los pacientes con IC que participaron en el estudio procedían de una unidad especializada en IC, estos resultados no pueden extrapolarse a otras poblaciones con IC, como personas con IC aguda o pacientes con IC en atención primaria. Debido al largo periodo de inclusión, no puede descartarse que hayan influido en los resultados del estudio los cambios en el diagnóstico y el tratamiento de la IC y la dislipemia durante este periodo. Las HDL tienen múltiples funciones como el transporte inverso del colesterol y la actividad antioxidante y antiinflamatoria35; de hecho, se ha demostrado que la funcionalidad de las HDL es más predictiva de eventos que su concentración en lo que respecta a la IC36,37. No se ha determinado ningún parámetro sobre la funcionalidad de las HDL y no se ha podido establecer diferencias entre las poblaciones con y sin IC en estos parámetros. Igualmente, no se determinaron parámetros nutritivos o inflamatorios y no pudo descartarse su influencia en los resultados observados. Podrían utilizarse otras muchas variables como criterios de emparejamiento en la selección de los controles, y las diferencias observadas podrían variar.
Los puntos fuertes de este estudio son que los valores de colesterol total y triglicéridos y el perfil lipoproteico son representativos de una cohorte de pacientes con IC crónica de la vida real. El grupo de control se seleccionó emparejando diversas variables clínicas, como edad, sexo, presencia de diabetes y tratamiento con estatinas, todas las cuales podrían influir en los resultados de las pruebas lipoproteicas, por lo que es más probable que las diferencias observadas se deban exclusivamente a la IC. Además, puesto que la concentración de lipoproteínas puede variar con la situación clínica, también se describe una comparación detallada de los subgrupos que tiene en cuenta el IMC y la clase funcional de la NYHA. Los resultados podrían servir como valores de referencia para la IC crónica en estudios futuros.
CONCLUSIONESEn una población ambulatoria con IC crónica, se observaron alteraciones considerables en las concentraciones séricas de colesterol total y de varias partículas lipoproteicas en comparación con un grupo de controles emparejados. Se presenta una descripción detallada de cada variable de modo que las observaciones puedan servir en el futuro como valores de referencia en la IC crónica. En general, la población con IC crónica presentaba menores concentraciones séricas de colesterol total y de partículas de LDL y de HDL. La reducción en la concentración de partículas HDL se debe a una significativa reducción de la subfracción pequeña de HDL. El tamaño de las partículas lipoproteicas fue significativamente mayor en la IC crónica, y en estos pacientes también se constató un cociente cHDL/pHDL alto. Las causas finales de las diferencias observadas en los perfiles lipoproteicos en la IC probablemente sean multifactoriales y deberían dilucidarse en investigaciones futuras.
Cabe destacar que todas las alteraciones en las HDL detectadas en los pacientes con IC crónica fueron invariables independientemente de la clase funcional de la NYHA o el IMC, aunque con una tendencia significativa a empeorar a mayor clase funcional de la NYHA. Este patrón indica que hay que saber más sobre las partículas de HDL en el contexto de la IC para comprender mejor su función patógena.
- –
El análisis de las partículas lipoproteicas ha aparecido como un nuevo y prometedor marcador de eventos cardiovasculares ateroescleróticos. No obstante, se carece de información sobre cómo varían las partículas lipoproteicas en la IC.
- –
Este artículo proporciona una descripción detallada del colesterol y las partículas lipoproteicas, posibles valores de referencia para futuros estudios, en pacientes con IC crónica comparados con un grupo de control emparejado. En resumen, los pacientes con IC crónica tienen concentraciones reducidas de partículas de LDL y HDL; en el caso de estas últimas, mediada por una reducción de la subfracción pequeña de HDL, lo que hace que las partículas HDL sean mayores y con mayor contenido en colesterol. Este patrón indica que convendría saber más sobre las partículas de HDL en el contexto de la IC para comprender mejor su función patógena.
Esta investigación contó con financiación de la Fundació La MARATÓ de TV3 (201502 y 201516 para A. Bayés-Genís, 201602-30-31 para N. Alonso y J. Julve); el Ministerio de Educación y Ciencia (SAF2014-59892 a A. Bayés-Genís); AdvanceCat (2014-2020 a A. Bayés-Genís); el Ministerio de Economía y Competitividad (MINECO)-Instituto de Salud Carlos III (ISCIII) (PI17-00232 a J. Julve, PI17-01362 a A. Bayés-Genís, PI15-00625 a D. Mauricio y RED2018-102799-T a J. Julve); Centro de Investigación Biomédica en Red Enfermedades Cardiovaculares (CIBERCV, CB16/11/00403 Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas [CIBERDEM, CB15/00071 y CB07/08/0016]), una iniciativa del ISCIII, España, con cofinanciación del Fondo Europeo de Desarrollo Regional (FEDER) y el Programa ISCIII Miguel Servet II (CPII18/00004 a J. Julve).
CONFLICTO DE INTERESESN. Amigó posee acciones de Biosfer Teslab y tiene una patente relacionada con el perfil lipoproteico descrito en el presente artículo. Los demás autores no tienen nada que declarar. Los patrocinadores de la financiación no participaron de manera alguna en el diseño del estudio, la obtención, análisis o interpretación de los datos, la redacción del artículo o la decisión de publicar los resultados.
CONTRIBUCIÓN DE LOS AUTORESA. Teis, Germán Cediel, N. Amigó, J. Julve, D. Mauricio, N. Alonso y A. Bayés-Genís contribuyeron a la concepción y el diseño del estudio. A. Teis, N. Amigó, E. Castelblanco, J. Ribalta, M. Guardiola, J. Franch, M. Bermúdez-López, P. Codina y J. Lupón contribuyeron a la obtención de datos para el estudio. A. Teis y G. Cediel analizaron e interpretaron los datos. Todos los autores participaron activamente en la redacción del artículo y su revisión crítica y aprobaron y acordaron la versión final. A. Teis y E. Castelblanco contribuyeron por igual a este artículo.
Se agradece al equipo de enfermería su participación activa en la obtención de muestras para el biobanco.