Palabras clave
INTRODUCCION
El principal objetivo del tratamiento del infarto agudo de miocardio (IAM) es restablecer la perfusión tisular1. Incluso en pacientes con una arteria relacionada con el infarto abierta, un defecto de perfusión microvascular se asocia con un peor pronóstico1-5.
La extensión del defecto de perfusión puede variar en los meses siguientes al IAM5,6. Mediante resonancia magnética cardiaca (RMC), la evolución de la perfusión es controvertida. Mientras unos autores, especialmente a través del análisis de las secuencias de captación tardía de gadolinio, han definido la perfusión anormal como un fenómeno siempre transitorio en pacientes con flujo TIMI 37-8, con el estudio de las secuencias de primer paso se ha detectado que la alteración de la perfusión puede hacerse crónica9,10. En el umbral de la era de la medicina regenerativa11 es importante clarificar si las alteraciones de la perfusión miocárdica pueden persistir en fase crónica tras un IAM con flujo TIMI 3 mantenido.
El método ideal para analizar la perfusión miocárdica todavía no está aclarado1. Con las limitaciones impuestas por su carácter invasivo, la ecografía miocárdica con inyección intracoronaria de contraste (EMC) permite evaluar de forma clara la perfusión y puede ser una técnica de referencia2,5,12.
Mediante EMC evaluamos la presencia de alteraciones de la microcirculación en fase crónica tras un IAM, así como su significado en relación con la dilatación ventricular y la función sistólica.
MÉTODOS
Grupo de estudio
Incluimos prospectivamente 67 pacientes consecutivos con un primer IAM con elevación del segmento ST tratados con trombolisis dentro de las primeras 6 h del inicio del dolor y a los que se realizó un cateterismo cardiaco (con angioplastia si era necesario) antes del alta. Los criterios de inclusión fueron: a) un curso clínico estable sin complicaciones durante los primeros 6 meses; b) enfermedad de un vaso con flujo TIMI 3 y estenosis residual < 50% en la arteria relacionada con el infarto al final del cateterismo prealta y en el sexto mes, y c) ausencia de contraindicaciones para la RMC. Excluimos 20 pacientes por enfermedad multivaso (10 casos), flujo TIMI < 3 (2 casos), reestenosis (5 casos), claustrofobia (2 casos) y reinfarto (un caso). Por lo tanto, el grupo de estudio final estaba compuesto por 47 pacientes.
El estudio cumple la Declaración de Helsinki y fue aprobado por el comité de ética de nuestra institución. Todos los sujetos firmaron el consentimiento informado.
Los pacientes incluidos en el grupo de estudio forman parte de un protocolo prospectivo en el que se evalúan diferentes aspectos de la remodelación, la perfusión y la viabilidad miocárdica mediante diferentes técnicas invasivas y no invasivas5,9,12,13. Recientemente hemos analizado la evolución de la microcirculación mediante secuencias de primer paso de gadolinio con RMC en 40 pacientes de esta serie9. Con 17 pacientes incluidos en este protocolo se realizó un análisis preliminar de la evolución de la perfusión con EMC, angiografía y RMC5. En el presente trabajo presentamos un análisis más exhaustivo de la evolución de las anomalías de la perfusión mediante EMC en un grupo de 47 pacientes.
Cateterismo cardiaco
Se realizó 4 ± 1 días tras el IAM. Se efectuó angioplastia de rescate dentro de las primeras 12 h tras la trombolisis en 3 pacientes por dolor torácico y elevación persistente del segmento ST. En estos 3 pacientes se repitió el cateterismo antes del alta y los índices de perfusión (tanto el flujo TIMI como la EMC) se determinaron en ese momento.
La arteria relacionada con el infarto fue la descendente anterior en 29 casos y la coronaria derecha en 18 casos. Se implantó un stent intracoronario en 41 pacientes (87%) con estenosis residual > 50%. Al final del cateterismo prealta todos los pacientes mostraron un flujo TIMI 3 y estenosis residual < 50%. Se repitió el cateterismo cardiaco a los 179 ± 8 días tras el IAM y se confirmaron el flujo TIMI 3 y la estenosis residual < 50% en todos los pacientes incluidos.
Ecografía miocárdica con inyección intracoronaria de contraste
Al final del cateterismo cardiaco (tanto prealta como en el sexto mes) se realizó la EMC de acuerdo con el protocolo previamente establecido en nuestro laboratorio5. Se inyectó un bolo de 1 ml (concentración 350 mg/ml) de Levovist (Schering AG, Alemania) seguido de 5 ml de suero salino a través del catéter que canalizaba la arteria responsable del infarto para las vistas paraesternal y apical. Se administraron bolos sucesivos de 1 ml de contraste si era necesario. Tras más de 100 estudios realizados no hemos detectado ningún efecto secundario. Las imágenes se registraron en tiempo real y segundo armónico, y se usó el ecocardiógrafo Ving Med 750 (General Electrics, Estados Unidos); la ganancia y la compresión se optimizaron en cada caso y no se variaron durante los estudios.
Análisis de la ecografía miocárdica con inyección intracoronaria de contraste
Las imágenes se digitalizaron y fueron analizadas en días separados por un observador experimentado que no conocía el resultado del resto de las exploraciones. Se capturaron las imágenes con máxima intensidad de contraste en telesístole y se definió el área de riesgo como la que incluía los segmentos dependientes de la arteria relacionada con el infarto en el modelo de 17 segmentos14. La cuantificación de las imágenes de perfusión se realizó mediante el paquete informático MATLAB 6.5 (The Mathworks Inc., Estados Unidos)12. Se definió una región de interés en cada segmento; se sustrajo la intensidad basal (unidades de videointensidad) y se normalizó por la del segmento que mostraba contractilidad normal y máxima intensidad (unidades de video-intensidad), resultando en todos los casos un rango normalizado de perfusión entre 0 y 1. De acuerdo con nuestra experiencia previa, definimos que un segmento presentaba perfusión anormal si su rango normalizado era < 0,7512. Se consideró que un paciente tenía mala perfusión en la zona infartada si más de un segmento mostraba perfusión anormal.
Se analizó la variabilidad intraobservador en 15 pacientes respecto a la presencia o no de perfusión normal; estos estudios fueron evaluados 2 veces por el observador que cuantificó todos los datos con un espacio entre ambos análisis de al menos 3 meses. Con la metodología descrita la variabilidad fue del 0%.
Resonancia magnética cardiaca
La RMC (1,5-Tesla, Sonata Magnetom, Siemens, Alemania) se realizó 7 ± 1 días (al menos 48 h tras el cateterismo) y 184 ± 11 días tras el IAM siguiendo el protocolo de nuestro laboratorio9,13. Se registraron las imágenes sincronizadas con el electrocardiograma durante pausas de apnea. Las imágenes de cine (secuencias true fast imaging with steady state presesión, tiempo de repetición/tiempo de eco: 3,2/1,6 ms, ángulo, 61º; matriz 256 x 128; grosor del corte, 6 mm) se adquirieron en vistas de 2, 3 y 4 cámaras y cada 1 cm en las vistas de eje corto.
Tras administrar 0,1 mmol/kg del contraste ácido gadolinio-dietil-enetriamine-pentaacético (Magnograf, Juste SAQF, España) con una velocidad de flujo de 3 ml/s, se adquirieron las imágenes de captación tardía de gadolinio 10 min tras la inyección del contraste utilizando una secuencia true fast imaging with steady state precession (tiempo de repetición/tiempo de eco: 2,5/1,1 ms; grosor del corte, 6 mm; ángulo, 50°; matriz, 195 x 192) anulando la señal miocárdica.
Análisis de la resonancia magnética cardiaca
Los estudios fueron analizados por un observador experimentado mediante el paquete informático QMASS MR 6.1.5 (Medis, Holanda). Se cuantificaron los volúmenes telediastólico y telesistólico (ml/m2), la masa ventricular (g/m²) y la fracción de eyección (%) mediante planimetría de las imágenes de cine.
En las imágenes de captación tardía se consideró que había realce tardío si la intensidad de la señal era > 2 desviaciones estándar respecto a una zona remota no infartada9; se calculó el porcentaje de masa ventricular con realce tardío (porcentaje de masa infartada). En el sexto mes se reevaluaron todos los índices.
Se analizó la variabilidad intraobservador en 15 pacientes; los estudios de RMC fueron evaluados 2 veces por el observador, que cuantificó todos los datos con un espacio entre ambos análisis de al menos 3 meses. La variabilidad intraobservador fue de 4,1 ± 2,9 ml/m² para el volumen telediastólico, 2 ± 1,4 ml/m² para el volumen telesistólico y 2,4 ± 2,4% para la fracción de eyección.
Análisis estadístico
Las variables continuas se expresaron como media ± desviación estándar y las variables categóricas, como porcentajes. Para las variables continuas, las comparaciones entre 2 grupos se realizaron mediante el test de la t de Student para datos pareados y no pareados. Las comparaciones entre más de 2 grupos se realizaron con análisis de varianza (con el test de Bonferroni para analizar las diferencias entre subgrupos). Se utilizó el test de la χ² para comparar porcentajes. Se consideraron estadísticamente significativos los valores de p < 0,05. Se utilizó el paquete estadístico SPSS 11.0 (SPSS Inc., Estados Unidos).
RESULTADOS
Las características basales de los 47 pacientes se exponen en la tabla 1.
Perfusión anormal por inyección intracoronaria de contraste
Se detectó perfusión anormal por EMC en 20 pacientes (43%) en la primera semana y en 10 (21%) en el sexto mes. Una perfusión anormal se relacionó con mayores volúmenes ventriculares, una fracción de eyección más deprimida y un mayor porcentaje de masa infartada, tanto en la primera semana como en el sexto mes. Sólo una perfusión anormal en el sexto mes se asoció con una mayor masa ventricular en fase crónica (tablas 2 y 3).
En cuanto a la evolución del volumen telediastólico desde la primera semana al sexto mes, no se detectaron incrementos significativos en el grupo de estudio en su totalidad (70 ± 21 frente a 69 ± 24 ml/m²; p = 0,9) ni en los pacientes con perfusión normal (65 ± 14 frente a 64 ± 17 ml/m²; p = 0,8) o anormal (78 ± 26 frente a 77 ± 32 ml/m²; p = 0,9) en la primera semana. Al analizar separadamente a los 20 pacientes con perfusión anormal en la primera semana, los que en el sexto mes normalizaron la perfusión (n = 10) mostraron una tendencia a reducir el volumen telediastólico (69 ± 15 frente a 64 ± 12 ml/m²; p = 0,2), mientras que los que presentaron una alteración crónica de la perfusión mostraron una tendencia a incrementar el volumen telediastólico (82 ± 33 frente a 91 ± 41 ml/m²; p = 0,1).
Evolución de la perfusión de la primera semana al sexto mes
El número de segmentos por paciente con perfusión anormal por EMC disminuyó desde la primera semana al sexto mes (2 ± 2,6 frente a 0,8 ± 1,8 segmentos; p < 0,0001).
Los 27 pacientes con perfusión normal por EMC en la primera semana mantuvieron esta condición en el sexto mes. De los 20 pacientes con perfusión anormal en la primera semana, 10 (50%) normalizaron la perfusión en el sexto mes mientras que la perfusión anormal se hizo crónica en 10 pacientes (21% de la totalidad del grupo) (figs. 1 y 2).
Fig. 1. Evolución de la perfusión mediante ecografía con inyección intracoronaria de contraste. Todos los pacientes con perfusión normal en la primera semana mantuvieron esta condición en el sexto mes. La perfusión anormal persistió en el sexto mes en 10 de los 20 casos con perfusión anormal en la primera semana.
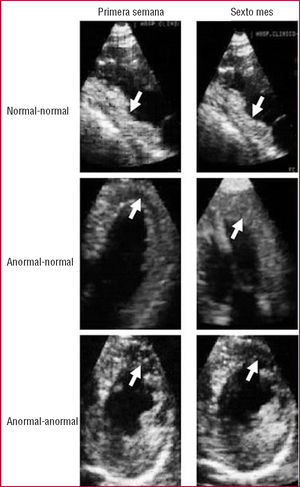
Fig. 2. Ecografía con inyección intracoronaria de contraste. Arriba: ejemplo de un paciente con un infarto inferior con perfusión normal en la zona infartada (flechas) tanto en la primera semana (izquierda) como en el sexto mes (derecha). Centro: ejemplo de un paciente con un infarto anterior con perfusión anormal en la zona infartada (flechas) en la primera semana (izquierda) y perfusión normal en el sexto mes (derecha). Abajo: ejemplo de un paciente con un infarto anterior con perfusión anormal en la zona infartada (flechas) tanto en la primera semana (izquierda) como en el sexto mes (derecha).
Los pacientes con perfusión anormal crónica exhibieron mayores volúmenes y masas ventriculares y una fracción de eyección más deprimida en el sexto mes que los otros 2 subgrupos. Asimismo, presentaron un mayor porcentaje de masa infartada que los pacientes con perfusión normal desde el principio, pero sin diferencias respecto al subgrupo con normalización tardía de la perfusión (fig. 3).
Fig. 3. De acuerdo con la evolución de la perfusión mediante ecografía con inyección intracoronaria de contraste desde la primera semana al sexto mes los pacientes se dividieron en 3 grupos: normal-normal (n = 27), anormal-normal (n = 10) y anormal-anormal (n = 10). Los pacientes con perfusión anormal sostenida mostraron una fracción de eyección más deprimida, un mayor porcentaje de masa infartada (arriba) y mayores volúmenes ventriculares y masa (abajo) en fase crónica. FE: fracción de eyección; VTD: volumen telediastólico; VTS: volumen telesistólico. ap < 0,01 de anormal-anormal frente a los otros 2 grupos. bp < 0,01 de anormal-anormal frente a normal-normal; p = no significativa para anormal-anormal frente a anormal-normal.
DISCUSION
En un grupo de pacientes con un primer IAM, enfermedad de un vaso y flujo TIMI 3 mantenido observamos mediante EMC que las alteraciones de la perfusión pueden persistir en fase crónica, lo cual se relaciona con peores parámetros de función ventricular.
Evolución de la perfusión mediante resonancia magnética cardiaca
El análisis de la evolución de las alteraciones de la perfusión mediante RMC ha aportado resultados dispares. Wu et al8 y Hombach et al7 detectaron defectos de perfusión en fase aguda en el 25 y el 46% de sus pacientes, respectivamente. En ambos estudios las alteraciones desaparecieron en la fase crónica en todos los casos.
Parece que esta alteración transitoria es más propia de los estudios que evalúan la microcirculación mediante secuencias de captación tardía (defectos de contraste rodeados de tejido necrótico con realce tardío). Los estudios que analizan la perfusión en las secuencias de primer paso de gadolinio indican que en algunos casos las alteraciones en la microcirculación pueden hacerse crónicas. Taylor et al10 observaron este fenómeno en un grupo de 16 pacientes.
En 40 pacientes pertenecientes al grupo de estudio del presente trabajo, recientemente hemos observado que las alteraciones crónicas de la perfusión pueden afectar hasta a un 14% de segmentos de la zona infartada en la fase crónica postinfarto mediante análisis de las secuencias de primer paso del gadolinio9.
En el umbral de la era de la medicina regenerativa11,15, este concepto requiere aclaración. Los pacientes con una mala perfusión microvascular tienen un peor pronóstico1-5, y la posibilidad de que haya defectos crónicos de la microcirculación no se ha de descartar, ya que en el futuro estos casos podrían ser el objetivo de la medicina regenerativa.
Perfusión anormal por inyección intracoronaria de contraste
En la evolución de las alteraciones de la perfusión con RMC se ha de tener en cuenta la cinética del gadolinio16: éste es un agente extracelular con una gran capacidad de difusión en el espacio intersticial. El fallo del gadolinio para rellenar el intersticio en la fase aguda podría ser debido no sólo al daño microvascular, sino también al edema intersticial masivo en los infartos extensos que podría impedir la entrada del gadolinio. Una vez la reacción inflamatoria desaparece, el contraste ocupa nuevamente el intersticio, lo cual explicaría la desaparición de la alteración microvascular en todos los casos en la fase crónica.
Teniendo en cuenta estas dudas, decidimos evaluar la microcirculación mediante un método alternativo. Dado el carácter puramente intravascular del contraste ecográfico, la EMC permite una evaluación directa de la microcirculación coronaria más que del intersticio. El contraste se inyecta directamente en la arteria coronaria y llega a los pequeños vasos2,5,12. La gran cantidad de burbujas permite una definición excelente de la perfusión (fig. 2).
Con esta metodología se confirmó la tendencia a la mejoría espontánea de la microcirculación observada con diferentes técnicas6-8. La mitad de los pacientes con perfusión anormal mediante EMC normalizó la perfusión en la fase crónica. El hallazgo más interesante fue que la EMC nos permitió detectar a un grupo (el 21% del total) en el que la perfusión anormal se convirtió en un fenómeno crónico.
Una alteración de la perfusión mantenida se asoció con una función sistólica más deprimida y volúmenes ventriculares más dilatados en comparación con una perfusión normal, ya sea desde la primera semana o por normalización tardía. Más aún, la masa ventricular sólo era mayor en caso de alteración crónica de la perfusión. Como cabía esperar, el porcentaje de masa infartada sólo era menor en el subgrupo con perfusión normal desde el principio. Por último, el único subgrupo que mostró una tendencia (no significativa, probablemente por el escaso número de pacientes, n = 10) hacia la dilatación ventricular progresiva fue el de los pacientes con anormalidad crónica de la perfusión. Estos datos indican que una perfusión anormal en la fase crónica no sólo es un hallazgo circunstancial, sino que tiene importantes consecuencias en el funcionamiento ventricular.
Limitaciones
Con la finalidad de realizar una evaluación cuidadosa de los objetivos, básicamente fisiopatológicos, incluimos a un grupo de pacientes muy seleccionado. Por lo tanto, los resultados sólo son aplicables a series similares a la presentada. Empleamos la EMC con inyección intracoronaria de contraste; esta técnica requiere un procedimiento invasivo, mientras que la inyección intravenosa ha mostrado resultados similares12. En nuestra experiencia, la EMC con inyección intracoronaria permite un análisis más adecuado de la perfusión; para asegurar los objetivos marcados elegimos este método. Los estudios de EMC tuvieron que ser realizados necesariamente al finalizar el cateterismo; esto podría relacionarse con un mayor porcentaje de casos con perfusión anómala en comparación con análisis más tardíos.
CONCLUSIONES
La mayoría de los pacientes con un flujo TIMI 3 mantenido presentan una perfusión miocárdica normal, ya sea desde la fase aguda o por normalización espontánea tardía sin necesidad de más intervenciones. En un grupo reducido de pacientes, la perfusión anormal persiste a pesar de tener una arteria permeable. Estos pacientes muestran un mayor deterioro del funcionamiento ventricular izquierdo y en el futuro podrían ser un objetivo de la medicina regenerativa.
Véase editorial en págs. 468-70
Estudio financiado con una beca de Guidant.
Correspondencia: Dr. V. Bodí.
Servicio de Cardiología. Hospital Clínico y Universitario de Valencia.
Blasco Ibáñez, 17. 46010 Valencia. España.
Correo electrónico: vicentbodi@hotmail.com
Recibido el 6 de julio de 2006.
Aceptado para su publicación el 12 de diciembre de 2006.