El implante percutáneo de válvula aórtica es actualmente el tratamiento de elección para los pacientes con estenosis aórtica sintomática grave inoperables o con alto riesgo quirúrgico, y su uso cada vez es más habitual para los pacientes con riesgo intermedio. El siguiente paso en esta evolución sería la indicación para los pacientes con bajo riesgo quirúrgico. El tratamiento exitoso de esta población de pacientes requerirá la definición de resultados clínicos y de coste-efectividad adaptados a ella. En esta revisión se presentan los principales obstáculos que se deberá superar antes de que el implante percutáneo de válvula aórtica sea aplicable como el tratamiento habitual para pacientes con bajo riesgo.
Palabras clave
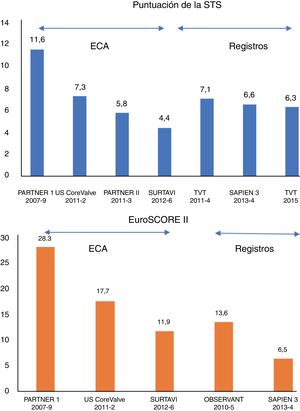
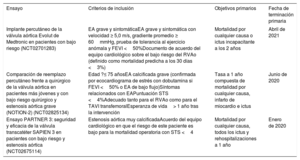
En menos de una década desde la publicación del ensayo PARTNER 1, el implante percutáneo de válvula aórtica (TAVI) ha revolucionado el tratamiento de la estenosis aórtica (EA). El TAVI es actualmente el tratamiento de elección para los pacientes con alto riesgo quirúrgico e inoperables1, y hay indicios que respaldan con solidez su uso frente al recambio quirúrgico de la válvula aórtica (RVAo) para pacientes con riesgo intermedio2,3. Los datos de los registros muestran que el riesgo quirúrgico promedio de los pacientes tratados con TAVI de la práctica real ya se halla en el intervalo intermedio4 (figura 1). El siguiente paso lógico en la evolución del TAVI es la expansión de las indicaciones terapéuticas a los pacientes con bajo riesgo, y hay ya 3 ensayos clínicos aleatorizados en marcha (PARTNER 3 [NCT02675114], Medtronic Evolut transcatheter aortic valve replacement in low risk patients [NCT02701283] y NOTION-2 [NCT02825134]) que comparan el TAVI con el RVAo en esta cohorte, y sus resultados iniciales son inminentes (tabla 1). Aunque el volumen de las intervenciones de TAVI ya se halla en crecimiento exponencial4,5, los análisis demográficos indican que la adición de pacientes en bajo riesgo como candidatos legítimos al TAVI aumentará el número potencial de intervenciones en al menos un 50%6. El tratamiento satisfactorio de esta población requerirá equipos de TAVI para establecer nuevos estándares de resultados clínicos y de rentabilidad. En esta revisión se presentan las principales dificultades que hay que resolver antes de que se pueda aplicar el TAVI como tratamiento estándar para los pacientes con bajo riesgo:
- •
Reducir la morbilidad y la mortalidad periprocedimentales.
- •
El tratamiento de la arteriopatía coronaria concomitante.
- •
Las dudas sobre la durabilidad a largo plazo.
- •
La rentabilidad.
Puntuación media de la Society of Thoracic Surgeons (STS) (arriba) y Logistic EuroSCORE II (gráfico inferior) de los principales ensayos controlados y aleatorizados (ECA) y registros sobre el implante percutáneo de válvula aórtica. El periodo de incorporación en cada ensayo/registro se incluye debajo.
Ensayos clínicos aleatorizados de TAVI frente a RVAo en pacientes con bajo riesgo quirúrgico
| Ensayo | Criterios de inclusión | Objetivos primarios | Fecha de terminación primaria |
|---|---|---|---|
| Implante percutáneo de la válvula aórtica Evolut de Medtronic en pacientes con bajo riesgo (NCT02701283) | EA grave y sintomáticaEA grave y sintomática con velocidad ≥ 5,0 m/s, gradiente promedio ≥ 60mmHg, prueba de tolerancia al ejercicio anómala y FEVI <50%Documento de acuerdo del equipo cardiológico sobre el bajo riesgo del RVAo (definido como mortalidad predicha a los 30 días <3%) | Mortalidad por cualquier causa o ictus incapacitante a los 2 años | Abril de 2021 |
| Comparación de reemplazo percutáneo frente a quirúrgico de la válvula aórtica en pacientes más jóvenes y con bajo riesgo quirúrgico y estenosis aórtica grave (NOTION-2) (NCT02825134) | Edad ?≤ 75 añosEA calcificada grave (confirmada por ecocardiograma de estrés con dobutamina si FEVI <50% o EA de bajo flujo)Síntomas relacionados con EAPuntuación STS <4%Adecuado tanto para el RVAo como para el TAVI transfemoralEsperanza de vida> 1 año tras la intervención | Tasa a 1 año compuesta de mortalidad por cualquier causa, infarto de miocardio e ictus | Junio de 2020 |
| Ensayo PARTNER 3: seguridad y eficacia de la válvula transcatéter SAPIEN 3 en pacientes con bajo riesgo y estenosis aórtica (NCT02675114) | Estenosis aórtica muy calcificadaAcuerdo del equipo cardiológico en que el riesgo de este paciente es bajo para la mortalidad operatoria con STS <4 | Mortalidad por cualquier causa, todos los ictus y rehospitalizaciones a 1 año | Enero de 2020 |
EA: estenosis aórtica; FEVI: fracción de eyección del ventrículo izquierdo; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica; RVAo: reemplazo quirúrgico de válvula aórtica.
Datos recientes de Estados Unidos demuestran que la disponibilidad del TAVI ha tenido un efecto considerable en el perfil de riesgo y los resultados del RVAo en centros con gran volumen de TAVI: las puntuaciones de riesgo de los pacientes tratados con RVAo han disminuido, junto con una reducción concomitante de la mortalidad periprocedimiento7. Además, la mortalidad a 30 días fue del 0% en un registro multicéntrico reciente de 200 pacientes en bajo riesgo sometidos a TAVI8, lo que indica que la intervención es una alternativa legítima al RVAo en esta cohorte. No obstante, el TAVI se asocia con mayor riesgo de complicaciones periprocedimiento importantes —fuga paravalvular (FPV), implante de marcapasos definitivo y eventos vasculares periféricos2,3,9— y se requerirá una mayor precisión para que el TAVI se convierta en el tratamiento de referencia de la EA para pacientes con bajo riesgo.
Fuga paravalvularSe notificó FPV moderada o grave en más del 20% de los pacientes sometidos a TAVI con dispositivos de primera generación10 y se asoció con una reducción de la supervivencia a largo plazo11. Aunque algunos datos indican que incluso la FPV leve conlleva un pronóstico adverso12, el impacto clínico de la FPV ha disminuido considerablemente a causa de 2 cambios importantes:
- •
Uso sistemático de la tomografía computarizada (TC) multicorte para el calibrado del anillo.
- •
Diseño mejorado de las válvulas de generación más reciente que incorporan bordes, marcos modificados y total posibilidad de recuperación (figura 2).
Figura 2.Válvulas cardiacas actualmente disponibles. Arriba, izquierda: Evolut PRO (Medtronic; Minnesota, Estados Unidos). Arriba, derecha: ACURATE Neo (Boston Scientific; Massachusetts, Estados Unidos). Abajo, izquierda: SAPIEN 3 Ultra (Edwards Lifesciences; California, Estados Unidos). Abajo, derecha: LOTUS Edge (Boston Scientific).
(0.12MB).
La tasa de FPV significativa es ahora tan baja como del 1,5% con las válvulas de generación más reciente13, con ventajas importantes para los pacientes en bajo riesgo, en los que es de esperar una mayor prevalencia de válvulas aórticas bicúspides y una mayor esperanza de vida tras el TAVI.
Implante de marcapasos definitivoEl implante de marcapasos definitivo es la complicación más frecuente del TAVI, que afecta al 13% de los pacientes, según un análisis combinado de 49 estudios (n=16.063) que utilizaron dispositivos de primera generación14. A diferencia de otras complicaciones, esta no ha mejorado de manera considerable con la generación más reciente de válvulas autoexpandibles CoreValve15 y las últimas iteraciones de la válvula expandible por balón SAPIEN pueden asociarse con una mayor tasa de implantes de marcapasos definitivo16,17. El impacto pronóstico del marcapasos definitivo después del TAVI sigue siendo controvertido: un metanálisis de 11 estudios (n=7.032) mostró que no había impacto alguno en la mortalidad al cabo de 1 año18, pero un informe posterior del registro Transcatheter Valve Therapy (n=9.875) indicó un aumento del 31% de la mortalidad al año cuando se requería un marcapasos definitivo después del TAVI19. No está claro si estos datos (de octogenarios con riesgo intermedio y alto) son relevantes para los pacientes con bajo riesgo. Mientras que en los pacientes con bajo riesgo es menor la prevalencia inicial de trastornos del sistema de conducción, es probable que los efectos negativos del ritmo ventricular prolongado20 o de las alteraciones de conducción de nuevo inicio21 sean más evidentes en esta cohorte.
En los últimos años se han llevado a cabo muchos avances para identificar cuáles son los factores que predicen la necesidad de un marcapasos definitivo tras el TAVI:
- •
Antes de la intervención: bloqueo auriculoventricular (BAV) de primer grado, hemibloqueo anterior izquierdo, bloqueo de rama derecha y sexo masculino.
- •
En la intervención: dispositivos autoexpandibles, bloqueo cardiaco durante el procedimiento y profundidad del implante22.
Es probable que la alta tasa de implante de válvulas expandibles por balón reduzca la de implante de marcapasos definitivo en pacientes en especial riesgo23,24. De esta manera, se podría evitar una proporción considerable de los implantes de marcapasos definitivos tras el TAVI. Las tasas de dependencia del marcapasos tras el TAVI oscilan entre el 27 y el 68%25,26 y en muchos de los pacientes a los que se implantó un marcapasos se ha recuperado la conducción auriculoventricular normal durante un seguimiento a los 30 días24. La probabilidad de que se produzca dependencia del marcapasos definitivo es muy alta en el BAV avanzado, pero es despreciable (< 1%) en el caso del bloqueo de rama izquierda de inicio reciente o el BAV de primer grado27, lo que indica que podría reducirse considerablemente la necesidad de un marcapasos definitivo mejorando la adhesión a las pautas terapéuticas de las alteraciones de la conducción en el momento de la intervención y recurriendo a un enfoque más liberal de observación con monitorización continua. Esta cuestión es particularmente relevante para los pacientes en bajo riesgo, ya que el principal factor del implante profiláctico e «innecesario» del marcapasos definitivo es el intento de acortar la estancia hospitalaria, una consideración específica que solo aumentará en los grupos con bajo riesgo (véase más adelante).
Ictus periprocedimientoEl ictus periprocedimiento aumenta la mortalidad del TAVI en 5 veces y se asocia con una discapacidad considerable y una peor calidad de vida de los supervivientes28: la incidencia a los 30 días del TAVI oscila entre el 2 y el 5% y fue del 2,8% en un metanálisis de 58 estudios29. El ensayo PARTNER II, que comparó el TAVI con el RVAo en pacientes con riesgo intermedio, mostró que no hay diferencias en la incidencia de ictus 30 días y 1 o 2 años después del seguimiento2, mientras que la incidencia de ictus era inferior después del TAVI y en los seguimientos a los 30 días y a 1 y 2 años según el ensayo SURTAVI (aunque esta diferencia era estadísticamente significativa solo a los 30 días)3. Notablemente, las medidas sobre calidad de vida apuntan a una mejoría más rápida tras el ictus relacionado con el TAVI que tras el RVAo30, mientras que un estudio retrospectivo que comparó a pacientes con ictus previo (excluidos en la mayor parte de los ensayos clínicos aleatorizados) que se sometían a TAVI (n=839) o RVAo (n=2.695) no halló diferencia alguna en la incidencia de ictus periprocedimiento (el 1,4 frente al 1,2%; p=0,642)31.
Una cuestión relacionada es la significación del ictus «asintomático», es decir, las nuevas lesiones cerebrales por isquemia detectadas mediante técnicas de imagen cerebral sistemáticas32,33. Los estudios han mostrado una frecuencia variable (aunque bastante alta) de nuevas lesiones cerebrales por isquemia tras el TAVI, con una frecuencia del 77,5% según un metanálisis de 25 estudios (n=1.225) y múltiples lesiones (media, 4,2) en la mayoría de los pacientes (59,5%)34. En contraposición con la población general35, la significación del ictus «asintomático» después del TAVI es poco clara, puesto que la mayoría de los pacientes con lesiones isquémicas recientes no presentan alteración neurológica o cognitiva36.
Se cree que los ictus periprocedimiento son de naturaleza embólica, que se originan a partir de material calcificado y ateroesclerótico de las valvas de la válvula y el arco aórtico, y las medidas para reducir el ictus relacionado con el TAVI se centran en el uso de dispositivos de protección embólica cerebral. Actualmente existen varios dispositivos: el Embrella Embolic Deflector y el sistema Embol-X (Edwards Lifesciences; Irvine, California, Estados Unidos), el sistema Triguard (Keystone Heart; Herzliya, Israel) y el dispositivo de protección embólica Sentinel (Claret Medical; Santa Rosa, California, Estados Unidos) (figura 3). Si bien todos estos dispositivos son seguros, son pocos los datos acerca de su eficacia. En consecuencia, aunque cada uno de los estudios y metanálisis ha mostrado sistemáticamente la reducción del volumen total de la lesión cerebral asociado con el uso de dispositivos de protección embólica, el impacto en la incidencia de eventos clínicos sigue sin estar claro37. Si bien un metanálisis (8 estudios, n=1.285) demostró una reducción en la incidencia de ictus a los 30 días de seguimiento (odds ratio=0,55; intervalo de confianza del 95%, 0,31-0,98; p=0,04)38, este resultado se debió principalmente a un único estudio no aleatorizado39.
Un concepto interesante en evaluación preliminar es el uso de dispositivos de protección cerebral combinados que protegen tanto la circulación carotídea (anterior) como la vertebral (posterior). Un informe reciente en el que se combina el uso del dispositivo Sentinel (que protege las arterias carótida derecha, carótida izquierda y vertebrales derechas) con un filtro vertebral izquierdo (Wirion, Allum Medical Inc.; Cesarea, Israel) demostró una distribución equitativa de los restos en ambos dispositivos40. Este enfoque puede ser clínicamente más beneficioso, dada la relación entre el nuevo volumen de la lesión y el deterioro cognitivo.
Otras medidas que pueden reducir la incidencia de ictus periprocedimiento son los dispositivos y sistemas de liberación con un perfil reducido, así como una mejora de la maniobrabilidad para minimizar el contacto aórtico innecesario durante la liberación y el implante. Asimismo, la valvuloplastia con balón preliminar ya no es sistemática y se reserva para una reducida proporción de casos (< 10%)41.
Mientras se dirige la atención a pacientes más jóvenes y con menor riesgo, la utilidad de los dispositivos de protección cerebral puede establecerse de un modo más específico para los pacientes con marcadores específicos del riesgo embólico, tales como trombo auricular izquierdo, enfermedad cerebrovascular prematura, engrosamiento de las valvas de la válvula y ateroma del arco aórtico.
Complicaciones vasculares relacionadas con el accesoLa incidencia de complicaciones vasculares importantes se mantiene constante por encima del 10% de las poblaciones en riesgo extremo y alto (figura 4). Sin embargo, la mayor experiencia de los cirujanos y las mejoras en el diseño de las válvulas (que permiten la reducción progresiva del tamaño de la vaina a 14/16 Fr) han reducido considerablemente el riesgo para los pacientes con riesgo intermedio (PARTNER II, el 7,9%2; SURTAVI, el 6,0%3, y registro SAPIEN 3, el 6,1%16).
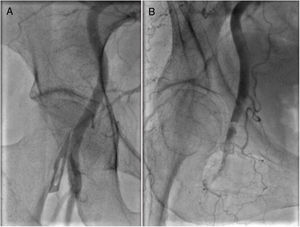
Angiografía femoral derecha antes (A) y después (B) del implante percutáneo de la válvula aórtica transfemoral que muestra la disección localizada de la arteria femoral. Se consiguió un resultado excelente con la colocación del stent a través de la arteria femoral izquierda utilizando una técnica de cruce.
Los predictores de complicaciones vasculares son la proporción entre vaina y arteria, la calcificación circunferencial, la tortuosidad grave, la imposibilidad de llevar a cabo el precierre utilizando dispositivos percutáneos y la experiencia previa en las técnicas de punción femoral de quienes llevan a cabo el TAVI. Mientras que la actual generación de especialistas en TAVI proceden de un entorno de intervenciones coronarias transfemorales, la formación de los futuros especialistas en TAVI será la de aquellos con experiencia en intervenciones principalmente radiales. El aumento en el uso del acceso radial se asocia con una mayor incidencia de complicaciones cuando se realizan intervenciones femorales42, lo que puede resultar en un proceso de aprendizaje más favorable para los nuevos especialistas en TAVI cuando lleven a cabo intervenciones de acceso femoral de gran calibre.
Otras medidas que ayudarían a reducir las complicaciones relacionadas con el acceso son la vía femoral guiada por ecografía43, la mejora de la vaina y el diseño del sistema de liberación, el uso de la reconstrucción con TC para identificar la calcificación, la tortuosidad y el tamaño ileofemoral preciso, y el uso de los accesos transaórtico44, transaxilar45 y transcaval46 en los pacientes con una anatomía ileofemoral complicada.
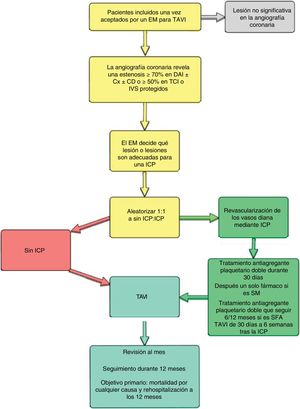
TRATAMIENTO DE LA ENFERMEDAD CORONARIA CONCOMITANTELa ateroesclerosis y la EA degenerativa comparten muchos factores de riesgo, y no sorprende que la enfermedad coronaria (EC) sea una de las enfermedades recurrentes con mayor frecuencia en la población tratada con TAVI, con una prevalencia del ≈50% en registros de gran tamaño47 y del 75% en el PARTNER 148,49. No obstante, al contrario que en el caso de otras enfermedades concurrentes —fragilidad50, enfermedad renal crónica51, enfermedad pulmonar obstructiva y fibrilación auricular52— que influyen en el pronóstico después del TAVI, la EC puede tratarse. Aunque la revascularización coronaria previa a la cirugía de la válvula aórtica mejora los resultados53, sigue sin estar claro si lo mismo es cierto para todos los receptores de TAVI54. Serían explicaciones posibles la menor esperanza de vida de los actuales pacientes tratados con TAVI, el riesgo competitivo de muerte por otras enfermedades recurrentes y la naturaleza heterogénea de la EC. En realidad, varios estudios retrospectivos55,56 han confirmado que los pacientes con EC moderada o grave (SYNTAX> 22 puntos) tienen peor pronóstico tras el TAVI y que la imposibilidad de conseguir una puntuación residual SYNTAX<8 antes del TAVI se asocia con un aumento de la mortalidad total (odds ratio=1,69; intervalo de confianza del 95%, 1,26-2,28; p <0,001)57. Actualmente no existen recomendaciones aceptadas con respecto a la necesidad de revascularización o su alcance en los pacientes sometidos a TAVI con EC concomitante, y se esperan con interés los resultados del ensayo ACTIVATION (ISRCTN75836930)58 sobre esta cuestión (figura 5).
Esquema del ACTIVATION (ISRCTN 75836930), el primer ensayo aleatorizado sobre la revascularización coronaria en candidatos al implante percutáneo de válvula aórtica con enfermedad coronaria concomitante. CD: arteria coronaria derecha; Cx: arteria circunfleja; DAI: arteria descendente anterior izquierda; EM: equipo multidisciplinario; ICP: intervención coronaria percutánea; IVS: injerto de vena safena; SFA: stent farmacoactivo; SM: stent metálico; TAVI: implante percutáneo de válvula aórtica; TCI: tronco coronario izquierdo.
Las cuestiones relacionadas con el tratamiento óptimo de la EC son de mayor importancia en los pacientes con bajo riesgo tratados con TAVI porque es probable que la EC no tratada tenga mayor significación pronóstica. Además, el acceso coronario y la intervención coronaria percutánea (ICP) pueden ser técnicamente más complicados tras el TAVI59, lo que respalda el argumento a favor de la revascularización preventiva previa al TAVI.
DESPEJAR LAS DUDAS SOBRE LA DURABILIDAD DE LA VÁLVULALas cuestiones relacionadas con la durabilidad a largo plazo y el riesgo de disfunción estructural de la válvula (DEV) son de la mayor importancia cuando se considera la posibilidad del TAVI para pacientes con bajo riesgo y mayor esperanza de vida que los estudiados hasta ahora. La DEV puede aparecer como resultado de degeneración, calcificación, trombosis, infección y formación de paño valvular y puede conducir a la muerte relacionada con la válvula o a la necesidad de una nueva intervención. Las definiciones internacionales de la DEV con finalidades clínicas y de investigación60 (figura 6) no se habían publicado hasta hace poco.
Mecanismos fisopatológicos de la disfunción de la válvula bioprotésica (izquierda) y definiciones de consenso europeas de la disfunción estructural de la válvula (derecha). DEV: disfunción estructural de la válvula. Adaptada con autorización de Capodanno et al.60.
Una revisión sistemática de estudios observacionales sobre la durabilidad de las válvulas bioprotésicas quirúrgicas puso de relieve una supervivencia sin DEV del 94, el 82 y el 52% a los 10, los 15 y los 20 años respectivamente61. Aunque escasos, los datos disponibles con respecto a la durabilidad a medio plazo de los dispositivos de TAVI son igualmente tranquilizadores. En el PARTNER 1A, ninguno de los pacientes de los 2 grupos sometidos a TAVI o RVAo que sobrevivían a los 5 años requirió RVAo a causa de la DEV, y la evaluación ecocardiográfica confirmó un desempeño de la válvula estable y equivalente en los pacientes que sobrevivieron11. Recientemente, los datos de seguimiento a largo plazo procedentes del registro FRANCE 260 comunicaron unas incidencias acumuladas de DEV grave y moderada/grave del 2,5 y el 13,3% a los 5 años, mientras que en el registro OBSERVANT62 las cifras correspondientes a 8 años fueron del 2,4 y el 8,3%. Aunque estos datos son tranquilizadores, se requerirán seguimientos a más largo plazo, de hasta 10 años y más, en registros a gran escala (que incluyan válvulas de segunda y tercera generación) antes de aplicar sistemáticamente el TAVI a pacientes más jóvenes y en bajo riesgo. Una cuestión relacionada se refiere a informes recientes en lo que respecta a la detección mediante TC de hipoatenuación y engrosamiento de las valvas, presentes en hasta el 15% de los pacientes que se someten a una TC63,64. Estas observaciones, que se solucionan con anticoagulantes tales como los antagonistas de la vitamina K o la heparina no fraccionada, se aceptan para representar la trombosis de las valvas. Este tipo de trombosis puede originar una insuficiencia valvular temprana que se manifieste en forma de aumento de los gradientes transvalvulares y disnea, tromboembolia e ictus, pero puede ser también un hallazgo fortuito sin secuelas65,66. No obstante, la práctica clínica actual no exige la obtención sistemática de imágenes de TC tras el TAVI, ya que no se ha probado correlación alguna con el resultado. Esto podría tener implicaciones importantes y podría limitar la posible expansión de los tratamientos percutáneos a la población con bajo riesgo.
COSTE-EFECTIVIDADEl debate sobre el coste-efectividad del TAVI es antiguo y está lejos de estar resuelto. Aunque los dispositivos de TAVI son mucho más caros que las válvulas quirúrgicas, los costes generales del tratamiento son inferiores como resultado de la menor estancia hospitalaria y la menor necesidad de cuidados intensivos y servicios de rehabilitación. Los análisis económicos basados en los resultados al cabo de 12 meses muestran que el TAVI transfemoral en pacientes con alto riesgo coincide con los estándares de rentabilidad de la asistencia sanitaria en Estados Unidos67,68. Análisis parecidos demostraron una reducción de los costes totales 2 años después del TAVI comparado con el RVAo en pacientes con riesgo intermedio, al tiempo que el TAVI se relaciona con resultados ajustados de mejor calidad y puede convertirse en la estrategia terapéutica económicamente dominante en este grupo (Cohen DJ, presentado en TCT 2017). Lo contrario puede ser cierto con los pacientes en bajo riesgo, dado que los resultados serán incluso mejores tanto con TAVI como con RVAo, mientras que los costes excesivos del TAVI seguirán siendo los mismos y las diferencias con respecto a la duración de la estancia hospitalaria y la necesidad de rehabilitación disminuyen. Es importante destacar que estas proyecciones se basan en costes de Estados Unidos y no pueden aplicarse a otros contextos de asistencia sanitaria.
Los requisitos clave para mejorar el coste-efectividad del TAVI son: dispositivos más económicos (que pueden aparecer en respuesta a las presiones competitivas del mercado), menor incidencia de complicaciones, reducción de la estancia hospitalaria (puede ser factible el alta el mismo día o al día siguiente)69,70 y posterior agilización del procedimiento (reducción de la necesidad de personal y sedación dirigida por enfermeras para pacientes seleccionados)71.
CONCLUSIONESEl continuo perfeccionamiento técnico y del procedimiento, junto con la preferencia muy comprensible de los pacientes por una intervención menos invasiva, indica que la extensión del TAVI a los pacientes con bajo riesgo es inevitable. No obstante, tal como se ha explicado, quedan muchas cuestiones por resolver antes de que este se convierta en la práctica habitual aceptable. Solo cuando se hayan tratado cuestiones clave relacionadas con la durabilidad y la eliminación de las complicaciones relevantes, el TAVI podrá poner en cuestión el RVAo como el tratamiento de referencia para todos los pacientes con EA grave. Incluso entonces, se requerirá que el coste-efectividad sea demostrable antes de que los sistemas de asistencia sanitaria pública lo adopten. Hasta que estas cuestiones se resuelvan, las discusiones del equipo cardiológico con respecto al tratamiento óptimo de los pacientes con bajo riesgo y EA grave deben tener en cuenta las restantes limitaciones del TAVI y tomar para cada paciente decisiones razonadas y basadas en la evidencia.
CONFLICTO DE INTERESESNo se declara ninguno.