El deterioro de la salud de la población y el aumento de la prevalencia de las enfermedades crónicas son un problema mundial de causas multifactoriales y complejas. El envejecimiento de la población, junto con la expansión de los malos hábitos nutricionales, la obesidad y la hipertensión, contribuye cada vez más al desarrollo epidémico de las enfermedades cardiovasculares. En este contexto, la población sometida a regímenes farmacológicos crónicos polimedicados ha sufrido un incremento significativo, lo que a su vez ha puesto de manifiesto la tasa de adherencia farmacológica alarmantemente baja en prevención tanto primaria como secundaria. Datos de registros, estudios clínicos y metanálisis concuerdan en indicar que más del 50% de los enfermos, como promedio, abandonan el tratamiento tras un infarto agudo de miocardio. La baja adherencia terapéutica tiene un impacto tanto sanitario como económico importantísimo y se asocia a fracaso en la consecución de los objetivos terapéuticos y mayor tasa de hospitalizaciones y muerte. En este marco se ha desarrollado el policomprimido Fuster-CNIC-Ferrer, que incluye ácido acetilsalicílico, estatina y un inhibidor de la enzima de conversión de la angiotensina, indicado como terapia de sustitución en prevención secundaria. En este artículo se revisan los datos científicos que avalan esta estrategia de salud pública, así como los hitos más importantes en su desarrollo.
Palabras clave
Keywords
ECV enfermedad cardiovascular infarto agudo de miocardio inhibidor de la enzima de conversión de la angiotensina
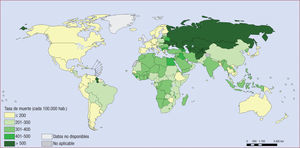
El escenario actual de la enfermedad cardiovascular (ECV) global comparte ciertos aspectos con el de la pandemia del virus de la inmunodeficiencia humana (VIH) de los años noventa: la enfermedad ha alcanzado proporciones pandémicas (las enfermedades no transmisibles se han convertido en la primera causa de mortalidad por encima de las enfermedades transmisibles1), los países más afectados por la morbimortalidad de las ECV son de rentas bajas-medias, donde el acceso a tratamientos es alarmantemente bajo y actualmente suceden 8 de cada 10 muertes por ECV2,3 (figura 1), y en países de rentas altas la adherencia terapéutica no supera el 50%4. Al igual que entonces, cuando se propuso uno de los primeros policomprimidos para garantizar el acceso general al tratamiento antirretroviral de forma coste-efectiva y aumentar la adherencia terapéutica, en la última década varios investigadores han propuesto un policomprimido cardiovascular para paliar los efectos de la pandemia de ECV5.
Tasa de mortalidad cardiovascular cada 100.000 habitantes de ambos sexos ajustada por edad, 2012. Reproducido de Mendis et al3 con permiso.
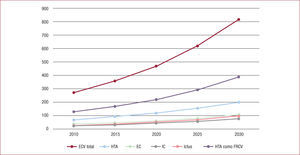
En los países de rentas altas hay una presión añadida al impacto sanitario de la ECV que exige la propuesta de fórmulas coste-efectivas. Datos provenientes de Estados Unidos indican que los costes derivados de la ECV suponen el 15% del gasto sanitario. Las proyecciones futuras ponen de manifiesto que entre 2010 y 2030 los costes totales de tratar la ECV llegarán a triplicarse, pasando de 272.500 a 818.100 millones de dólares6 (figura 2). Por lo tanto, más allá de la preocupante carga sociosanitaria derivada de la morbimortalidad de la ECV, en un escenario de envejecimiento poblacional y aumento de la prevalencia de factores de riesgo a medio plazo, el coste derivado de tratar la ECV será inasumible incluso para las economías más pudientes7.
Incremento del coste de tratar la enfermedad cardiovascular en Estados Unidos proyectado (en billones de dólares). Reproducido de Heidenreich et al6 con permiso.
EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FRCV: factor de riesgo cardiovascular; HTA: hipertensión arterial; IC: insuficiencia cardiaca.
Una vez asumido el complejo escenario cardiovascular global actual, parece claro que tenemos la responsabilidad de proponer diferentes estrategias de salud pública para mejorar la prevención cardiovascular y así frenar y paliar el desarrollo de la ECV. Seguramente ninguna estrategia por sí misma será suficiente para tener un impacto real en el mapa global de la ECV; por lo tanto, el policomprimido debe necesariamente formar parte de un marco integral de prevención cardiovascular en todo el mundo, que incluya otras estrategias de salud pública como educación, control de factores de riesgo, aumento de la actividad física, disminución del sobrepeso, reducción del consumo de sal, acceso a tratamientos eficaces, desarrollo de sistemas de salud en regiones deprimidas, medidas antitabáquicas, etc.8. El policomprimido como estrategia de prevención en salud pública está incluido formalmente en el Global Action Plan de la Organización Mundial de la Salud (OMS), así como del 25×25 road map de la Federación Mundial de la Salud.
La propuesta inicial de Wald et al9, denominada «estrategia de vacunación», consistía en administrar un policomprimido con seis principios activos a todos los individuos mayores de 55 años, independientemente de sus factores de riesgo y sin necesidad de conocer sus concentraciones de colesterol o las cifras de presión arterial. Esta propuesta encontró fuerte oposición en la comunidad científica, basada en las consecuencias de medicalizar a toda la población, especialmente las reacciones adversas y su coste, los efectos psicológicos en una población sana o la posibilidad de que favoreciera el abandono de los hábitos de vida saludables. Sin estudios clínicos apropiados que demuestren su eficacia, esta propuesta se ha abandonado definitivamente.
Partiendo de la idea inicial de Wald et al, varios autores10–12 propusieron utilizar el policomprimido más selectivamente en individuos sin ECV pero en alto riesgo de padecerla (prevención primaria). Aunque varios estudios piloto han demostrado la factibilidad de esta estrategia, no hay prueba definitiva de su utilidad, su seguridad y su relación coste-efectividad. Además, dichos estudios incluyen poblaciones heterogéneas de pacientes con y sin ECV previa, lo que dificulta la interpretación de los resultados13. En su conjunto han demostrado que el policomprimido aumenta significativamente la adherencia terapéutica (alrededor de un 56%), sin resultados concordantes en control de la presión arterial o la concentración de lípidos14–16. Ninguno de estos estudios tenía potencia para detectar diferencias en la tasa de nuevos eventos coronarios.
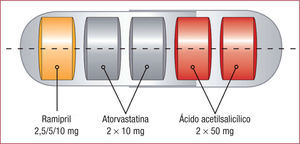
El policomprimido cardiovascular desarrollado por el Dr. Fuster en el Centro Nacional de Investigaciones Cardiovasculares (CNIC), en colaboración con Grupo Ferrer (policomprimido Fuster-CNIC-Ferrer), ha refinado el concepto tanto en composición como en indicación. Incluye ácido acetilsalicílico (AAS) (100 mg), atorvastatina (20 mg) y ramipril (en dosis de 2,5, 5 o 10 mg) y está aprobado por la Agencia Europea del Medicamento (EMA) en prevención secundaria de ECV como terapia de sustitución para pacientes adultos adecuadamente controlados con los monocompuestos dados concomitantemente a dosis terapéuticas equivalentes.
El policomprimido cardiovascular: del debate conceptual a la realidad clínicaEl policomprimido Fuster-CNIC-Ferrer se desarrolló dentro de un marco conceptual muy claro: permitir el mayor acceso a tratamiento farmacológico al mayor número de pacientes en todo el mundo de manera simple y coste-efectiva, incluyendo principios activos que se requieren de por vida en prevención secundaria y recomendados por la guías clínicas con eficacia probada para prevenir recurrencias de eventos17.
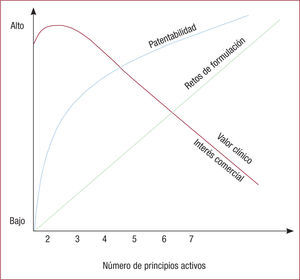
La transición de la propuesta conceptual al desarrollo farmacéutico y posteriormente al terreno clínico de un policomprimido plantea varios retos técnicos. La idea de combinar varios compuestos en un único comprimido podría parecer atractiva teóricamente, pero la realidad es que la dificultad técnica aumenta con cada compuesto añadido de modo casi lineal18 (figura 3). En primer lugar, la propiedad intelectual de cada uno de los compuestos implica que solo se puede incluir los principios activos genéricos fuera de patente. Además, las características de cada compuesto afectan a la estabilidad química y física del policomprimido: la combinación de compuestos con diversos perfiles de solubilidad y sensibilidad al calor y la humedad dificulta enormemente su desarrollo, así como las interacciones acidobásicas (que se dan en el caso específico de AAS y ramipril, por ejemplo). Otros aspectos técnicos incluyen combinar compuestos a bajas dosis (como ramipril 2,5 mg) con otros compuestos a dosis mucho más altas (como AAS 100 mg), lo que puede suponer un reto técnico con los métodos analíticos usados en la fase de purificación. Por último, las interacciones entre fármacos alteran la biodisponibilidad de los componentes del policomprimido. Desde el punto de vista clínico, cada principio activo adicional implica la posibilidad de mayores efectos adversos, lo que limita la población que podría beneficiarse de su uso.
Relación entre el número de principios activos en un policomprimido y los retos de formulación, patentabilidad y valor clínico. Adaptado de Guglietta et al18 con permiso.
El desarrollo farmacológico del policomprimido Fuster-CNIC-Ferrer se ha logrado gracias a una plataforma tecnológica patentada por Ferrer que logra combinar diferentes principios activos en una única cápsula que evita las incompatibilidades físico-químicas y mantiene las propiedades biofarmacéuticas y farmacocinéticas de cada uno de sus componentes (figura 4).
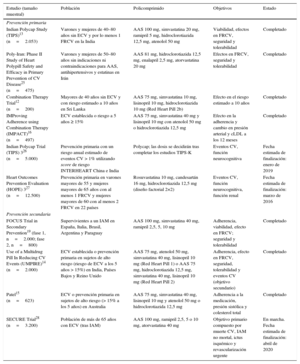
Desarrollo científicoTeniendo en cuenta que las primeras propuestas de un policomprimido para prevención cardiovascular son de poco más de una década, los últimos años se ha generado gran cantidad de datos que avalan el uso de esta estrategia. Los estudios llevados a cabo hasta el momento se han centrado en seguridad, adherencia y coste-efectividad (tabla 1).
Ensayos clínicos más relevantes con el policomprimido cardiovascular.
| Estudio (tamaño muestral) | Población | Policomprimido | Objetivos | Estado |
|---|---|---|---|---|
| Prevención primaria | ||||
| Indian Polycap Study (TIPS)13 (n=2.053) | Varones y mujeres de 40–80 años sin ECV y por lo menos 1 FRCV en la India | AAS 100 mg, simvastatina 20 mg, ramipril 5 mg, hidroclorotiazida 12,5 mg, atenolol 50 mg | Viabilidad, efectos en FRCV, seguridad y tolerabilidad | Completado |
| Poly-Iran: Phase II Study of Heart Polypill Safety and Efficacy in Primary Prevention of CV Disease25 (n=475) | Varones y mujeres de 50–80 años sin indicaciones ni contraindicaciones para AAS, antihipertensivos y estatinas en Irán | AAS 81 mg, hidroclorotiazida 12,5 mg, enalapril 2,5 mg, atorvastatina 20 mg | Efectos en FRCV, seguridad y tolerabilidad | Completado |
| Combination Therapy Trial12 (n=200) | Mayores de 40 años sin ECV y con riesgo estimado a 10 años en Sri Lanka | AAS 75 mg, simvastatina 10 mg, lisinopril 10 mg, hidroclorotiazida 10 mg (Red Heart Pill 2b) | Efecto en el riesgo estimado a 10 años | Completado |
| IMProving Adherence using Combination Therapy (IMPACT)16 (n=497) | ECV establecida o riesgo a 5 años ≥ 15% | AAS 75 mg, simvastatina 40 mg y lisinopril 10 mg con atenolol 50 mg o hidroclorotiazida 12,5 mg | Efecto en la adherencia y cambio en presión arterial y cLDL a los 12 meses | Completado |
| Indian Polycap Trial (TIPS) 326 (n=5.000) | Prevención primaria con un riesgo anual estimado de eventos CV > 1% utilizando score de riesgo INTERHEART China e India | Polycap; las dosis se decidirán tras completar los estudios TIPS-K | Eventos CV, función neurocognitiva | Fecha estimada de finalización: enero de 2019 |
| Heart Outcomes Prevention Evaluation (HOPE) 327 (n=12.500) | Prevención primaria en varones mayores de 55 y mujeres mayores de 65 años con al menos 1 FRCV y mujeres mayores de 60 con al menos 2 FRCV en 22 países | Rosuvastatina 10 mg, candesartán 16 mg, hidroclorotiazida 12,5 mg (diseño factorial 2×2) | Eventos CV, función neurocognitiva, función renal | Fecha estimada de finalización: marzo de 2016 |
| Prevención secundaria | ||||
| FOCUS Trial in Secondary Prevention19 (fase 1, n=2.000; fase 2, n=800) | Supervivientes a un IAM en España, Italia, Brasil, Argentina y Paraguay | AAS 100 mg, simvastatina 40 mg, ramipril 2,5, 5, 10 mg | Adherencia, viabilidad, efecto en FRCV; seguridad y tolerabilidad | Completado |
| Use of a Multidrug Pill In Reducing CV Events (UMPIRE)14 (n=2.000) | ECV establecida o prevención primaria en sujetos de alto riesgo (riesgo de ECV a los 5 años > 15%) en India, Países Bajos y Reino Unido | AAS 75 mg, atenolol 50 mg, simvastatina 40 mg, lisinopril 10 mg (Red Heart Pill 1) o AAS 75 mg, hidroclorotiazida 12,5 mg, simvastatina 40 mg, lisinopril 10 mg (Red Heart Pill 2) | Adherencia, efecto en FRCV, seguridad, tolerabilidad y eventos CV (objetivo secundario) | Completado |
| Patel15 (n=623) | ECV o prevención primaria en sujetos de alto riesgo (> 15% a los 5 años) en Australia | AAS 75 mg, simvastatina 40 mg, lisinopril 10 mg y atenolol 50 mg o hidroclorotiazida 12,5 mg | Adherencia a la medicación, presión sistólica y colesterol total | Completado |
| SECURE Trial28 (n=3.200) | Población de más de 65 años con ECV (tras IAM) | AAS 100 mg, ramipril 2,5, 5 o 10 mg, atorvastatina 40 mg | Objetivo primario compuesto por muerte CV, IAM no mortal, ictus isquémico y revascularización urgente | En marcha. Fecha estimada de finalización: abril de 2020 |
AAS: ácido acetilsalicílico; cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular; ECV: enfermedad cardiovascular; FRCV: factores de riesgo cardiovascular;IAM: infarto agudo de miocardio.
Recientemente se han completado y publicado los resultados de cuatro estudios diseñados para medir el impacto de un policomprimido cardiovascular en la adherencia terapéutica. Si bien los diferentes estudios han incluido poblaciones, periodos de seguimiento y mediciones de adherencia diversos, todos ellos concuerdan en demostrar el gran impacto de dicha estrategia en la adherencia terapéutica. Tres de estos estudios se han llevado a cabo en prevención primaria o poblaciones mixtas14–16 y han encontrado, en conjunto, una probabilidad de adherencia entre los pacientes aleatorizados al brazo de policomprimido un 56% mayor que en el grupo control.
Cabe destacar los resultados del estudio FOCUS19, dado que incluyó una población homogénea de pacientes tras infarto agudo de miocardio (IAM). El estudio FOCUS se llevó a cabo en cinco países (España, Italia, Argentina, Brasil y Paraguay) con el objetivo de estudiar los factores que impiden una correcta adherencia al tratamiento cardiovascular en prevención secundaria, así como investigar el efecto de un policomprimido en la adherencia y el control de los factores de riesgo. El estudio FOCUS fase 1 incluyó a 2.118 pacientes, y su objetivo era elucidar los factores que interfieren con una correcta adherencia al tratamiento cardiovascular en prevención secundaria tras un IAM. Además, se aleatorizó a 695 pacientes de fase 1 en un ensayo clínico de fase 2 con el fin de probar el efecto de un policomprimido (compuesto por AAS 100 mg, simvastatina 40 mg y ramipril 2,5, 5 o 10 mg) comparado con los tres fármacos por separado en adherencia, presión arterial y colesterol unido a lipoproteínas de baja densidad (cLDL), además de seguridad y tolerabilidad en un periodo de 9 meses. Para ello, el objetivo primario se definió como adherencia al tratamiento en la visita final medida mediante el cuestionario de Morisky-Green, además del recuento directo de píldoras.
En la fase 1, la adherencia al tratamiento cardiovascular por el método de Morisky-Green fue del 45,5%. En un análisis de regresión multivariable, el riesgo de no seguir el tratamiento se asoció con edades menores de 50 años, depresión (cualquier grado; a mayor grado de depresión, peor adherencia), seguir un tratamiento complejo, niveles bajos de apoyo social y coberturas de seguro menores, con resultados concordantes en todos los países. En la fase 2, el grupo asignado al policomprimido mostró un incremento significativo en los niveles de adherencia tras 9 meses comparado con el grupo asignado a los tres fármacos por separado: el 50,8 frente al 41% (población por intención de tratar, p=0,019) y el 65,7 frente al 55,7% (por protocolo, p=0,012) con el objetivo primario de atender la última visita y considerarlos adherentes mediante la combinación de Morisky-Green y recuento de comprimidos. Los niveles de adherencia también fueron significativamente mayores en el grupo de policomprimido cuando se usó el método de Morisky-Green solo (el 68 frente al 59%; p=0,049).
El estudio no encontró diferencias significativas en los objetivos secundarios en cifras de presión arterial sistólica (129,6 frente a 128,6 mmHg), media de cLDL (89,9 frente a 91,7 mg/dl), efectos adversos serios (23 [6,6%] frente a 21 [6%]) o muerte (1 [0,2%] en cada grupo).
Se ha demostrado que el uso del policomprimido tiene buena seguridad y tolerabilidad a corto plazo y que la reducción de factores de riesgo a corto plazo es aproximadamente la que se esperaba de los efectos agregados de los agentes individuales.
En conclusión, en prevención secundaria, respecto a los tres fármacos por separado, el tratamiento con un policomprimido aumenta significativamente la adherencia terapéutica, lo que pone de relevancia la utilidad de esa estrategia.
El policomprimido cardiovascular es una estrategia coste-efectivaParte de la carga del coste asociado a la ECV recae en la falta de eficacia terapéutica derivada de la falta de adherencia. De hecho, los costes directos e indirectos derivados de esa falta de adherencia en Estados Unidos se han calculado entre 100.000 millones y 289.000 millones de dólares anuales20,21. Este es uno de los motivos que ha impulsado a la industria, las aseguradoras y las agencias reguladoras y gubernamentales a buscar fórmulas que promuevan la adherencia de manera eficaz y coste-efectiva.
La relación coste-efectividad del policomprimido se ha estudiado en múltiples entornos socioeconómicos. Gaziano et al22 realizaron un estudio farmacoeconómico para evaluar diferentes regímenes de policomprimidos para prevención tanto primaria como secundaria en países de rentas bajas y medias. El incremento en coste-efectividad en prevención secundaria fue de entre 306 y 388 dólares por cada año de vida ajustado por calidad (QALY) ganado, lo que demuestra que el policomprimido es una estrategia coste-efectiva para pacientes en prevención cardiovascular secundaria, incluso en países de rentas más bajas.
Más recientemente se han publicado los resultados de un interesante modelo de Markof alimentado con datos de ensayos clínicos para analizar el papel de un policomprimido cardiovascular en prevención secundaria en el Reino Unido23. Dicho modelo comparó el uso de un policomprimido compuesto por AAS 100 mg, atorvastatina 20 mg y ramipril 2,5, 5, o 10 mg con monoterapia. El objetivo primario era la prevención de eventos cardiovasculares por cada 1.000 pacientes y los objetivos secundarios incluyeron coste por año de vida y QALY ganados. El modelo estimó que por cada 10% de incremento en los niveles de adherencia, se puede prevenir el 6,7% de los eventos cardiovasculares mortales y no mortales. Utilizando un aumento de un 20% en la adherencia derivado del policomprimido, se calculó que el uso de un policomprimido podría prevenir 47 de 323 (15%) eventos cardiovasculares mortales y no mortales por cada 1.000 pacientes, comparado con el tratamiento estándar en monoterapia, con una razón incremental de coste-efectividad de 8.200 libras esterlinas por QALY. Basándonos en estos y otros resultados, el uso de un policomprimido cardiovascular en prevención secundaria podría ser una estrategia con alta razón de coste-efectividad para prevenir eventos cardiovasculares.
Impacto de un policomprimido cardiovascular en eventos cardiovascularesHa pasado poco más de una década desde que se propuso el concepto del policomprimido cardiovascular hasta que se ha logrado desarrollar el fármaco y aportar suficiente evidencia científica para conseguir su aprobación por las agencias reguladoras. Los ensayos clínicos aleatorizados prospectivos llevados a cabo hasta el momento carecían de poder estadístico para medir el impacto del tratamiento con un policomprimido en los eventos cardiovasculares. Recientemente, el programa de investigación e innovación H2020 de la Comunidad Europea ha financiado en su totalidad el estudio SECURE (Secondary Prevention of Cardiovascular Disease in the Elderly), cuyo objetivo primario es medir el efecto de tratar a una población post-IAM de más de 65 años con un policomprimido o tratamiento estándar en eventos cardiovasculares duros (mortalidad cardiovascular, recurrencia de IAM, ictus isquémico o revascularización urgente). El estudio está coordinado por el Centro Nacional de Investigaciones Cardiovasculares (CNIC) y cuenta con los Dres. Fuster y Castellano como investigadores principales. El estudio SECURE incluirá a más de 3.200 pacientes en siete países europeos (España, Italia, Alemania, Francia, República Checa, Hungría y Polonia) y los seguirá un mínimo de 2 años y un máximo de 4. Está programado que la inclusión de pacientes empiece en el primer trimestre de 2016 y los datos estarán disponibles en mayo de 2020. Sin duda los datos del estudio SECURE serán importantes a la hora de adoptar la mencionada estrategia de tratamiento en prevención secundaria de forma global.
Conclusiones y perspectivas futurasLa dimensión global de las ECV requiere que la comunidad científica proponga estrategias eficaces que se pueda implementar de manera generalizada24. La sencillez conceptual que representa el policomprimido (en contraposición a la complejidad técnica que ha supuesto su desarrollo) responde a la necesidad de simplificar el tratamiento para buscar el equilibrio perfecto entre accesibilidad, adherencia y viabilidad desde el punto de vista de coste-efectividad. El policomprimido cardiovascular Fuster-CNIC-Ferrer es una de las respuestas a la necesidad de tratamiento global frente al avance de las ECV y nace fruto de la colaboración público-privada entre el CNIC y Ferrer. Esta innovación terapéutica es la primera en su clase que recibe la aprobación de las agencias reguladoras de 15 países europeos: Alemania, Austria, Bélgica, Bulgaria, España, Finlandia, Francia, Grecia, Irlanda, Italia, Polonia, Portugal, República Checa, Rumanía y Suecia. Además ha sido aprobada en Chile. Actualmente se comercializa en España, Portugal, Rumanía y Alemania bajo los nombres de Trinomia® y Sincronium®.
Conflicto de interesesV. Fuster y J.M. Castellano participan como investigadores principales en ensayos clínicos que evalúan la utilidad de la polypill en disminuir los eventos cardiovasculares.