Las complicaciones hemorrágicas se asocian a un peor pronóstico en pacientes con síndrome coronario agudo (SCA)1. En los últimos años se han desarrollado diversas escalas para predecir el desarrollo de complicaciones hemorrágicas intrahospitalarias en el SCA2–4, que han mostrado un adecuado rendimiento predictivo en diferentes escenarios5. Sin embargo, estas escalas no han sido validadas para predecir complicaciones hemorrágicas más allá de la fase de hospitalización.
El objetivo de este estudio fue estudiar la capacidad de las escalas de riesgo hemorrágico CRUSADE2, Mehran3 y ACTION4 para predecir el desarrollo de complicaciones hemorrágicas al año tras el alta hospitalaria, y comparar dicha capacidad predictiva con la mostrada por las 3 escalas para predecir hemorragias hospitalarias.
Se trata de un estudio retrospectivo en el que se incluyeron prospectivamente pacientes ingresados en la unidad coronaria de un hospital terciario por SCA, entre octubre de 2009 y abril de 2014. Se calculó la puntuación de las escalas CRUSADE2, Mehran3 y ACTION4 para cada paciente. Para definir hemorragia intrahospitalaria se utilizó la definición BARC6 (categorías 3 y 5).
Se realizó un seguimiento clínico al año mediante revisión de la historia clínica o contacto telefónico, registrando el desarrollo de sucesos hemorrágicos clínicamente relevantes, definidos como aquellos que hubiesen requerido ingreso hospitalario, transfusión de ≥ 1 concentrado de hematíes o suspensión del tratamiento antitrombótico.
La capacidad de las 3 escalas para la predicción de hemorragias intrahospitalarias se analizó mediante regresión logística binaria, cálculo de curvas ROC (receiver operating characteristic) y sus correspondientes áreas bajo la curva (ABC), comparándolas con el método de DeLong. La capacidad predictiva de las 3 escalas para las hemorragias durante el seguimiento se analizó mediante regresión de riesgos competitivos de Fine y Gray (considerando la muerte como suceso competitivo), cálculo de curvas ROC y sus correspondientes ABC, comparándolas de nuevo con el método de DeLong.
Se incluyó a 1.489 pacientes, con una edad media de 62,5 años y de los cuales el 77,7% eran varones. Cuarenta y nueve pacientes (3,3%) presentaron hemorragias BARC tipo 3 o 5 durante el ingreso. La mortalidad hospitalaria fue del 6,3%. De los 94 pacientes fallecidos durante el ingreso, 35 (37,2%) lo hicieron por causas no cardiacas y 5 (5,3%) debido a complicaciones hemorrágicas.
Se dispuso de seguimiento en 1.375 pacientes (97,9%, mediana de tiempo de seguimiento de 365 días), y durante este 69 pacientes desarrollaron complicaciones hemorrágicas y 73 fallecieron. La media de tiempo hasta la ocurrencia de las hemorragias tras el alta fue de 169 días. Ocho (11,6%) de estos sucesos hemorrágicos ocurrieron en los primeros 30 días, y 38 hemorragias (55,1%) se produjeron en los primeros 6 meses. La localización más frecuente de las hemorragias tras el alta fue urinaria en 24 pacientes (34,8%), seguida de la digestiva en 16 (23,2%), respiratoria en 15 (21,7%), intracraneal en 5 (7,2%) y muscular en 5 (7,2%).
De los 73 pacientes fallecidos durante el seguimiento, 43 (58,9%) lo hicieron por causas no cardiacas y 4 (5,5%) debido a complicaciones hemorrágicas.
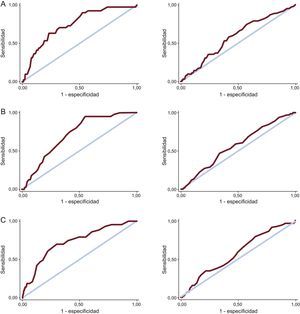
En el conjunto de pacientes, las 3 escalas mostraron una buena capacidad para predecir hemorragias intrahospitalarias (tabla), sin apreciarse diferencias estadísticamente significativas entre las diferentes ABC (p=NS). En contraste, la capacidad de las 3 escalas para predecir complicaciones hemorrágicas al año tras el alta en los supervivientes al ingreso fue deficiente, sin apreciar tampoco diferencias significativas entre las 3 ABC (p=NS). La figura muestra las curvas ROC de la predicción de hemorragias intrahospitalarias y durante el seguimiento para las 3 escalas.
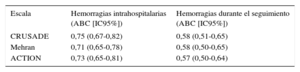
Área bajo la curva de las diferentes escalas para la predicción de hemorragias
| Escala | Hemorragias intrahospitalarias (ABC [IC95%]) | Hemorragias durante el seguimiento (ABC [IC95%]) |
|---|---|---|
| CRUSADE | 0,75 (0,67-0,82) | 0,58 (0,51-0,65) |
| Mehran | 0,71 (0,65-0,78) | 0,58 (0,50-0,65) |
| ACTION | 0,73 (0,65-0,81) | 0,57 (0,50-0,64) |
ABC: área bajo la curva ROC; IC95%: intervalo de confianza del 95%.
Nuestro estudio tiene las limitaciones inherentes a un registro de un único centro, con un número relativamente pequeño de sucesos y un manejo clínico homogéneo. En consecuencia, estos resultados podrían no ser aplicables a poblaciones con características y tratamientos diferentes. Además, el hecho de tratarse de pacientes ingresados en la unidad coronaria podría implicar un sesgo de selección. La utilización de definiciones de hemorragia diferentes para la fase hospitalaria y la fase tras el alta constituye otra limitación del estudio. No obstante, las diferencias conceptuales y fisiopatológicas entre hemorragias hospitalarias y tras el alta justifican, en nuestra opinión, la utilización de diferentes definiciones, ya que algunas características de la definición utilizada para las hemorragias tras el alta (fundamentalmente la necesidad de ingreso) no son aplicables a un paciente ya ingresado. En cualquier caso, a nuestro juicio, la utilización de distintas definiciones no justifica las contundentes diferencias apreciadas de forma concordante para las ABC de las 3 escalas.
Datos recientes1 sugieren que las hemorragias mayores tras el alta por un SCA se asocian con la mortalidad de manera comparable a las que ocurren durante la hospitalización. La predicción de hemorragias tras el alta es de gran relevancia debido a varios motivos, como la disponibilidad de nuevos y potentes fármacos antiplaquetarios, las dudas sobre la duración óptima de la doble antiagregación tras un SCA o la cada vez más frecuente indicación de anticoagulación por fibrilación auricular u otra comorbilidad debido al progresivo envejecimiento de la población. En ausencia de otras herramientas, son usualmente estas escalas de riesgo hemorrágico las utilizadas por los clínicos para seleccionar el tipo y la duración del tratamiento antitrombótico tras el alta. A pesar de las limitaciones mencionadas, nuestros datos muestran razonablemente el pobre rendimiento de estas escalas para predecir el desarrollo de complicaciones hemorrágicas dentro del primer año tras el SCA, lo que a nuestro juicio evidencia la necesidad de desarrollar nuevas herramientas, más precisas y fiables, para la estratificación del riesgo hemorrágico tras la fase de hospitalización.
CONFLICTO DE INTERESESE. Abu-Assi es Editor Asociado de Revista Española de Cardiología.