El beneficio de la angioplastia primaria puede reducirse si se producen demoras hasta la reperfusión, y es preciso identificar los factores implicados.
MétodosAnálisis del registro Codi Infart de Cataluña y el tiempo transcurrido hasta la angioplastia según el lugar de primera asistencia médica.
ResultadosEn 3.832 pacientes, la primera asistencia se produjo en un 18% en centros de atención primaria y un 37% en hospitales sin hemodinámica. Hubo mayores demoras en estos 2 grupos que en los casos atendidos por el sistema de emergencias extrahospitalario o en hospitales con hemodinámica (p < 0,0001, resultados en medianas): tiempo primera asistencia-indicación angioplastia, 42 min en ambos (total, 35 min); primera asistencia-apertura de la arteria, 131 y 143 min respectivamente (total, 121 min); tiempo total de isquemia, 230 y 260 min (total, 215 min). El tiempo primera asistencia-apertura de la arteria > 120 min mostró fuerte asociación con la primera asistencia en centros sin hemodinámica (odds ratio = 4,96; intervalo de confianza del 95%, 4,14-5,93) y edad, cirugía coronaria previa, primera asistencia en horario nocturno, electrocardiograma no diagnóstico y clase Killip ≥ III. La mortalidad al mes y al año fue del 5,6 y el 8,7% y se relacionó independientemente con la edad, el retraso hasta la angioplastia, la clase Killip ≥ II y la primera asistencia en un hospital con hemodinámica.
ConclusionesLa primera asistencia de los pacientes tributarios de angioplastia primaria se produce en un centro sin hemodinámica en más de la mitad de casos y es un importante factor predictor de retraso hasta la apertura de la arteria.
Palabras clave
La angioplastia primaria es la terapia de reperfusión de elección para los pacientes con infarto de miocardio con elevación del segmento ST (IAMCEST) mientras se realice en los plazos recomendados1,2. En la práctica diaria, pueden llevar a cabo la primera asistencia de estos pacientes el sistema de emergencias extrahospitalario (SEE), hospitales con hemodinámica (HH), hospitales sin hemodinámica o comarcales (HSH) y centros de atención primaria (CAP). El escenario ideal es el primero, donde el paciente es trasladado directamente al laboratorio tras el diagnóstico y evitando demoras intermedias en los servicios de urgencias. Sin embargo, en no pocas ocasiones la primera asistencia se realiza en centros sin hemodinámica, con los inherentes retrasos hasta la reperfusión3–8.
En junio de 2009 se puso en marcha el protocolo Codi Infart, consistente en una red asistencial para tratar el IAMCEST mediante angioplastia primaria preferentemente y coordinada por el Departament de Salut de la Generalitat de Catalunya9. Se incluye sistemáticamente a todos los pacientes en un registro que incluye variables demográficas, del procedimiento y de mortalidad y permite analizar los resultados y mejorar la asistencia.
El objetivo principal del estudio es conocer los tiempos de actuación entre el inicio del dolor y la apertura de la arteria de los pacientes en los que se activa el Codi Infart, analizar si difieren en función del lugar donde se realice la primera asistencia e identificar variables predictoras de retraso en la reperfusión. El objetivo secundario es determinar la mortalidad al mes y al año y las variables asociadas.
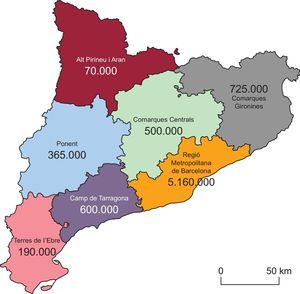
MÉTODOSOrganización del programa Codi InfartCataluña está dividida en 7 áreas (sectorización territorial), con 10 HH que actúan como centro de referencia según el área asignada (figura 1). El centro que realiza el diagnóstico es el que activa el protocolo Codi Infart; si se produce en un HH, es el propio hospital el que lleva a cabo el procedimiento intervencionista; en los otros 3 escenarios (CAP, HSH y SEE), el SEE traslada al paciente al hospital de referencia para realizar la angioplastia, siempre que el tiempo estimado sea ≤ 90 min desde la primera asistencia hasta la llegada al laboratorio; en caso contrario, se administra fibrinolisis si no hay contraindicación9.
Población de estudio y variables a analizarSe analizó a todos los pacientes tratados consecutivamente con angioplastia primaria entre 2010 y 2011 e incluidos sistemáticamente en el registro (3.832 pacientes). Se diferenciaron 4 grupos según el lugar de primera asistencia: CAP, HSH, HH (que actúa de referencia para el intervencionismo) y SEE. Se analizaron los siguientes intervalos de tiempo: inicio del dolor-primera asistencia, primera asistencia-electrocardiograma, primera asistencia-activación Codi Infart, primera asistencia-llegada a hemodinámica, primera asistencia-apertura de la arteria (TPA), retraso atribuible a la angioplastia y tiempo total de isquemia. El análisis de los tiempos de actuación se realizó en 3.794 pacientes, al no disponer de todos los datos de 38. Se diferenció entre horario de primera asistencia diurno (entre las 8.00 y las 21.59 horas) y nocturno (entre las 22.00 y las 7.59 horas). La valoración inicial del electrocardiograma la realizó el médico responsable de la primera asistencia y en su interpretación se consideraron las variables: elevación del segmento ST, sin elevación del segmento ST, presencia de bloqueo de rama izquierda y electrocardiograma no diagnóstico. Se recogieron las siguientes complicaciones en la fase aguda: taquicardia ventricular, fibrilación ventricular, asistolia, bloqueo auriculoventricular avanzado y grado Killip. Se determinó también la mortalidad en las primeras 24 h de evolución, al primer mes y al año.
Análisis estadísticoLas variables continuas se expresan como medianas [intervalo intercuartílico] y las variables categóricas, como frecuencia absoluta. Se utilizó la prueba de la t de Student para comparar las medias y la prueba de la χ2 (o la exacta de Fisher, de ser necesario) se utilizó para evaluar la relación entre las variables dicotómicas. Para la predicción de la demora en la reperfusión, se utilizó regresión logística multivariable con la variable dependiente TPA > 120 min, y se calcularon las odds ratio (OR) para las diferentes variables. Para la predicción de la mortalidad a los 30 días y al año, se utilizó asimismo regresión logística (todas las variables con un valor de p < 0,1 en el análisis univariable se incorporaron en el modelo); se consideró estadísticamente significativo un valor de p < 0,05. Tras obtener el modelo estadístico con las variables asociadas, se analizó su capacidad predictiva mediante el cálculo de las curvas ROC y su correspondiente área bajo la curva (se consideró significativa un área > 0,8). El software SPSS 18 (SPSS, Inc.; Chicago, Illinois, Estados Unidos) se utilizó para llevar a cabo el análisis estadístico.
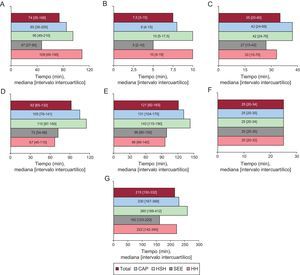
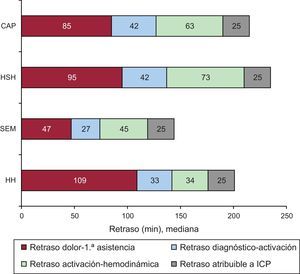
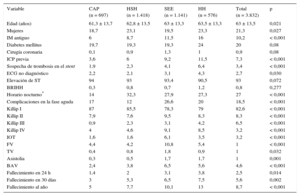
RESULTADOSDurante los años 2010 y 2011 se realizó angioplastia primaria a 3.832 pacientes con IAMCEST (media de edad, 62,6 ± 13,5 años; el 79% varones). La primera asistencia se realizó en un centro sin hemodinámica en 2.115 casos (el 55% del total): 697 en un CAP y 1.418 en HSH. Las diferencias según el lugar de primera asistencia se recogen en la tabla 1. Los pacientes atendidos inicialmente por el SEE o en HH tenían mayor prevalencia de infarto previo, antecedente de revascularización percutánea e insuficiencia cardiaca en la fase aguda en comparación con los otros 2 grupos. La figura 2A–G muestran los diferentes tiempos de actuación en función del lugar de primera asistencia. En los grupos CAP y HSH se observó mayor demora en todos los tiempos registrados desde el inicio del dolor hasta la apertura de la arteria, excepto en el retraso atribuible a la angioplastia (figura 3). La apertura de la arteria en los grupos CAP y HSH se alcanzó con más de 30 y 40 min de retraso desde la primera asistencia respecto a los grupos SEE y HH (131 y 143 frente a 99 y 96 min respectivamente; p < 0,0001) y solo en un 34% se alcanzó un TPA ≤ 120 min, en comparación con un 70% de los pacientes del grupo SEE y un 68% del grupo HH (p < 0,0001).
Características basales según el lugar de primera asistencia médica
| Variable | CAP (n = 697) | HSH (n = 1.418) | SEE (n = 1.141) | HH (n = 576) | Total (n = 3.832) | p |
|---|---|---|---|---|---|---|
| Edad (años) | 61,3 ± 13,7 | 62,8 ± 13,5 | 63 ± 13,3 | 63,5 ± 13,3 | 63 ± 13,5 | 0,021 |
| Mujeres | 18,7 | 23,1 | 19,5 | 23,3 | 21,3 | 0,027 |
| IM antiguo | 6 | 8,7 | 11,5 | 16 | 10,2 | < 0,001 |
| Diabetes mellitus | 19,7 | 19,3 | 19,3 | 24 | 20 | 0,08 |
| Cirugía coronaria | 0,1 | 0,9 | 1,3 | 1 | 0,9 | 0,08 |
| ICP previa | 3,6 | 6 | 9,2 | 11,5 | 7,3 | < 0,001 |
| Sospecha de trombosis en el stent | 1,9 | 2,3 | 4,1 | 6,4 | 3,4 | < 0,001 |
| ECG no diagnóstico | 2,2 | 2,1 | 3,1 | 4,3 | 2,7 | 0,030 |
| Elevación de ST | 94 | 93 | 93,4 | 90,5 | 93 | 0,072 |
| BRIHH | 0,3 | 0,8 | 0,7 | 1,2 | 0,8 | 0,277 |
| Horario nocturno* | 14 | 32,3 | 27,9 | 27,3 | 27 | < 0,001 |
| Complicaciones en la fase aguda | 17 | 12 | 26,6 | 20 | 18,5 | < 0,001 |
| Killip I | 87 | 85,5 | 78,3 | 79 | 82,6 | < 0,001 |
| Killip II | 7,9 | 7,6 | 9,5 | 8,3 | 8,3 | < 0,001 |
| Killip III | 0,9 | 2,3 | 3,1 | 4,2 | 6,5 | < 0,001 |
| Killip IV | 4 | 4,6 | 9,1 | 8,5 | 3,2 | < 0,001 |
| IOT | 1,6 | 1,6 | 6,1 | 3,5 | 3,2 | < 0,001 |
| FV | 4,4 | 4,2 | 10,8 | 5,4 | 1 | < 0,001 |
| TV | 0,4 | 0,8 | 1,8 | 0,9 | 1 | 0,032 |
| Asistolia | 0,3 | 0,5 | 1,7 | 1,7 | 1 | 0,001 |
| BAV | 2,4 | 3,8 | 6,5 | 5,6 | 4,6 | < 0,001 |
| Fallecimiento en 24 h | 1,4 | 2 | 3,1 | 3,8 | 2,5 | 0,014 |
| Fallecimiento en 30 días | 3 | 5,3 | 6,5 | 7,5 | 5,6 | 0,002 |
| Fallecimiento al año | 5 | 7,7 | 10,1 | 13 | 8,7 | < 0,001 |
BAV: bloqueo auriculoventricular avanzado; BRIHH: bloqueo de rama izquierda del haz de His; CAP: centro de atención primaria; ECG: electrocardiograma; FV: fibrilación ventricular; HH: hospital con hemodinámica; HSH: hospital sin hemodinámica; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IOT: intubación orotraqueal; SEE: sistema de emergencias extrahospitalario; TV: taquicardia ventricular.
Intervalos según el lugar de primera asistencia. A: tiempo inicio del dolor-primera asistencia. B: tiempo primera asistencia-electrocardiograma. C: tiempo primera asistencia-activación Codi Infart. D: tiempo primera asistencia-llegada a sala de hemodinámica. E: tiempo primera asistencia-apertura de la arteria. F: retraso atribuible a la angioplastia. G: tiempo total de isquemia. CAP: centro de atención primaria; HH: hospital con hemodinámica; HSH: hospital sin hemodinámica; SEE: sistema de emergencias extrahospitalario. p < 0,0001 en todas las comparaciones entre grupos (excepto en el retraso atribuible a la angioplastia, p = 0,589).
Retrasos en el tiempo hasta la reperfusión coronaria desde el inicio del dolor según el lugar de primera asistencia. CAP: centro de atención primaria; HH: hospital con hemodinámica; HSH: hospital sin hemodinámica; ICP: intervención coronaria percutánea; SEE: sistema de emergencias extrahospitalario.
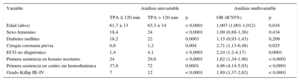
El lugar de primera asistencia (centro sin hemodinámica, que engloba CAP y HSH) fue el predictor más importante de demora hasta la apertura de la arteria, junto con la edad, el antecedente de cirugía de revascularización coronaria, la ausencia de electrocardiograma diagnóstico inicial, la primera asistencia en horario nocturno y grado Killip ≥ III (tabla 2). El modelo predictivo obtenido mostró una óptima capacidad para predecir el retraso en la reperfusión, con un área bajo la curva ROC de 0,87.
Variables asociadas con TPA > 120 min en los análisis univariable y multivariable
| Variable | Análisis univariable | Análisis multivariable | |||
|---|---|---|---|---|---|
| TPA ≤ 120 min | TPA > 120 min | p | OR (IC95%) | p | |
| Edad (años) | 61,7 ± 13 | 63,3 ± 14 | < 0,0001 | 1,007 (1,001-1,012) | 0,016 |
| Sexo femenino | 18,4 | 24 | < 0,0001 | 1,09 (0,88-1,36) | 0,434 |
| Diabetes mellitus | 18,2 | 22 | 0,0003 | 1,15 (0,93-1,43) | 0,209 |
| Cirugía coronaria previa | 0,6 | 1,2 | 0,004 | 2,71 (1,13-6,48) | 0,025 |
| ECG no diagnóstico | 1,4 | 4,1 | < 0,0001 | 2,24 (1,2-4,17) | 0,0001 |
| Primera asistencia en horario nocturno | 24 | 29,6 | < 0,0001 | 1,62 (1,34-1,96) | < 0,0001 |
| Primera asistencia en centro sin hemodinámica | 37,8 | 72 | 0,0001 | 4,96 (4,14-5,93) | < 0,0001 |
| Grado Killip III–IV | 7 | 12 | < 0,0001 | 1,89 (1,37-2,62) | < 0,0001 |
ECG: electrocardiograma; IC95%: intervalo de confianza del 95%; OR: odds ratio; TPA: tiempo primera asistencia-apertura de la arteria.
Los valores expresan porcentaje o media ± desviación estándar.
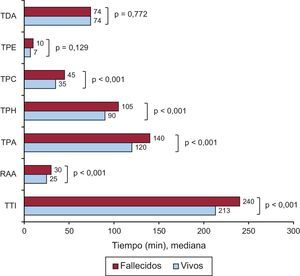
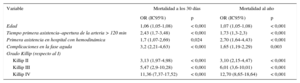
La mortalidad total fue del 5,6% al mes del infarto y del 8,7% al año. Esta fue significativamente mayor según el grado Killip (p < 0,001): Killip I, el 2,2% al mes y el 4,3% al año; Killip II, el 10 y el 16%; Killip III, el 16,5 y el 30%, y Killip IV, el 38 y el 46%. Los tiempos de actuación fueron significativamente mayores en los pacientes fallecidos que en los vivos (figura 4). Las variables relacionadas con la mortalidad al mes y al año del infarto fueron la edad, un TPA > 120 min, presencia de complicaciones en la fase aguda, grado Killip ≥ II y la primera asistencia en un HH (tabla 3). El modelo predictivo resultante mostró una óptima capacidad para predecir la mortalidad al mes (área bajo la curva ROC, 0,88) y al año (área bajo la curva ROC, 0,85).
Diferencias en los intervalos de tiempo (en medianas) entre los pacientes vivos y los fallecidos al año. RAA: retraso atribuible a la angioplastia; TDA: tiempo inicio del dolor-primera asistencia; TPA: tiempo primera asistencia-apertura de la arteria; TPC: tiempo primera asistencia-activación Codi Infart; TPE: tiempo primera asistencia-electrocardiograma; TPH: tiempo primera asistencia-llegada a hemodinámica; TTI: tiempo total de isquemia.
Variables asociadas con mortalidad total a los 30 días y al año en el análisis multivariable
| Variable | Mortalidad a los 30 días | Mortalidad al año | ||
|---|---|---|---|---|
| OR (IC95%) | p | OR (IC95%) | p | |
| Edad | 1,06 (1,05-1,08) | < 0,001 | 1,07 (1,05-1,08) | < 0,001 |
| Tiempo primera asistencia–apertura de la arteria > 120 min | 2,43 (1,7-3,48) | < 0,001 | 1,73 (1,3-2,3) | < 0,001 |
| Primera asistencia en hospital con hemodinámica | 1,7 (1,07-2,69) | 0,024 | 2,70 (1,64-4,43) | < 0,001 |
| Complicaciones en la fase aguda | 3,2 (2,21-4,63) | < 0,001 | 1,65 (1,19-2,29) | 0,003 |
| Grado Killip (respecto al I) | ||||
| Killip II | 3,13 (1,97-4,98) | < 0,001 | 3,10 (2,15-4,47) | < 0,001 |
| Killip III | 5,47 (2,9-10,28) | < 0,001 | 6,01 (3,6-10,01) | < 0,001 |
| Killip IV | 11,36 (7,37-17,52) | < 0,001 | 12,70 (8,65-18,64) | < 0,001 |
IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los principales hallazgos del presente estudio son: a) a más de la mitad de los pacientes sometidos a angioplastia primaria en este entorno se los atiende inicialmente en centros sin hemodinámica; b) los tiempos de actuación difieren significativamente en función del lugar de primera asistencia, con mayor demora para los pacientes atendidos inicialmente en CAP y hospitales comarcales; c) el lugar de primera asistencia se comportó como predictor independiente de retraso en la reperfusión, y d) la demora en la reperfusión se comportó como predictor independiente de mortalidad al mes y al año del infarto en los pacientes de esta serie.
Relación entre el lugar de primera asistencia médica y retrasos hasta la reperfusiónEn esta serie de pacientes consecutivos tratados con angioplastia primaria en los primeros 2 años de la puesta en marcha del protocolo Codi Infart, en más de la mitad de casos la primera asistencia se realizó en un centro sin hemodinámica, que incluye hospitales comarcales (67%) y CAP (33%). Se trata del grupo que mayores retrasos hasta la reperfusión registra y solo se alcanza un TPA ≤ 120 min en un tercio de los pacientes, respecto al 70 y el 68% de los grupos SEE y HH. Otros registros contemporáneos muestran resultados parecidos4,7,8. La puesta en marcha de redes asistenciales para potenciar la terapia de reperfusión en el IAMCEST ha conllevado un aumento significativo del número de angioplastias primarias10. Sin embargo, estos protocolos deben tener en cuenta la posibilidad de que se produzcan retrasos excesivos en su aplicación que limiten los beneficios, por lo que otro objetivo de relevancia es que los tiempos de activación no difieran según el lugar de atención inicial. Tanto las guías de práctica clínica1 como el protocolo del Codi Infart9 consideran como escenario ideal que sea el SEE el que realice la primera asistencia en estos casos, y nuestra serie aporta datos que refrendan esta indicación; sin embargo, esto solo se produce con 3 de cada 10 pacientes en nuestro estudio, un porcentaje que se repite en la literatura4,7.
Numerosos factores pueden explicar estos resultados. En primer lugar, hay un retraso desde el inicio del dolor hasta la solicitud de asistencia médica que repercute en el tiempo de isquemia total. Por otra parte, el lugar de primera asistencia puede variar según cuánto conozca el paciente de su enfermedad, la gravedad de los síntomas y la influencia de factores demográficos y culturales11. Si hay poca conciencia de gravedad, el paciente acudirá seguramente al centro más cercano (probablemente un hospital comarcal o un CAP), mientras que un enfermo más grave o conocedor de su enfermedad puede solicitar inicialmente asistencia urgente vía SEE12 o acudir directamente al hospital donde ya se trató con anterioridad.
Tras solicitar atención médica, los minutos transcurridos desde el diagnóstico del infarto hasta la indicación de angioplastia son clave para iniciar el traslado a la sala de hemodinámica y se puede acortar este tiempo mediante una rápida selección inicial. Miedema et al.2 identificaron que en el 64% de los casos los factores relacionados con la demora hasta la reperfusión se originan en el lugar de primera asistencia (errores en el reconocimiento de los síntomas y la interpretación inicial del electrocardiograma, tiempo de espera para el traslado del enfermo). Finalmente, los tiempos requeridos para la llegada a hemodinámica y apertura de la arteria tienen factores constantes propios2, como la geografía y el clima en uno (en caso de traslado entre centros) y de la duración del procedimiento intervencionista en el otro, pero el tiempo total hasta la reperfusión puede acortarse si se realiza un diagnóstico y activación rápidos13.
Variables predictoras de un tiempo primera asistencia-apertura de la arteria > 120 minLas variables asociadas con un TPA > 120 min fueron la edad, el antecedente de cirugía de revascularización coronaria, tener un primer electrocardiograma no diagnóstico, la primera asistencia en horario nocturno (entre las 22.00 y las 7.59), el lugar de primera asistencia (centro sin hemodinámica respecto a SEE y HH) y un grado Killip ≥ III.
Los pacientes de más edad pueden presentar una mayor atipicidad en la clínica inicial14, lo cual hace que consulten más tarde y se retrase el diagnóstico, y además tienen mayor incidencia de complicaciones en la fase aguda15, lo cual contribuye a demorar la reperfusión mientras se estabilizan.
Los pacientes con un electrocardiograma inicial no diagnóstico duplicaron el riesgo de demora. Esta relación es lógica, y si bien los criterios electrocardiográficos de indicación de terapia de reperfusión están bien definidos1, no es infrecuente encontrar casos con criterios limítrofes en la práctica diaria16, o que no son evidentes hasta horas más tarde y con un infarto más evolucionado. No obstante, se ha demostrado que en estos casos se puede aumentar la sensibilidad realizando electrocardiogramas seriados en los 30 min siguientes17. Por otra parte, los pacientes con antecedentes de cirugía coronaria suelen tener más comorbilidades18,19, mayor incidencia de complicaciones19 y menor elevación del segmento ST en la fase aguda18, lo que retrasa el diagnóstico y la apertura de la arteria.
La primera asistencia en horario nocturno aumenó en más del 50% el riesgo de sufrir un retraso en la indicación de angioplastia. En la literatura esta relación está presente, aunque de manera variable según sea la definición de horario nocturno5,7,8. La dotación de personal sanitario durante este intervalo horario suele ser menor que durante el día en la gran mayoría de los centros, y esto puede contribuir lógicamente a una mayor lentitud en el diagnóstico y la puesta en marcha del traslado a hemodinámica.
El lugar de primera asistencia es un factor predictor muy importante y ya se ha comentado que el escenario ideal para minimizar el tiempo transcurrido es que sea el SEE el que realice el diagnóstico y la indicación de angioplastia primaria.
Finalmente, los pacientes con insuficiencia cardiaca u otras complicaciones necesitan una estabilización previa al traslado, lo que puede implicar soporte de ventilación mecánica invasiva, perfusión de aminas vasoactivas y en algunos casos implante de un marcapasos provisional; todo ello, lógicamente, retrasa la reperfusión5.
Factores relacionados con la mortalidad a los 30 días y al añoLas variables relacionadas con la mortalidad al mes y al año fueron la edad, el mayor tiempo hasta la apertura de la arteria (TPA > 120 min), la presencia de complicaciones en la fase aguda, un grado Killip inicial ≥ II y la primera asistencia en un HH.
Tanto la edad como el grado de insuficiencia cardiaca son variables clásicas asociadas a peor pronóstico15. Respecto al TPA, hay fuerte relación entre el retraso hasta la apertura de la arteria y un peor pronóstico tras el infarto, independientemente de otras variables de riesgo asociadas, y que es progresiva: a mayor retraso, mayor mortalidad4,20.
Finalmente, cabe destacar una mayor mortalidad de los pacientes asistidos inicialmente en un HH, pese a tratarse de uno de los grupos que registran menos demoras hasta la apertura de la arteria. Las variables que pueden contribuir a explicar estas diferencias son una mayor frecuencia de Killip I y una menor incidencia de complicaciones en los grupos CAP y HSH respecto al grupo HH. Aun así, estos resultados deben interpretarse con cautela, pues puede existir un sesgo de confusión residual atribuible a otras variables no incluidas en el registro.
Propuestas de mejora e implementación de la calidad asistencialLos resultados del estudio permiten plantear diferentes propuestas para mejorar la calidad asistencial. Los retrasos que más impactaron en el tiempo total de isquemia fueron los transcurridos desde el inicio del dolor a la solicitud de asistencia médica, desde el diagnóstico a la activación y desde la activación a la llegada a hemodinámica, mientras que el tiempo empleado en el procedimiento intervencionista fue similar entre los 4 grupos.
Desde la puesta en marcha del protocolo Codi Infart se han llevado a cabo campañas de educación poblacional y se dispone de un teléfono de contacto (112) en caso de sospecha de infarto, con el objetivo de que sea el SEE el que realice la primera asistencia médica. También se realizan periódicamente cursos de actualización en el tratamiento del infarto orientados para el personal sanitario implicado en la atención inicial de estos pacientes, así como revisiones de los protocolos según la evidencia científica disponible y la idiosincrasia propia de cada centro. Por otra parte, es importante llevar a cabo análisis periódicos de los tiempos de actuación (tanto en general como en cada centro implicado en la primera asistencia) para poder identificar los factores que más impactan en las demoras innecesarias hasta la apertura de la arteria21; este último aspecto es de vital importancia en los centros sin hemodinámica (desde el primer contacto con el paciente hasta el inicio del traslado), dada su relevancia en el escenario del tratamiento inicial del IAMCEST.
Finalmente, es importante conocer a los pacientes con mayor riesgo de que se produzca un retraso en el diagnóstico (edad avanzada, cirugía cardiaca previa), para no subestimarlos.
LimitacionesNuestro estudio tiene algunas limitaciones. Por un lado, dado que el análisis se realiza en una única comunidad autónoma (Cataluña), es posible que los resultados no sean aplicables a las demás comunidades, con organización asistencial y geografía diferentes, si bien son bastante similares a los de otros registros contemporáneos4,7,8 y se trata de una extensa serie de pacientes incluidos sistemáticamente, lo cual aporta robustez a los resultados. Por otra parte, por limitaciones del propio registro, hay algunas variables que no se han recogido, como el tiempo entre la primera asistencia y el inicio del traslado al HH de los pacientes de los grupos CAP y HSH, o la distancia en quilómetros hasta el hospital con hemodinámica en los traslados entre centros; no obstante, los resultados obtenidos describen de modo razonable el funcionamiento del programa Codi Infart en sus primeros 2 años de implantación y se han identificado variables que influyen en este de manera significativa y con alto valor predictivo. Finalmente, y dado que se trata de un registro y no un estudio aleatorizado, puede haber un sesgo de confusión atribuible a otras variables no incluidas en el registro, si bien se trata de una larga serie de pacientes consecutivos y, por lo tanto, reflejan de modo fiable la práctica clínica diaria.
CONCLUSIONESLa primera asistencia de los pacientes con un IAMCEST en nuestro entorno, con una red asistencial organizada para realizar angioplasta primaria como tratamiento de elección, se realiza en centros sin laboratorio de hemodinámica cardiaca en más de la mitad de los casos, por lo que se debe trasladarlos a otro hospital, lo cual implica mayores demoras hasta la apertura de la arteria. El lugar de primera asistencia es un predictor importante e independiente del retraso en la reperfusión, junto con la edad o no tener un electrocardiograma diagnóstico inicial y otros no tan conocidos como el horario de primera asistencia, el antecedente de cirugía coronaria y la presencia de insuficiencia cardiaca (grado Killip ≥ III). Identificar estas variables es de vital importancia para mejorar la atención de estos enfermos en el futuro. Finalmente, el retraso hasta la apertura de la arteria es un predictor independiente de mortalidad al mes y al año.
- –
La puesta en marcha de redes asistenciales en el tratamiento del IAMCEST puede colaborar a reducir la demora desde el diagnóstico hasta la apertura de la arteria mediante angioplastia primaria. Este aspecto es de gran importancia, pues el retraso en la reperfusión tiene implicaciones pronósticas y puede minimizar el beneficio de la terapia.
- –
El escenario ideal es que el SEE realice la primera asistencia y traslade directamente al paciente al laboratorio de hemodinámica, evitando retrasos intermedios que se producirían al acudir inicialmente a centros sin hemodinámica.
- –
En un entorno con una red asistencial organizada para tratar el IAMCEST, se atiende inicialmente en centros sin hemodinámica a más de la mitad de los pacientes sometidos a angioplastia primaria.
- –
El lugar de primera asistencia es un predictor importante e independiente de la demora en la reperfusión, junto con la edad o no tener un electrocardiograma diagnóstico inicial y otros no tan conocidos como el horario de primera asistencia, el antecedente de cirugía coronaria y la presencia de insuficiencia cardiaca.
- –
La demora en la reperfusión es un predictor independiente de mortalidad a los 30 días y al año.
Se dispuso de una ayuda para realizar el análisis estadístico del estudio, financiada por el programa del Codi Infart del Plà director de malalties de l’aparell circulatori.
CONFLICTO DE INTERESESNinguno.
A todos los profesionales implicados en el programa Codi Infart, que con su esfuerzo y dedicación consiguen que cada día mejore la asistencia de estos pacientes. A Josep Ramon Marsal, por su colaboración con el análisis estadístico