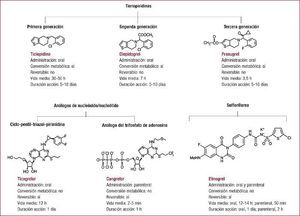
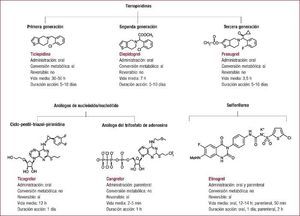
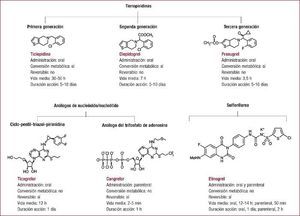
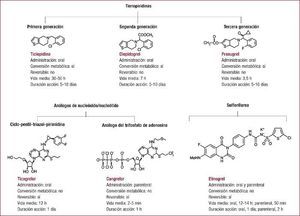
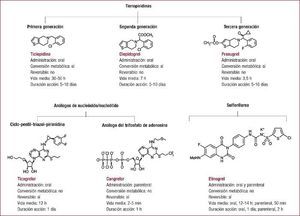
La doble terapia consistente en ácido acetilsalicílico y un inhibidor del receptor plaquetario P2Y12 es el pilar básico del tratamiento antiagregante en el síndrome coronario agudo, especialmente en aquellos pacientes a los que se les practica una revascularización percutánea con implante de stent coronario. El clopidogrel ha sido el inhibidor del receptor P2Y12 de uso mayoritario durante más de una década. En los últimos años, disponemos de dos nuevos inhibidores del receptor P2Y12, prasugrel y ticagrelor. Estos nuevos fármacos son más potentes, rápidos en su acción y presentan menos variabilidad en su respuesta que el clopidogrel. Sin embargo, esta ampliación del arsenal terapéutico de uno a tres fármacos hace que se presenten dudas en la elección del antiagregante acompañante de la aspirina en casos específicos. Además, existen diversos escenarios que presentan un desafío en cuanto a la elección del tratamiento antiagregante óptimo, como la necesidad de una cirugía no coronaria durante el periodo de tratamiento con la doble terapia. En esta sección se describen tres casos clínicos con el fin de discutir tres escenarios comunes en la práctica clínica diaria: paciente con síndrome coronario agudo con elevación del ST, paciente con síndrome coronario agudo sin elevación del ST, y paciente con necesidad de cirugía no coronaria y tratamiento antiagregante.
Palabras clave
Varón de 79 años con factores de riesgo cardiovascular (hipertensión arterial, hipercolesterolemia y exfumador de 15 paquetes/año), con antecedentes de enfermedad renal crónica (aclaramiento de creatinina, 45 ml/min) e hiperplasia benigna de próstata. Su historia cardiovascular se inicia en 2006 con un infarto de miocardio inferolateral; se realizó cateterismo urgente y se objetivó una oclusión completa de la arteria circunfleja y una extensa lesión en la arteria descendente anterior. El resto del árbol coronario estaba sin lesiones. Se decidió tratar mediante angioplastia primaria e implante de stent farmacoactivo la lesión de la arteria circunfleja y mediante angioplastia y stent farmacoactivo en un segundo tiempo la lesión de la arteria descendente anterior. La función sistólica del ventrículo izquierdo estaba conservada. Al alta, el tratamiento consistió en ácido acetilsalicílico (AAS) 100 mg/día, clopidogrel 75 mg/día, atorvastatina 40 mg/día, atenolol 50 mg/día y enalapril 10 mg/día.
En 2009 el paciente sufrió un episodio de dolor torácico, y en el ECG de urgencias se objetivó elevación del segmento ST inferolateral. Se realizó cateterismo urgente, que objetivó oclusión de la arteria circunfleja en el stent previamente implantado. Se realizó aspiración de material trombótico, angioplastia primaria e implante de stent farmacoactivo. Al alta, el tratamiento consistió en AAS 100 mg/día y clopidogrel 150 mg/día.
En 2010 sufrió un nuevo infarto de miocardio con elevación del segmento ST de localización inferolateral. En la coronariografía urgente se objetivó trombosis tardía del stent previamente implantado en la circunfleja, y se decidió realizar nueva angioplastia e implante de stent farmacoactivo. Al alta, el tratamiento antitrombótico fue AAS 100 mg/día y prasugrel 5 mg/día.
Asintomático hasta ahora, el paciente ha vuelto a sufrir nuevo episodio de angina, por lo que ha acudido a urgencias. En el ECG realizado se objetiva elevación del segmento ST de localización inferolateral (Figura 1). Se realizó nueva coronariografía urgente, que objetiva trombosis del stent implantado en la arteria circunfleja. Se trata mediante tromboaspiración y se realiza ecografía intravascular (IVUS) para comprobar la aposición de este stent, que en este caso era normal. Comprobada la normal aposición del stent, se decide realizar angioplastia con balón medicado (Figura 2). El paciente evoluciona satisfactoriamente. Se decide administrar como tratamiento antiagregante AAS 100 mg/día y ticagrelor (dosis de carga de 180 mg y mantenimiento con 90 mg/12 h). El paciente evoluciona satisfactoriamente, sin nuevos eventos isquémicos ni de sangrado.
Figura 1. Electrocardiograma en el que se puede apreciar elevación del segmento ST de localización inferolateral (caso 1).
Figura 2. A: coronariografía que muestra la trombosis del stent previamente implantado en la arteria circunfleja. B: buen flujo TIMI tras la angioplastia (caso 1).
Discusión del caso 1El caso clínico presentado integra varios problemas que se presentan en la práctica diaria. El primero de ellos consiste en evaluar, según los factores de riesgo y las características clínicas del paciente, el inhibidor del receptor P2Y12 más adecuado para combinar con el AAS1. En el paciente presentado convergen varias circunstancias: en primer lugar, sus características clínicas (edad > 75 años, enfermedad renal crónica, trombosis del stent, sin elevado riesgo de sangrado a priori) orientan a que el antiagregante más adecuado a dicho perfil sería el ticagrelor, en vista de los resultados de los ensayos clínicos que se han comentado en los artículos previos. Sin embargo, hay que tener en cuenta un segundo problema: el momento en que han surgido los tres episodios de trombosis del stent, cuando todavía no se comercializaban en nuestro país los nuevos antiagregantes. De ahí que, tras la primera trombosis del stent, se iniciara tratamiento con doble dosis de clopidogrel y en la segunda con prasugrel a la dosis de 5 mg, la aprobada para pacientes mayores de 75 años. Es en el tercer episodio cuando se decidió iniciar tratamiento con ticagrelor. Por último, hay que tener en cuenta que no solo el tipo y la duración de la terapia antiagregante son fundamentales en la aparición de una trombosis del stent, sino que factores puramente «técnicos» (mala aposición del stent, lesiones complejas, etc.) o intrínsecos del paciente (diabetes mellitus, etc.) favorecen la trombosis repetida del stent2.
Caso clínico 2: síndrome coronario agudo sin elevación del segmento STMujer de 55 años, hipertensa, diabética, exfumadora y obesa como factores de riesgo, que acudió a urgencias por dolor torácico, llevaba una vida y una actividad adecuadas para su edad y no tenía antecedentes cardiovasculares. Años atrás había sido diagnosticada de un hipotiroidismo subclínico y era posmenopáusica, sin tratamiento hormonal sustitutivo. Como antecedente de interés, presentó diagnóstico de anemia microcítica grave (sin especificar las cifras de hemoglobina), remitida para estudio por el servicio de digestivo de nuestro hospital; se realizó colonoscopia y gastroscopia. En estas exploraciones los únicos hallazgos destacables fueron una hernia de hiato y anillo de Schatzki. La biopsia fue negativa para enfermedad celiaca.
La paciente refería historia de unos 2 meses de evolución de dolor torácico de esfuerzo irradiado a espalda, que cedía en reposo y no se acompañaba de cortejo vegetativo. El umbral del dolor fue acortándose progresivamente. La noche previa al ingreso sufrió dolor de las mismas características mientras estaba en reposo en su casa, con una duración de aproximadamente 45 min, por lo que acudió a su centro de salud, desde donde se la envió finalmente a urgencias. A su llegada a este servicio, presentaba leve molestia torácica, y el ECG realizado muestra descenso del segmento ST y ondas T negativas en I, aVL y V1-V5 (Figura 3). La paciente negaba la presencia de melenas u otro tipo de sangrados, así como dispepsia. En la exploración física se apreció presión arterial de 140/80 mmHg, sin signos de mala perfusión o fallo ventricular. Ante los hallazgos electrocardiográficos en urgencias, se le administró una cafinitrina sublingual y quedó asintomática. Se administró también carga de AAS de 250 mg y 600 mg de clopidogrel, y se avisó al cardiólogo de guardia, quien comprobó que la paciente se encontraba asintomática y estable, aunque mantenía los cambios del ECG. Se determinó la troponina T de alta sensibilidad, que era de 18 pg/ml al ingreso y pasó a 59 y 57 pg/ml a las 3 y a las 6 h respectivamente. Los demás parámetros bioquímicos y de hematimetría resultaron normales. De esta manera se diagnosticó de síndrome coronario agudo sin elevación del ST (SCASEST) y se estimó un riesgo de sangrado CRUSADE de 30 (moderado) y un riesgo GRACE de 139 (moderado-alto). En ese momento se decidió realizar cambio del inhibidor del receptor P2Y12 a ticagrelor; se administró en el momento una dosis de carga de 180 mg y se prescribió 90 mg/12 h. El resto de su tratamiento se compuso de anticoagulación con enoxaparina 80 mg/12 h, ramipril, bisoprolol, omeprazol y atorvastatina, además de 100 mg de AAS. La paciente quedó ingresada y permaneció estable y asintomática, sin signos ni síntomas de insuficiencia cardiaca. Nunca presentó signos de sangrado digestivo, la hemoglobina se mantuvo en torno a 12,5 g/dl. En la ecocardiografía se apreció una amplia acinesia anteroapical con función ventricular izquierda por estimación biplanar del 40%, sin otras alteraciones. Por estos hallazgos, se añadieron al tratamiento 25 mg de eplerenona. Se realizó cateterismo cardiaco 48 h después, y se apreció una lesión suboclusiva con trombo en el segmento medio de la arteria descendente anterior (Figura 4), por lo que se implantó un stent recubierto de everolimus de 3 × 12 mm, sin complicaciones y con buen resultado final (Figura 4). La paciente evolucionó después de manera satisfactoria y recibió el alta a las 24 h del procedimiento. Tres meses después, la paciente se encontraba libre de angina y sin disnea u otros síntomas de insuficiencia cardiaca ni evidencia de sangrados.
Figura 3. Electrocardiograma realizado a la llegada a urgencias de la paciente del caso 2, en el que se puede ver una taquicardia sinusal con descenso del segmento ST y ondas T negativas en las derivaciones I, aVl y V1-5.
Figura 4. Imágenes de la coronariografía realizada a la paciente del caso 2. A: coronariografía diagnóstica que muestra lesión crítica en el segmento medio de la descendente anterior. B: resultado tras implante de stent liberador de fármaco (Sinergy® con everolimus de 3 × 12 mm).
Discusión del caso 2Del caso expuesto, merecen comentario varios puntos. Primero, la importancia de identificar no solo el riesgo isquémico, sino también el hemorrágico. La valoración del riesgo de hemorragia es de vital importancia en estos pacientes3. En el caso presentado se hizo de dos modos, mediante la historia clínica del antecedente de hemorragia digestiva y de sus exploraciones complementarias previas, ausencia de sangrado en curso y estabilidad de la hemoglobina. Además, se utilizó la escala de riesgo hemorrágico derivada del estudio CRUSADE4 y se adjudicó un riesgo hemorrágico moderado durante su estancia. Esto es de vital importancia, como ya se ha expuesto en otro artículo de la presente monografía, principalmente por la implicación pronóstica que conlleva sufrir un evento hemorrágico durante el episodio isquémico en cuanto a aumento de la morbimortalidad3,5. Sufrir un sangrado mayor durante el ingreso del evento índice aumenta 5 veces el riesgo de muerte en los siguientes 30 días de seguimiento5. La presencia de un sangrado mayor no solo se relaciona con muerte, sino también con un aumento de riesgo de eventos isquémicos recurrentes, incluidos el infarto de miocardio y el ictus5, 6, 7, 8. Los mecanismos fisiopatológicos que engloban estos fenómenos son varios y ya se han enumerado en otra parte de la presente monografía.
Se estimó que el riesgo de sangrado que presentaba esta paciente era moderado-alto según la escala GRACE9, por lo que se recomienda un manejo invasivo con coronariografía. Además, el uso de un nuevo antiagregante tiene recomendación de clase I tanto en la guía de práctica clínica de la Sociedad Europea de Cardiología10 como en las de la American Heart Association/American College of Cardiology11. En cuanto a la elección del fármaco, en nuestro caso influyó que se le hubiera administrado la dosis de carga de clopidogrel a su llegada a urgencias y que no conocíamos la disponibilidad de la sala de hemodinámica en las siguientes 24 h, por lo que se prefirió no seguir sin administrar un inhibidor del receptor P2Y12 durante ese tiempo. El ticagrelor, en el ensayo clínico PLATO12, demostró un beneficio clínico evidente en pacientes en todo el espectro del síndrome coronario agudo. Es interesante destacar la reducción de la mortalidad total registrada con ticagrelor y la reducción de la incidencia de trombosis del stent registrada en dicho ensayo clínico. En ningún momento la paciente tuvo contraindicaciones o característica alguna de precaución para el uso de ticagrelor13.
Una alternativa habría sido utilizar prasugrel, puesto que la paciente era diabética y no tenía contraindicación ni ninguna de las características de precaución con este fármaco. El beneficio clínico que mostró el prasugrel en el TRITON-TIMI 3814 fue mayor en el subgrupo de diabéticos (HR = 0,74; p = 0,001) sin aumentar el riesgo de sangrado. Sin embargo, el prasugrel no puede emplearse en pretratamiento, por lo que su uso queda para el momento en que se decide llevar a cabo un ICP15.
Aunque el uso de clopidogrel pudiera haber sido una opción, de acuerdo con la actual guía de práctica clínica10,11, debe dejarse para pacientes a los que no se pueda tratar con los nuevos antiagregantes. Estos pacientes, en nuestra opinión, son aquellos que presenten contraindicaciones a los nuevos agentes, alguna característica de precaución, los que hayan recibido terapia fibrinolítica en las últimas 48 h (en el caso de síndrome coronario agudo con elevación del ST [SCACEST]) o tengan alergias demostradas a estos compuestos. Desde nuestro punto de vista, otro factor que se debe tener en cuenta hoy en día es el nivel económico del paciente, ya que podría poner en riesgo la compra y la toma de los nuevos compuestos. Esto podría influir en que se elija como segundo antiagregante el clopidogrel, del que ya existe genérico, para evitar el riesgo de trombosis del stent por incumplimiento terapéutico.
En resumen, se expone el caso de un SCASEST de riesgo moderado-alto y se resalta también la valoración del riesgo de sangrado en primer lugar, lo que no solo es determinante en el pronóstico de estos pacientes, sino que avala la elección del tratamiento con un nuevo antiagregante.
Caso clínico 3: paciente con doble terapia antiagregante, revascularización coronaria percutánea y necesidad de cirugía mayor urgenteDe la doble terapia antiagregante plaquetaria (DAP) se ha demostrado un beneficio importante en pacientes con síndrome coronario agudo sometidos a ICP, está recomendada en las guías de práctica clínica durante 12 meses como norma general para pacientes con síndrome coronario agudo o a los que se implanta un stent liberador de fármaco (SFL)10,16,17. Sin embargo, no es excepcional que el paciente deba someterse a una cirugía mayor en los 12 meses posteriores al evento, lo que puede condicionar la interrupción del tratamiento antiagregante y un aumento del riesgo de eventos isquémicos. Por tal motivo, es prioritaria la evaluación individual y personalizada de estos casos para decidir la mejor estrategia de revascularización y de tratamiento antitrombótico. Presentamos el caso de un paciente afecto de un SCASEST y revascularización coronaria percutánea con necesidad de cirugía mayor dentro de los primeros 12 meses tras el evento.
Un varón de 76 años, con hipertensión arterial, diabetes mellitus tipo 2 (en tratamiento con insulina y antidiabéticos orales) y dislipemia, ingresó en un hospital comarcal por un SCASEST con cambios eléctricos en derivaciones anteriores y elevación de marcadores de daño miocárdico 10 veces por encima del límite de la normalidad. Se inició tratamiento antiagregante con AAS y ticagrelor, además de heparina de bajo peso molecular y tratamiento antianginoso. Se realizó un ecocardiograma, que mostró una fracción de eyección conservada en general, con acinesia localizada inferobasal y sin alteraciones valvulares significativas, y se lo derivó al hospital terciario de referencia para realizar la coronariografía. En la analítica de ingreso destacaba una anemia microcítica hipocroma desconocida hasta entonces. En la coronariografía se apreció una enfermedad de dos vasos con dos lesiones extensas en la arteria descendente anterior media y distal, con el vaso difusamente ateromatoso (Figura 5) y una oclusión crónica en el segmento medio de la coronaria derecha; en ese momento se decidió presentar el caso del paciente en sesión médico-quirúrgica para valorar la estrategia de revascularización. El cuarto día de ingreso, el paciente presentó episodios de hematoquecia con anemización muy importante que requirió la transfusión de dos concentrados de hematíes y ferroterapia, y se retiró el tratamiento con ticagrelor. Tras consultar con el servicio de gastroenterología, se realizó una endoscopia digestiva alta y baja, que evidenció una masa ulcerada y estenosante que indicaba un proceso neoformativo en el colon descendente; se completó el estudio con tomografía computarizada (TC) toracoabdominal, que mostró adenopatías locorregionales (T3-T4a). Ante el diagnóstico de una neoplasia de colon en un paciente pendiente de revascularización tras un SCASEST, se discutió el caso en una sesión médico-quirúrgica multidisciplinaria, con participación de los servicios de cardiología, cirugía cardiaca, cirugía digestiva y oncología médica. En dicha sesión se decidió que el paciente no era candidato a revascularización quirúrgica (malos lechos distales) y que debía realizarse revascularización percutánea en el territorio de la descendente anterior con stents metálicos, minimizando el tiempo de doble antiagregación, antes de proceder a una hemicolectomía. La recomendación del equipo de oncología y cirugía digestiva fue que dicha intervención debía realizarse de manera urgente o semielectiva, idealmente no más tarde de 1 mes desde ese momento. Por lo tanto, se realizó al día siguiente un ICP sobre la descendente anterior y se implantaron tres stents metálicos superpuestos (Figura 5), sin complicaciones, y se añadió clopidogrel al tratamiento. Tras 1 mes de DAP con AAS y clopidogrel, habiendo permanecido el paciente estable desde el punto de vista cardiológico y sin que se repitiera una hemorragia digestiva baja, se procedió a hemicolectomía izquierda (retirando el clopidogrel 5 días antes de la intervención y sin abandonar el tratamiento con AAS). Tras un postoperatorio sin complicaciones relevantes, se reinició el tratamiento con clopidogrel y el paciente permaneció estable hasta 3 meses después de la cirugía (4 desde el ICP), cuando se inició una clínica de angina que fue rápidamente progresiva hasta hacerse de mínimos esfuerzos, por lo que se hospitalizó de nuevo al paciente. Se realizó una nueva coronariografía el día siguiente al ingreso, que evidenció una reestenosis difusa y extensa de los stents implantados en la arteria descendente anterior, que era oclusiva a nivel distal del último stent (Figura 5); en el mismo acto se procedió a implantar dos SLF (dentro de stent) superpuestos, con buen resultado angiográfico (Figura 5), tras lo cual el paciente quedó asintomático y con una fracción de eyección conservada en la ecocardiografía de control.
Figura 5. A: lesiones graves en segmentos medio y distal de la descendente anterior, que es un vaso difusamente ateromatoso. B: resultado tras implantar tres stents metálicos (2,5 × 26, 2,25 × 23, 2 × 20 mm) en la descendente anterior. C: reestenosis difusa en los stents implantados en la descendente anterior y oclusiva en el stent implantado más distalmente (flecha blanca). D: resultado tras implantar dos stents liberadores de fármaco superpuestos dentro del stent (2,75 × 48 y 2,25 × 23 mm) en la descendente anterior.
Discusión del caso 3La duración estándar de la DAP con AAS y un inhibidor del receptor P2Y12 (clopidogrel, prasugrel o ticagrelor) para pacientes con un síndrome coronario agudo es de 12 meses, como se recomienda en las guías de práctica clínica actuales10,16,17. Sin embargo, existen condicionantes que pueden hacer variar esta recomendación general. Entre ellas, a la hora de decidir la estrategia de revascularización para un paciente determinado, se debe tener en cuenta la necesidad de cirugía mayor (cardiaca o no) en los 12 meses posteriores a padecer el síndrome coronario agudo, cuya frecuencia se ha estimado en alrededor de un 5% en diferentes series18. En casos particulares como el aquí presentado, es de capital importancia que la decisión de revascularizar o no al paciente y cómo hacerlo se tome de manera consensuada por el equipo médico-quirúrgico, teniendo en cuenta además la opinión de las especialidades involucradas en la cirugía a la que debe someterse el paciente, pues aportan una información relevante acerca de la urgencia y el riesgo hemorrágico, que a su vez condicionará el manejo prequirúrgico y posquirúrgico del tratamiento antitrombótico.
Los dos aspectos más importantes para manejar el tratamiento antitrombótico en los pacientes con DAP que deben someterse a un procedimiento quirúrgico son su grado de urgencia de la cirugía y su riesgo hemorrágico, como se especifica tanto en la actual guía de revascularización miocárdica de la Sociedad Europea de Cardiología16 como en un documento de consenso para el manejo perioperatorio de la terapia antiplaquetaria en pacientes con enfermedad coronaria de diversas sociedades, entre ellas el Grupo de Trabajo de Trombosis de la Sociedad Europea de Cardiología19. El grado de urgencia de la cirugía se clasifica en: a) electiva, que se debe diferir hasta completar el tiempo recomendado de DAP; b) urgente o semielectiva, en la que se debe individualizar cuidadosamente la recomendación y tomar decisiones para cada caso concreto, y c) emergente, cuando no se puede tomar otra decisión que no sea la cirugía inmediata16,19. En lo que respecta al riesgo hemorrágico de la intervención, se recomienda continuar la DAP si es posible o, como mínimo, la monoterapia con AAS. Si la cirugía se estima de alto riesgo hemorrágico (p. ej., cirugía prostática), se recomienda suspender el antagonista del receptor P2Y12 antes de la cirugía (clopidogrel y ticagrelor 5 días antes [según ficha técnica, 7 días], prasugrel 7 días antes) y reiniciarlo lo antes posible, manteniendo, si es factible, el tratamiento con AAS, salvo en casos particulares de muy alto riesgo hemorrágico o cirugía en espacio cerrado (p. ej., cirugía intracraneal, de cámara posterior del ojo, del canal medular), en cuyo caso se puede considerar suspender también el AAS 5 días antes de la intervención y reiniciarlo lo antes posible16,19.
La suspensión de la DAP es el principal factor predictor de trombosis del stent en los pacientes tratados con un SLF, fundamentalmente cuando dicha interrupción se produce en los primeros 6 meses de tratamiento20. Por ello, se recomienda considerar el uso de stents metálicos, o incluso angioplastia simple, para pacientes en los que deba realizarse un procedimiento quirúrgico dentro de los 12 meses siguientes al ICP. Sin embargo, según las características del paciente, su anatomía coronaria y el tiempo que puede retrasarse la cirugía, podría plantearse también el uso de un SLF de nueva generación21, 22, 23, 24, con menor riesgo de trombosis que los SLF de primera generación, particularmente si la cirugía puede diferirse hasta unos 3–6 meses (preferiblemente 6) tras el ICP. En el supuesto de implantar stents metálicos debido a la necesidad de cirugía en un tiempo relativamente corto, es importante realizar un estricto seguimiento clínico del paciente, dada la posibilidad de reestenosis, como sucedió en el caso expuesto.
En opinión de los autores, este caso ejemplifica la dificultad en la toma de decisiones sobre pacientes con DAP tras un síndrome coronario agudo o que han sido revascularizados con ICP y que dichas decisiones deben tomarse en consenso con todos los servicios y unidades implicados (cardiología clínica, intervencionista, cirugía cardiaca, especialidades relacionadas con la cirugía a la que debe someterse el paciente, etc.), evaluando cada caso de manera individualizada.
Conflicto de interesesD. Vivas: honorarios por ponencias de Daiichi-Sankyo, Eli Lilly Co, AstraZeneca y Sanofi; miembro de Advisory Board Daiichi-Sankyo.
A. Tello-Montoliu: honorarios por ponencias de AMGEM, AstraZeneca, Merck Sharp; miembro de Advisory Board Daiichi-Sankyo, beca de investigación Daiichi-Sankyo-SEC.
J.L. Ferreiro: honorarios por ponencias de Astra Zeneca, Eli Lilly Co, Daiichi-Sankyo, Inc.; Advisory Boards de AstraZeneca, Eli Lilly Co, Ferrer.
Autor para correspondencia: Servicio de Cardiología, Hospital Clínico Universitario Virgen de la Arrixaca, Ctra. Madrid–Cartagena s/n, 30120 El Palmar, Murcia, España. atellomont@hotmail.com