Palabras clave
INTRODUCCIÓN
Muchos estudios han demostrado la relación entre foramen oval permeable (FOP), solo o asociado a aneurisma del septo interauricular, e ictus criptogénico en pacientes jóvenes1-4. Sin embargo, hasta hace poco, sólo algunas series habían estudiado esta relación en pacientes de mayor edad2,5-7 y con resultados contradictorios. Dos estudios recientes muestran la relación entre anomalías del septo interauricular e ictus criptogénico en pacientes de edad avanzada. Sin embargo, en uno de ellos8, una parte de los pacientes podría no tener ictus criptogénico, al no utilizarse la ecocardiografía transesofágica (ETE) de forma sistemática para descartar otras causas del ictus, como la enfermedad arteriosclerótica del arco aórtico9-11. En el otro estudio12, el FOP aislado no fue más frecuente en el grupo de pacientes mayores con ictus criptogénico que en aquellos con causa conocida, aunque sí la asociación de FOP y aneurisma del septo interauricular (ASA).
Por ello, el objetivo de este trabajo es estudiar, mediante ETE, la prevalencia del FOP en pacientes mayores (55 años o más) con ictus criptogénico, en comparación con los menores de 55 años.
MÉTODOS
Desde enero de 2000 hasta mayo de 2008, se estudió de forma prospectiva a todos los pacientes ingresados en el servicio de neurología, con edad > 14 años y diagnóstico de ictus, en los que, tras un estudio completo, no se llegó a identificar una causa.
Se catalogó como ictus: accidente cerebrovascular (déficit neurológico focal de inicio brusco que persiste total o parcialmente más de 24 h entre los pacientes que sobreviven) o accidente isquémico transitorio (déficit neurológico focal de inicio brusco y que se resuelve totalmente en las primeras 24 h). Para la clasificación etiológica del ictus se utilizaron los criterios recomendados por el Grupo de Estudio de las Enfermedades Cerebrovasculares de la Sociedad Española de Neurología13 similares a la clasificación TOAST14, que incluye cinco tipos etiológicos según los datos clínicos y los resultados de las técnicas diagnósticas, uno de los cuales es el ictus de causa desconocida o incierta.
El protocolo de estudio consistía en:
- Estudio básico sistemático. Se realizó a todos los pacientes una historia clínica detallada y un estudio etiológico completo que incluía radiografía de tórax, electrocardiograma, estudio Holter si se sospechaban arritmias supraventiculares, técnicas de imagen cerebral (tomografía computarizada [TC] y/o resonancia magnética [RM] cerebral), estudio de troncos supraaórticos y arterias intracraneales (con Doppler de troncos supraaórticos y/o angio-TC y/o angio-RM cerebral), y estudio hematológico para descartar estados de hipercoagulabilidad.
- Estudio cardiológico. Éste incluyó ecocardiografía transtorácica (ETT), que se realizó siempre que se sospechara causa cardioembólica o no se encontrara otra causa en el estudio etiológico previo, y si era normal o no concluyente, se solicitaba examen ecocardiográfico transesofágico con estudio de FOP y ateromatosis aórtica. Los registros ecocardiográficos se realizaron con un ecocardiógrafo Acuson® Sequoia con sonda transtorácica multifrecuencia de 2,5-5 MHz y segundo armónico y con sonda transesofágica multiplano multifrecuencia de 3,5-7 MHz.
En el estudio transesofágico se investigó, en todos los casos, la presencia de una causa de ictus con especial atención a: anatomía del septo interauricular, estudio del FOP, valoración de la aorta y posibles ateromas en ésta, pequeñas tumoraciones o excrecencias en valvas o tabiques, ecocontraste espontáneo y trombos en aurícula u orejuela izquierda.
Se valoró la anatomía del septo interauricular, y se definió aneurisma del septo interauricular cuando la suma de la excursión total de éste dentro de la aurícula izquierda, la aurícula derecha o la suma de ambas era de 11 mm o mayor15.
Para el estudio del FOP se realizó una inyección por vía venosa braquial de suero estéril con gelafundina al 4%. En todos los estudios se realizaron inyecciones en reposo y tras la maniobra de Valsalva.
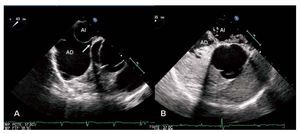
El criterio utilizado para el diagnóstico de FOP fue la visualización del paso de microburbujas (tres o más) a la aurícula izquierda dentro de los primeros tres latidos tras su llegada a la aurícula derecha, tanto en reposo como tras la maniobra de Valsalva. Un ecocardiografista experto realizó la cuantificación del paso derecha-izquierda contando el número de microburbujas; se diagnosticó de leve cuando el número de microburbujas era < 20 en un ciclo y amplio si se observaron 20 o más microburbujas en un ciclo (fig.1). Se valoró además el tamaño del FOP midiendo en reposo y en el plano vertical la máxima apertura entre septum primum y secundum.
Fig. 1. A: visualización mediante ecocardiografía transesofágica del foramen oval en forma de túnel (flecha), en la proyección retroaórtica. B: paso amplio de contraste (gelafundina estéril) a través del foramen oval permeable, en la misma proyección. AD: aurícula derecha; AI: aurícula izquierda.
Se estudiaron la aorta ascendente y el cayado aórtico hasta la salida de la subclavia izquierda, clasificándose la ateromatosis en 3 grados según los criterios modificados del French Study of Aortic Plaques in Stroke Groups10 (grado I: placas < 4 mm; grado II: placas ≥ 4 mm; grado III: placas de cualquier grosor con componente sobreañadido móvil intraluminal). Se tomó para su clasificación la placa de mayor grosor, de manera que las de grado II y III se consideraron complejas.
Se consideró ictus criptogénico cuando tras realizar todo el estudio no se encontró ninguna causa de las definidas en la literatura como causales de ictus, incluyendo la ateromatosis aórtica con placas complejas de grados II y III.
Grupos de estudio
Se derivó a un total de 262 pacientes consecutivos con ictus para estudio con ETE, en los que no se había encontrado ninguna causa de ictus en todas las otras técnicas diagnósticas, incluida la ETT. Todos estaban en ritmo sinusal. Se clasificó a estos pacientes en 3 grupos de estudio según edad y hallazgos en el estudio ecográfico:
- Grupo A: pacientes de edad ≥ 55 años con ictus criptogénico, que se consideró como el grupo principal del estudio.
- Grupo B: pacientes de edad < 55 años con ictus criptogénico.
- Grupo C: pacientes de edad ≥ 55 años, en los que se encontró en la ETE ateromatosis aórtica compleja (grados II y III), filiados como ictus de causa ateroembólica y considerados como grupo control del grupo A.
Criterios de exclusión
Se excluyó de los grupos A y B a los pacientes que en el estudio transesofágico presentaban otras causas de ictus de las reconocidas en la literatura.
Se estudió la presencia de FOP y aneurisma del septo interauricular en los 3 grupos, y se compararon los datos del grupo A (de estudio) con los de los otros dos grupos (grupo B y grupo C o control).
Análisis estadístico
Se utilizó el programa de estadística SPSS para Windows versión 12. Las variables continuas se describen como media ± desviación estándar. Las variables categóricas se muestran como porcentaje. Se analizó el ajuste a la normalidad de las variables cuantitativas mediante el test de Kolmogorov-Smirnov. Para la comparación de las variables cuantitativas se empleó la prueba de la t de Student para variables de distribución normal y la prueba de la U de Mann-Withney para variables con distribución no normal. Para comparación de variables cualitativas entre dos grupos se utilizó la prueba de la χ2 de Pearson o el test exacto de Fisher. Se consideraron significativos los valores de p < 0,05.
RESULTADOS
De los 262 pacientes derivados para estudio con ETE, 68 tenían una edad > 55 años. De éstos, en 24 (35%) no se consideró ictus criptogénico al encontrar en la ETE placas de ateroma complejas en el arco aórtico (grupo C), mientras que en los otros 44 (65%) se consideró auténtico ictus criptogénico (grupo A) al no encontrar ninguna otra causa de ictus. Los 194 pacientes restantes eran jóvenes menores de 55 años, todos con ictus criptogénico (grupo B). Las características generales de éstos aparecen en la tabla 1, donde se comparan los dos grupos de pacientes con ictus criptogénico (grupo A con el B), y la tabla 2, donde se comparan los dos grupos de pacientes mayores (grupo A con el grupo C).
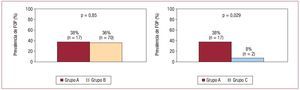
En ambos grupos de ictus criptogénico, hubo una alta frecuencia de FOP, sin diferencias significativas independientemente de la edad (el 38% del grupo A frente al 36% del grupo B; sin significación estadística) (fig. 2). Sin embargo, el FOP fue más frecuente en el grupo A que en el C (el 38 frente al 8%; p = 0,029) (fig. 2). Tampoco hubo diferencias en el tamaño del FOP entre los grupos A y B (2,1 ± 2,5 frente a 4 ± 1,7 mm; sin significación estadística) ni en la cuantía del paso de contraste, que fue amplia en la mayoría de los casos (el 87% del grupo A frente al 77% del grupo B; sin significación estadística). No hubo ningún caso de paso amplio de contraste a través del FOP en el grupo C, con diferencias significativas con el A (p < 0,01).
Fig. 2. Prevalencia del foramen oval permeable (FOP) en los tres grupos de estudio y comparación del grupo principal de estudio (grupo A) con los otros dos.
En la asociación de FOP y aneurisma del septo interauricular, ocurrió lo mismo, con una frecuencia similar entre ambos grupos de pacientes con ictus criptogénico (el 18% del grupo A frente al 11% del grupo B; sin significación estadística) (fig. 3), y una mayor frecuencia en el grupo A que en el C (el 18% frente a 0; p = 0,039) (fig. 3).
Fig. 3. Prevalencia de la asociación de foramen oval permeable (FOP) y aneurisma del septo interauricular (ASA) en los tres grupos de estudio y comparación del grupo principal de estudio (grupo A) con los otros dos.
Sin embargo, la presencia de aneurisma no asociado a FOP fue mayor en el grupo A que en el B (el 4,8 frente al 0,5%; p < 0,05) y algo menor que en el grupo C, pero sin significación estadística (el 4,8 frente al 8%).
En las características clínicas del ictus, cabe destacar el mayor porcentaje de accidentes cerebrovasculares agudos en los pacientes mayores de los grupos A y C (tabla 2), frente a aquellos con ictus transitorios, más frecuentes en el grupo B (tabla 1).
La frecuencia de los factores de riesgo cardiovascular entre ambos grupos de pacientes mayores (grupos A y C) fue similar (tabla 2). En cambio, en el grupo B, había menos diabetes e hipertensión arterial que en el A, y más tabaquismo (tabla 1).
Tan sólo en 3 pacientes del grupo A, se objetivaron síntomas y signos clínicos de trombosis venosa profunda, asociado en un caso a tromboembolia pulmonar, y en sólo 2 del grupo B, todos ellos con FOP. No hubo ningún caso en el grupo C.
DISCUSIÓN
El ictus criptogénico es menos frecuente en pacientes mayores que en jóvenes2,8. En nuestra experiencia de casi 8 años de estudio exhaustivo, sólo hemos encontrado 44 casos de ictus criptogénico en pacientes mayores, frente a los 194 entre los de menor edad. Sin embargo, el ictus criptogénico en pacientes mayores constituye un gran reto asistencial, pues técnicas diagnósticas poco agresivas como la ETE son infrautilizadas, y pueden aportar nuevas causas etiológicas en esta enfermedad.
Cuando se estudia de forma sistemática con ETE a todos los pacientes sin causa aparente de ictus, los mayores con ictus criptogénico tienen una prevalencia similar de FOP que los jóvenes, y significativamente mayor que los mayores con ictus de causa cardioembólica. Esta relación entre FOP e ictus criptogénico, que es clara en la literatura para pacientes jóvenes1-4,16,17, es más controvertida en los mayores, donde unos pocos estudios de casos-control mostraban resultados contradictorios, fundamentalmente por utilizar diferentes tests diagnósticos para identificar FOP5-7; así metaanálisis como el de Overell et al2 no pudieron aportar datos concluyentes.
En el estudio de Handke et al8, también se encuentra una mayor prevalencia de FOP en pacientes mayores con ictus criptogénico que en aquellos con ictus de otra etiología. Sin embargo, la prevalencia del FOP en los pacientes mayores con ictus criptogénico es menor que en los jóvenes (el 28 frente al 44%), probablemente porque muchos casos no eran auténticos ictus criptogénico, al no haber estudiado los vasos intracraneales en la mitad de ellos. Además, tampoco utilizaron sistemáticamente la ETE, como en nuestro protocolo y en otros estudios publicados18, por lo que no todos los ictus serían auténticamente criptogénicos; esto fue lo que ocurrió en el 35% de los pacientes mayores de nuestra serie, que resultaron tener ateromatosis compleja en el arco aórtico en el estudio con ecocardiograma transesofágico.
Recientemente, otros autores12, utilizando sistemáticamente la ETE en la clasificación del ictus, sólo encuentran una tendencia a la significación en la mayor presencia de FOP en pacientes mayores con ictus criptogénico. Sin embargo, este estudio presenta la limitación de ser retrospectivo.
En la asociación de FOP y aneurisma, ocurre algo similar a lo previamente comentado para el FOP aislado, con mayor prevalencia para los dos grupos de ictus criptogénico, frente al grupo de mayores con ictus de causa conocida. Estos resultados son concordantes con los obtenidos en los estudios más recientes realizados en pacientes mayores con ictus criptogénico, que ya han sido comentados con anterioridad8,12. Mas et al19 encuentran que la presencia de FOP y ASA se asocia con un alto riesgo de ictus por embolia paradójica, lo que contrasta con la baja prevalencia (1,7%) de esta asociación en la población general20. Por ello, nuestros resultados podrían indicar que la presencia de FOP y ASA también se podría asociar a alto riesgo de ictus en pacientes mayores.
Sin embargo, la frecuencia de ASA aislado sin FOP, en los dos grupos de pacientes mayores con ictus, es bastante más baja que la asociación de FOP y ASA, y sin diferencias entre ambos, lo que coincide con lo comunicado por otros autores12.
La ETE presenta la ventaja de aportar datos anatómicos y funcionales de interés acerca del FOP, como la cuantía del cortocircuito derecha-izquierda. Ésta era amplia en la mayoría de los casos de ictus criptogénico para ambos grupos de edad, lo que concuerda con la relación descrita en la literatura entre cuantía de paso a través de él y riesgo de ictus16,17. Algo similar ocurre con el tamaño del FOP16,17, que también es mayor en ambos grupos de pacientes con ictus criptogénico, aunque esta diferencia no llega a ser estadísticamente significativa, probablemente por el escaso número de FOP en los pacientes mayores con ictus ateroembólico.
Como ya se ha comentado, la ventaja de nuestro estudio sobre otros realizados en pacientes con ictus criptogénico es que la ETE se realizó sistemáticamente. Aunque la ETE haya aumentado la potencialidad diagnóstica en la evaluación del ictus criptogénico, no están bien establecidas sus indicaciones en la isquemia cerebral21, y su uso se restringe en los pacientes mayores. Sin embargo, nuestros resultados apuntan a que la ETE debería incluirse de forma sistemática en el estudio etiológico del ictus criptogénico en este grupo de edad, pues permite detectar otras causas potencialmente tratables. Esto fue lo que ocurrió en el 35% de los pacientes mayores con placas ateromatosas complejas en el arco aórtico, frecuencia muy similar a la de otros estudios9.
La ETE presenta ventajas sobre otras técnicas diagnósticas para el estudio del FOP, como el ecocardiograma transtorácico, con menor sensibilidad22 y una peor definición de la anatomía del septo interauricular. Por otro lado, el Doppler transcraneal tiene una alta sensibilidad para detectar cortocircuito derecha-izquierda, pero no discrimina si éste es intracardiaco o extracardiaco ni proporciona ningún tipo de información anatómica del FOP23.
En cuanto a las características clínicas de los pacientes de este estudio, la distribución de los factores de riesgo cardiovascular entre los tres grupos es similar a lo descrito en la literatura24,25, sin diferencias entre ambos grupos de pacientes mayores, y con una menor prevalencia en los pacientes jóvenes con ictus criptogénico, excepto para el tabaquismo.
En pocos casos hubo evidencia clínica de trombosis venosa profunda, en concordancia con otras series de FOP e ictus criptogénico26,27, donde además la búsqueda sistemática tiene escasa rentabilidad diagnóstica; sin embargo, y a pesar de ello, hechos fisiopatológicos inherentes a la edad, como es el aumento del potencial de embolia paradójica28 y enfermedad tromboembólica venosa29, junto con una mayor frecuencia de FOP en pacientes mayores con ictus criptogénico, como en este estudio, parecen apoyar la relación causal entre FOP e ictus en pacientes de 55 años o más.
La presencia de FOP en pacientes mayores con ictus criptogénico se relaciona con un incremento del riesgo de eventos adversos, a pesar de tratamiento antiagregante o anticoagulante, y no así en pacientes jóvenes30. Esto haría pensar que quizá se deba estudiar y tratar más agresivamente a este grupo de pacientes mayores con ictus criptogénico. En la actualidad, no hay evidencias de la superioridad del cierre percutáneo sobre el tratamiento médico en pacientes con ictus criptogénico y FOP31, y aunque los estudios aleatorizados en marcha (RESPECT, CLOSURE) podrían aclarar algo al respecto, no incluyen prácticamente a pacientes mayores de 60 años, que podrían ser los que más se beneficien de esta estrategia terapéutica.
Limitaciones
No se realizó estudio sistemático de ETE en pacientes de 55 años o más en los que se pudo diagnosticar una causa del ictus en las pruebas básicas, ya que se indicó a criterio del neurólogo clínico, por lo que no se ha podido estudiar la prevalencia de FOP en este grupo.
No hay un grupo control de pacientes mayores sin enfermedad cerebrovascular, al ser un estudio realizado con pacientes de la práctica clínica diaria.
A pesar de un periodo de inclusión de casi 8 años, la muestra del grupo principal de estudio (≥ 55 años) no es muy numerosa, lo cual podría limitar la potencia estadística de los resultados. Sin embargo, creemos que refleja la escasa prevalencia del ictus criptogénico en poblaciones de mayor edad cuando se hace una búsqueda exhaustiva de las causas del ictus. También el grupo control de pacientes mayores con ateromatosis severa en la ETE es poco numeroso, al haberse encontrado en el estudio básico habitual una causa de ictus en la mayoría de ellos, lo que por otro lado coincide con los porcentajes descritos en la literatura.
Por último, se excluyó del estudio a los pacientes que presentaron en la ETE otra causa de ictus, excepto los pacientes mayores en que se encontró ateromatosis compleja en el arco aórtico, que fueron el grupo control. Por ello, otras utilidades de la ETE en este escenario no se pueden analizar, habiéndonos centrado en el FOP.
CONCLUSIONES
Los pacientes con ictus criptogénico presentan, para cualquier edad (mayor o menor de 55 años), mayor incidencia de FOP, con o sin ASA, al compararlos con pacientes de similares características pero con ictus de origen cardioembólico, puesto de manifiesto por la presencia de placas aterosclerosas aórticas complejas. Este hallazgo indica que la embolia paradójica podría ser la causa fisiopatológica subyacente en este tipo de ictus.
En los pacientes mayores sin causa conocida o aparente de ictus, la ETE tiene una alta rentabilidad diagnóstica para la detección de placas ateromatosas complejas en el arco aórtico como fuente de ictus ateroembólico. Aunque en la totalidad de los pacientes mayores con ictus isquémico, este grupo supone una minoría, en ellos el estudio sistemático con ETE podría tener importantes implicaciones terapéuticas.
ABREVIATURAS
ASA: aneurisma del septo interauricular.
ETE: ecocardiografía transesofágica.
ETT: ecocardiografía transtorácica.
FOP: foramen oval permeable.
Full English text available from: www.revespcardiol.org
Correspondencia: Dra. D. Mesa Rubio.
Ctra. de las Ermitas, 65. 14012 Córdoba. España.
Correo electrónico: dmesar@ya.com
Recibido el 30 de mayo de 2009.
Aceptado para su publicación el 25 de noviembre de 2009.