En el año 1944, Alfred Blalock, cirujano vascular de Baltimore, siguiendo las indicaciones teóricas de Helen B. Taussig, cardióloga pediátrica de la misma ciudad, realizó una conexión de la arteria subclavia izquierda a la arteria pulmonar homolateral de un paciente cianótico con tetralogía de Fallot (TF), y en 1955 John W. Kirklin realizó la primera reparación quirúrgica completa de esta anomalía utilizando la máquina de circulación extracorpórea. A partir de entonces, la evolución clínica de esta enfermedad se trasformó de manera espectacular. Mientras que los primeros estudios sobre la historia «natural», publicados por Maurice Campbell hace 50 años, mostraban que la mayoría de los pacientes fallecían durante la edad pediátrica, hoy en día más del 90% de los pacientes con TF reparada (TFr) sobreviven hasta la vida adulta y esta malformación cardiaca se ha convertido en la cardiopatía congénita del adulto más prevalente en España1.
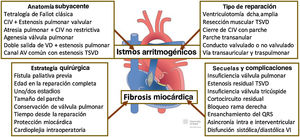
Sin embargo, la esperanza de vida ajustada por edad y sexo de los adultos con TFr sigue siendo inferior a la de la población general2. El exceso de mortalidad está relacionado con el riesgo de muerte súbita (MS) durante las primeras décadas de vida y con la aparición de insuficiencia cardiaca en décadas más avanzadas3. Así, uno de los mayores dilemas en el seguimiento clínico de esta población es cómo prevenir eficazmente la MS. Aunque el bloqueo auriculoventricular, las taquicardias auriculares con conducción rápida o algunas complicaciones mecánicas como la embolia pulmonar aguda se han vinculado con esta catástrofe clínica, las arritmias ventriculares son, sin duda, los principales desencadenantes. La patogénesis de las arritmias ventriculares en la TFr es compleja. Dos mecanismos fundamentales interactivos son la existencia de pasillos entre áreas cicatriciales, anillos valvulares y parches posquirúrgicos y la fibrosis miocárdica difusa que afecta a la masa muscular de uno o ambos ventrículos4. El primer mecanismo está relacionado principalmente con la anatomía subyacente y el tipo de reparación y el segundo, con la estrategia quirúrgica y las complicaciones mecánicas (figura 1).
Sustrato anatómico, tipo de reparación, estrategia quirúrgica y complicaciones mecánicas en la patogénesis de las arritmias ventriculares en la tetralogía de Fallot reparada. Dibujo adaptado con permiso de https://www.chd-diagrams.com. AU: auriculoventricular; CIV: comunicación interventricular; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho; VI: ventrículo izquierdo.
Clásicamente esta anomalía se define como una unidad anatomopatológica formada por la conjunción de 4 elementos: a) estenosis del tracto de salida del ventrículo derecho (VD); b) comunicación interventricular (CIV) subaórtica de gran tamaño; c) cabalgamiento de la raíz aórtica, y d) hipertrofia del VD. Sin embargo, en un sentido más amplio, se incluye habitualmente bajo el epónimo TF cualquier combinación de CIV no restrictiva y obstrucción del tracto de salida derecho, con independencia de la localización de la CIV o de la estenosis. El objetivo de la reparación quirúrgica es liberar la obstrucción del tracto de salida y cerrar la CIV. Típicamente se realiza a través de una incisión de ventriculotomía amplia, cierre de la CIV con un parche de material sintético y ampliación del tracto de salida también con parche que, como en la mayoría de los casos el anillo valvular pulmonar es hipoplásico, frecuentemente tiene una extensión transanular. Así, entre los parches de la CIV y del tracto de salida, la incisión de ventriculotomía y los obstáculos anatómicos como el anillo tricuspídeo y la arteria pulmonar, se localiza una serie de corredores que condicionan circuitos de conducción eléctrica preferente. Con frecuencia estos corredores presentan áreas de conducción lenta que facilitan los mecanismos de macrorreentrada que dan lugar a taquicardias ventriculares (TV)5. Sin embargo, los modos de intervención varían ampliamente. A lo largo del tiempo, la incisión de ventriculotomía se ha ido reduciendo y sustituyendo, en muchos casos, por una aproximación combinada a través de la aurícula derecha y la arteria pulmonar. Otras veces la reparación de la obstrucción se lleva a cabo mediante la inserción de un conducto valvulado (o no valvulado) entre el VD y la arteria pulmonar que incluso puede tener una disposición extraanatómica. Así, el espectro anatómico-funcional y el sustrato electroanatómico son muy heterogéneos, y esta variabilidad condiciona tanto los procedimientos de reparación quirúrgica como la incidencia de complicaciones a largo plazo, incluidas las arritmias ventriculares y la MS.
Inicialmente, la reparación quirúrgica se retrasaba hasta después de los 6-12 meses de vida, y era necesario llevar a cabo alguna intervención paliativa durante el ínterin para mejorar la hipoxemia. Las fístulas de Blalock-Taussig, Watterston-Cooley o Potts se diseñaron para aumentar el flujo pulmonar y disminuir la cianosis. Aunque clínicamente eficaces, las fístulas prolongan la hipoxemia y provocan sobrecarga de volumen del ventrículo izquierdo (VI), con el resultado de isquemia miocárdica difusa. La mejora de las técnicas de circulación extracorpórea mediante métodos de protección miocárdica (cardioplejia) supuso un antes y un después a partir de los años ochenta al reducirse la isquemia miocárdica intraoperatoria y la incidencia de infartos permanentes. Con el tiempo, la cronología de la reparación se fue adelantando hacia los primeros 30 días de vida, con lo que se soslayaba la necesidad de fístulas paliativas. Pero el pequeño tamaño del corazón neonato obligaba a utilizar grandes parches de ampliación transanular, condicionando la gravedad de la insuficiencia de la válvula pulmonar (IP) y la sobrecarga de volumen del VD. Más recientemente, para reducir la intensidad de la IP, la ampliación del tracto de salida se realiza con parches más pequeños, pero esta estrategia puede provocar un mayor gradiente de presión persistente y mayor sobrecarga de presión del VD.
Las diferentes estrategias quirúrgicas condicionan secuelas mecánicas que provocan sobrecarga de volumen y/o presión de uno o ambos ventrículos. La principal secuela mecánica es la IP, prácticamente universal cuando se utilizan parches de ampliación transanular. Pronto se vio que existía una asociación entre la gravedad de la IP y la incidencia de TV sostenidas o MS, y se estableció una corriente de valvulación pulmonar precoz para reducir las consecuencias hemodinámicas de la IP crónica grave. Por desgracia, aún no se ha podido demostrar que la sustitución protésica de la válvula pulmonar disminuya la incidencia de arritmias ventriculares o MS y la programación de la sustitución de la válvula pulmonar en la TFr sigue siendo motivo de controversia. La principal secuela electrofisiológica de la TFr es la prolongación del complejo QRS. La morfología del complejo muestra habitualmente un patrón de bloqueo de rama derecha, muchas veces acompañado de melladuras en la porción terminal (fragmentación). El ensanchamiento y la morfología del QRS se ha puesto en relación tanto con la dilatación y disfunción del VD como con la extensión de las cicatrices miocárdicas y el retraso de la conducción intraventricular. La sobrecarga volumétrica del VD y la mayor duración del complejo QRS colaboran para alterar la sincronía mecanoeléctrica entre ambos ventrículos y tiene efectos adversos en la mecánica del VI tanto en sístole como en diástole.
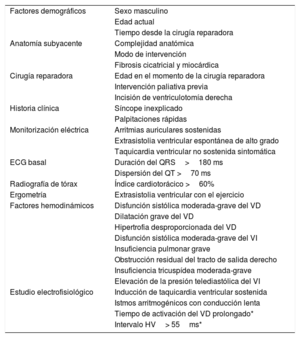
No es de extrañar, pues, que se hayan descrito múltiples predictores asociados con la incidencia de arritmias ventriculares y/o MS en la TFr (tabla 1). Estos predictores incluyen factores demográficos, anatómicos, quirúrgicos, clínicos, electrocardiográficos, radiológicos, ergométricos, hemodinámicos y electrofisiológicos. Sin embargo, el valor predictivo positivo de cada uno de estos predictores considerados individualmente es más bien discreto. Esto se manifiesta en las recomendaciones norteamericanas7 o europeas8 de implantar desfibrilador automático implantable como prevención primaria. Además de la recomendación de clase I común a las cardiopatías adquiridas (fracción de eyección del VI sistémico<35%, fisiología biventricular y clase funcional II–III de la New York Heart Association), las guías han optado por basar sus recomendaciones con indicación IIa en la asociación de múltiples factores de riesgo, como disfunción sistólica o diastólica del VI, TV no sostenidas en la monitorización con Holter, QRS ≥ 180 ms, cicatrización extensa del VD en la resonancia magnética cardiaca o TV inducible en el estudio electrofisiológico. Sin embargo, cuando se analizó el valor predictivo de estas recomendaciones en una gran cohorte multicéntrica de más de 25.000 adultos con cardiopatías congénitas con 171 casos de MS de causa arrítmica, se encontró que más del 60% de los casos habrían pasado inadvertidos y la capacidad discriminativa era bastante pobre (área bajo la curva [AUC], 0,61-0,62). Específicamente, el 39% de los pacientes con TFr y MS frente al 24% de los controles (p=0,28) tenían una recomendación de clase IIa del documento de consenso norteamericano y el 35 frente al 27% (p=0,37) en la guía europea9.
Predictores clínicos de arritmias ventriculares malignas y/o muerte súbita en la tetralogía de Fallot reparada
| Factores demográficos | Sexo masculino |
| Edad actual | |
| Tiempo desde la cirugía reparadora | |
| Anatomía subyacente | Complejidad anatómica |
| Modo de intervención | |
| Fibrosis cicatricial y miocárdica | |
| Cirugía reparadora | Edad en el momento de la cirugía reparadora |
| Intervención paliativa previa | |
| Incisión de ventriculotomía derecha | |
| Historia clínica | Síncope inexplicado |
| Palpitaciones rápidas | |
| Monitorización eléctrica | Arritmias auriculares sostenidas |
| Extrasistolia ventricular espontánea de alto grado | |
| Taquicardia ventricular no sostenida sintomática | |
| ECG basal | Duración del QRS>180 ms |
| Dispersión del QT >70 ms | |
| Radiografía de tórax | Índice cardiotorácico >60% |
| Ergometría | Extrasistolia ventricular con el ejercicio |
| Factores hemodinámicos | Disfunción sistólica moderada-grave del VD |
| Dilatación grave del VD | |
| Hipertrofia desproporcionada del VD | |
| Disfunción sistólica moderada-grave del VI | |
| Insuficiencia pulmonar grave | |
| Obstrucción residual del tracto de salida derecho | |
| Insuficiencia tricuspídea moderada-grave | |
| Elevación de la presión telediastólica del VI | |
| Estudio electrofisiológico | Inducción de taquicardia ventricular sostenida |
| Istmos arritmogénicos con conducción lenta | |
| Tiempo de activación del VD prolongado* | |
| Intervalo HV> 55ms* |
HV: intervalo Hiss-Purkinje; VD: ventrículo derecho; VI: ventrículo izquierdo.
En un artículo recientemente publicado en Revista Española de Cardiología, Rivas-Gándara et al.6 presentan su trabajo sobre predictores electrofisiológicos de arritmias ventriculares en la TFr, en el que analizan a 56 pacientes consecutivos a los que se realizó cartografía electroanatómica del VD. La indicación más frecuente del estudio (64%) fue la estratificación del riesgo previa a la intervención quirúrgica de valvulación pulmonar; 11 de los 56 pacientes habían presentado TV sostenida antes del procedimiento y en otros 10 casos se indujo TV sostenida durante la estimulación eléctrica. El análisis multivariante mostró que los predictores asociados independientemente con la incidencia de TV clínica y/o inducida fueron: a) extrasistolia ventricular frecuente (> 30/h) y/o TV no sostenida en el ECG basal, un Holter de 24 h o la interrogación del desfibrilador implantado; b) tiempo de activación del VD (en estratos de 10 ms de incremento), y c) prolongación del intervalo HV (> 55 ms). La capacidad discriminatoria del modelo fue excelente (AUC=0,88).
La activación eléctrica retrasada en el VD de los pacientes con TFr puede deberse a áreas de bloqueo en el sistema de Purkinje, cicatrices quirúrgicas o parches utilizados para liberar la estenosis pulmonar, o el daño estructural (fibrosis) causado por alteraciones hemodinámicas, dilatación y/o hipertrofia ventricular o lesiones isquémicas. Jalal et al.10 han demostrado recientemente, mediante cartografía electroanatómica y resonancia magnética de alta resolución, que la activación del VD está prolongada en toda la cavidad, incluidas las áreas libres de escaras, y que la duración del QRS solo refleja parcialmente el tiempo de activación del VD. La prolongación del intervalo HV es más intrigante. En pacientes con TFr, el hallazgo de un bloqueo de rama derecha es muy frecuente y algunos pacientes presentan también hemibloqueo anterior. La prolongación del intervalo HV indica que existe también un retraso de la activación proximal, lo que afecta a la conducción rápida de la red de Purkinje. De manera análoga al patrón de contracción anormal observado en el VI de pacientes con bloqueo de rama izquierda, los pacientes con TFr y bloqueo de rama derecha muestran contracción asincrónica en el VD. La disincronía en sí misma conduce al remodelado ventricular, lo que podría empeorar aún más la función ventricular y aumentar el riesgo de arritmia. Los resultados de este estudio, junto con los publicados por Kapel et al.11, apoyan la valoración de otras variables electrofisiológicas además de la inducibilidad de TV sostenida. La combinación de variables electrofisiológicas, como la inducibilidad, la prolongación del tiempo de conducción y/o del intervalo HV y la presencia de istmos anatómicos de conducción lenta tal vez podrían aumentar la capacidad predictiva del estudio electrofisiológico.
La utilidad de los estudios que han analizado el papel del estudio electrofisiológico como predictor de arritmias ventriculares está limitada por su diseño retrospectivo, los tamaños de muestra pequeños y, más aún, la escasa frecuencia de eventos, lo que impide estimaciones significativas del valor predictivo. La realización de un estudio prospectivo para analizar el valor predictivo de las variables electrofisiológicas comentadas y de su combinación no es fácil. La heterogeneidad de la enfermedad y la baja tasa anual de eventos requieren grandes cohortes de pacientes y periodos de tiempo considerablemente largos para tener una potencia estadística apropiada. Otra limitación importante es la inclusión en el mismo saco de los episodios clínicos y la inducción de TV sostenida por estimulación ventricular programada, que no son equivalentes en términos de riesgo. Algunos estudios han mostrado una significativa asociación entre la inducción de TV y la incidencia de eventos arrítmicos en pacientes con TFr12, mientras otros (como el estudio de referencia) no encuentran una relación significativa entre ambos. La necesidad de realizar un estudio invasivo para analizar estos factores de riesgo suscita la pregunta de si se puede evitar en algunos pacientes con otros factores de riesgo no invasivos que han mostrado ser predictores independientes de inducción de TV sostenida en el estudio electrofisiológico (tabla 1). Recientemente Ghonim et al.13 han demostrado que el volumen tridimensional de realce tardío de gadolinio en la resonancia megnética cardiaca tiene también buena capacidad de discriminación para predecir la inducción de arritmias ventriculares (AUC=0,81) y muestra buena correlación con el tamaño de la escara en la cartografía de voltaje. Este campo, al igual que el valor predictivo de los hallazgos del mapeo en T1 en la predicción de TV sostenidas, tanto inducidas como espontáneas, y MS están siendo objeto de investigación.
Pero la mayor limitación de este y otros estudios es asumir que la TV sostenida puede utilizarse como un marcador indirecto de MS arrítmica. Es indudable que muchos episodios de MS son desencadenados por una TV pero, mientras que la prevalencia de TV en pacientes con TFr es la más alta de todas las cardiopatías congénitas del adulto (alcanza hasta el 15% de los casos en algunos estudios14), la incidencia de MS arrítmica en esta población muestra tasas anuales entre el 0,1 y el 0,2%. Las causas principales de MS arrítmica en adultos con cardiopatías congénitas son el síndrome de Eisenmenger, las cardiopatías cianóticas no reparadas, las lesiones del corazón izquierdo, principalmente estenosis o coartación aórtica, las anomalías coronarias congénitas y la disfunción sistólica grave de un ventrículo sistémico de morfología derecha, pero la prevalencia de TV sostenida clínica en todas estas entidades es mucho más baja que en la TFr15. Los mecanismos potenciales de las arritmias ventriculares son heterogéneos y muy variables en función de la lesión subyacente y el modo —y el timing— de la reparación quirúrgica, y las consecuencias de la TV sostenida difieren mucho dependiendo de los mecanismos arritmogénicos. Cuando la causa está relacionada con fibrosis miocárdica difusa en ventrículos con gran daño estructural, las arritmias ventriculares se toleran mal y frecuentemente desencadenan la muerte. Sin embargo, las posibilidades de recuperarse de una TV por macrorreentrada para los pacientes jóvenes con función ventricular conservada son mucho mayores. Datos recientes muestran que, en la mayoría de los pacientes con TFr y arritmias ventriculares graves, las propiedades de conducción del miocardio ventricular son normales y que, aunque a menudo hay líneas de bloqueo funcional, especialmente en el tracto de salida, las líneas de bloqueo estructural son muy escasas16. La evidencia actual indica que la mayoría de las TV en la TFr, espontáneas o inducidas, tienen causa en istmos anatómicos arritmogénicos (largos, estrechos, con velocidad de conducción disminuida y bajo voltaje), lo cual facilita la ablación preventiva de las áreas ístmicas por catéter o cirugía. Sin embargo, el implante profiláctico de un desfibrilador automático implantable todavía es necesario en pacientes con TFr y función ventricular izquierda o derecha deteriorada y múltiples factores de riesgo, aun si se consigue una ablación eficaz de los istmos de conducción lenta que sustentan las TV.
En resumen, las arritmias ventriculares graves, especialmente la TV sostenida, son una causa frecuente de morbilidad en pacientes adultos con TFr y en ocasiones pueden llegar a desencadenar una MS. Recientes estudios han mejorado nuestro conocimiento de los mecanismos fisiopatológicos y los procedimientos de detección y prevención de estas graves complicaciones. Sin embargo, aún se desconoce si la implementación de estos procedimientos redundará en una reducción significativa de la MS arrítmica en esta joven y vulnerable población.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESLos autores no tienen conflictos de intereses que declarar.