Existe escasa evidencia sobre la evolución de los pacientes con miocardiopatía valvular remitidos para implante de desfibrilador por prevención primaria. Se pretende describir la evolución de este subgrupo particular.
MétodosEstudio multicéntrico retrospectivo en 15 centros españoles que incluyó pacientes consecutivos remitidos para implante de desfibrilador en los años 2010 y 2011, y en tres centros desde el 1 enero de 2008.
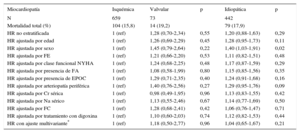
ResultadosDe un total de 1.174 pacientes, 73 (6,2%) presentaron miocardiopatía valvular. Comparados con los pacientes con miocardiopatía isquémica (n=659; 56,1%) o dilatada (n=442; 37,6%), presentaron peor clase funcional, mayor anchura del QRS y antecedente de fibrilación auricular. Durante un seguimiento de 38,1 ± 21,3 meses, 197 (16,7%) pacientes fallecieron por cualquier causa, sin diferencias significativas entre grupos (19,2% en miocardiopatía valvular, 15,8% en isquémica y 17,9% en miocardiopatía dilatada; p=0,2). De estos, 136 murieron por causa cardiovascular (11,6%), sin diferencias significativas (12,3%; 10,5% y 13,1%, respectivamente; p=0,1). Tampoco hubo diferencias en la proporción de intervenciones apropiadas del desfibrilador (13,7%; 17,9% y 18,8%; p=0,4), pero sí en el de inapropiadas (8,2%; 7,1% y 12,0%, respectivamente; p=0,03).
ConclusionesLas tasas de mortalidad por cualquier causa y por causa cardiovascular en pacientes con miocardiopatía valvular fueron similares a las del resto de los pacientes remitidos para implante de desfibrilador. También presentaron similares tasas de intervenciones apropiadas. Estos datos parecen indicar que el implante de un desfibrilador en este grupo confiere un beneficio similar al que obtienen los pacientes con miocardiopatía isquémica y miocardiopatía dilatada.
Palabras clave
La evidencia actual indica que los desfibriladores automáticos implantables (DAI) reducen la mortalidad en los pacientes con miocardiopatía dilatada isquémica y no isquémica1–5. Sin embargo, aquellos con disfunción ventricular izquierda secundaria a valvulopatía están infrarrepresentados en este subgrupo, y la evidencia sobre la evolución de estos pacientes es menos robusta6.
Se pretende describir la evolución de los pacientes con disfunción ventricular izquierda aguda secundaria a valvulopatía remitidos para implante de DAI como prevención primaria de muerte súbita, tomando como referencia pacientes con «miocardiopatía isquémica» y «miocardiopatía dilatada».
MÉTODOSEstudio multicéntrico retrospectivo realizado en 15 centros españoles con experiencia en el implante y el seguimiento de pacientes portadores de DAI. Se incluyeron pacientes consecutivos con primoimplante del dispositivo en prevención primaria entre los años 2010 y 2011, y en tres centros se recogieron además pacientes consecutivos con implantes realizados desde el 1 de enero de 2008.
Criterios de inclusiónSe incluyeron aquellos pacientes remitidos para implante de desfibrilador en prevención primaria con o sin terapia de resincronización, según las recomendaciones vigentes7.
Criterios de exclusiónSe excluyeron los pacientes con canalopatías, displasia arritmogénica del ventrículo derecho, miocardiopatía hipertrófica y cardiopatías congénitas.
Definición de las variablesLa muerte de origen cardiaco incluyó la muerte súbita y la muerte atribuida a infarto de miocardio o a insuficiencia cardiaca. Se consideró muerte súbita el fallecimiento que se produjo en la primera hora desde el inicio de los síntomas, o de manera inesperada en una persona que vivía sola y se encontraba bien en las 24 h previas. Se consideró muerte por insuficiencia cardiaca refractaria la que se produjo en un paciente con insuficiencia cardiaca descompensada que no respondió al tratamiento médico, en ausencia de cualquier otra causa de muerte. Se consideró muerte secundaria a infarto de miocardio cuando este causó complicaciones eléctricas o mecánicas que llevaron a la consiguiente muerte temprana. El resto de las muertes fuera de este origen se consideraron muertes de causa no cardiaca.
Por último, se consideró como miocardiopatía valvular la secundaria a recambio o reparación valvular aórtica o mitral, o la valvulopatía grave inoperable que ha generado disfunción ventricular, en ausencia de otras causas que la justifiquen previas al implante del dispositivo8.
Estratificación del riesgo basalPara la estratificación del riesgo basal de la población se recurrió a las escalas MADIT9 y SHOCKED10. Las variables incluidas en estas escalas y su puntuación se muestran de forma resumida en la tabla 1.
Variables incluidas en los tres modelos de predicción de mortalidad utilizados y sistema de puntuación
| Escala | Variables | Categorías |
|---|---|---|
| MADIT II | Edad > 70 años (1 punto)Anchura QRS > 120ms (1 punto)FA (1 punto)NYHA > II (1 punto)BUN > 26 mg/dl (1 punto) | Riesgo bajo: puntuación 0Riesgo intermedio: puntuación 1 o 2Riesgo alto: puntuación ≥ 3 |
| SHOCKED | Edad ≥ 75 años (62 puntos)NYHA III (36 puntos)FA (27 puntos)EPOC (62 puntos)Enfermedad renal crónica (100 puntos)FEVI ≤ 20% (28 puntos)Diabetes mellitus (41 puntos) | La ecuación del modelo abreviado se representa en forma de nomogramas de hasta 360 puntos. Las tasas de mortalidad se basan en quintiles de riesgoEl mayor quintil de riesgo es > 202 |
BUN: nitrógeno ureico en sangre; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association.
Inicialmente se realizó un análisis descriptivo en el cual las variables continuas gaussianas se expresan como media y desviación típica, y las no gaussianas como mediana (mínimo y máximo). Para identificar las diferencias entre los grupos de estudio (miocardiopatía de etiología valvular, isquémica y dilatada) se utilizaron la prueba paramétrica de análisis de la varianza para las variables gaussianas y la prueba de Kruskal-Wallis para las no gaussianas. Las variables categóricas se compararon mediante el test de χ2. Se realizaron tablas de Kaplan-Meier y análisis de riesgos competitivos. Se calculó la mortalidad por cualquier causa y por causa cardiovascular para cada tipo de miocardiopatía mediante modelos de regresión de Cox. En estos modelos, para las variables continuas se realizó suavización mediante p-spline para determinar la linealidad de las variables. Se hicieron varios modelos de Cox multivariantes con la finalidad de encontrar el mejor modelo explicativo, y se eligió aquel con mejor verosimilitud o R cuadrado de Atkinson y mejor c-statistic. Para el análisis de las intervenciones apropiadas e inapropiadas del DAI (presencia o ausencia) se utilizaron modelos de regresión de Cox (incluyendo las variables edad, sexo, escalas MADIT y SHOCKED, enfermedad arterial periférica, diabetes mellitus, fracción de eyección del ventrículo izquierdo, clase funcional de la New York Heart Association, enfermedad pulmonar obstructiva crónica, dislipemia, síndrome de apnea obstructiva del sueño, antecedente de fibrilación auricular, anchura del QRS, aclaramiento de creatinina, frecuencia cardiaca en el momento del implante, nitrógeno ureico en sangre, bloqueo de rama en el momento del implante, hipertensión arterial, miocardiopatía isquémica, no revascularización completa, índice de masa corporal, y uso de bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina y antagonistas de los receptores de la angiotensina, estatinas, antialdosterónicos y digoxina). Los valores p de significación estadística se obtuvieron con test realizados con dos colas, y los valores < 0,05 se consideraron estadísticamente significativos. Todas las estadísticas se realizaron usando los programas SPSS 19 y Stata 13 (stcompet), y el software libre R (survival package).
Para el análisis univariante se consideró la categoría «miocardiopatía isquémica» como subcategoría de referencia para la variable explicativa «tipo de miocardiopatía».
RESULTADOSDe los 1.185 pacientes incluidos se excluyó a 11 pacientes por no disponer de datos del seguimiento (n final=1.174). Los pacientes con miocardiopatía hipertrófica o miocardiopatía arritmogénica del ventrículo derecho, y aquellos con canalopatías, no se incluyeron en la base de datos y por tanto no pudo concretarse cuántos no se incluyeron por estos motivos. De los 1.174, en 281 pacientes la fecha del implante fue anterior al año 2010 (en tres centros concretos: Hospital Clínico Universitario de Santiago de Compostela, Hospital Universitario Marqués de Valdecilla y Hospital Clínico Universitario de Valencia), y en el resto fue posterior a 2010 (n=893). No hubo diferencias relevantes entre el perfil de riesgo de los pacientes previos a 2010 y los posteriores, ni entre la proporción del tipo de miocardiopatía en cada categoría (25% isquémicos, 18% valvulares y 21% dilatada; p=0,1).
Características basalesDe los 1.174 pacientes incluidos en el estudio, 73 presentaban miocardiopatía dilatada de origen valvular (en 10 pacientes, aunque la causa de la disfunción se atribuyó a la valvulopatía, había además enfermedad coronaria con la consiguiente revascularización completa en todos).
Las características basales de la población general y los diferentes subtipos de miocardiopatías se muestran en la tabla 2; destaca el hecho de que los pacientes con miocardiopatía de etiología valvular presentaron peor clase funcional, mayor anchura del QRS y antecedente de fibrilación auricular.
Características basales de la población total y por subgrupos de miocardiopatía. En la última columna se indican la diferencias entre los tres grupos correspondiente al test de análisis de la varianza
| Total (n=1.174) | Miocardiopatía valvular (n=73) | Miocardiopatía isquémica (n=659) | Miocardiopatía dilatada (n=442) | p (global) | |
|---|---|---|---|---|---|
| Edad, años | 62,72 (11,1) | 64,42 (8,8) | 63,66 (10,5) | 61,05 (12,3) | < 0,01 |
| Mujeres (%)a | 218 (18,6) | 20 (27,4) | 67 (10,2) | 131 (29,6) | < 0,01 |
| Hemoglobina, g/dlb | 13,5 (8,4-17,9) | 12,8 (9,3-17,0) | 13,5 (9,0-17,8) | 13,5 (8,4-17,9) | < 0,01 |
| Sodio, mEq/lb | 139,0 (125-154) | 138,3 (125-154) | 139,2 (125-154) | 138,8 (128-150) | 0,3 |
| BUN, mg/dl | 25,3 (13,7) | 25,6 (11,7) | 25,0 (12,7) | 25,6 (15,4) | 0,6 |
| Creatinina, mg/dl | 1,18 (0,6) | 1,19 (0,7) | 1,17 (0,4) | 1,19 (0,7) | 0,2 |
| IMC | 28,7 (4,7) | 28,5 (4,1) | 28,4 (4,4) | 29,2 (5,2) | 0,4 |
| Frecuencia cardiaca, lpmb | 70,7 (30-139) | 70,7 (35-104) | 69,0 (30-132) | 73,0 (30-139) | < 0,01 |
| Duración QRS > 120, ms | 127,7 (32,2) | 147,9 (32,4) | 120,0 (29,8) | 135,0 (32,3) | < 0,01 |
| NYHA III-IV (%)a | 456 (35,3) | 47 (64,4) | 184 (27,9) | 225 (50,9) | < 0,01 |
| FEVI %b | 26,2 (7,6) | 25,1 (5,1) | 26,8 (6,3) | 25,5 (9,8) | 0,01 |
| Antecedente de FA (%)a | 412 (38,8) | 52 (71,2) | 187 (28,5) | 173 (39,1) | < 0,01 |
| Ritmo sinusal al implante (%)a | 902 (76,8) | 31 (42,5) | 542 (82,2) | 329 (74,4) | < 0,01 |
| Marcapasos previo (%)a | 71 (6,0) | 9 (12,3) | 35 (5,3) | 27 (6,1) | 0,06 |
| Hipertensión (%)a | 707 (60,2) | 40 (54,8) | 425 (64,5) | 242 (54,8) | 0,003 |
| Diabetes mellitus (%)a | 387 (33,0) | 20 (27,4) | 244 (37,0) | 123 (27,8) | 0,004 |
| Tabaquismo activo (%)a | 264 (22,5) | 8 (11,0) | 184 (27,9) | 72 (16,3) | < 0,01 |
| EPOC (%)a | 167 (14,2) | 11 (15,1) | 94 (14,3) | 62 (14,0) | 0,9 |
| SAOS (%)a | 75 (6,4) | 7 (9,6) | 38 (5,8) | 30 (6,8) | 0,4 |
| CPAP (%)a | 46 (3,9) | 5 (6,8) | 24 (3,6) | 17 (3,8) | 0,4 |
| Ingreso previo por IC (%) | 320 (27,3) | 25 (34,2) | 152 (23,1) | 143 (32,4) | < 0,01 |
| Dislipemia (%) | 576 (49,1) | 24 (32,9) | 377 (57,2) | 175 (39,6) | < 0,01 |
| Arteriopatía periférica (%) | 101 (8,6) | 2 (2,7) | 81 (12,3) | 18 (4,1) | < 0,01 |
| Ictus previo (%) | 93 (7,9) | 7 (9,6) | 61 (9,3) | 25 (5,7) | 0,08 |
| Bloqueadores beta (%) | 1.009 (85,9) | 55 (75,3) | 569 (86,5) | 385 (87,1) | 0,02 |
| IECA/ARA (%) | 1.026 (87,4) | 59 (80,8) | 573 (87,1) | 394 (89,1) | 0,12 |
| Antagonistas del calcio (%) | 56 (4,8) | 1 (1,4) | 41 (6,2) | 14 (3,2) | 0,02 |
| Sotalol (%) | 7 (0,6) | 1 (1,4) | 3 (0,5) | 3 (0,7) | 0,6 |
| Digoxina (%) | 163 (13,9) | 20 (27,4) | 59 (8,9) | 84 (19,0) | < 0,01 |
| Dronedarona (%) | 2 (0,2) | 0 (0,0) | 2 (0,3) | 0 (0,0) | 0,4 |
| Amiodarona (%) | 114 (9,7) | 8 (11,0) | 61 (9,3) | 45 (10,2) | 0,8 |
| Antialdosterónicos (%) | 591 (50,3) | 46 (63,0) | 302 (45,9) | 243 (55,0) | < 0,01 |
| Ácido acetilsalicílico (%) | 634 (54,0) | 12 (16,4) | 527 (80,1) | 95 (21,5) | < 0,01 |
| Anticoagulantes orales (%) | 407 (34,7) | 59 (80,1) | 188 (28,6) | 160 (36,2) | < 0,01 |
| Estatinas (%) | 749 (63,8) | 25 (34,2) | 528 (80,2) | 196 (44,3) | < 0,01 |
| Tipo de dispositivo | |||||
| DAI DDD | 222 (18,9) | 3 (4,1) | 148 (22,5) | 71 (16,1) | < 0,01 |
| DAI VVI | 457 (38,9) | 21 (28,8) | 326 (49,5) | 110 (24,9) | < 0,01 |
| TRC/D DDD | 385 (32,8) | 26 (35,6) | 151 (22,9) | 208 (47,0) | < 0,01 |
| TRC/D VVI | 110 (9,4) | 23 (31,5) | 34 (5,2) | 53 (12,0) | < 0,01 |
| Escala MADIT | 1,9 (1,4) | 3,0 (1,2) | 1,6 (1,3) | 2,2 (1,3) | < 0,01 |
| Escala SHOCKED | 53,0 (40,9) | 68,0 (40,2) | 47,4 (39,6) | 58,64 (41,7) | < 0,01 |
ARA: antagonistas de los receptores de la angiotensina; BUN: nitrógeno ureico en sangre; CPAP: presión continua área positiva; DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NYHA: New York Heart Association; SAOS: síndrome de apnea obstructiva del sueño; TRC/D: terapia de resincronización cardiaca/desfibrilador.
Se encontraron diferencias estadísticamente significativas con relación al tratamiento farmacológico según el tipo de miocardiopatía. El 85,9% del conjunto de pacientes recibió bloqueadores beta (86,5% con miocardiopatía isquémica, 87,1% con miocardiopatía dilatada y 75,3% con miocardiopatía valvular; p=0,02). El 4,8% siguió tratamiento con antagonistas del calcio (6,2% con miocardiopatía isquémica, 3,2% con miocardiopatía dilatada y 1,4% con miocardiopatía valvular; p=0,02). El 13,9% recibió tratamiento con digoxina (27,4% con miocardiopatía valvular, 19,0% con miocardiopatía dilatada y 8,9% con miocardiopatía isquémica; p<0,01). En cuanto al tratamiento con antialdosterónicos, se observaron diferencias significativas entre los tres grupos (63,0% con miocardiopatía valvular, 55,0% con miocardiopatía dilatada y 45,9% con miocardiopatía isquémica; p<0,01). Un 54,0% de los pacientes estaba en tratamiento con ácido acetilsalicílico (80,1% con miocardiopatía isquémica, 16,4% con miocardiopatía valvular y 21,5% con miocardiopatía dilatada; p<0,01). Un 34,7% seguía tratamiento con anticoagulantes orales, de forma significativamente mayor aquellos con miocardiopatía valvular (80,1%, frente al 28,6% con miocardiopatía isquémica y el 36,2% con miocardiopatía dilatada; p<0,01 (tabla 2).
Los pacientes con miocardiopatía valvular presentaron un peor perfil de riesgo según las escalas MADIT (media y desviación estándar de MADIT de los pacientes con enfermedades valvulares) y SHOCKED (ídem) que los grupos con miocardiopatía isquémica y miocardiopatía dilatada.
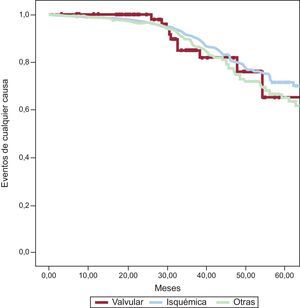
Mortalidad total y de causa cardiovascular por subgrupos de miocardiopatíaDurante un seguimiento de 38,1±21,3 meses fallecieron 197 (16,7%) pacientes: 14 (19,2%) con miocardiopatía valvular, 104 (15,8%) con miocardiopatía isquémica y 79 (17,9%) con miocardiopatía dilatada (p=0,2) (figura).
De los 197 fallecidos, la causa de muerte fue cardiovascular en 136 (11,6%): 9 (12,3%) pacientes del grupo de miocardiopatía valvular, 69 (10,5%) del grupo de miocardiopatía isquémica y 58 (13,1%) de aquellos con miocardiopatía dilatada (p=0,1).
El efecto no estratificado de las diferentes variables analizadas sobre el evento «muerte por cualquier causa» se muestra en la tabla 3.
Efecto no estratificado y ajustado del tipo de miocardiopatía valvular e isquémica idiopáticas sobre la mortalidad total en pacientes que reciben un desfibrilador automático implantable como prevención primaria. Se compara la mortalidad total de cada cardiopatía con la mortalidad total en pacientes con cardiopatía isquémica (referencia)
| Miocardiopatía | Isquémica | Valvular | p | Idiopática | p |
|---|---|---|---|---|---|
| N | 659 | 73 | 442 | ||
| Mortalidad total (%) | 104 (15,8) | 14 (19,2) | 79 (17,9) | ||
| HR no estratificada | 1 (ref) | 1,28 (0,70-2,34) | 0,55 | 1,20 (0,88-1,63) | 0,29 |
| HR ajustada por edad | 1 (ref) | 1,26 (0,69-2,29) | 0,45 | 1,28 (0,95-1,73) | 0,11 |
| HR ajustada por sexo | 1 (ref) | 1,45 (0,79-2,64) | 0,22 | 1,40 (1,03-1,91) | 0,02 |
| HR ajustada por FE | 1 (ref) | 1,21 (0,66-2,20) | 0,53 | 1,11 (0,82-1,51) | 0,48 |
| HR ajustada por clase funcional NYHA | 1 (ref) | 1,24 (0,68-2,25) | 0,48 | 1,17 (0,87-1,59) | 0,29 |
| HR ajustada por presencia de FA | 1 (ref) | 1,08 (0,58-1,99) | 0,80 | 1,15 (0,85-1,56) | 0,35 |
| HR ajustada por presencia de EPOC | 1 (ref) | 1,29 (0,71-2,35) | 0,40 | 1,24 (0,91-1,68) | 0,16 |
| HR ajustada por arteriopatía periférica | 1 (ref) | 1,40 (0,76-2,56) | 0,27 | 1,29 (0,95-1,76) | 0,09 |
| HR ajustada por Cr sérica | 1 (ref) | 0,98 (0,49-1,95) | 0,96 | 1,13 (0,83-1,55) | 0,42 |
| HR ajustada por Na sérico | 1 (ref) | 1,13 (0,55-2,46) | 0,67 | 1,14 (0,77-1,69) | 0,50 |
| HR ajustada por FC | 1 (ref) | 1,28 (0,68-2,41) | 0,42 | 1,06 (0,76-1,47) | 0,71 |
| HR ajustada por tratamiento con digoxina | 1 (ref) | 1,10 (0,60-2,03) | 0,74 | 1,12 (0,82-1,53) | 0,44 |
| HR con ajuste multivariante* | 1 (ref) | 1,18 (0,50-2,77) | 0,96 | 1,04 (0,65-1,67) | 0,21 |
Cr: creatinina; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FC: frecuencia cardiaca; FE: fracción de eyección; HR: hazard ratio; Na: sodio; NYHA: clase funcional de la New York Heart Association; ref: referencia.
En el análisis ajustado, fueron predictores independientes de mortalidad por cualquiera causa la fracción de eyección del ventrículo izquierdo al ingreso (hazard ratio [HR]=0,96; intervalo de confianza del 95% [IC95%], 0,93-0,97), la edad (HR=1,03; IC95%, 1,01-1,06), la creatinina sérica (HR=1,66; IC95%, 1,36-2,02), el sexo masculino (HR=2,5; IC95%, 1,27-4,95), la enfermedad pulmonar obstructiva crónica (HR=1,73; IC95%, 1,09-2,75) y el tratamiento con digoxina (HR=1,61; IC95%, 1,02-2,53), con un c-statistic para este modelo de 0,71. No se apreciaron cambios relevantes al realizar el análisis de mortalidad específica por causa cardiovascular, considerando la fracción de eyección del ventrículo izquierdo al ingreso (HR=0,96; IC95%, 0,94-0,98), la edad (HR=1,02; IC95%, 1,01-1,04), la creatinina sérica (HR=1,58; IC95%, 1,30-1,91), el sexo masculino (HR=2,35; IC95%, 1,26-4,38), la enfermedad pulmonar obstructiva crónica (HR=1,64; IC95%, 1,08-2,48) y el tratamiento con digoxina (HR=1,84; IC95%, 1,23-2,76). El tipo de miocardiopatía no fue significativo en el análisis univariante ni en ninguno de los análisis multivariantes realizados, ya fuese muerte por cualquier causa o por causa cardiovascular. En los análisis realizados mediante análisis de regresión para riesgos competitivos se descartó la existencia de estos.
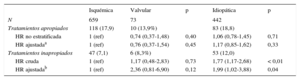
Tratamientos apropiados e inapropiados según subgruposDurante el periodo de estudio, en 211 (18%) pacientes se registró intervención apropiada del dispositivo (estimulación antitaquicardia, choque o ambos): 10 pacientes (13,7%) con miocardiopatía valvular, 118 (17,9%) con miocardiopatía isquémica y 83 (18,7%) con miocardiopatía dilatada (p=0,4). En el análisis no estratificado, la única variable que se asoció con un menor riesgo de tratamientos apropiados fueron los bloqueadores beta (HR=0,63; IC95%, 0,42-0,93; p=0,02). Sin embargo, para la variable tipo de miocardiopatía, tras ajustar por edad, sexo y tratamiento con bloqueadores beta, no se encontró un riesgo significativamente mayor de experimentar tratamientos apropiados en los pacientes con miocardiopatía valvular o no isquémica (HR=0,76; IC95%, 0,37-1,54; p=0,4) respecto a aquellos con miocardiopatía isquémica (HR=1,17; IC95%, 0,85-1,62; p=0,3) (tabla 4).
Relación entre el tipo de miocardiopatía y la incidencia de tratamientos apropiados e inapropiados realizados por el desfibrilador automático implantable
| Isquémica | Valvular | p | Idiopática | p | |
|---|---|---|---|---|---|
| N | 659 | 73 | 442 | ||
| Tratamientos apropiados | 118 (17,9) | 10 (13,9%) | 83 (18,8) | ||
| HR no estratificada | 1 (ref) | 0,74 (0,37-1,48) | 0,40 | 1,06 (0,78-1,45) | 0,71 |
| HR ajustadaa | 1 (ref) | 0,76 (0,37-1,54) | 0,45 | 1,17 (0,85-1,62) | 0,33 |
| Tratamientos inapropiados | 47 (7,1) | 6 (8,3%) | 53 (12,0) | ||
| HR cruda | 1 (ref) | 1,17 (0,48-2,83) | 0,73 | 1,77 (1,17-2,68) | < 0,01 |
| HR ajustadab | 1 (ref) | 2,36 (0,81-6,90) | 0,12 | 1,99 (1,02-3,88) | 0,04 |
HR: hazard ratio.
Presentaron intervención inapropiada del DAI 106 (9%) pacientes: 6 (8,2%) con miocardiopatía valvular, 47 (7,1%) con miocardiopatía isquémica y 53 (12,0%) con miocardiopatía dilatada (p=0,4). En el análisis de Cox multivariante, las variables que se asociaron con tratamientos inapropiados fueron la edad < 65 años (HR=2,58; IC95%, 1,28-5,22; p<0,01), el antecedente de fibrilación auricular (HR=2,25; IC95%, 1,23-4,11; p<0,01) y el tratamiento de resincronización cardiaca (HR=0,38; IC95%, 0,20-0,74; p<0,01). No se encontró un riesgo significativamente mayor de tener tratamientos inapropiados en los pacientes con miocardiopatía valvular (HR=2,36; IC95%, 0,81-6,90; p=0,12), pero sí en aquellos con miocardiopatía no isquémica (HR=1,99; IC95%, 1,02-3,88; p=0,01) respecto a los pacientes con miocardiopatía isquémica tomados como referencia tras ajustar por edad, sexo, fracción de eyección del ventrículo izquierdo, frecuencia cardiaca, hipertensión arterial, enfermedad pulmonar obstructiva crónica y arteropatía periférica (tabla 4).
DISCUSIÓNEn la presente cohorte no se observaron diferencias reseñables en la tasa de mortalidad por cualquier causa y por causa cardiovascular en los pacientes con disfunción ventricular izquierda de diferente etiología a quienes se implantó un DAI como prevención primaria. Tampoco hubo diferencias estadísticamente significativas en la tasa de intervención apropiada del dispositivo, a pesar de presentar un perfil clínico de riesgo más adverso estimado por las puntuaciones de predicción de eventos (escalas MADIT y SHOCKED). Estos hallazgos parecen indicar que los pacientes con miocardiopatía de origen valvular obtienen igual beneficio que el resto de la población remitida para implante de un DAI como prevención primaria.
El objetivo principal del estudio fue describir la evolución de esta población particular, puesto que en la actualidad la evidencia que respalda el implante de un DAI para prevenir la mortalidad de origen arrítmico en pacientes con disfunción ventricular izquierda secundaria a valvulopatía es menos robusta1–5. De hecho, este tipo de pacientes está en general infrarrepresentado en los grandes estudios aleatorizados6, y el presente trabajo representa una de las mayores series disponibles hasta la fecha. Sin embargo, sí es conocido que estos pacientes presentan una tasa considerable de eventos arrítmicos, en especial tras el recambio valvular11–14, de hasta el 25% en algunas series12,14, y son varios los mecanismos que lo explican. En primer lugar hay que señalar la presencia de hipertrofia ventricular izquierda, dilatación y disfunción ventricular izquierda, en este tipo de patología14–16. Además, se ha sugerido que la presencia de fibrosis secundaria a la cirugía podría generar el sustrato propicio para la creación de fenómenos de reentrada y las consiguientes arritmias ventriculares13. De hecho, en la serie de Rosenheck et al17, la estimulación antitaquicardia fue eficaz en el 99% de los episodios de taquicardia ventricular, lo que supone que la reentrada sería el principal mecanismo de arritmias ventriculares en esta población. Estos detalles podrían explicar la significativa tasa de eventos cardiovasculares, similar a la de los pacientes con miocardiopatía isquémica, por ejemplo, con independencia de la corrección de la valvulopatía subyacente.
Valles et al15 publicaron una serie de 31 pacientes con miocardiopatía de origen valvular e implante de DAI como prevención primaria y secundaria. En esta serie no hubo diferencias (en cuanto a supervivencia y descargas apropiadas) en comparación con pacientes con miocardiopatía isquémica y un grupo control, aunque sí hubo tendencia a una peor evolución en los pacientes con miocardiopatía de origen isquémico. Rosenheck et al17 describieron 31 pacientes con miocardiopatía valvular y prevención primaria y secundaria (de un total de 438 individuos). Como es inherente a este grupo, y de igual manera que en la población del presente estudio, hubo diferencias en el perfil basal de los pacientes en comparación con los que tenían miocardiopatía isquémica. Aunque hubo una ligera tendencia a una mayor supervivencia acumulada total que en los pacientes con miocardiopatía isquémica y miocardiopatía dilatada, no se hallaron diferencias estadísticamente significativas.
Estos datos, junto con los resultados de esta serie, parecen indicar que este subgrupo de pacientes puede beneficiarse del DAI como prevención primaria, de igual manera que la población con miocardiopatía de otra etiología. Tales conclusiones deben analizarse bajo la perspectiva de que se trata de pacientes con diferentes características clínicas que aquellos con miocardiopatía isquémica o miocardiopatía no isquémica ni valvular, como queda reflejado en la mayor puntuación en los escalas clínicas de predicción de eventos de mortalidad (MADIT y SHOCKED). Sí es cierto que, en contrapartida, presentaban menos diabetes, tabaquismo, arteriopatía periférica, dislipemia y, como era de esperar, particularidades propias de este grupo en lo referente al tratamiento médico (mayor uso de digoxina y anticoagulantes orales), además de QRS significativamente más anchos, lo que probablemente haya influido en un porcentaje significativamente mayor de implante de sistema de resincronización cardiaca.
Por último, otra conclusión importante en esta cohorte es que el grupo de pacientes con enfermedades valvulares no presentó una mayor tasa de tratamientos inapropiados que los pacientes con cardiopatía isquémica (incluso menor que la de aquellos con miocardiopatía dilatada). Aunque antiguamente se presuponía que la alta incidencia de fibrilación auricular en los pacientes con enfermedades valvulares podría representar un factor de riesgo, la evidencia actual (la presente cohorte y la de Valles et al15) no sostiene dicha afirmación.
Este hecho, junto con los resultados antes mencionados, vienen a apoyar la relación riesgo/beneficio del implante de un DAI como prevención primaria en los pacientes con miocardiopatía de origen valvular, de igual manera que en los pacientes con miocardiopatía isquémica o miocardiopatía dilatada. Será preciso no obstante confirmar estos hallazgos en series con mayor número de pacientes y con un perfil basal más homogéneo.
LimitacionesEste estudio debe interpretarse con las limitaciones que supone el ser retrospectivo y no aleatorizado. Las conclusiones tienen que tomarse bajo la particularidad de que a un alto porcentaje de pacientes del grupo de miocardiopatía valvular se les implantó asimismo un electrodo ventricular izquierdo con vistas a resincronización ventricular. Por lo tanto, es esperable que las tasas de supervivencia y de descargas del dispositivo se hayan visto influidas notablemente por el tratamiento de resincronización. No obstante, la tasa de pacientes con terapia de resincronización añadida es similar a la de estudios previos de donde se obtuvieron las recomendaciones vigentes hoy en día.
Por último, hay que señalar como limitación importante el hecho de no disponer de la información referente al tipo de valvulopatía (aórtica, mitral), intervención quirúrgica (reemplazo valvular frente a reparación) y patología asociada (hipertensión pulmonar, disfunción ventricular derecha, etc.), que seguramente sean condicionantes de supervivencia y de intervención del dispositivo. Por lo tanto, el presente trabajo supondría una aproximación inicial en el estudio de estos pacientes, pero sus resultados deberán ser matizados por estos condicionantes en futuros estudios con vistas a optimizar los criterios de selección de los pacientes con enfermedades valvulares remitidos para implante de un DAI.
CONCLUSIONESEn los pacientes con disfunción ventricular izquierda de causa valvular, el implante de un DAI parece conferir un beneficio similar al que obtienen los pacientes con miocardiopatía isquémica o con miocardiopatía dilatada. Las tasas de mortalidad por cualquier causa y por causa cardiovascular han sido similares a las del resto de los pacientes remitidos para implante de DAI, sin diferencias estadísticamente significativas. También han presentado similares tasas de intervención apropiada del dispositivo (estimulación antitaquicardia, choque o ambos). No obstante, sí se han registrado diferencias basales en cuanto al perfil de riesgo y el tratamiento médico de esta población respecto a los pacientes con miocardiopatía isquémica y aquellos con miocardiopatía dilatada, lo cual hace que estas conclusiones deban interpretarse con cautela y confirmarse en futuros estudios centrados especialmente en esta población hasta ahora infraestudiada.
CONFLICTO DE INTERESESNinguno.
Los autores quieren manifestar su admiración y gratitud al Dr. Sáenz de Buruaga, por sus enseñanzas en la atención de los pacientes con enfermedades valvulares y por la minuciosa revisión de este manuscrito.
Cristina González-Cambeiro, Luis Martínez-Sande y José Ramón González-Juanatey (Hospital Universitario de Santiago de Compostela, Santiago de Compostela); Óscar Salvador-Montañés (Hospital Universitario La Paz, Madrid); José Moreno-Arribas (Hospital Universitario de San Juan, Sant Joan d’Alacant, Alicante); Agustín Fernández-Cisnal y Alonso Pedrote-Martínez (Hospital Universitario Virgen del Rocío, Sevilla); Juan Benezet-Mazuecos (Hospital Fundación Jiménez Díaz, Madrid); Hugo Arguedas-Jiménez (Clínica Universidad de Navarra, Pamplona, Navarra); Jesús Jiménez-López (Hospital Virgen de la Salud, Toledo); Juan José Olalla Antolín (Hospital Universitario Marqués de Valdecilla, Santander, Cantabria); Ricardo Ruiz-Granell (Hospital Clínico Universitario de Valencia); Jose Ormaetxe (Hospital de Basurto, Bilbao, Vizcaya); Enrique García (Hospital Universitario de Vigo, Vigo, Pontevedra); Jose Olagüe de Ros (Hospital Universitario y Politécnico La Fe, Valencia), y Luis Tercedor-Sánchez (Hospital Virgen de las Nieves, Granada).