El shock cardiogénico refractario en pacientes con disfunción biventricular grave supone un reto terapéutico, pues con frecuencia requieren asistencia circulatoria mecánica de corta duración (ACM-CD) como puente al trasplante cardiaco (TxC). La elección del tipo de ACM-CD es compleja. La ACM-CD univentricular aumenta el flujo anterógrado, con el consiguiente incremento del retorno venoso contralateral, que puede provocar la claudicación de ese ventrículo por falta de reserva contráctil. Por ello, idealmente estos pacientes se benefician de la ACM-CD biventricular o de sistemas de soporte vital extracorpóreo como el oxigenador extracorpóreo de membrana venoarterial (ECMO-VA), que suple la función de ambos ventrículos simultáneamente. Sin embargo, estos dispositivos complican la cirugía del trasplante y su evolución. Hasta ahora, la ACM-CD biventricular más utilizada es central. Sus cánulas se colocan directamente en las cavidades cardiacas o en los grandes vasos, por lo que la reintervención del TxC puede prolongar el tiempo de isquemia del injerto y propiciar hemorragias. Por otro lado, el ECMO-VA, que habitualmente se canaliza por vía percutánea en vasos centrales, aunque resulta menos invasivo, presenta riesgos como el incremento de la poscarga del ventrículo izquierdo (VI), complicaciones relacionadas con los accesos vasculares como la isquemia de extremidades y un consumo de hematíes y plaquetas elevado, cuya reposición implica transfusiones que favorecen la producción de anticuerpos citotóxicos. El reciente desarrollo de la ACM-CD percutánea para el ventrículo derecho (VD) y su combinación con ACM-CD percutánea para el VI ofrecen una alternativa. Se presenta el primer caso de implante percutáneo de Impella biventricular (Bi-Pella) como puente al TxC realizado en España, empleando Impella CP e Impella RP (Abiomed Inc., Estados Unidos) para suplir parcialmente la función del VI y el VD respectivamente.
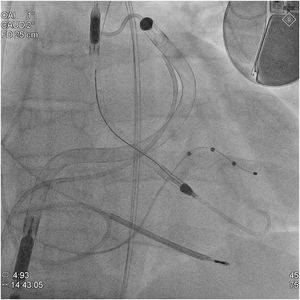
Un varón de 47 años, con miocardiopatía dilatada familiar, disfunción biventricular grave e insuficiencias mitral y tricuspídea graves en espera de TxC, ingresó en la unidad de cuidados agudos cardiológicos por shock cardiogénico, congestión sistémica e insuficiencia renal aguda AKIN 3. Se consideró necesario escalar a ACM-CD por mala tolerancia al tratamiento con dobutamina (taquicardias ventriculares sostenidas) y deterioro progresivo de la función renal (INTERMACS 2). En la valoración previa, los predictores ecocardiográficos (desplazamiento sistólico del plano del anillo tricuspídeo [TAPSE], 10 mm; S’, 5 cm/s; relación VD/VI, 0,9; fracción de acortamiento, 25%) y hemodinámicos (relación de presiones de llenado, 1,6; índice de pulsatilidad de la arteria pulmonar, 0,8; índice de trabajo sistólico del VD, 0,3mmHg/l/m2) indicaban alto riesgo de insuficiencia del VD, por lo que se optó por la ACM-CD biventricular percutánea como puente al TxC. Los dispositivos se implantaron en la sala de hemodinámica con sedoanalgesia consciente. El dispositivo Impella CP se insertó por la arteria femoral izquierda (14 Fr) y el Impella RP, por la vena femoral derecha (23 Fr) (figura 1). Se programaron asistencias iniciales a nivel P8 y P6, que aportaban flujos de 3,4 y 3,1 l/min respectivamente. Se obtuvo el consentimiento escrito del paciente para la publicación de su caso y sus imágenes en una revista científica, con el compromiso de no divulgar sus datos de identificación.
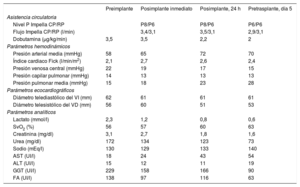
Tras el implante, la evolución fue favorable (tabla 1), con mejoría hemodinámica inmediata, reducción de los volúmenes y presiones de llenado de ambos ventrículos y mejora de la perfusión tisular y la función renal. Esto permitió disminuir el soporte inotrópico, sin nuevos eventos arrítmicos. La ACM-CD se mantuvo 5 días hasta el TxC, que resultó exitoso, con extubación y retirada precoz del soporte vasoactivo (24 h) y con una estancia posterior en la unidad de cuidados cardiológicos posquirúrgicos de 11 días y hospitalaria de 30 días. Durante el periodo de ACM-CD aparecieron algunas complicaciones. Primeramente, el sangrado inicial del acceso venoso (pérdida de 2,2mg/dl de hemoglobina) en contexto de trombocitopenia (plaquetas, 102×103/μl) y anticoagulación, que se controló con sutura local. En segundo lugar, la anemia hemolítica que se trató con transfusiones periódicas (4 concentrados de hematíes) y disminución de la ACM izquierda hasta P6 el cuarto día, sin repercusión hemodinámica significativa. En último lugar, la trombocitopenia progresiva (nadir 46×103 plaquetas/μl) sin hemorragias relacionadas, que precisó un único concentrado de plaquetas para optimizar la hemostasia antes del trasplante.
Evolución hemodinámica, ecocardiográfica y analítica
| Preimplante | Posimplante inmediato | Posimplante, 24 h | Pretrasplante, día 5 | |
|---|---|---|---|---|
| Asistencia circulatoria | ||||
| Nivel P Impella CP/RP | P8/P6 | P8/P6 | P6/P6 | |
| Flujo Impella CP/RP (l/min) | 3,4/3,1 | 3,5/3,1 | 2,9/3,1 | |
| Dobutamina (μg/kg/min) | 3,5 | 3,5 | 2,2 | 2 |
| Parámetros hemodinámicos | ||||
| Presión arterial media (mmHg) | 58 | 65 | 72 | 70 |
| Índice cardiaco Fick (l/min/m2) | 2,1 | 2,7 | 2,6 | 2,4 |
| Presión venosa central (mmHg) | 22 | 19 | 17 | 15 |
| Presión capilar pulmonar (mmHg) | 14 | 13 | 13 | 13 |
| Presión pulmonar media (mmHg) | 15 | 18 | 23 | 28 |
| Parámetros ecocardiográficos | ||||
| Diámetro telediastólico del VI (mm) | 62 | 61 | 61 | 61 |
| Diámetro telesistólico del VD (mm) | 56 | 60 | 51 | 53 |
| Parámetros analíticos | ||||
| Lactato (mmol/l) | 2,3 | 1,2 | 0,8 | 0,6 |
| SvO2 (%) | 56 | 57 | 60 | 63 |
| Creatinina (mg/dl) | 3,1 | 2,7 | 1,8 | 1,6 |
| Urea (mg/dl) | 172 | 134 | 123 | 73 |
| Sodio (mEq/l) | 130 | 129 | 133 | 140 |
| AST (UI/l) | 18 | 24 | 43 | 54 |
| ALT (UI/l) | 15 | 12 | 11 | 19 |
| GGT (UI/l) | 229 | 158 | 166 | 90 |
| FA (UI/l) | 138 | 97 | 116 | 63 |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; FA: fosfatasa alcalina; GGT: gamma-glutamil transferasa; SvO2: saturación venosa mixta de oxígeno; VD: ventrículo derecho; VI: ventrículo izquierdo.
Tres aspectos del tratamiento resultaron más complejos que con el Impella univentricular. El primero de ellos fue el control de la coagulación: se optó por heparina no fraccionada con un objetivo de tiempo de coagulación activado (TCA) de 160-180 s. La anticoagulación completa que recibió el paciente provenía de la suma de los flujos de purga de las asistencias más la heparina sistémica complementaria para alcanzar el objetivo. Con respecto a los líquidos de purga, se programaron 10 UI/ml, con lo que las cantidades fueron 110 UI/h por el Impella CP (flujo de 11 ml/h) y 140 UI/h por el Impella RP (flujo de 14ml/h). La heparina no fraccionada complementaria se inició cuando el TCA bajó de 250 s. Para evitar sobredosificación (anemia, trombocitopenia, sangrado del acceso e insuficiencia renal) se comenzó con la banda baja (10 UI/kg/h), lo que para el paciente (60 kg) suponían 600 UI/h. Dado que los dispositivos suministraban 250 UI/h, se pautaron de inicio 350 UI/h, que se fueron ajustando según los controles de TCA. El segundo de ellos fue la monitorización hemodinámica invasiva: el catéter de Swan-Ganz permitió optimizar las presiones de llenado. No obstante, el cálculo del índice cardiaco por termodilución no resultó fiable porque, además de la insuficiencia tricuspídea grave, el Impella RP puentea parcialmente la arterial pulmonar, por lo que se estimó mediante el método de Fick. Una alternativa para los pacientes con pulsatilidad, derivada de experiencias con ECMO, podrían ser los sistemas de análisis de contorno de la onda de pulso que, aunque no son válidos para calcular el gasto cardiaco absoluto, pueden ser útiles para monitorizar su tendencia1. Por último, había hemolisis y trombocitopenia superiores a lo habitual.
En conclusión, esta estrategia aporta ventajas con respecto a los implantes quirúrgicos y el ECMO-VA2, entre las que destacan el abordaje mínimamente invasivo con sedación consciente, la menor tasa de complicaciones vasculares (introductores más pequeños), la menor necesidad de transfusiones que con el ECMO-VA y el menor aporte de volumen para reanimar al paciente. No obstante, la extrapolación de estas conclusiones es limitada al tratarse de la experiencia derivada de un único caso.
FINANCIACIÓNNinguna entidad ha financiado esta investigación.
CONTRIBUCIÓN DE LOS AUTORESE. Puerto ha concebido la idea de este artículo y ha redactado el manuscrito. R. Martín-Asenjo ha colaborado en la redacción del manuscrito y ha realizado una revisión crítica del texto. R. Maruri, L. Domínguez-Pérez, H. Bueno y F. Arribas-Ynsaurriaga han realizado una revisión crítica del texto. Todos los autores aprueban la versión final del texto.
CONFLICTOS DE INTERESESNinguno de los autores declara conflictos de interés en relación con el trabajo enviado.
A la Dra. María Dolores García-Cosío y al Dr. Juan Delgado (Unidad de Trasplante) y a la Dra. María Teresa Velázquez y al Dr. Agustín Albarrán (Hemodinámica) por su colaboración en el tratamiento del paciente.