El uso de dispositivos cardiacos implantables (DCI) se ha expandido en los últimos años. La infección relacionada con estos dispositivos es una de las principales complicaciones y se asocia con grandes morbilidad, mortalidad y costes. El objetivo del estudio es construir una puntuación predictiva del riesgo de infección del DCI.
MétodosSe diseñó un estudio retrospectivo de casos y controles anidado. Tanto los casos como los controles pertenecían a una cohorte que incluía a todos los pacientes sometidos a un procedimiento relacionado con un DCI entre enero de 2009 y diciembre de 2015. Los casos se definieron como pacientes con infección, y se seleccionó aleatoriamente a 3 controles de la cohorte por cada caso incluido.
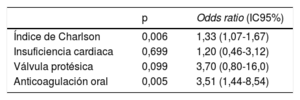
ResultadosDurante el periodo de estudio, se realizaron 2.323 procedimientos. Se identificaron en total 33 infecciones relacionadas con el DCI. Se seleccionó como controles a 99 pacientes. Se identificaron como factores de riesgo independientes el índice de Charlson (OR=1,33; IC95%, 1,07-1,67), la anticoagulación oral (OR=3,51; IC95%, 1,44-8,54), la revisión o el reemplazo de un dispositivo anterior (OR=2,75; IC95%, 1,12-6,71) y la presencia de más de 2 cables (OR=3,42; IC95%, 1,25-9,37). Se generó una escala de riesgo predictivo y se denominó CIED-AI (índice de Charlson, más de 2 cables/electrodos, revisión/reemplazo del dispositivo, anticoagulación oral, infección previa). Esta puntuación presentó un área bajo la curva receiver operating characteristic de 0,79 (IC95%, 0,71-0,88).
ConclusionesLa puntuación CIED-AI puede ayudar a identificar a los pacientes con mayor riesgo de infección que serían candidatos a medidas de prevención intensivas.
Palabras clave
El uso de dispositivos cardiacos implantables (DCI) se ha ampliado en los últimos años debido al aumento en el número de pacientes con trastornos que requieren estas intervenciones1,2. Esto incluye el uso de marcapasos permanentes (MPP), desfibriladores automáticos implantables (DAI) y dispositivos de terapia de resincronización cardiaca (TRC). La infección relacionada con estos dispositivos es una de sus principales complicaciones y causa grandes morbilidad, mortalidad y coste económico3.
A pesar de la estricta asepsia observada sistemáticamente en los quirófanos y de la profilaxis antibiótica, la incidencia de estas infecciones teóricamente prevenibles ha aumentado en los últimos años4,5. Recientemente se han descrito estrategias más complejas y costosas, que todavía no están definitivamente aceptadas, en un intento de reducir en mayor medida estas infecciones5, como el uso posoperatorio de antibióticos por vía local y sistémica y envolver el dispositivo en una cubierta antibacteriana de rifampicina y minociclina5. Por consiguiente, identificar a los pacientes con mayor riesgo de infección es importante a la hora de valorar la aplicación de estas medidas adicionales o incluso descartar el uso del dispositivo para los pacientes cuya indicación es discutible.
En los últimos años se han identificado varios factores de riesgo de infección de los DCI6. Algunas están relacionadas con características de los pacientes, como el sexo masculino, la diabetes mellitus, la insuficiencia renal y la anticoagulación oral, mientras que otras lo están con el dispositivo o con la intervención (pacientes ya operados, más de 2 cables y uso de DAI o TRC en comparación con MPP)7-12. Sin embargo, el riesgo de infección de cada individuo puede tener mayor relación con una combinación de determinados factores de riesgo que la suma total de factores de riesgo que se dé en cada caso.
Hasta donde se sabe, se han publicado 2 estudios que describen una escala combinada para estratificar el riesgo de infección13,14. En el primero no se incluyó a pacientes con MPP, ya que se los supone menos susceptibles a infecciones que los pacientes con DAI o TRC13. En el segundo, la diferencia entre los pacientes con riesgo alto y bajo no alcanzó significación estadística14. Por consiguiente, se planteó la formulación de una escala basada en factores de riesgo que, para todos los tipos de dispositivos, pudiera predecir la probabilidad de aparición de una infección en cada paciente individual.
MÉTODOSSe llevó a cabo un estudio retrospectivo de casos y controles anidado. Tanto los casos como los controles formaban parte de una cohorte definida que incluía a todos los pacientes sometidos a intervención relacionada con un DCI en un hospital universitario entre enero de 2009 y diciembre de 2015. Las intervenciones estudiadas incluyeron tanto implantes de novo como las de revisión o reemplazo de DCI en las que se había utilizado un MPP, un DAI o una TRC.
Se llevó a cabo una revisión retrospectiva de todas las historias clínicas electrónicas relativas a la cohorte previamente definida hasta diciembre de 2016. Los casos se definieron como una infección relacionada con un DCI si se había realizado alguna intervención relacionada con el DCI (incluido el implante de novo, la revisión o el reemplazo) en el periodo del estudio.
La infección relacionada con un DCI se definió según los criterios de Duke modificados de infección relacionada con un DCI. Se incluyeron las infecciones locales del DCI (infección del bolsillo) y las sistémicas (endocarditis relacionada con electrodo). En todos los casos, se dispuso de un mínimo de 2 series de hemocultivos. En todos los casos, se había realizado una tinción de Gram y un cultivo del tejido del receptáculo de la batería y del electrodo del DCI al retirar el dispositivo. Se realizó una ecocardiografía transesofágica en los casos de fiebre o sospecha de endocarditis del DCI, para evaluar la posible presencia de vegetaciones valvulares o del cable e inspeccionar las válvulas cardiacas izquierdas a pesar de que la ecocardiografía transtorácica fuera normal. En todos los casos hubo un seguimiento de como mínimo 1 año tras el diagnóstico. Se consideraron infecciones tempranas las que se produjeron antes de transcurrido 1 año tras el implante y tardías las que se produjeron después.
El protocolo de profilaxis antibiótica en nuestro centro consistió en una irrigación local de 2g de cefazolina más una dosis única de 400mg de teicoplanina por vía intravenosa y 80mg de gentamicina intravenosa en los los 60min posteriores la incisión quirúrgica. La anticoagulación antes de la intervención se realizó según criterios médicos, sin que hubiera ningún protocolo establecido en nuestro centro respecto a un tratamiento puente con heparina.
Se definió como controles a los pacientes que se sometieron a una intervención relacionada con un DCI durante el periodo de la cohorte (hasta diciembre de 2015) y no habían sufrido infección relacionada con el DCI en el momento de la revisión de las historias clínicas electrónicas (diciembre de 2016). Se seleccionó a los controles de la cohorte inicial que incluía todas las intervenciones. Mediante un programa informático online de generación de números aleatorios, se seleccionó aleatoriamente a 3 controles no emparejados para cada caso incluido en el estudio. La selección de los controles se realizó sin emparejar para facilitar el análisis de los posibles factores de riesgo de infección, como la edad o el sexo, que no podrían haberse analizado de otro modo.
Se obtuvo la siguiente información sobre los parámetros demográficos y la forma de presentación clínica: edad, sexo, anticoagulación oral, enfermedades previas (incluidos los antecedentes de endocarditis o infección del DCI o válvula cardiaca protésica), tabaquismo activo, obesidad (índice de masa corporal> 30), tratamientos previos e ingresos hospitalarios recientes (definidos como un ingreso hospitalario en los 90 días previos a la intervención) o infección reciente (definida como cualquier infección en los 90 días previos a la intervención). Se determinó el índice de comorbilidad de Charlson en el momento de la intervención15. Se obtuvo también información relativa al dispositivo y la intervención, como el tipo de dispositivo, el número de electrodos, la indicación para la intervención, la profilaxis antibiótica, la localización de la intervención, el tipo de intervención (implante de dispositivo de novo frente a revisión/reemplazo), año de la intervención y hematoma posintervención (se consideró hematoma posintervención que el médico encargado del paciente describiera su aparición en la historia clínica electrónica). Se incluyó también la siguiente información relativa a la infección en los pacientes estudiados como casos: forma de presentación clínica, microbiología, tratamiento y resultados clínicos. Todos los pacientes dieron su consentimiento informado para el uso de sus historias clínicas con fines de investigación. El estudio fue autorizado por el comité de ética de investigación clínica local.
Análisis estadísticoLas variables cualitativas se expresan en forma de valor absoluto y porcentaje. Las variables cuantitativas, como mediana [intervalo intercuartílico]. En el análisis univariable, las variables cualitativas se compararon mediante la prueba de la χ2 o la prueba exacta de Fisher en caso necesario, y se calcularon también los valores de las odds ratio (OR) con sus intervalos de confianza del 95% (IC95%). Las variables cuantitativas se compararon con la prueba de la t de Student o la prueba de la U de Mann-Whitney en caso necesario. Respecto al análisis multivariable, se construyeron 2 modelos de regresión logística no condicionados para incluir el mayor número posible de variables clínicamente importantes asociadas con la aparición de infección: el primer modelo incluyó las variables de interés relacionadas con el paciente (p. ej., variables demográficas, enfermedades previas) y el segundo, las relacionadas con el dispositivo o la intervención. Se presentan los valores de OR (IC95%) de ambos modelos.
Con los resultados obtenidos en el análisis multivariable, así como las variables clínicamente importantes, se elaboró una escala predictiva del riesgo de infección de marcapasos. La calibración de la escala se evaluó con la prueba de bondad de ajuste de Hosmer-Lemeshow y con la discriminación mediante el área bajo la curva (AUC) de características operativas del receptor (ROC). Se presentan los resultados de sensibilidad, especificidad y razones de verosimilitud16.
Se consideraron estadísticamente significativos los valores de p <0,05. Todos los análisis estadísticos se realizaron con el programa SPSS versión 23 (SPSS Inc., IBM; Chicago, Illinois, Estados Unidos).
RESULTADOSDurante el periodo de estudio, se realizaron 2.323 intervenciones a 2.193 pacientes: 1.591 (68,5%) se llevaron a cabo en el laboratorio de electrofisiología y 732 (31,5%), en el quirófano. Hubo 1.675 implantes de novo (72,1%): 1.071 (46,1%) correspondieron a MPP; 378 (16,3%), a DAI y 226 (9,7%), a TRC. Las 648 (27,9%) intervenciones restantes eran revisiones o reemplazos, y 339 (14,5%) de ellas fueron de un MPP; 230 (10%), de un DAI y 79 (3,4%), de una TRC. Todos los pacientes recibieron profilaxis antibiótica según el protocolo establecido en nuestro centro.
Durante el seguimiento de la cohorte, se detectaron 33 casos de infección relacionada con un DCI en 31 pacientes, lo cual corresponde a una tasa de infecciones del 1,4%. En 2 pacientes hubo 2 episodios de infección relacionada con DCI durante el periodo de estudio. Las tasas de infecciones del MPP y del DAI fueron similares (el 0,9 y el 1,0% respectivamente), pero la tasa de infecciones de la TRC fue significativamente superior (4,5%; p=0,004). La mediana de edad fue 63,0 [54,0-75,5] años, un 73% de los pacientes eran varones y el índice de Charlson fue 4,7 [3,4-6,0]. La mediana de tiempo entre la intervención y la infección del dispositivo fue de 8 [3-28] meses. La infección se detectó durante el primer año en 20 casos (60,6%) y durante el primer mes en 5 (15,2%). Se detectó infección del bolsillo en 11 casos (33,3%), endocarditis en 16 (48,5%) e infección mixta en 6 (18,2%). En un total de 17 casos (51,5%) hubo fiebre, 17 (51,5%) presentaron inflamación local y 9 (27,3%) tenían una disfunción renal (definida como un aumento de la creatinina ≥ 0,5 mg/dl respecto a la basal). No se observó una diferencia estadísticamente significativa en las frecuencias de intervenciones de DCI realizadas en el laboratorio de electrofisiología y en el quirófano (p=0,30). No hubo diferencias significativas en el tiempo transcurrido hasta la infección del dispositivo entre los implantes realizados de novo y las revisiones del dispositivo (mediana de 9,5 meses para el implante primario y 8 meses para la modificación; p=0,957). Fallecieron 6 pacientes (20%) durante el primer año, 3 (10%) de ellos durante el ingreso hospitalario: 2 a causa de la infección y 1 por shock cardiogénico. Los otros 3 pacientes fallecieron después del alta: 1 por muerte súbita y 1 por una causa no cardiogénica o infecciosa; la causa de la muerte del tercer paciente no se registró en la historia clínica electrónica. No se perdió a ningún paciente para el seguimiento.
Los cultivos fueron positivos en 30 casos (91%), y los hemocultivos en 12 (36%) (1 infección del bolsillo y 11 endocarditis relacionadas con el electrodo). Fueron positivos 8 cultivos de muestras de la herida y 18 cultivos de la batería, mientras que se aislaron microorganismos de 19 cultivos de electrodos (66%).
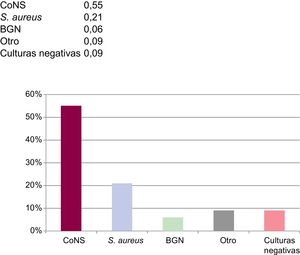
En 9 casos se identificó más de 1 especie bacteriana. Se aislaron estafilococos coagulasa-negativos (ECN) o Staphylococcus aureus en 25 casos (76,8%). Entre ellos había 14 casos con resistencia a meticilina: 1 de S. aureus y el resto, ECN (un 76% de los ECN aislados). Se detectaron 2 casos de infección por bacilos gramnegativos (Pseudomonas aeruginosa y Serratia marscenses), 1 caso de infección por estreptococos, 1 caso de infección a causa de bacterias anaerobias y 1 caso de infección fúngica (Candida albicans). Se presenta información microbiológica adicional en la figura 1.
Se seleccionó a 99 controles sin infección no emparejados. Los resultados del análisis univariable de comparación de estos grupos se resumen en la tabla 1 y la tabla 2. Se seleccionó un pequeño número de variables estadísticas y de interés clínico para los análisis multivariables. Los resultados de los análisis multivariables se resumen en la tabla 3 y la tabla 4. Dado el bajo número de casos disponibles, fue preciso excluir del análisis algunas variables, como los antecedentes de endocarditis, infección previa relacionada con el DCI o ingreso hospitalario reciente. Sin embargo, se realizó un análisis multivariable post-hoc en el que se incluyó la hospitalización reciente, y se obtuvo con una OR=2,20 (IC95%, 0,84-6,10; p=0,102).
Análisis univariable de las variables relacionadas con el paciente
| Casos (n=33) | Controles (n=99) | p | Odds ratio(IC95%) | |
|---|---|---|---|---|
| Varones | 24 (72) | 69 (71) | 0,829 | 0,89 (0,37-2,15) |
| Edad (años) | 63,0 [54,0-75,5] | 72,5 [63,7-81,0] | 0,084 | |
| Índice de Charlson | 4,7 [3,4-6,0] | 4,0 [1,0-5,0] | 0,004 | |
| Tabaquismo activo | 6 (20) | 9 (10) | 0,200 | 2,25 (0,73-6,95) |
| Alcohol | 6 (18) | 6 (7) | 0,098 | 3,00 (0,89-10,10) |
| Hipertensión | 25 (76) | 66 (68) | 0,511 | 1,47 (0,60-3,62) |
| Diabetes mellitus | 10 (30) | 34 (35) | 0,675 | 0,80 (0,34-1,89) |
| EPOC | 6 (18) | 14 (17) | 0,598 | 1,37 (0,46-3,77) |
| Insuficiencia cardiaca | 22 (67) | 44 (45) | 0,044 | 2,41 (1,05-5,51) |
| Cardiopatía isquémica | 8 (24) | 27 (28) | 0,821 | 0,83 (0,33-2,06) |
| Fibrilación auricular | 13 (39) | 30 (31) | 0,394 | 1,47 (0,65-3,35) |
| Válvula protésica | 6 (18) | 4 (4) | 0,016 | 5,22 (1,37-19,90) |
| Insuficiencia renal crónica | 9 (27) | 21 (21) | 0,632 | 1,37 (0,56-3,40) |
| Insuficiencia hepática | 3 (9) | 2 (2) | 0,101 | 4,80 (0,76-30,10) |
| Obesidad | 9 (47) | 36 (56) | 0,602 | 0,70 (0,25-1,96) |
| Inmunosupresión | 2 (6) | 3 (3) | 0,599 | 2,04 (0,33-12,79) |
| Cáncer activo | 2 (6) | 11 (11) | 0,515 | 0,51 (0,11-2,43) |
| Infección de DCI previa | 5 (15) | 3 (3) | 0,01 | 7,38 (1,73-31,54) |
| EI o infección de DCI previa | 6 (19) | 3 (3) | 0,003 | 11,1 (2,11-58,10) |
| Ingreso reciente* | 13 (39) | 15 (15) | 0,006 | 3,59 (1,48-8,75) |
| Tratamiento con corticoides | 1 (3) | 3 (3) | 1,000 | 0,99 (0,09-9,85) |
| Anticoagulación oral | 20 (61) | 25 (25) | <0,001 | 4,49 (1,95-10,30) |
| Tratamiento antiagregante plaquetario | 13 (39) | 42 (42) | 0,839 | 0,87 (0,39-1,94) |
DCI: dispositivo cardiaco implantable; EI: endocarditis infecciosa; EPOC: enfermedad pulmonar obstructiva crónica; IC95%: intervalo de confianza del 95%.
Las variables cualitativas se expresan como n (%) y las variables cuantitativas como mediana [intervalo intercuartílico].
Análisis univariable de las variables relacionadas con la intervención y con el dispositivo
| Casos(n=33) | Controles(n=99) | p | Odds ratio(IC95%) | |
|---|---|---|---|---|
| Indicación urgente | 8 (24) | 32 (32) | 0,393 | 0,66 (0,29-1,63) |
| Modificación/reemplazo del dispositivo | 19 (57) | 25 (25) | 0,001 | 3,96 (1,73-9,05) |
| Reemplazo de la batería | 17 (51) | 24 (24) | 0,004 | 3,49 (1,52-8,04) |
| Reemplazo del electrodo | 6 (18) | 6 (6) | 0,041 | 3,54 (1,05-11,90) |
| Cambio a dispositivo más avanzado | 2 (6) | 0 (0) | 0,056 | |
| Abandono del electrodo | 4 (12) | 5 (5) | 0,228 | 2,57 (0,65-10,20) |
| Dispositivo temporal previo | 4 (12) | 6 (6) | 0,260 | 2,19 (0,58-8,31) |
| TRC | 14 (43) | 16 (16) | 0,004 | 3,73 (1,55-8,94) |
| DAI | 6 (18) | 18 (18) | 1,000 | 0,97 (0,35-2,71) |
| MPP | 13 (39) | 65 (66) | 0,014 | 0,76 (0,60-0,95) |
| 2 o más cables | 25 (76) | 61 (62) | 0,205 | 1,64 (0,80-3,32) |
| 3 o más cables | 13 (39) | 11 (11) | 0,001 | 5,14 (2,01-13,20) |
| Electrodo ventricular izquierdo | 14 (43) | 19 (19) | 0,011 | 3,06 (1,30-7,19) |
| Intervención en quirófano | 15 (45) | 34 (34) | 0,302 | 1,57 (0,70-3,50) |
| Hematoma posintervención | 9 (27) | 13 (13) | 0,103 | 2,45 (0,94-6,42) |
| Ingreso hospitalario (días) | 2 [1-10] | 2 [1-6] | 0,158 | |
| Intervenciones durante el ingreso hospitalario | 1 [1-1] | 1 [1-1] | 0,563 | |
| Año de la intervención | 0,95 | |||
| 2009 | 3 (9) | 11 (11,1) | ||
| 2010 | 5 (15) | 15 (15,2) | ||
| 2011 | 4 (12) | 14 (14,1) | ||
| 2012 | 5 (15) | 16 (16,2) | ||
| 2013 | 7 (22) | 14 (14,1) | ||
| 2014 | 4 (12) | 12 (12,1) | ||
| 2015 | 5 (15) | 17 (17,2) |
DAI: desfibrilador automático implantable; IC95%: intervalo de confianza del 95%; MPP: marcapasos permanente; TRC: terapia de resincronización cardiaca.
Las variables cualitativas se expresan como n (%) y las cuantitativas como mediana [intervalo intercuartílico].
Análisis multivariable de las variables relacionadas con el paciente
| p | Odds ratio (IC95%) | |
|---|---|---|
| Índice de Charlson | 0,006 | 1,33 (1,07-1,67) |
| Insuficiencia cardiaca | 0,699 | 1,20 (0,46-3,12) |
| Válvula protésica | 0,099 | 3,70 (0,80-16,0) |
| Anticoagulación oral | 0,005 | 3,51 (1,44-8,54) |
IC95%: intervalo de confianza del 95%.
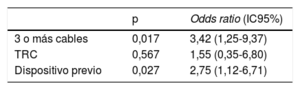
Análisis multivariable de las variables relacionadas con la intervención y con el dispositivo
| p | Odds ratio (IC95%) | |
|---|---|---|
| 3 o más cables | 0,017 | 3,42 (1,25-9,37) |
| TRC | 0,567 | 1,55 (0,35-6,80) |
| Dispositivo previo | 0,027 | 2,75 (1,12-6,71) |
IC95%: intervalo de confianza del 95%; TRC: terapia de resincronización cardiaca.
Se elaboró una puntuación de riesgo basada en estos resultados, teniendo en cuenta el coeficiente beta de las variables identificadas en el análisis multivariable como asociadas con el riesgo de contraer una infección relacionada con el dispositivo. Se agregó también el parámetro antecedente de endocarditis o infección de dispositivo cardiaco, ya que se consideró clínicamente relevante6.
El nombre de la escala proviene del acrónimo en inglés de las variables incluidas: escala Cardiac Implantable Electronic Device-Associated Infection (CIED-AI: índice de Charlson: más de 2 cables/electrodos, revisión/reemplazo del dispositivo, anticoagulación oral, infección previa). La escala CIED-AI (tabla 5) mostró una buena calibración en la prueba de bondad de ajuste de Hosmer-Lemeshow (p=0,60), y una buena discriminación, con un AUC ROC de 0,79 (IC95%, 0,71-0,88). Al aplicar la escala para predecir el riesgo de infección temprana del DCI únicamente, se obtuvo una AUC ROC similar (0,76; IC95%, 0,65-0,87). Se estimó el riesgo de infección según cada nivel de puntuación en nuestra población. Se calcularon también las razones de verosimilitud y el riesgo de infección según los valores de corte de la puntuación. Estos cálculos se muestran en la tabla 6 y la tabla 7 respectivamente.
Riesgo de infección estimado en nuestra población según el valor de la escala CIED-AI
| Puntuación CIED-AI | Riesgo estimado de infección, % | Casos | Controles | Total, n | Controles estimados, n |
|---|---|---|---|---|---|
| 0 | 0 | 0 | 21 (100) | 21 | 486 |
| 3 | 0,3 | 1 (7,7) | 12 (92,3) | 13 | 278 |
| 4 | 0,6 | 1 (12,5) | 7 (97,5) | 8 | 162 |
| 5-8 | 0,9 | 8 (18,6) | 35 (81,4) | 43 | 808 |
| 9-10 | 2,5 | 9 (37) | 15 (65) | 24 | 348 |
| 11-17 | 4,1 | 8 (50) | 8 (50) | 16 | 186 |
| > 18 | 20,6 | 6 (86) | 1 (14) | 7 | 23 |
| Total | 1,42 | 33 (25) | 99 (75) | 132 | 2.290 |
Salvo otra indicación, los valores expresan n (%).
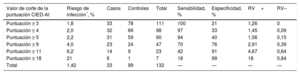
Diferentes valores de corte posibles de la puntuación CIED-AI y sus correspondientes valores de razón de verosimilitud
| Valor de corte de la puntuación CIED-AI | Riesgo de infección*, % | Casos | Controles | Total | Sensibilidad, % | Especificidad, % | RV+ | RV– |
|---|---|---|---|---|---|---|---|---|
| Puntuación ≥ 3 | 1,8 | 33 | 78 | 111 | 100 | 21 | 1,26 | 0 |
| Puntuación ≥ 4 | 2,0 | 32 | 66 | 98 | 97 | 33 | 1,45 | 0,09 |
| Puntuación ≥ 5 | 2,2 | 31 | 59 | 90 | 94 | 40 | 1,56 | 0,15 |
| Puntuación ≥ 9 | 4,0 | 23 | 24 | 47 | 70 | 76 | 2,91 | 0,39 |
| Puntuación ≥ 11 | 6,2 | 14 | 9 | 23 | 42 | 91 | 4,67 | 0,64 |
| Puntuación ≥ 18 | 21 | 6 | 1 | 7 | 18 | 99 | 18 | 0,84 |
| Total | 1,42 | 33 | 99 | 132 | — | — | — | — |
RV+: razón de verosimilitud positiva; RV–: razón de verosimilitud negativa.
El riesgo de infección con cada valor de corte puede calcularse con las siguientes fórmulas13:
Probabilidad pospuntuación=(RV+)×(riesgo de infección en la población / 1 – riesgo de infección en la población).
Riesgo de infección=probabilidad pospuntuación / (1+probabilidad pospuntuacion).
En estas fórmulas el riesgo de infección se expresa en puntos (1,4%=0,014).
De igual modo, el riesgo de infección con una puntuación inferior al valor de corte puede calcularse así:
Probabilidad pospuntuación=(RV–)×(riesgo de infección en la población / 100 – riesgo de infección en la población).
Riesgo de infección=probabilidad pospuntuación / (1+probabilidad pospuntuacion).
En estas fórmulas, el riesgo de infección se expresa en forma de probabilidad, no de porcentaje (p. ej., 1,4%=0,014).
Por ejemplo, en nuestra población un paciente con una puntuación ≥ 5 tendría un riesgo de infección del 2,2%, mientras que un paciente con una puntuación < 5 tendría un riesgo de infección del 0,2%.
Este estudio es un intento de determinar la probabilidad de infección del DCI en pacientes individuales, lo cual permitiría adoptar medidas preventivas excepcionales. Los resultados posibles de la escala permiten determinar la probabilidad de una infección del DCI, que oscila entre el 0 y el 20% (tabla 6 y tabla 7).
La tasa general de infecciones fue baja (1,4%) y similar a la observada en otros estudios1,6,17, lo cual puede deberse a la aplicación generalizada de medidas para prevenir la infección5. Nuestra tasa de infecciones de los MPP fue similar a la del registro español de marcapasos1, si bien no se pudo comparar los datos relativos a DAI o TRC, ya que en el registro español de desfibriladores automáticos implantables no se dispone de ellos2. Tal como se ha establecido ya en la literatura médica, hubo un claro predominio de ECN y S. aureus como causas de la infección10,13,17,18. Respecto al tipo de infección, se produjeron más casos de endocarditis por DCI (48,5%) que de infección del bolsillo (33%) o infecciones mixtas (18,5%), lo cual no concuerda con lo indicado por estudios previos, en los que se ha descrito un mayor número de infecciones locales que de endocarditis11,17,19. Esto podría estar relacionado con el gran porcentaje de ingresos hospitalarios previos (39%), pero no se puede descartar completamente la posibilidad de que algún caso de leve inflamación localizada del bolsillo del DCI no se incluyera en nuestro estudio.
Hasta donde sabemos, este es el primer estudio en el que se identifican los factores de riesgo de infección del DCI en nuestro país. Los principales factores de riesgo de infección del DCI en nuestra serie fueron la comorbilidad, la anticoagulación oral, la infección previa, la revisión/reemplazo del dispositivo y los dispositivos con más de 2 cables. Todos ellos se han identificado como factores de riesgo relevantes en estudios previos6,8-10. Concretamente, el implante de dispositivos con más de 2 cables se ha relacionado con unas intervenciones más complejas y más largas8,10,20. Por otro lado, determinados factores de riesgo de infección identificados en estudios previos, como edad avanzada, sexo masculino, diabetes mellitus, insuficiencia cardiaca, hipertensión, insuficiencia renal o uso de corticoides, no se observaron en nuestro estudio6,9,10,13. Sin embargo, puede que el bajo número de casos y las posibles diferencias entre las poblaciones de estudio pudieran justificar este hecho. No se pudo analizar otros factores de riesgo, como la fiebre en las 24 h tras el implante del dispositivo o la reexploración temprana del receptáculo, debido a las limitaciones del diseño del estudio13. El análisis se realizó teniendo en cuenta todos los episodios de infección, ya que se consideró que el antecedente de infección relacionada con el DCI era un factor de riesgo importante6-10, y la exclusión de los 2 episodios repetidos podría conllevar un sesgo al analizar este factor. De hecho, al realizar estos análisis con la exclusión de la segunda infección relacionada con el DCI en los pacientes con una infección repetida, los resultados obtenidos fueron equivalentes, excepto en la variable antecedente de endocarditis infecciosa o infección relacionada con un DCI, que dejó de ser estadísticamente significativa.
Recientemente se han presentado datos que indican que una envoltura antibacteriana puede reducir la tasa de infecciones en un 80% en comparación con los datos de controles históricos13,21. Este efecto positivo se ha observado incluso empleando emparejamiento por protección en cuanto al riesgo de infección del DCI13,14 y parece ser económicamente favorable en los pacientes con alto riesgo22. Para 2018 se preveía la aparición de los resultados del WRAP-IT (NCT02277990), un amplio ensayo multicéntrico, prospectivo, controlado y aleatorizado, pero en el que se incluyó únicamente a pacientes con revisiones/reemplazos de DCI o implantes de TRC de novo, por lo que es posible que se haya excluido a otros grupos en alto riesgo23. Se ha propuesto que un sistema de puntuación podría ser útil para identificar a los pacientes en alto riesgo candidatos a la técnica de envoltura24.
Otra posible estrategia incluye la profilaxis antibiótica posoperatoria. En el estudio PADIT25 se comparó la profilaxis antibiótica convencional (cefazolina o vancomicina) con la misma pauta más lavado del bolsillo con bacitracina y 2 días posoperatorios de cefalexina oral, y en breve se publicarán sus resultados. Otra acción preventiva consagrada por el tiempo es el cribado de los pacientes para detectar la colonización nasal por S. aureus con cultivos convencionales o de una reacción en cadena de la polimerasa. Si se observa que los pacientes presentan una colonización por S. aureus sensible o resistente a la meticilina, se puede proceder a una descolonización mediante tratamiento nasal con pomada de mupirocina y un baño de clorhexidina durante los 5 días previos a la intervención. Si se identifica S. aureus resistente a la meticilina, podría administrarse vancomicina y cefazolina como profilaxis5.
Todas estas medidas podrían aplicarse en casos de alto riesgo inicial de infección. Incluso la decisión de reemplazar un DCI debe tomarse tras valorar riesgos y beneficios, comparando la mortalidad debida al fallo del dispositivo, la tasa de fallos del DCI y el riesgo de mortalidad asociada con la intervención. En ciertos casos, maximizar la duración de la batería fijando un límite de frecuencia cardiaca inferior o con otras medidas se puede evitar la necesidad de reemplazo del DCI5,7,24.
Hasta donde sabemos, en la literatura solo se han descrito otras 2 escalas. La de Mittal et al.13 incluía una variable que no se conoce en el momento de realizar el implante (la reexploración temprana del bolsillo) y se elaboró sin incluir a pacientes con MPP. Otro sistema es el de Shariff et al.14, que consideraron como pacientes en alto riesgo a los que tenían una puntuación ≥ 3, pero la diferencia entre los grupos no alcanzó la significación estadística. Además, la puntuación no se elaboró a través de un análisis estadístico de los factores previos, sino teniendo en cuenta las variables asociadas con mayor riesgo de infección en diversos estudios previos.
En cambio, la escala que se describe en nuestro estudio puede calcularse con facilidad preoperatoriamente y se ha elaborado a través de un análisis estadístico; además, muestra una buena discriminación entre los grupos. En conclusión, es fácil de aplicar y, como se ha indicado, puede contribuir a mejorar el tratamiento de los pacientes24. Por ejemplo, en una población hipotética similar a la nuestra, con un riesgo de infección total del 1,4%, un paciente con una puntuación ≥ 5 (razón de verosimilitud positiva, 1,56; razón de verosimilitud negativa, 0,15) tendría un riesgo de infección del 2,0%, mientras que si tuviera una puntuación <5, el riesgo de infección sería del 0,2%. Con una puntuación ≥ 9 (razón de verosimilitud positiva, 2,91; razón de verosimilitud negativa, 0,39), el paciente tendría un riesgo de infección del 4,0%, mientras que si la puntuación fuera <9, habría un riesgo de infección del 0,5%. La escala podría aplicarse también a poblaciones diferentes de la nuestra. Por ejemplo, en una población hipotética con una prevalencia de factores de riesgo similar, pero con un riesgo de infección del 3%, una puntuación ≥ 9 predice un riesgo de infección del 8,2%, mientras que una <9 predice un riesgo del 1,1%. En esa misma población, una puntuación ≥ 5 predice un riesgo de infección del 4,6%, mientras que una <5 predice un riesgo del 0,4%. Estos cálculos pueden basarse en las fórmulas descritas en la tabla 7 o empleando calculadoras online16. Se sabe que en algunos de los casos de nuestra muestra hubo infecciones tardías, y los factores de riesgo analizados en estos casos pueden tener una influencia menor. Sin embargo, la mayor parte de nuestros casos sufrieron infecciones tempranas, por lo que creemos que la escala resulta útil de todos modos. Además, al aplicar la escala teniendo en cuenta solo los casos de infección temprana, se continuaba prediciendo de manera similar el riesgo de infección (datos no presentados).
Este estudio retrospectivo se llevó a cabo en un solo centro, lo cual reduce la posibilidad de generalización y constituye una limitación importante. Otra limitación es el bajo número de pacientes incluidos, que podría impedir la detección de más diferencias clínicas entre casos y controles. Otro inconveniente es que no se incluyeron algunas de las variables, como la experiencia del operador, la duración de la intervención, el tratamiento anticoagulante, la fiebre en las primeras 24 h tras la intervención o la revisión temprana de la zona quirúrgica, ya que no se pudo obtener estos datos en una revisión retrospectiva de las historias clínicas de los pacientes. Por último, la efectividad de la escala no se ha validado en una cohorte externa. Sin embargo, nuestro grupo está trabajando en un estudio de validación externa de este tipo para reforzar la aplicabilidad de la escala.
CONCLUSIONESEn resumen, se identificó que la comorbilidad, la anticoagulación oral, la revisión/reemplazo del dispositivo y los dispositivos con más de 2 cables eran factores independientes del riesgo de infección relacionada con un DCI. Además, los antecedentes de endocarditis o infección de un dispositivo aumentan la probabilidad de una infección del DCI. Estos factores pueden ser útiles para identificar a los pacientes con más riesgo basal de infección que podrían ser candidatos a la aplicación de medidas preventivas extraordinarias. La escala CIED-AI podría ser de gran utilidad para la determinación de esos riesgos. Serán necesarios nuevos estudios para validar el uso de este instrumento.
Las infecciones relacionadas con el DCI son una de las principales causas de morbilidad y mortalidad en los pacientes a los que se implantan estos dispositivos, y actualmente hay un gran interés por mejorar su prevención. En otras publicaciones se ha identificado que la modificación o reemplazo del dispositivo, la TRC, los antecedentes de infección del dispositivo y diversas comorbilidades son factores de riesgo de esas infecciones.
¿QUÉ APORTA ESTE ESTUDIO?En nuestro estudio, se han identificado como factores de riesgo la anticoagulación oral, un índice de Charlson más alto, las intervenciones de modificación o reemplazo, la presencia de más de 2 cables y los antecedentes de endocarditis infecciosa o infección de DCI. La escala CIED-AI propuesta podría ser útil para la identificación de los pacientes con un riesgo elevado de sufrir infecciones relacionadas con el DCI que pueden ser candidatos a la aplicación de medidas preventivas excepcionales.
J. Toquero Ramos declara recibir pagos personales no relacionados con el estudio presentado de Medtronic, Boston Scientific y Abbott. I. Fernández Lozano declara subvenciones de la Sociedad Española de Cardiología y la Fundación de Investigación Cardiovascular, además de subvenciones y pagos personales no relacionados con el estudio presentadod de Microport, Biotronik, Medtronic y Abbott. Los demás autores no tienen nada que declarar.