La insuficiencia cardiaca crónica (ICC) se considera una epidemia moderna y creciente que comporta una enorme carga social y económica1. Dado que la manifestación clínica principal de la ICC es la disnea, llama la atención que las anomalías respiratorias de este complejo síndrome clínico raramente sean el centro de atención de la comunidad científica dedicada a la investigación cardiovascular. Un enfoque de la ICC centrado en el estado pulmonar puede aportar una información fisiopatológica importante y abrir el camino a nuevos avances en el tratamiento de este trastorno tan frecuente y complejo. En su artículo publicado en este número de Revista española de Cardiología, Pascual-Figal et al2 dan un nuevo paso en esta dirección, al confirmar un aumento de la proteína surfactante tipo B (PS-B) circulante en la ICC, y señalan —por primera vez— una relación con la insuficiencia ventilatoria2.
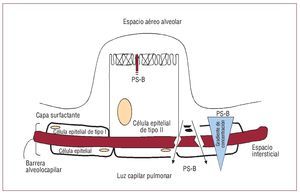
La barrera alveolocapilar separa los gases alveolares de la sangre pulmonar. Se trata, necesariamente, de una estructura extremadamente delgada, y tiene una gran superficie para permitir una difusión rápida y suficiente de los gases. Las células epiteliales alveolares forman la capa externa y las células endoteliales, la interna. Ambas capas celulares se apoyan en sus respectivas membranas basales. Entre las membranas basales epitelial y endotelial, se encuentra el espacio intersticial pulmonar. Representa tan sólo un espacio virtual en las regiones de intercambio gaseoso. Las células epiteliales alveolares de tipo I son células grandes, extremadamente aplanadas, que cubren el 95% de la superficie pulmonar. Estas células forman un recubrimiento fino de la interfase externa (superficie alveolar) y se unen a las células adyacentes a través de uniones intercelulares estrechas. La célula epitelial alveolar de tipo II es la célula más compleja del epitelio alveolar. Se trata de células cuboideas, metabólicamente muy activas, cuya función mejor conocida es la síntesis y secreción de surfactante pulmonar. Las células endoteliales pulmonares recubren internamente los capilares situados en el parénquima pulmonar (fig. 1).
Fig. 1. Proteína surfactante de tipo B (PS-B) y barrera alveolocapilar.
La exposición de la frágil barrera alveolocapilar a una presión microvascular pulmonar elevada como consecuencia de la insuficiencia cardiaca (tanto aguda como crónica) y la exposición de los componentes de la barrera a las hormonas y citocinas del medio en la insuficiencia cardiaca tienen múltiples efectos, todavía insuficientemente explorados, en su estructura y su función. Estas acciones van desde la distensión de poros proteínicos hasta la insuficiencia de estrés3 y de la lesión inflamatoria4 a la fibrosis5.
La PS-B es una de las cuatro proteínas surfactantes específicas. Cuantitativamente es una proteína menor, pero desde el punto de vista fisiológico es un componente crucial del surfactante pulmonar6,7.
La produce la célula epitelial alveolar de tipo II y no se conoce ni se sospecha la existencia de ningún otro lugar de síntesis6. Dado que hay un amplio gradiente de concentración de PS-B desde la capa surfactante alveolar a través de la barrera alveolocapilar hasta llegar a la circulación, donde se elimina rápidamente, las concentraciones circulantes aumentan en las situaciones en que hay una lesión de la barrera alveolocapilar6,7. Se ha acuñado el término «neumoproteinemia» para describir la presencia anormal de proteínas específicas pulmonares (como la PS-B) en la circulación y su capacidad de reflejar los trastornos pulmonares, al ser un indicador de la salud de la barrera alveolocapilar8. Se ha observado que la PS-B circulante está elevada en el síndrome de distrés respiratorio agudo9, en el edema pulmonar cardiogénico agudo10 y en la ICC11. Este estudio de la PS-B se llevó a cabo con un ELISA competitivo.
En su estudio, Pascual-Figal et al han demostrado un aumento de la PS-B circulante en pacientes con ICC, en comparación con voluntarios sanos2.
Se trata de una observación de notable interés por dos razones. En primer lugar, confirma el otro único informe existente sobre el aumento de la PS-B en la ICC11, y en segundo lugar, lo hace utilizando una técnica de determinación distinta y en un laboratorio diferente (inmunotransferencia Western blot). Dados los conocidos cambios de la estructura y función de la barrera alveolocapilar en la ICC, esta observación podría resultar inesperada. Al igual que ocurre en la estenosis mitral, la exposición crónica de la frágil barrera alveolocapilar a una presión microvascular pulmonar elevada en la ICC da lugar a modificaciones estructurales adaptativas, destinadas a proteger esta barrera de un daño vascular mayor12. Esos cambios incluyen un engrosamiento de la barrera, con más células epiteliales alveolares de tipo II, membranas basales más gruesas y aumento de la matriz intersticial13. Se cree que este engrosamiento de la barrera alveolocapilar es la principal causa de la observación aceptada y clínicamente importante de que el intercambio de gases está reducido en la ICC14. Sin embargo, es difícil establecer la causa por la que un engrosamiento de la barrera alveolar pueda facilitar un aumento del paso de PS-B del alvéolo a la circulación, cuando cabría haber esperado lo contrario. Aunque los estudios básicos han demostrado un aumento bidireccional en la permeabilidad de la barrera alveolocapilar para las proteínas en la ICC a pesar de su engrosamiento15, parece claro que se necesitan nuevas investigaciones que examinen los efectos de la insuficiencia cardiaca en la subunidad básica de la respiración constituida por la barrera alveolocapilar.
En el ámbito clínico, tan sólo recientemente se ha reconocido que una parte importante de la reducción de la capacidad de ejercicio en la ICC refleja una reducción del intercambio de gases. Esta anomalía fisiológica se traduce en una reducción del consumo máximo de oxígeno (VO2) y un aumento de la pendiente en la relación lineal entre la ventilación (VE) y la producción de dióxido de carbono (VCO2), la pendiente VE/VCO2. Estas dos variables fisiológicas tienen importancia pronóstica en la ICC16. Ello implica que una relación entre un biomarcador circulante indicativo de la salud de la barrera alveolocapilar (PS-B) y variables cardiorrespiratorias indicativas de la función de la barrera alveolocapilar (VO2 máximo y pendiente VE/VCO2) podría tener interés, tanto desde el punto de vista clínico como fisiopatológicamente. Pascual-Figal et al han demostrado por primera vez que la ineficiencia ventilatoria medida con la pendiente VE/VCO2 está relacionada con las concentraciones de PS-B circulantes, con lo que relacionan estos dos marcadores de función anormal de la barrera alveolocapilar en la ICC2. Los autores señalan que la relación entre las concentraciones de péptido natriurético cerebral y el VO2 máximo es intuitiva, dada su estrecha relación con el gasto cardiaco, mientras que la relación de la PS-B con la pendiente VE/VCO2 refleja una anomalía fundamental diferente en la ICC, es decir, el estado de la barrera alveolocapilar.
Queda aún mucho trabajo por hacer, tanto en las ciencias básicas como en el ámbito clínico, para explorar las consecuencias respiratorias de la ICC. Éste es un campo fértil para posibles investigaciones, pues se sitúa entre los investigadores cardiacos que se centran en el corazón y los vasos sanguíneos en la ICC, y los investigadores pulmonares, que suelen centrarse en los pulmones, en lo que tradicionalmente se consideran «enfermedades pulmonares», de las que no forma parte la ICC. Las observaciones de Pascual-Figal et al nos sirven de recordatorio de que, en el complejo síndrome clínico de la ICC, hay importantes consecuencias pulmonares de la enfermedad cardiaca.
Véase artículo en pags. 136-42
Declaración de conflictos de intereses:
El Dr. De Pasquale posee acciones de una compañía creada para comercializar el uso de la proteína surfactante tipo B como biomarcador.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. C.G. De Pasquale.
Cardiac Services. Flinders Medical Centre.
Flinders Drive. Bedford Park, 5042. South Australia. Australia.
Correo electrónico: carmine.depasquale@health.sa.gov.au