La saturación de oxígeno mediante pulsioximetría se usa habitualmente en la monitorización de pacientes críticos, pero su utilidad como marcador diagnóstico de insuficiencia cardiaca aguda no ha sido evaluada. Este estudio analiza el papel diagnóstico de la saturación de oxígeno mediante pulsioximetría en una serie de pacientes con infarto agudo de miocardio.
MétodosEn un estudio observacional prospectivo, se incluyó a 220 pacientes consecutivos con infarto agudo de miocardio. Se registraron la saturación de oxígeno mediante pulsioximetría basal (sin oxígeno), las constantes fisiológicas, la clase Killip y la puntuación radiológica a la misma hora, durante los primeros 3 días del ingreso. Se siguió a los pacientes durante 1 año.
ResultadosSe obtuvieron 612 valoraciones. La saturación de oxígeno mediante pulsioximetría basal disminuyó de forma progresiva respecto a la presencia y la gravedad de la insuficiencia cardiaca, tanto valorada con la clasificación de Killip 1-3 (medias, 95, 92 y 85, respectivamente; p<0,001), como con la puntuación radiológica 0-4 (95, 94, 92, 89 y 83, respectivamente; p<0,001), con un cociente de correlación de 0,66 y 0,63 respectivamente. Las curvas receiver operating characteristic para la saturación de oxígeno mediante pulsioximetría mostraron que el punto de corte <93 tenía la mayor área, con sensibilidad del 65%, especificidad del 90% y precisión diagnóstica del 83%. Los pacientes agrupados según su saturación de oxígeno mediante pulsioximetría más baja, mostraron tasas significativamente distintas de mortalidad o rehospitalización con insuficiencia cardiaca.
ConclusionesLa saturación de oxígeno mediante pulsioximetría es útil para establecer el diagnóstico y la gravedad de la insuficiencia cardiaca en situaciones agudas como el infarto de miocardio y puede tener implicaciones pronósticas. El diagnóstico debe sospecharse cuando la saturación de oxígeno mediante pulsioximetría basal es <93.
Palabras clave
La insuficiencia cardiaca aguda (ICA) es una complicación frecuente en los pacientes con infarto agudo de miocardio (IAM)1, 2. La incidencia puede ser bastante variable, según los criterios diagnósticos aplicados3. En la práctica clínica, el diagnóstico suele hacerse al ingreso mediante anamnesis y exploración física4. Sin embargo, es frecuente que la identificación de esta complicación resulte difícil y que sea necesario obtener datos complementarios mediante una radiografía de tórax con un aparato portátil5 u otras técnicas como la ecocardiografía6, el catéter pulmonar enclavado7 o los marcadores biológicos8. Dado que la ICA afecta a la función pulmonar9, el intercambio gaseoso puede estar alterado, incluso en las formas leves. Aunque la ICA se ha asociado a hipoxemia10, no se ha analizado la contribución diagnóstica de la saturación de oxígeno determinada mediante pulsioximetría a la cabecera del paciente (SpO2). La mayoría de los estudios previos en los que se ha utilizado esta técnica en el IAM se han limitado a investigar la incidencia de hipoxemia o del síndrome de apnea del sueño nocturno11, 12, 13, 14, 15. Realizamos, pues, un estudio observacional para evaluar la utilidad de la SpO2 basal en el diagnóstico y la gravedad de la ICA en pacientes con IAM, una población homogénea que presenta una prevalencia elevada de esta complicación.
MétodosPoblación de pacientesEl comité ético de nuestro centro aprobó el diseño del estudio y todos los pacientes dieron su consentimiento informado. Se consideró para la inclusión en el estudio a todos los pacientes consecutivos, de cualquier edad, con IAM con o sin elevación del segmento ST ingresados en nuestra unidad de cuidados intensivos críticos/semicríticos. El IAM se definió por un dolor torácico prolongado con alteraciones electrocardiográficas de carácter isquémico y elevación de los biomarcadores de necrosis miocárdica. Se incluyó a los pacientes con independencia del tratamiento recibido antes del ingreso (angioplastia coronaria primaria, tratamiento fibrinolítico o convencional). Se excluyó a los pacientes con enfermedad pulmonar obstructiva crónica moderada o grave (clases GOLD II-III) y a los que sufrieron un shock cardiogénico.
Diseño del estudioSe realizó un estudio de cohorte prospectivo observacional. Se efectuó una monitorización continua de los pacientes mediante pulsioximetría durante los primeros 3 días, con el empleo de pulsioxímetros modulares Hewlett-Packard (SpO2/Plet M1020A) monitorizados en una estación central. El objetivo de SpO2 fue la «SpO2 basal matutina» (MB-SpO2), registrada por enfermeras con los pacientes despiertos en el pase de visita de la mañana, generalmente después de obtener la radiografía de tórax y tomando el valor más estable con aire ambiental. De los pacientes en que se utilizaba oxigenoterapia, se registró cuándo se alcanzaba un valor estable después de la suspensión del oxígeno durante varios minutos.
Los datos de la exploración física los registraban los médicos de la unidad (clase de Killip)4 al ingreso y cada mañana después del pase de visita matutino. Se obtuvieron también radiografías de tórax diariamente con un aparato portátil durante el pase de visita y se evaluaron con una puntuación radiológica asignada por consenso de dos observadores, y ocasionalmente tres en caso de desacuerdo inicial. Esta puntuación se basó en la clasificación de Battler et al5 y se establecieron cinco categorías: (0) normal; (1) redistribución vascular hacia los campos pulmonares altos; (2) edema intersticial definido por la presencia de líneas B de Kerley o de un contorno hiliar prominente y difuso con redistribución vascular; (3) edema localizado con infiltrados alveolares en menos del 50% de los campos pulmonares, principalmente hiliobasal, y (4) edema alveolar difuso con infiltrados alveolares en tres o cuatro cuadrantes.
Los datos obtenidos en la primera mañana siguiente al ingreso se introdujeron como «primer día». Así pues, el tiempo transcurrido desde el inicio del IAM hasta ese momento pudo variar. Sin embargo, los datos de los días siguientes se obtuvieron también por la mañana pero a intervalos constantes hasta el tercer día. Se administró oxigenoterapia si el valor basal de SpO2 era<93%. Se determinaron los marcadores de necrosis cardiaca (fracción MB de la creatincinasa /troponina T) al ingreso y cada 6 h hasta identificar el valor máximo. En nuestro centro no disponíamos de determinaciones de péptidos natriuréticos cuando se realizó el reclutamiento de pacientes para el estudio.
Las variables registradas en los pases de visita diarios fueron la frecuencia cardiaca, la frecuencia respiratoria, la presión arterial, la MB-SpO2, la clase de Killip y la puntuación radiológica. La variable «SpO2 basal más baja» (LB-SpO2) se determinó retrospectivamente en el momento del alta de la unidad de cuidados intensivos, tomando el valor más bajo de SpO2 de entre los registrados durante la permanencia en cuidados cardiacos agudos.
La función ventricular se evaluó mediante la ecocardiografía realizada durante la hospitalización. Tras el alta, se efectuó un seguimiento de los pacientes durante 1 año y se registraron los casos de muerte o rehospitalización por ICA.
Diagnóstico de la insuficiencia cardiaca agudaEn los pacientes con una clase de Killip 2 o 3 se consideró inicialmente que había una ICA en el análisis bayesiano. Sin embargo, se exigió una radiografía de tórax anormal para confirmar este diagnóstico, de tal manera que en los pacientes que tenían una radiología normal (puntuación 0) se consideró que no había ICA (Killip falso positivo) fuera cual fuera la clase de Killip asignada. Y a la inversa, en los pacientes a los que se había asignado inicialmente una clase 1 de Killip según la exploración física y presentaban signos inequívocos de congestión pulmonar en la radiología (puntuación 3-4), se consideró que había una ICA (Killip falso negativo).
Análisis estadísticoEl total de datos registrados durante los 3 días de monitorización supuso más de 600 determinaciones para cada una de las seis variables del estudio (clase de Killip, puntuación radiológica, MB-SpO2, frecuencia cardiaca, frecuencia respiratoria y presión arterial). Se utilizaron curvas receiver operating characteristic (ROC) de estas determinaciones simultáneas para analizar la exactitud de la prueba para el diagnóstico de ICA con el empleo de diferentes puntos de corte de la MB-SpO2, la frecuencia cardiaca y la frecuencia respiratoria.
Al analizar a los pacientes, se les asignó individualmente el valor de LB-SpO2. Las comparaciones entre las medias se analizaron con la prueba de la t de Student o con un análisis de la varianza. Para las variables que no tenían una distribución normal o no presentaban varianzas homogéneas, se utilizó una prueba no paramétrica (Kruskal-Wallis o Mann-Whitney). Se realizaron comparaciones múltiples de datos apareados mediante las diferencias mínimas significativas o la prueba de Tamhane cuando las varianzas no eran iguales. Las variables no continuas se analizaron con la prueba exacta de Fisher. Las variables continuas se presentan en forma de media±desviación estándar. Todos los valores de p son de pruebas estadísticas de comparación bilaterales.
Los factores independientes se analizaron con un análisis de regresión logística. Se utilizó un análisis de Kaplan-Meier de la supervivencia sin eventos (muerte o rehospitalización por ICA) para la evaluación del seguimiento, asignando a los pacientes a uno de tres grupos definidos según su LB-SpO2. La franja de LB-SpO2 para estos grupos se basó en los intervalos de confianza del 95% (IC95%) de la media de SpO2 en cada grupo definido por la clase de Killip. Estos grupos son: grupo 1 (SpO2>93%); grupo 2 (SpO2=90-93%), y grupo 3 (SpO2<90%).
ResultadosDurante un periodo de 2 años, ingresó en nuestra unidad de cuidados intensivos/semiintensivos un total de 220 pacientes consecutivos con IAM, con o sin elevación del segmento ST. El estudio fue aprobado por nuestro comité de ética e investigación y se llevó a cabo en el año 2000. En total, 14 pacientes (6%) presentaron un shock cardiogénico o necesitaron ventilación mecánica, invasiva o no, por lo que se los excluyó posteriormente. En el resto, hubo 122 pacientes con elevación del segmento ST y 9 con bloqueo de rama izquierda. En 106 pacientes, el diagnóstico final fue un IAM sin onda Q.
En la Tabla 1 se presentan las características de los pacientes en relación con la incidencia de ICA. En general, los pacientes con ICA eran de mayor edad, con un menor predominio de varones y tenían tasas más altas de antecedentes previos de hipertensión, diabetes, infarto de miocardio e insuficiencia cardiaca que los pacientes sin ICA.
Tabla 1. Características de 206 pacientes con infarto agudo de miocardio en función de que presentaran insuficiencia cardiaca aguda
| Sin ICA (n=133) | Con ICA (n=73) | p | |
| Características | |||
| Edad (años) | 61,5±12,4 | 70±9,4 | < 0,001 |
| Varones | 105 (79) | 47 (64) | 0,031 |
| Diabetes | 34 (26) | 35 (48) | 0,002 |
| Hipertensión | 59 (45) | 48 (69) | 0,002 |
| Infarto de miocardio previo | 19 (15) | 28 (39) | < 0,001 |
| Insuficiencia cardiaca previa | 6 (5) | 22 (31) | < 0,001 |
| BRIHH | 1 (0,8) | 8 (11) | 0,001 |
| Elevación del segmento ST | 84 (63) | 48 (66) | 0,760 |
| Resultados | |||
| Mortalidad a 30 días | 0 | 9 (12,3) | < 0,001 |
| Mortalidad a 1 año | 6 (4,9) | 18 (26,1) | < 0,001 |
| Parámetros fisiológicos | |||
| SpO2 más baja | 93,4±2,1 | 87,9±6,3 | < 0,001 |
| Presión arterial sistólica* (mmHg) | 118,6±14,6 | 118,9±17,5 | 0,880 |
| Frecuencia cardiaca* (lpm) | 71,7±11,7 | 81,1±13,5 | < 0,001 |
| Frecuencia respiratoria* (rpm) | 18,9±2,4 | 21,5±3,8 | < 0,001 |
| FEVI (%) | 60,1±8,7 | 45,8±10,5 | < 0,001 |
| Diámetro telediastólico (mm) | 52,3±5,7 | 54,7±5,9 | 0,010 |
BRIHH: bloqueo de rama izquierda del haz de His; FEVI: fracción de eyección del ventrículo izquierdo; ICA: insuficiencia cardiaca aguda; SpO2: saturación de oxígeno determinada mediante pulsioximetría.
Las cifras indican media ± desviación estándar o n (%).
*Los valores corresponden a la media de las determinaciones realizadas en los 3 días del estudio durante los pases de visita matutinos.
A los 3 días la incidencia acumulada de algún grado de ICA fue del 35%. Dos terceras partes de los pacientes presentaban ICA al ingreso, mientras que los demás sufrieron esta complicación posteriormente. Por lo que respecta a los síntomas, la ICA fue clínicamente silente en la mayoría de los pacientes, y menos del 20% mostró cierto grado de dificultad respiratoria. La mortalidad a los 30 días y a 1 año fue significativamente mayor entre los pacientes con ICA.
En la Tabla 1 se presentan también las mediciones de parámetros fisiológicos. Los pacientes con ICA tenían valores significativamente superiores de frecuencia respiratoria y frecuencia cardiaca y valores más bajos de LB-SpO2 y fracción de eyección ventricular izquierda, mientras que no había diferencias en la presión arterial.
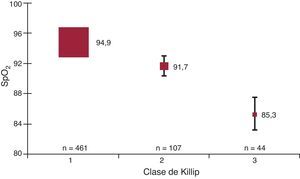
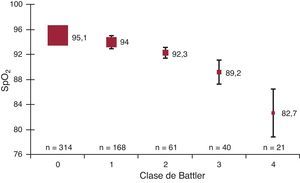
La distribución de los valores medios de MB-SpO2 en relación con el grado de ICA se presenta en las Figura 1, Figura 2. La mediana de MB-SpO2 fue significativamente inferior en relación con el grado de ICA determinado mediante las clases de Killip (n=612) o mediante las puntuaciones de Battler (n=604). Todas las comparaciones por pares realizadas entre los grupos mostraron también diferencias significativas. Asimismo, se observaron diferencias significativas de la frecuencia respiratoria para las clases de Killip 1-3 (19 [3], 21 [4] y 26 [8], respectivamente; p < 0,001) y para las puntuaciones de Battler 0-4 (19 [3], 20 [3], 21 [5], 24 [7] y 26 [7], respectivamente; p < 0,001). Todas las comparaciones por pares realizadas entre los grupos para la frecuencia respiratoria mostraron también diferencias significativas.
Figura 1. Valores basales de saturación de oxígeno determinada mediante pulsioximetría en relación con el grado de insuficiencia cardiaca evaluado mediante la exploración física (clases de Killip) para todas las determinaciones. Las cajas indican medias y las barras, desviación estándar. SpO2: saturación de oxígeno determinada mediante pulsioximetría.
Figura 2. Valores basales de saturación de oxígeno determinada mediante pulsioximetría en relación con el grado de insuficiencia cardiaca evaluado mediante el score radiológico (clases de Battler) para todas las determinaciones. Las cajas indican medias y las barras, desviación estándar. SpO2: saturación de oxígeno determinada mediante pulsioximetría.
Exactitud diagnósticaPor lo que respecta a las determinaciones realizadas (n=612), los coeficientes de correlación entre MB-SpO2 y clase de Killip y puntuación de Battler fueron –0,666 y –0,619 respectivamente (p<0,001). Por lo que respecta a los pacientes, el coeficiente de correlación entre LB-SpO2 y fracción de eyección ventricular izquierda fue 0,433 (p<0,001).
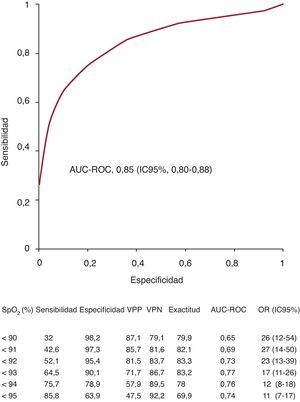
Se representaron gráficamente las determinaciones de la MB-SpO2 en una curva ROC para el diagnóstico de la ICA (Figura 3). El punto de corte de SpO2<93 fue el que mostró un valor más alto del área bajo la curva, con la máxima exactitud de la prueba (83%). El punto de corte para los pacientes con bronquitis crónica (n=45) con un área superior fue también de una SpO2<93. Se obtuvieron también las curvas ROC para la frecuencia respiratoria y la frecuencia cardiaca. El punto de corte con mayor área para la frecuencia respiratoria fue > 21rpm (área, 0,64), con una exactitud de la prueba del 59% (odds ratio=2,19; IC95%, 1,53-3,16). El punto de corte para la frecuencia cardiaca fue > 76 lpm (área, 0,61) y la exactitud de la prueba, del 73% (odds ratio=4,21; IC95%, 2,8-6,3).
Figura 3. Curva receiver operating characteristic para la saturación de oxígeno determinada mediante pulsioximetría y la insuficiencia cardiaca aguda. La tabla incluye información sobre diferentes puntos de corte. AUC, area under curve; IC95%: intervalo de confianza del 95%; OR: odds ratio; ROC: receiver operating characteristic; SpO2: saturación de oxígeno determinada mediante pulsioximetría; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Se clasificó erróneamente mediante la puntuación de Killip a un total de 29 pacientes, con 20 (10%) falsos negativos y 9 (4%) falsos positivos. La combinación de MB-SpO2<93 y la clase de Killip (≥ 2) o la frecuencia respiratoria (> 21 rpm) aumentó la especificidad al 99,4 y el 97% y el valor predictivo positivo al 97,2 y el 78% respectivamente.
SeguimientoLa media de seguimiento fue de 13 meses y se llevó a cabo en 192 pacientes (93%). El análisis de regresión logística multivariable mostró que la edad y la ICA eran variables predictivas independientes para la muerte o rehospitalización por ICA en 1 año (Tabla 2). La LB-SpO2 fue el único factor independiente al no introducir la ICA en el análisis.
Tabla 2. Factores de riesgo de muerte o rehospitalización por insuficiencia cardiaca en 1 año
| Análisis univariable | Análisis multivariable | |||
| OR (IC95%) | p | OR (IC95%) | p | |
| Insuficiencia cardiaca aguda | 7,8 (3,6-17,1) | < 0,001 | 7,1 (2,7-19) | < 0,001 |
| Determinaciones | ||||
| SpO2a | 5,5 (2,6-11,8) | < 0,001 | ||
| Función ventricular izquierda b | 4,3 (1,9-9,6) | 0,001 | ||
| Frecuencia cardiaca b | 2,5 (1,2-5) | 0,013 | ||
| Frecuencia respiratoria b | 2,5 (1,2-5) | 0,02 | ||
| Características clínicas | ||||
| Antecedentes de insuficiencia cardiaca | 5,5 (2,3-12,9) | < 0,001 | ||
| Infarto de miocardio previo | 3,5 (1,7-7,4) | 0,001 | ||
| Diabetes | 2,5 (1,2-5) | 0,015 | ||
| Hipertensión | 2,2 (1,05-4,6) | 0,049 | ||
| Edad c | 1,13 (1,07-1,18) | < 0,001 | 1,12 (1,05-1,18) | < 0,001 |
IC95%: intervalo de confianza del 95%; OR: odds ratio; SpO2: saturación de oxígeno determinada mediante pulsioximetría.
La OR refleja la probabilidad en los pacientes con la característica en cuestión, en comparación con los que no presentan la característica.
a Variable discreta (punto de corte < 93) obtenida tomando el valor más bajo registrado en los pases de visita para cada paciente.
b Variables discretas (puntos de corte: fracción de eyección < 0,50; frecuencia cardiaca > 76 lpm; frecuencia respiratoria > 21 rpm).
c La OR para la edad corresponde al exponente para cada año de edad en la ecuación logística.
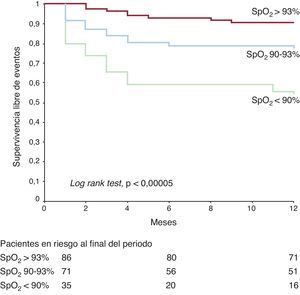
En la Figura 4 se muestran las curvas de Kaplan-Meier de supervivencia sin eventos (mortalidad y rehospitalización por ICA) de los tres grupos establecidos según la LB-SpO2. Se observaron diferencias significativas en las tasas de ausencia de eventos entre los tres grupos, así como en las comparaciones de los grupos por pares: grupo 1 frente a grupo 2 (el 90,7 frente al 76,1%; p=0,01), grupo 2 frente a grupo 3 (el 76,1 frente al 54,3%; p=0,01) y grupo 1 frente a grupo 3 (el 90,7 frente al 54,3%; log rank test, p=0,00005).
Figura 4. Curvas de Kaplan-Meier de la supervivencia libre de eventos para los tres grupos de saturación de oxígeno determinada mediante pulsioximetría. Los eventos considerados son muerte y rehospitalización por insuficiencia cardiaca en el primer año. Las cifras corresponden a pacientes en riesgo en cada grupo a los 1, 6 y 12 meses. SpO2: saturación de oxígeno determinada mediante pulsioximetría.
DiscusiónEste estudio pone de manifiesto la utilidad de la determinación basal de la SpO2 como herramienta complementaria para establecer el diagnóstico y la gravedad de la ICA. Optamos por realizar el estudio en pacientes con IAM debido a la elevada prevalencia de la ICA en esa población. La principal ventaja de la SpO2 está en que es una técnica no invasiva que puede monitorizarse de manera continua y no se ve afectada por las variabilidades interobservador o intraobservador. La observación de un valor basal de SpO2 menor que 93 puede considerarse una señal de ICA y debe alertar al clínico respecto a esa posible complicación que puede ser de especial utilidad en los periodos entre los pases de visita. Cuanto menor sea el valor de la SpO2, mayores son la probabilidad y la gravedad de la ICA.
Los resultados obtenidos resaltan también el papel de la frecuencia respiratoria y la frecuencia cardiaca. Esto cobra especial interés, puesto que no se suele considerar la frecuencia respiratoria un indicador diagnóstico de la ICA. Aunque la frecuencia cardiaca se tiene en cuenta a menudo para el diagnóstico, su valor puede verse alterado por el uso de bloqueadores beta. La asociación de una disminución de la SpO2 con un aumento de la frecuencia respiratoria puede elevar la sospecha de ICA en pacientes en que los criterios diagnósticos son dudosos.
Nuestro estudio observó una buena correlación entre el valor basal de SpO2 y el grado de ICA o la fracción de eyección ventricular izquierda. Estos resultados concuerdan con los de ensayos previos en los que se ha analizado la saturación de oxígeno mediante CO-oximetría en muestras de sangre arterial, en los que se puso de manifiesto una estrecha correlación entre los defectos del intercambio de gases y la gravedad de la ICA o las presiones pulmonares capilares enclavadas10, 16, 17, 18, si bien esta correlación se reducía en los pacientes crónicos19. La hipoxemia en la ICA se explica por un aumento del cortocircuito venoso-arterial y un desequilibrio de ventilación-perfusión10, 16, 17, 18. Sin embargo, a pesar de esta interacción bien conocida, la determinación de la saturación de oxígeno (SaO2) mediante punción arterial como marcador diagnóstico de la ICA no es una práctica común y es frecuente que no se obtenga esta información valiosa. Aunque los valores de SpO2 están estrechamente relacionados con los de la SaO2 obtenida mediante CO-oximetría, la exactitud de la pulsioximetría puede disminuir en situaciones especiales como hipoxemia grave, anemia, acidosis, pigmentación, estados de baja perfusión y uso de fármacos vasoactivos20, 21. En consecuencia, la SpO2 y la SaO2 no son totalmente equivalentes y la información existente en la literatura médica sobre el papel de la SpO2 en la ICA es escasa. Algunos autores han descrito su experiencia con la SpO2 en la detección de la respiración de Cheyne-Stokes en pacientes con insuficiencia cardiaca22, pero, que nosotros sepamos, no hay ningún estudio previo en el que se haya examinado la utilidad de la SpO2 para el diagnóstico de la ICA.
El diagnóstico de la ICA puede resultar difícil en pacientes con IAM debido a que con frecuencia es silente23. En nuestra serie, la mayoría de los pacientes con ICA no presentaron dificultad respiratoria. Por consiguiente, puesto que la ICA puede no diagnosticarse correctamente en muchos casos mediante la exploración física24, 25 (un 5-10% de los pacientes de nuestro estudio fueron clasificados erróneamente con ella), los criterios diagnósticos de ICA de este estudio exigieron la presencia de una radiología anormal, ya que ello aumenta la sensibilidad y la exactitud diagnóstica3, 23. La radiografía de tórax se considera una recomendación de clase I en las guías de la Sociedad Europea de Cardiología sobre el diagnóstico y el tratamiento de la ICA26, 27. En dichas guías, la SpO2 recibe también esa misma consideración para la monitorización, pero no para el diagnóstico.
En las últimas décadas la determinación de la función ventricular y de las presiones de llenado mediante ecocardiografía ha pasado a ser una práctica generalizada en la evaluación de la ICA, a menudo sustituyendo a otros métodos invasivos como el cateterismo pulmonar27, 28, 29. De todos modos, la información aportada por la ecocardiografía no es continua. Los marcadores bioquímicos como los péptidos natriuréticos muestran con frecuencia una elevación anormal al ingreso30 y tienen mayor valor para el pronóstico que para el diagnóstico en los pacientes con IAM8. En este contexto, la SpO2 puede convertirse en un parámetro complementario, determinable de manera continua y de bajo coste para evaluar la ICA, con repercusiones pronósticas, tal como se pone de manifiesto en el seguimiento.
LimitacionesEste estudio tiene algunas limitaciones, como que no se determinaran los péptidos natriuréticos, que no se empleaban de manera habitual en nuestro centro cuando se llevó a cabo el estudio, y la ausencia de un patrón de referencia establecido para el diagnóstico de la ICA en los pacientes con IAM. Otras limitaciones son el formato de registro, que introducía los datos de cada paciente varias veces, la imposibilidad de realizar una evaluación aplicando un diseño ciego y, finalmente, el hecho de que los pacientes con ICA fueran de mayor edad, puesto que podría haber una disminución de la SpO2 producida por la propia edad. Además, evaluamos las ventajas de la SpO2 como marcador diagnóstico de la ICA en pacientes con IAM, pero no pudimos evaluarla en pacientes con una enfermedad pulmonar obstructiva crónica importante o con shock, y en el futuro será preciso evaluar su uso en otros trastornos cardiacos agudos. Por último, esta serie no debe considerarse representativa de la incidencia de ICA en pacientes con síndromes coronarios agudos, puesto que nuestra población fue reclutada en un solo hospital local con un claro sesgo en el ingreso de pacientes.
ConclusionesEn este estudio, el valor basal de la SpO2 aportó una información fiable para establecer el diagnóstico y la gravedad de la ICA como complicación del IAM utilizando un punto de corte < 93 como señal de alarma. Puede recomendarse el uso de la pulsioximetría con fines diagnósticos en el manejo de los pacientes con riesgo de ICA.
FinanciaciónEl estudio fue financiado por nuestro centro.
Conflicto De InteresesNinguno.
Agradecimientos
Damos las gracias a los médicos Gaietà Permanyer, Xavier Bosch, Pilar Tornos, Jordi Otero y Pere Codinach por su revisión crítica del artículo; a los médicos Rosario Cañizares, Jaume Padró y Josep Ballús, así como a todo el equipo de enfermería de nuestra unidad de cuidados intensivos por la ayuda técnica en la obtención de los datos; a la epidemióloga Montserrat Martin por la ayuda estadística; a Mitsi Ito y Joshua Morris por la ayuda idiomática en la redacción del artículo. Todos ellos dieron su consentimiento para ser mencionados en este apartado.
Recibido 12 Febrero 2012
Aceptado 18 Febrero 2012
Autor para correspondencia: Unidad de Cuidados Intensivos, Hospital Sant Joan Despí Moisès Broggi, Consorci Sanitari Integral, Universidad de Barcelona, Jacint Verdaguer 90, 08970 Sant Joan Despí, Barcelona, España. jmasip@ub.edu