El antígeno carbohidrato 125 (CA125) se ha mostrado útil para la estratificación del riesgo de los pacientes ingresados por insuficiencia cardiaca aguda (ICA). Se intenta determinar un punto de corte para identificar a los pacientes con bajo riesgo de muerte y muerte/reingreso por insuficiencia cardiaca 1 mes tras el ingreso por ICA.
MétodosLa cohorte de derivación incluyó a 3.231 pacientes con ICA consecutivos. Se identificaron valores de corte de CA125 con un valor predictivo negativo (VPN) del 90% y una sensibilidad de hasta el 85%. La idoneidad de estos puntos de corte y el riesgo de muerte/reingreso al mes se evaluaron mediante el método de Royston-Parmar. Se seleccionó el mejor punto de corte y se validó en una cohorte del BIOSTAT-CHF (n=1.583).
ResultadosEn la cohorte de derivación, la mediana [intervalo intercuartílico] de CA125 fue 57 [25,3-157] U/ml. El punto de corte óptimo fue <23 U/ml (el 21,5% de los pacientes), con VPN de muerte y del objetivo compuesto del 99,3 y el 94,1% respectivamente. En los análisis multivariables, el CA125 <23 U/ml se asoció con un menores riesgos de muerte (HR=0,20; IC95%, 0,08-0,50; p <0,001) y del objetivo combinado (HR=0,63; IC95%, 950,45-0,90; p=0,009). Su capacidad para discriminar a los pacientes con riesgo bajo a 1 mes se confirmó en la cohorte de validación (VPN de muerte y del objetivo compuesto, el 98,6 y el 96,6%). La capacidad predictiva seguía siendo significativa a los 6 meses de seguimiento.
ConclusionesEn pacientes ingresados por ICA, el CA125 <23 U/ml identificó un subgrupo de pacientes con bajo riesgo de eventos clínicos adversos a corto plazo que pueden no requerir un seguimiento estrecho.
Palabras clave
Los primeros meses tras un ingreso hospitalario por insuficiencia cardiaca aguda (ICA) se caracterizan por un elevado riesgo de muerte y reingresos por insuficiencia cardiaca (IC)1,2. La mayor parte de las iniciativas de estratificación del riesgo se centran en identificar a los pacientes en mayor riesgo tras el alta, pero se hace menos énfasis en la identificación de aquellos que están en menos riesgo. Una identificación exacta de esta población con riesgo bajo puede permitir una mejor asignación de los recursos tras el alta para destinarlos a los pacientes con riesgo alto.
Las concentraciones plasmáticas de antígeno carbohidrato 125 (CA125) se han convertido en un marcador pronóstico útil en los pacientes con ICA3–12. Se ha observado que los valores superiores de CA125 constituyen una herramienta útil como marcador indirecto de la congestión, el pronóstico, el seguimiento de la enfermedad y la individualización del tratamiento diurético durante la hospitalización y los primeros 3 meses después del alta3–12. La mayoría de los enzimoinmunoanálisis comerciales recomiendan un valor de corte de 35 U/ml para definir los valores normales (). Este umbral se obtuvo en estudios del cáncer realizados en la década de los ochenta13,14. Sin embargo, la evidencia publicada sobre el CA125 como marcador pronóstico en la ICA6,8 ha puesto de relieve un aumento exponencial del riesgo dentro del intervalo de valores considerados normales. Con base en el examen de esta curva de riesgo creciente de forma sigmoidea, se planteó la hipótesis de que unos valores de corte más bajos podrían servir para identificar a los pacientes con menos riesgo de sufrir eventos clínicos tempranos.
El objetivo del estudio es determinar los valores de corte del CA125 más bajos que fueran útiles para identificar a los pacientes con riesgo de muerte y muerte/reingreso por IC en el mes posterior a una hospitalización por ICA.
MÉTODOSMuestras de estudioCohorte de desarrolloSe estudió retrospectivamente una cohorte de 3.302 pacientes consecutivos que ingresaron por ICA en el servicio de cardiología de un centro universitario de nivel terciario entre enero de 2007 y junio de 2018. La ICA fue diagnosticada por cardiólogos según la definición propuesta por la guía en vigor en el momento de la inclusión de los pacientes. Al ingreso, todos los pacientes presentaban signos o síntomas atribuibles a congestión. Se incluyó en el estudio tanto a pacientes con ICA de reciente aparición como a los que presentaban una descompensación de una IC crónica. Se excluyó a los pacientes sin determinaciones del CA125 disponibles y a los sometidos a intervención quirúrgica de reemplazo valvular o implante percutáneo de una válvula durante el ingreso índice, así como a los que se remitió a trasplante cardiaco (n=71). La muestra final del estudio la formaron 3.231 pacientes.
Se determinó la fracción de eyección del ventrículo izquierdo (FEVI) mediante ecocardiografía bidimensional durante la hospitalización índice. El tratamiento médico se individualizó según lo indicado en la guía vigente.
El seguimiento se limitó a 6 meses. Los datos de seguimiento de los pacientes se censuraron para el análisis estadístico si se producía la muerte o se practicaba un trasplante cardiaco (n=2) durante ese periodo. El estudio fue aprobado por el comité de ética de investigación del centro (Hospital Clínico Universitario de Valencia), y los pacientes dieron su consentimiento informado por escrito. El protocolo del estudio se ajustó a lo establecido en las directrices éticas de la Declaración de Helsinki de 1975 que se reflejaban en la autorización obtenida a priori del comité de investigación humana del centro.
Estudio BIOSTAT-CHF (cohorte de validación)El Biology Study to Tailored Treatment in Chronic Heart Failure (BIOSTAT-CHF) fue un estudio multicéntrico, multinacional, prospectivo y observacional en el que se incluyó a 2.516 pacientes con signos o síntomas de IC de reciente aparición o un agravamiento de los ya existentes, de 69 centros en 11 países europeos, entre diciembre de 2010 y diciembre de 201215. La mediana de seguimiento fue de 21 [intervalo intercuartílico, 15-27] meses. Se incluyó a los pacientes en el estudio tras una IC de reciente aparición o un agravamiento de la ya existente. La IC se definió por una FEVI ≤ 40% y/o una concentración de péptido natriurético cerebral (BNP) > 400 pg/ml o de la fracción aminoterminal del propéptido natriurético ceebral (NT-proBNP) > 2.000 pg/ml. Los pacientes fueron identificados en el contexto ambulatorio o en el hospital. Se incluyó en el presente estudio a 1.583 pacientes hospitalizados con determinaciones del CA125 disponibles. Todos los pacientes incluidos en el estudio BIOSTAT-CHF dieron su consentimiento informado por escrito para participar en él, y el estudio BIOSTAT-CHF se llevó a cabo cumpliendo lo establecido en la Declaración de Helsinki, los requisitos éticos y legales nacionales y la legislación pertinente de la Unión Europea. El estudio fue aprobado también por los comités de ética nacionales y locales. Las características de la cohorte de pacientes del BIOSTAT-CHF se han descrito en otra publicación15.
Criterios de valoraciónLos criterios de valoración elegidos fueron la mortalidad por cualquier causa y la combinación de muerte y reingreso por IC tras 1 y 6 meses del ingreso hospitalario. La información acerca de la causa de la muerte se extrajo de la historia clínica del paciente y fue validada («adjudicada») por un investigador al que se ocultaron los valores de la variable de exposición.
Determinación del CA125En la cohorte de desarrollo, el CA125 de determinó durante la hospitalización (48± 24 h después del ingreso) con el empleo de un kit de inmunoanálisis comercial (Elecsys CA 125 II-Roche Diagnostics, Alemania). En la cohorte de validación, el CA125 se determinó al ingreso con el test ARCHITECT CA 125 II (Abbott Laboratories, Estados Unidos) (lote 81007M800), un inmunoanálisis de micropartículas quimioluminiscentes (CMIA), en un sistema ARCHITECTi (Abbott Laboratories, Estados Unidos).
La semivida del CA125 es de 7 a 12 días, y en estudios previos no se han observado cambios significativos del CA125 durante las 72 h siguientes al ingreso6. El valor normal del CA125 establecido para los análisis es de 35 U/ml (), y el coeficiente de variación total descrito es ≤ 10% para todos los métodos de análisis.
Análisis estadísticoSe compararon las características basales en las diversas categorías de CA125 mediante pruebas de ANOVA, de Kruskal-Wallis o de la χ2 según procediera.
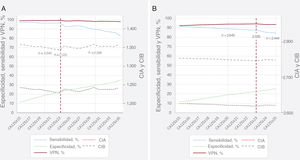
Valor de corte del CA125 para la predicción de un riesgo bajoSe elaboró la curva de características operativas del receptor (ROC) para los 2 criterios de valoración evaluados a 1 mes. Para determinar los valores de corte óptimos del CA125 para identificar a los pacientes con riesgo bajo, se calculó la sensibilidad, la especificidad, el valor predictivo negativo (VPN) y el valor predictivo positivo a lo largo de todo el espectro continuo de valores del biomarcador (instrucción diagt). Partiendo de un intervalo de valores de corte considerados predictivos del riesgo bajo, se analizaron con mayor detalle en análisis de supervivencia multivariantes los valores de corte que tenían un VPN ≥ 90%, una sensibilidad ≥ 85% y los que clasificaban como mínimo a un 10% de pacientes como casos con riesgo bajo. En esta última situación, el mejor valor de corte era el que daba un mejor resultado según el criterio de información de Akaike (CIA) y el criterio de información bayesiano (CIB). Se evaluó también que la idoneidad pronóstica del valor de corte fuera óptima a los 6 meses de seguimiento. En la figura 1 se presentan los resultados de sensibilidad, VPN, CIA y CIB de los valores de CA125 preseleccionados. Se comparó el mejor valor de corte con los valores de corte publicados anteriormente (valor de corte tradicional propuesto en la mayoría de los métodos de análisis, 35 U/ml; valores de corte pronósticos empleados en estudios anteriores, 65 U/ml)6–11. Para esta comparación, se clasificó a los pacientes en las siguientes categorías de valores del CA125: C1, <23 U/ml; C2, 23-34,9 U/ml; C3, 35-64,9 U/ml, y C4, ≥ 65 U/ml.
Rendimiento de diferentes valores de corte del CA125 en la predicción de los eventos adversos a 1 mes. A: mortalidad por cualquier causa. B: mortalidad por cualquier causa/reingreso por IC. CA125: antígeno carbohidrato 125; CIA: criterio de información de Akaike; CIB: criterio de información bayesiano; IC: insuficiencia cardiaca; VPN: valor predictivo negativo.
Con un modelo de regresión paramétrico flexible (modelo de Royston-Parmar), se determinó el efecto pronóstico independiente de las categorías de valores de CA125 respecto a los 2 resultados clínicos evaluados. Con objeto de mantener el supuesto de linealidad con el resultado al elaborar un modelo con una exposición continua, se eligió la mejor transformación polinómica fraccional con base en los criterios de CIA/CIB. En la cohorte de desarrollo, los cálculos de la regresión basados en el modelo de mortalidad se ajustaron respecto a las siguientes variables: sexo, ingreso previo por ICA, clase de la New York Heart Association (NYHA) antes del ingreso, etiología, fibrilación auricular, frecuencia cardiaca, presión arterial sistólica, hemoglobina, nitrógeno de urea en sangre, NT-proBNP, FEVI, toma de bloqueadores beta durante la hospitalización y dosis equivalente de furosemida al ingreso. Para la variable de valoración combinada, se agregaron el índice de comorbilidad de Charlson y la insuficiencia tricuspídea grave al conjunto de covariables de la mortalidad. En el mismo escenario multivariante, se evaluó también la idoneidad pronóstica de los diferentes valores de corte del CA125.
Se aplicó una estrategia de modelización similar a la cohorte de validación, excepto porque estos cálculos de la regresión se ajustaron tan solo con una puntuación de riesgo específica para el resultado clínico (puntuación de riesgo del BIOSTAT-CHF)16. La puntuación de riesgo de muerte del BIOSTAT-CHF incluía como factores la edad, el nitrógeno de urea en sangre, el NT-proBNP, la hemoglobina en suero y la toma de bloqueadores beta. La puntuación de riesgo del criterio de valoración combinado del BIOSTAT-CHF incluía los siguientes factores: edad, hospitalización previa por IC, edema periférico, presión arterial sistólica, NT-proBNP, hemoglobina, lipoproteínas de alta densidad, sodio y prescripción de bloqueadores beta. En un análisis de sensibilidad realizado en la cohorte de desarrollo, las estimaciones del riesgo de ajustaron también según la puntuación de riesgo de ambos objetivos del BIOSTAT-CHF16. Se calcularon también las estimaciones del riesgo según el sexo, la FEVI (≥ 50% y <50%), la tasa de filtrado glomerular estimada (TFGe > 60 frente a ≤ ml/min/1,73 m2) y el NT-proBNP (≥ mediana frente a < mediana). Todas las estimaciones se presentan en forma de hazard ratio (HR) y sus intervalos de confianza del 95% (IC95%). Se utilizó el estadístico C de Harrell como medida de la capacidad de discriminación del modelo y este dato se presenta en los pies de figura.
Se estableció un valor de p bilateral <0,05 como umbral para la significación estadística. Para el análisis principal se utilizó el programa Stata 15.1 (Stata Statistical Software, versión 15 [2017]; StataCorp LP, Estados Unidos).
RESULTADOSLa media de edad de la muestra de la cohorte de desarrollo fue 73,6±11,3 años; 1.553 pacientes (48,1%) eran mujeres, 861 (26,7%) habían tenido una hospitalización previa por ICA, 1.142 (35,4%) tenían antecedentes de cardiopatía isquémica y 1.697 (52,5%) tenían una FEVI ≥ 50%. Las medianas [intervalo intercuartílico] de los valores de CA125, NT-proBNP y TFGe fueron 57 [25,3-127] U/ml, 3.418 [1.831-6.918] pg/ml y 60 [43,9-76,3] ml/min/1,73 m2 respectivamente. En la tabla 1 y tabla 2 se presentan las características basales en las diversas categorías de CA125. En los pacientes de la categoría de CA125 más baja, había una mayor frecuencia de mujeres y un mayor porcentaje de casos de IC con fracción de eyección conservada. En términos generales, tenían un perfil de riesgo clínico más favorable (tabla 1 y tabla 2). Por ejemplo, presentaban una presión arterial más alta, menos signos de congestión, una mejor función renal y valores de NT-proBNP más bajos. De igual modo, los pacientes de la categoría de CA125 más baja recibían tratamiento con dosis más bajas de diuréticos del asa por vía intravenosa y era menos frecuente que recibieran antagonistas de los receptores de aldosterona.
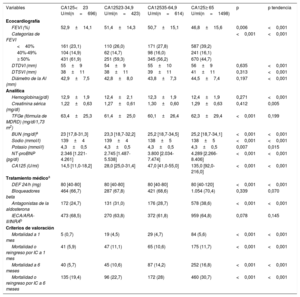
Características basales en las diversas categorías de CA125. Cohorte de desarrollo
| Variables | CA125 < 23 U/ml(n=696) | CA125 23-34,9 U/ml(n=423) | CA125 35-64,9 U/ml(n=614) | CA125 ≥ 65 U/ml(n=1498) | p | p tendencia |
|---|---|---|---|---|---|---|
| Epidemiología y antecedentes patológicos | ||||||
| Edad (años) | 74,1±10,9 | 74,5±10,6 | 75,0±11,0 | 72,6±11,6 | 0,065 | 0,002 |
| Sexo, varones | 334 (48,0) | 206 (48,7) | 314 (51,1) | 824 (55,0) | 0,008 | 0,001 |
| Hipertensión | 594 (85,3) | 350 (82,7) | 491 (80,0) | 1.118 (74,6) | <0,001 | <0,001 |
| Diabetes | 311 (44,7) | 187 (44,2) | 272 (44,3) | 674 (45,0) | 0,988 | 0,844 |
| Tabaquismo | 88 (12,6) | 40 (9,5) | 76 (12,4) | 190 (12,7) | 0,328 | 0,572 |
| Exfumadores | 155 (22,3) | 122 (26,5) | 146 (23,8) | 399 (26,6) | 0,120 | 0,056 |
| Cirugía valvular previa | 51 (7,3) | 25 (5,9) | 35 (5,7) | 85 (5,7) | 0,474 | 0,163 |
| Ingreso previo por IC | 185 (26,6) | 110 (26,0) | 172 (28,0) | 394 (26,3) | 0,857 | 0,960 |
| Cardiopatía isquémica | 244 (35,1) | 167 (39,5) | 228 (37,1) | 503 (33,6) | 0,107 | 0,222 |
| Valvulopatía | 206 (29,6) | 135 (31,9) | 195 (31,8) | 542 (36,2) | 0,012 | 0,002 |
| Revascularización coronaria | 34 (4,9) | 12 (2,8) | 26 (4,2) | 51 (3,4) | 0,234 | 0,196 |
| EPOC | 156 (22,4) | 85 (20,1) | 153 (24,9) | 297 (19,8) | 0,056 | 0,251 |
| Ictus | 58 (8,3) | 50 (11,8) | 69 (11,2) | 157 (10,5) | 0,204 | 0,254 |
| EAP | 62 (8,9) | 30 (7,1) | 57 (9,3) | 122 (8,14) | 0,588 | 0,775 |
| Signos | ||||||
| Frecuencia cardiaca (lpm) | 98±28 | 95±29 | 100±28 | 99±28 | 0,980 | 0,189 |
| PAS (mmHg) | 154±36 | 148±31 | 149±33 | 141±31 | <0,001 | <0,001 |
| PAD (mmHg) | 84±22 | 80±20 | 82±20 | 79±18 | <0,001 | <0,001 |
| Edema periférico | 310 (44,5) | 226 (53,4) | 362 (59,0) | 1.068 (71,3) | <0,001 | <0,001 |
| ECG | ||||||
| Fibrilación auricular | 256 (36,8) | 179 (42,3) | 284 (46,2) | 728 (48,6) | <0,001 | <0,001 |
| Bloqueo de rama del haz | 239 (34,3) | 148 (35,0) | 197 (32,1) | 464 (31,0) | 0,272 | 0,064 |
CA125: antígeno carbohidrato 125; EAP: enfermedad arterial periférica; ECG: electrocardiograma; EPOC: enfermedad pulmonar obstructiva crónica; IC: insuficiencia cardiaca; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Los valores expresan n (%) o media±desviación estándar.
Exploraciones complementarias, tratamiento médico y eventos clínicos en las diversas categorías de CA125. Cohorte de desarrollo
| Variables | CA125<23 U/ml(n=696) | CA12523-34,9 U/ml(n=423) | CA12535-64,9 U/ml(n=614) | CA125≥ 65 U/ml(n=1498) | p | p tendencia |
|---|---|---|---|---|---|---|
| Ecocardiografía | ||||||
| FEVI (%) | 52,9±14,1 | 51,4±14,3 | 50,7±15,1 | 46,8±15,6 | 0,006 | <0,001 |
| Categorías de FEVI | <0,001 | <0,001 | ||||
| <40% | 161 (23,1) | 110 (26,0) | 171 (27,8) | 587 (39,2) | ||
| 40%-49% | 104 (14,9) | 62 (14,7) | 98 (16,0) | 241 (16,1) | ||
| ≥ 50% | 431 (61,9) | 251 (59,3) | 345 (56,2) | 670 (44,7) | ||
| DTDVI (mm) | 55±9 | 54±9 | 55±10 | 56±9 | 0,635 | <0,001 |
| DTSVI (mm) | 38±11 | 38±11 | 39±11 | 41±11 | 0,313 | <0,001 |
| Diámetro de la AI (mm) | 42,9±7,5 | 42,8±8,0 | 43,8±7,3 | 44,5±7,4 | 0,197 | <0,001 |
| Analítica | ||||||
| Hemoglobina(g/dl) | 12,9±1,9 | 12,4±2,1 | 12,3±1,9 | 12,4±1,9 | 0,271 | <0,001 |
| Creatinina sérica (mg/dl) | 1,22±0,63 | 1,27±0,61 | 1,30±0,60 | 1,29±0,63 | 0,412 | 0,005 |
| TFGe (fórmula de MDRD) (mg/dl/1,73 m2) | 63,4±25,3 | 61,4±25,0 | 60,1±26,4 | 62,3±29,4 | <0,001 | 0,199 |
| BUN (mg/dl)a | 23 [17,8-31,3] | 23,3 [18,7-32,2] | 25,2 [18,7-34,5] | 25,2 [18,7-34,1] | <0,001 | <0,001 |
| Sodio (mmol/l) | 139±4 | 139±4 | 138±5 | 138±5 | <0,001 | <0,001 |
| Potasio (mmol/l) | 4,3±0,5 | 4,3±0,5 | 4,3±0,5 | 4,3±0,5 | 0,007 | 0,015 |
| NT-proBNP (pg/dl) | 2.346 [1.221-4.261] | 2.745 [1.487-5.538] | 3.800 [2.034-7.474] | 4.289 [2.266-8.406] | <0,001 | <0,001 |
| CA125 (U/ml) | 14,5 [11,0-18,2] | 28,0 [25,0-31,4] | 47,0 [41,0-55,0] | 135,0 [92,0-216,0] | <0,001 | <0,001 |
| Tratamiento médicoa | ||||||
| DEF 24/h (mg) | 80 [40-80] | 80 [40-80] | 80 [40-80] | 80 [40-120] | <0,001 | <0,001 |
| Bloqueadores beta | 464 (66,7) | 287 (67,8) | 421 (68,6) | 1.054 (70,4) | 0,339 | 0,070 |
| Antagonistas de la aldosterona | 172 (24,7) | 131 (31,0) | 176 (28,7) | 578 (38,6) | <0,001 | <0,001 |
| IECA/ARA-II/INRAb | 473 (68,5) | 270 (63,8) | 372 (61,8) | 959 (64,8) | 0,078 | 0,145 |
| Criterios de valoración | ||||||
| Mortalidad a 1 mes | 5 (0,7) | 19 (4,5) | 29 (4,7) | 84 (5,6) | <0,001 | <0,001 |
| Mortalidad o reingreso por IC a 1 mes | 41 (5,9) | 47 (11,1) | 65 (10,6) | 175 (11,7) | <0,001 | <0,001 |
| Mortalidad a 6 meses | 40 (5,7) | 45 (10,6) | 87 (14,2) | 252 (16,8) | <0,001 | <0,001 |
| Mortalidad o reingreso por IC a 6 meses | 135 (19,4) | 96 (22,7) | 172 (28) | 460 (30,7) | <0,001 | <0,001 |
AI: aurícula izquierda; ARA-II: antagonistas de los receptores de la angiotensina II; BUN: nitrógeno de urea en sangre; CA125: antígeno carbohidrato 125; DEF: dosis equivalente de furosemida; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprisilina y del receptor de angiotensina; MDRD: Modification of Diet in Renal Disease; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
La media de edad de la cohorte de validación fue 69±12,3 años, con 1.141 (72,1%) pacientes varones y 425 (26,8%) que habían tenido una hospitalización previa por ICA. La mediana de los valores del CA125 fue 64 [21-69] U/ml y la distribución; las características de los pacientes según las categorías del CA125 se muestran en la . En términos generales, las características de los pacientes con valores inferiores de CA125 fueron similares a las observadas en la cohorte de desarrollo.
Valor de corte del CA125 para seleccionar a los pacientes con riesgo bajoLas áreas bajo la curva ROC del CA125 para la mortalidad y para la combinación de mortalidad/reingreso por IC a 1 mes fueron 0,639 y 0,570. En el caso de la mortalidad a 1 mes, se preseleccionó un intervalo entre 15 y 34 U/ml. En el caso del criterio de valoración combinado a 1 mes, se preseleccionó un intervalo entre 15 y 24 U/ml. En la figura 1 se presentan los resultados de sensibilidad, VPN, CIA y CIB para los valores de CA125 preseleccionados.
Un valor de corte de 23 U/ml permitió identificar a un 21,5% de los pacientes con un VPN y una sensibilidad del 99,3 y el 96,4% para la mortalidad a 1 mes. Los respectivos resultados de exactitud diagnóstica para el criterio de valoración combinado fueron del 94,1 y el 87,9% respectivamente. Tras una evaluación multivariante detallada, el valor de CA125 de 23 U/ml fue el que mostró los valores más bajos de CIA/CIB para ambos criterios de valoración (figura 1).
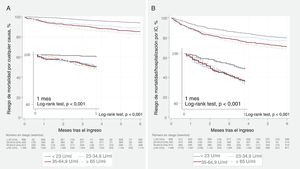
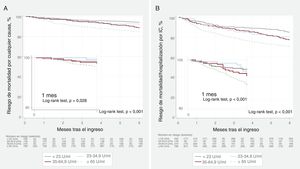
CA125 bajo y resultados clínicos adversosCohorte de desarrolloEn el seguimiento de 1 mes, se registraron 137 (4,2%) muertes y 328 (10,2%) episodios del criterio de valoración combinado. Fallecieron un total de 98 pacientes (3,0%) durante la hospitalización. Para los 2 criterios de valoración, las tasas brutas aumentaban al pasar de cada categoría de valores de CA125 más bajos a una superior (tabla 1). Las curvas de Kaplan-Meier mostraron una separación progresiva de las curvas a lo largo de todo el seguimiento, con una separación apreciable de las curvas en el primer mes para ambos criterios de valoración, y en especial en los pacientes con un valor de CA125 <23 U/ml (figura 2A,B). Después de un ajuste multivariante, y en comparación con los pacientes con un valor de CA125 ≥ 23 U/ml, los que tenían CA125 <23 U/ml mostraron una reducción del 80% en el riesgo de muerte (HR = 0,20; IC95%, 0,08-0,50; p <0,001) y una reducción del 37% en el del criterio de valoración combinado (HR = 0,63; IC95%, 0,45-0,89; p=0,009). Se observó una reducción del riesgo similar al de los pacientes con CA125 entre 23 y 35 U/ml (mortalidad, HR = 0,20; IC95%, 0,07-0,53; p=0,001; mortalidad/reingreso por IC, HR = 0,52; IC95%, 0,34-0,79; p=0,002). En la figura 1 y la se presentan las curvas de supervivencia correspondientes a los diversos subgrupos preespecificados. Los análisis multivariantes mostraron una asociación no diferencial según el sexo (varones frente a mujeres), la FEVI (≥ 50% frente a <50%), las categorías de valores del NT-proBNP (≥ mediana [3.480 pg/ml] frente a < mediana) y TFGe (> 60 frente a ≤ 60ml/min/1,73 m2) (figura 3).
CA125 <23 U/ml y riesgo de eventos adversos. Estimaciones de riesgo multivariantes. Análisis de subgrupos. A: mortalidad por cualquier causa. B: mortalidad por cualquier causa/reingreso por IC. Para el conjunto de los pacientes, las estimaciones del riesgo de mortalidad se ajustaron respecto a los siguientes factores: edad, sexo, ingreso previo por ICA, clase de la New York Heart Association antes del ingreso, etiología, fibrilación auricular, frecuencia cardiaca, presión arterial sistólica, hemoglobina, nitrógeno de urea en sangre, NT-proBNP, FEVI, toma de bloqueadores beta durante la hospitalización y dosis equivalente de furosemida al ingreso. Para la variable de valoración combinada, se agregaron al conjunto de covariables para la mortalidad el índice de comorbilidad de Charlson y la insuficiencia tricuspídea grave. El estadístico C de Harrell para los modelos multivariantes de la mortalidad y del criterio de valoración combinado fue 0,81 y 0,71 respectivamente. CA125: antígeno carbohidrato 125; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; ICA: insuficiencia cardiaca aguda; NT-proBNP, fracción aminoterminal del propéptido natriurético cerebral; TFGe: tasa de filtrado glomerular estimada.
Un análisis de sensibilidad con ajuste por la puntuación de riesgo del BIOSTAT-CHF reveló también el mismo patrón de riesgo de los criterios de valoración evaluados a 1 mes. Los pacientes con CA125 <23 U/ml continuaron presentando similar asociación con menos riesgo (HRmortalidada1mes = 0,17; IC95%, 0,07-0,41; p <0,001; HRmortalidad/reingresoporICa1mes = 0,43; IC95%, 0,31-0,59; p <0,001).
En el seguimiento realizado a los 6 meses, se observaron 424 (13,1%) muertes y 863 (26,7%) episodios del criterio de valoración combinado. En ese momento de evaluación, las diferencias indicativas de un riesgo inferior en los pacientes con CA125 <23 U/ml fueron de menor magnitud, pero continuaron siendo significativas para ambos criterios de valoración (figura 2A,B). Por lo que respecta a estos criterios de valoración secundarios, las estimaciones del riesgo ajustado confirmaron que un valor de CA125 <23 U/ml identificaba a un subgrupo de pacientes con un riesgo de muerte un 51% inferior (HR = 0,49; IC95%, 0,35-0,69; p <0,001) y un riesgo de muerte/reingreso por IC un 22% inferior (HR = 0,78; IC95%, 0,64-0,94; p=0,010).
Cohorte de validaciónEn el seguimiento a 1 mes, fallecieron 42 pacientes (2,6%) y 120 (7,6%) sufrieron un episodio del criterio de valoración combinado. Durante la hospitalización fallecieron 51 pacientes (3,2%). En el seguimiento realizado a los 6 meses, fallecieron 184 pacientes (11,6%) y 371 (23,4%) reingresaron por IC. El VPN y la sensibilidad del valor del CA125 <23 U/ml para la mortalidad a 1 mes fueron del 98,6 y el 85,7% respectivamente. Estos mismos parámetros fueron del 96,6 y el 88,3% para el criterio de valoración de muerte/reingreso por IC a 1 mes. En la se muestran las tasas brutas de los criterios de valoración a 1 y a 6 meses para las diferentes categorías del CA125.
Los pacientes con CA125 <23 U/ml fueron los que presentaron las tasas más bajas de eventos adversos, con diferencias que estaban presentes ya a partir del primer mes (figura 4A,B). Tras un ajuste multivariante por la puntuación de riesgo del BIOSTAT-CHF, los pacientes con CA125 <23 U/ml continuaron mostrando un riesgo inferior al de los pacientes con CA125 > 23 U/ml por lo que respecta a los episodios de muerte/reingreso por IC a 1 mes (HR = 0,54; IC95%, 0,32-0,91; p=0,021). Las estimaciones del riesgo ajustadas para la mortalidad a 1 mes no alcanzaron significación estadística (HR = 0,61; IC95%, 0,26-1,47; p=0,267). A los 6 meses, un valor de CA125 <23 U/ml se asoció con menos riesgo de ambos criterios de valoración (HRmortalidada6meses = 0,59; IC95%, 0,39-0,90; p=0,014; HRmortalidad/reingresoporICalos6meses = 0,65; IC95%, 0,49-0,86; p=0,002).
DISCUSIÓNEste estudio confirma el papel del CA125 en la estratificación del riesgo a corto y medio plazo tras una hospitalización por ICA. Además, se observa que un valor de CA125 <23 U/ml (en vez del umbral convencional <35 U/ml) es el punto de corte óptimo para identificar a los pacientes con un riesgo inferior de mortalidad a 1 mes tras el ingreso hospitalario. El hecho de que este nuevo valor de corte (que abarca a un 21% de la población) diera resultados igual de buenos para el criterio de valoración combinado de mortalidad/reingreso por IC a 1 mes da mayor solidez a nuestros resultados. Este valor de corte mostró también un excelente rendimiento para ambos criterios de valoración en las evaluaciones realizadas a los 6 meses de seguimiento. Estos resultados se reprodujeron satisfactoriamente en pacientes hospitalizados de la cohorte internacional del estudio BIOSTAT-CHF formada por pacientes con un agravamiento de la IC.
CA125 en los síndromes de ICAEl CA125, también denominado MUC16, es una glucoproteína de alto peso molecular y extremadamente compleja, sintetizada por las células epiteliales celómicas4,5,17. Aunque se utiliza ampliamente para el seguimiento del cáncer de ovario, se han descrito unas concentraciones plasmáticas elevadas en hasta 2 de cada 3 pacientes con ICA4–6. Aunque no se conocen todavía los mecanismos de regulación que conducen a un aumento del CA125, se ha propuesto que el aumento de las presiones venosas y la inflamación pueden ser mecanismos cruciales4,5,17. En la ICA, los factores más importantes con una relación positiva con los valores de CA125 son indicadores indirectos de congestión e IC derecha bien conocidos4–8,17,18. Esto ha hecho que el CA125 generara gran interés en los clínicos como indicador de la congestión17, en especial teniendo en cuenta su amplia disponibilidad, bajo coste y el escaso valor de los signos/síntomas y los péptidos natriuréticos para medir con exactitud la gravedad de la congestión4,5,19,20.
Se ha observado de manera uniforme que un valor más alto del CA125 se asocia con mayor riesgo de muerte y de reingreso por IC en diferentes situaciones de ICA3–8. De hecho, un reciente subestudio del registro BIOSTAT-CHF ha confirmado la asociación de este biomarcador con mayores riesgos de muerte y de reingreso por IC a 1 año de manera independiente de los factores pronósticos tradicionales, incluidos los signos y síntomas de congestión8.
Tiene interés señalar que este biomarcador mostró unas propiedades atractivas para el seguimiento en los primeros meses después de una descompensación y para orientar los tratamientos de depleción9–11. En un reciente estudio de 946 pacientes dados de alta tras una ICA, una evaluación longitudinal del CA125 puso de manifiesto que su evolución en las primeras semanas después del alta mostraba asociación independiente con la mortalidad9. Además, en el ensayo clínico aleatorizado CHANCE-HF se observó que una estrategia de ajuste de las dosis de diuréticos con personalización de la intensidad del seguimiento basada en las concentraciones de CA125 fue superior a la asistencia estándar por lo que respecta a la reducción del riesgo de muerte o reingreso por IC a 1 año10. Más recientemente, el tratamiento diurético guiado por la concentración de CA125 se ha asociado también con una mejora de la función renal en comparación con la asistencia habitual en 160 pacientes con ICA y disfunción renal concomitante11.
CA125 bajo, pronóstico y posibles consecuencias clínicasLos valores de corte tradicionales del CA125 se basaron en estudios centrados en la utilidad diagnóstica del CA125 para considerar/descartar el cáncer de ovario y otros cánceres13,14,21. Por ejemplo, Klug et al.13 observaron que un valor de CA125 <35 U/ml permitía diferenciar claramente a los individuos sanos de las pacientes con cáncer de ovario, mientras que un valor de corte de 65 U/ml maximizaba la diferencia entre las pacientes con una enfermedad benigna y las que tenían un carcinoma ovárico. En otros cánceres, se tomó también el umbral de CA125 > 35 U/ml como valor de corte más ampliamente aceptado21. Sin embargo, hasta la fecha, estos valores de corte establecidos para el cáncer se han utilizado en la ICA sin que haya datos de valores de corte específicos para ella. Nuestros resultados indican que un valor de corte del CA125 <23 U/ml permite identificar a un subgrupo de pacientes con riesgo bajo, con un aumento gradual del riesgo en las categorías superiores (como las de CA125 23-35 U/ml o superiores). Este efecto pronóstico se observó en los 2 criterios de valoración evaluados, aunque fue más potente para la mortalidad, y se produjo de manera uniforme en ambos sexos, en los pacientes con fracción de eyección conservada o reducida, con o sin disfunción renal y de manera independiente de los valores del NT-proBNP. Además, la capacidad pronóstica del CA125 <23 U/ml se observó también a los 6 meses de seguimiento, y se obtuvo una validación positiva en la cohorte internacional de la puntuación de riesgo del BIOSTAT-CHF. Estos resultados concuerdan con los de estudios previos en los que se han descrito valores <20 U/ml en personas sanas14.
Es de prever que nuestros resultados puedan proporcionar una herramienta ampliamente disponible para determinar la fisiopatología subyacente en los síndromes de ICA. Por ejemplo, un CA125 bajo puede indicar un predominio de la congestión intravascular o una redistribución vascular, en vez de una congestión extravascular o tisular22. Desde un punto de vista clínico, estos pacientes pueden beneficiarse de una estrategia de diuréticos menos intensiva, un ajuste más rápido del aumento de la dosis de los tratamientos estándares recomendados para la IC y, probablemente, un seguimiento más flexible tras el alta. Por último, estos resultados respaldan el valor emergente del CA125 como biomarcador en la IC, tal como se ha indicado recientemente en un consenso de expertos en IC23.
LimitacionesEl estudio tiene algunas limitaciones que es preciso reconocer. En primer lugar, estos resultados no son aplicables a los pacientes con una IC crónica estable. La determinación del CA125 no se hizo en el mismo momento en las 2 cohortes. En la cohorte de desarrollo, el CA125 se determinó durante la hospitalización, mientras que en la cohorte de validación se determinó al ingreso. Creemos que esto es irrelevante, dada la larga semivida de este biomarcador4,6,17. En segundo lugar, no se evaluó el efecto de la intensidad del seguimiento ni de los cambios de los tratamientos tras el alta en la incidencia de los desenlaces. En tercer lugar, dado que se trata de una cohorte formada predominantemente por pacientes caucásicos, nuestros resultados no pueden extrapolarse a otras razas. En cuarto lugar, no se determinaba este marcador al alta, por lo que con nuestro enfoque no fue posible evaluar la utilidad adicional de los cambios secuenciales del CA125, en especial en pacientes con hospitalizaciones prolongadas. En quinto lugar, en el presente estudio no se evaluaron los cambios del tratamiento médico que se produjeron durante el seguimiento, lo cual puede haber impedido evaluar su efecto en los valores de CA125 y en qué medida podrían haber modificado los resultados presentados aquí. Por consiguiente, será necesario evaluar en futuros estudios la posible influencia de los nuevos productos farmacológicos, como sacubitrilo-valsartán y los inhibidores del transportador de sodio-glucosa, en nuestros resultados.
CONCLUSIONESEn los pacientes hospitalizados por ICA, un valor de corte de CA125 <23 U/ml permitió identificar a un subgrupo de pacientes con riesgo bajo de mortalidad a corto plazo, así como del criterio de valoración combinado de mortalidad/reingreso por IC. Ese mismo valor de corte mantuvo su capacidad predictiva de ambos criterios de valoración determinados a los 6 meses de seguimiento. Serán necesario nuevos estudios para confirmar estos resultados y evaluar si, a este subgrupo de pacientes, puede aplicarse una pauta de seguimiento más relajada durante la fase de transición.
FINANCIACIÓNEl presente trabajo fue financiado por la Comisión Europea [FP7-242209-BIOSTAT-CHF; EudraCT 2010-020808-29] y CIBER Cardiovascular [16/11/00420 y 16/11/00403], que no intervinieron en modo alguno en el diseño del estudio, el análisis y la interpretación de los datos ni en la decisión de presentar el artículo para publicación.
CONTRIBUCIÓN DE LOS AUTORESJ. Núñez y A. Bayés-Genís, conceptualización, análisis de los datos, metodología, investigación, visualización, gestión del proyecto, recursos, preparación del manuscrito y aprobación de la versión final del manuscrito. E. Revuelta-López, G. Miñana, E. Santas, J.M. ter Maaten, R. de la Espriella, Arturo Carratalá, M. Lorenzo, P. Palau, Pau Llàcer, A. Valle, V. Bodi, E. Núñez, J. Lupón, C. Lang, L.L. Ng, M. Metra, J. Sanchis, A.A. Voors, obtención de los datos, análisis de los datos, investigación, metodología, visualización y aprobación de la versión final del manuscrito.
- –
Los primeros meses tras una hospitalización por ICA se caracterizan por un elevado riesgo de muerte y reingreso por ICA.
- –
En los pacientes ingresados por ICA, se ha observado que el CA125 es útil para la estratificación del riesgo.
- –
La mayor parte de las iniciativas de estratificación del riesgo se centran en identificar a los pacientes con mayor riesgo tras el alta, pero se hace menos hincapié en la identificación de aquellos con menos riesgo.
- –
La identificación de una población con riesgo bajo podría traducirse en una mejor asignación de los recursos después del alta.
- –
El empleo de un nuevo valor de corte del CA125 (< 23 U/ml, en vez del umbral convencional <35 U/ml) permitió identificar a pacientes con menores riesgos de mortalidad o de la combinación de mortalidad/reingreso por insuficiencia cardiaca a corto plazo 1 mes después del alta tras el ingreso por ICA.
- –
La capacidad predictiva de este valor de corte continuó siendo significativa a los 6 meses de seguimiento.
- –
La identificación de este nuevo valor de corte permite seleccionar a pacientes con riesgo bajo en la fase de transición tras el ingreso por ICA.
Los autores declaran que no tienen relaciones relevantes que declarar en relación con el contenido de este artículo.