El control actual de la concentración de colesterol unido a lipoproteínas de baja densidad en el paciente con enfermedad cardiovascular ateroesclerótica es muy escaso y esto se asocia con un aumento del riesgo de que se presenten complicaciones cardiovasculares. Además, cuanto más tarde se logren dichos objetivos, el riesgo será mayor. Esto se debe principalmente a un uso insuficiente de las terapias hipolipemiantes actualmente disponibles. De hecho, con los tratamientos actuales (estatinas, ezetimiba e inhibidores de la proteína PCSK9), la mayoría de los pacientes en prevención secundaria debería lograr los objetivos de control del colesterol unido a lipoproteínas de baja densidad. Por estos motivos, en el presente documento promovido por la Sociedad Española de Cardiología se proponen 3 algoritmos de abordaje sencillos y fácilmente aplicables, que abarcan la mayoría de las situaciones clínicas que nos podemos encontrar en los pacientes con cardiopatía isquémica, con el doble objetivo de lograr controlar a la mayoría de los pacientes y hacerlo lo antes posible, ya que el beneficio en prevención secundaria depende del riesgo y del tiempo.
Palabras clave
A pesar de los grandes avances en el diagnóstico y el tratamiento de la enfermedad cardiovascular (CV) de origen aterotrombótico que han ocurrido en los últimos años, los pacientes que la padecen siguen presentando una alta incidencia de recurrencias isquémicas1. Ello se debe, entre otros motivos, a la actual situación de falta de control de los factores de riesgo CV2, entre los cuales la hipercolesterolemia tiene una gran relevancia3. Una amplia base de evidencias ha demostrado que el exceso de colesterol sanguíneo, y sobre todo del colesterol unido a lipoproteínas de baja densidad (cLDL) y al conjunto de lipoproteínas que contienen apolipoproteína B, representadas por el valor del colesterol no unido a lipoproteínas, son una causa fundamental de enfermedad CV ateroesclerótica4,5. En el mismo sentido, la disminución con fármacos hipolipemiantes del cLDL y el colesterol no unido a lipoproteínas de alta densidad tiene una alta eficacia para prevenir tanto los primeros episodios de enfermedad CV ateroesclerótica como sus recurrencias4,6. Los ensayos clínicos con fármacos para disminuir el colesterol aterogénico, con estatinas7, estatinas combinadas con ezetimiba8, e inhibidores de la proteína PCSK9, han demostrado de forma fehaciente que cuanto más bajo es el valor de cLDL conseguido con el tratamiento9, mayor es el efecto preventivo de la enfermedad CV ateroesclerótica. De hecho, no se ha identificado un valor umbral por debajo del cual el descenso del cLDL deje de asociarse con una reducción del riesgo CV, incluso con valores de cLDL <30mg/dl10,11, como tampoco se han observado efectos negativos para la salud relacionados con estas bajas concentraciones12, si bien son necesarios estudios a más largo plazo. Los estudios de fisiología celular y orgánica, de aleatorización mendeliana, los casos de enfermedades genéticas raras que cursan con concentraciones muy bajas de cLDL desde el nacimiento y los datos derivados de los ensayos clínicos muestran que, aun con concentraciones muy bajas de cLDL, se mantienen las funciones fisiológicas relacionadas con el metabolismo del colesterol y no hay mayor riesgo de enfermedad13.
Ante las mencionadas evidencias, las guías de prevención CV están fijando unos objetivos de control del colesterol aterogénico para los pacientes con enfermedad CV ateroesclerótica cada vez más estrictos y adaptados a distintos condicionantes de riesgo, entre ellos diferentes variables de gravedad de la enfermedad CV ateroesclerótica y la existencia de comorbilidades y otros factores de riesgo CV asociados14. Las guías también destacan la urgencia con que dichos objetivos han de lograrse, ya que cuanto antes se consiguen, mayor es el beneficio preventivo15. Así, con referencia al cLDL del paciente con enfermedad CV ateroesclerótica, cabe aplicar el aforismo «cuanto más bajo y cuanto antes, mejor». En este sentido, la Sociedad Europea de Cardiología recomienda que los pacientes con síndrome coronario agudo (SCA) inicien lo antes posible un tratamiento con estatinas de alta potencia y ello con independencia de los valores de cLDL del paciente16.
A pesar de lo comentado, los estudios de práctica clínica diaria siguen mostrando que la mayoría de los pacientes con enfermedad CV ateroesclerótica no alcanzan los objetivos terapéuticos de los principales factores de riesgo CV. Así, en el reciente estudio EUROASPIRE V, solo un tercio de los pacientes coronarios estaban en objetivos del cLDL2,17. Esta situación deficitaria se debe, entre otras razones, a que una proporción significativa de facultativos no prescriben los tratamientos hipolipemiantes de la intensidad suficiente o actúan con cierta inercia a la hora de ajustar la intensidad del tratamiento cuando no se alcanzan los objetivos, pero también a problemas de cumplimiento terapéutico por parte de los pacientes18. La falta de consecución de objetivos lipídicos es preocupante porque se relaciona directamente con la alta incidencia de recurrencias de la enfermedad CV ateroesclerótica y conlleva un alto coste económico y social19,20. Por lo tanto, es necesario conseguir que el personal sanitario por un lado y los propios pacientes por el otro hagan un uso adecuado de los recursos terapéuticos disponibles.
El presente documento se ha realizado con el objetivo de facilitar la consecución de los objetivos de cLDL al paciente con enfermedad CV ateroesclerótica lo antes posible. En el documento se presta especial atención a la valoración precisa del riesgo CV, a la definición de los objetivos de cLDL y del tratamiento hipolipemiante más adecuado para lograrlos, tanto en el contexto de la enfermedad coronaria aguda como en el de la crónica. No se trata, por lo tanto, de elaborar una guía de práctica clínica, sino de realizar una aproximación práctica para mejorar el control de cLDL en nuestro medio. Este documento ha sido promovido por la Sociedad Española de Cardiología y está avalado por las 3 secciones de la Sociedad Española de Cardiología más directamente implicadas en este tema (Sección de Cardiología Clínica, Sección de Riesgo Vascular y Rehabilitación Cardiaca y Sección de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares).
MÉTODOS Y JUSTIFICACIÓN DE LOS ALGORITMOSEn el presente trabajo, tras el análisis de las evidencias provenientes de los distintos ensayos clínicos por un grupo de expertos en el campo de la hiperlipemia de diferentes ámbitos clínicos (cardiología, atención primaria, unidades de lípidos), se proponen varios algoritmos de abordaje del tratamiento hipolipemiante con el objetivo de lograr los objetivos de control del cLDL en el menor tiempo posible para el paciente con cardiopatía isquémica, independientemente del médico que atienda al paciente (cardiólogos, internistas, médicos de atención primaria, etc.) y del ámbito asistencial (hospital o consulta). Se han dividido en 2 grandes contextos clínicos, el agudo (hospitalización por SCA y primer año tras un infarto de miocardio y/o la revascularización coronaria) y el crónico (más de 1 año tras el SCA, la revascularización coronaria percutánea o quirúrgica o la angina estable no revascularizada).
En ambos escenarios clínicos se siguió la misma dinámica, dividida en 6 pasos: valoración del riesgo CV del paciente, tratamiento previo con estatinas, si está tomando la dosis máxima tolerada de estatina, niveles de cLDL en el momento de atender al paciente, opciones terapéuticas posibles para conseguir los objetivos de cLDL en ese momento, y alternativas terapéuticas si no se controla a las 4-6 semanas en los escenarios agudo y crónico de riesgo extremo y 4-8 semanas en el escenario crónico de riesgo CV muy elevado.
Siguiendo las recomendaciones realizadas por la Asociación Americana de Endocrinólogos Clínicos en 2017 y 2019, a los pacientes con cardiopatía isquémica se los ha dividido en 2 grupos, riesgo CV extremo y riesgo CV no extremo (o muy elevado) en función de sus características clínicas21,22. Sin embargo, a raíz de la evidencia proveniente de recientes estudios8,11,23,24, se ha ampliado el grupo de pacientes pertenecientes a la categoría de riesgo CV extremo (aunque no todos los pacientes con un riesgo CV extremo tienen el mismo riesgo de sufrir nuevos eventos CV, todos los pacientes incluidos en esta categoría tienen un riesgo mayor que los incluidos en la categoría de riesgo CV muy elevado). Los pacientes con cardiopatía isquémica que no cumplan ninguna de las características incluidas en la categoría de riesgo extremo serán considerados como con riesgo CV muy elevado (tabla 1).
Pacientes con cardiopatía isquémica y riesgo cardiovascular extremo o muy elevado
| Riesgo CV extremo | • Diabetes• Enfermedad renal crónica (estadios 3b A2-A3 o 4)• Enfermedad vascular ateroesclerótica a otro nivel (clínica o documentada por imagen de manera inequívoca)• ≥ 2 infartos de miocardio previos• Infarto de miocardio en los 2 años previos• Afectación de ≥ 2 vasos coronarios (enfermedad multivaso), independientemente de revascularización• Cirugía de revascularización coronaria previa• SCA en paciente joven (varón <55 años, mujer <65 años)• Progresión de enfermedad CV (clínica o documentada por técnicas de imagen) pese a estar en objetivos*• Hipercolesterolemia familiar• Lipoproteína (a) >180 mg/dl |
| Riesgo CV no extremo (muy elevado) | • Si no cumple ninguna de las características anteriores |
CV: cardiovascular; SCA: síndrome coronario agudo.
En cuanto a los objetivos de cLDL, tanto en el escenario agudo como en el crónico de pacientes con un riesgo CV extremo, se ha considerado un valor de cLDL <55 mg/dl. Los motivos para defender esta reducción del objetivo se basan en los resultados de los siguientes estudios: en el estudio IMPROVE-IT (pacientes tras un SCA)8, en comparación con el grupo de simvastatina 40mg (cLDL, 69,5mg/dl), el tratamiento intensivo con la combinación de simvastatina 40mg y ezetimiba 10mg (cLDL, 53,7mg/dl) se asoció con una reducción significativa de los eventos CV. En un metanálisis de 8 ensayos clínicos en el que se incluyó a 38.153 pacientes asignados al tratamiento con estatinas, los sujetos que sufrieron menos eventos CV fueron los que lograron cifras de cLDL <50mg/dl7. Incluso los recientes estudios con inhibidores de la PCSK9 lograron objetivos de cLDL más estrictos. Así, en el estudio FOURIER (pacientes con enfermedad CV ateroesclerótica)23, en el brazo de evolocumab la mediana de cLDL fue de 30mg/dl, mientras que en el estudio ODYSSEY (pacientes con SCA en el año previo)11, en el brazo de tratamiento con alirocumab la reducción inicial de cLDL alcanzó los 38 mg/dl, si bien por el diseño del estudio subió hasta 53 mg/dl al final del seguimiento. En ambos estudios los inhibidores de la PCSK9 produjeron reducciones adicionales de los eventos CV añadidos al tratamiento estándar de los pacientes con cardiopatía isquémica11,23. En el contexto crónico, para los pacientes que no tienen un riesgo CV extremo, se ha decidido mantener el objetivo de cLDL <70mg/dl, si bien cuando el paciente sufra un nuevo evento CV con cLDL entre 70 y 135mg/dl, en especial el pretratado con estatinas, se debería buscar reducir el cLDL en al menos un 50%25.
Para la elección del tratamiento hipolipemiante más adecuado y estimar la capacidad para reducir el cLDL de cada opción terapéutica, se siguieron las recomendaciones realizadas por Masana et al.26–28 y recientemente refrendadas por la Sociedad Española de Aterosclerosis29, si bien se han hecho algunas matizaciones (tabla 2)30. Aunque las mayores evidencias del beneficio CV de reducir el cLDL provienen de los ensayos clínicos con estatinas (frente a la combinación de estatinas con ezetimiba y los inhibidores de la PCSK9), se ha primado conseguir los objetivos de cLDL lo antes posible con los tratamientos hipolipemiantes actualmente disponibles y con demostrado beneficio CV8,11,23.
Clasificación de la terapia hipolipemiante según su eficacia terapéutica para reducir el cLDL
| Intensidad de reducción de cLDL | Alternativas terapéuticas |
| Reducción extrema (76-85%) | Tratamiento hipolipemiante máximo de base más inhibidores de PCSK9*:• Evolocumab 140 mg (∼85%)• Alirocumab 75 mg (∼76%)• Alirocumab 150 mg (∼85%) |
| Reducción muy elevada (60-75%) | Estatinas potentes+ezetimiba:• Atorvastatina 40-80 mg+ezetimiba 10 mg• Rosuvastatina 10-40 mg+ezetimiba 10 mg |
| Reducción elevada (50-59%) | Estatina alta potencia:• Atorvastatina 40-80 mg• Rosuvastatina 20-40 mgEstatina potencia intermedia+ezetimiba:• Simvastatina 20-40 mg+ezetimiba 10 mg• Pravastatina 40 mg+ezetimiba 10 mg• Lovastatina 40 mg+ezetimiba 10 mg• Fluvastatina 80 mg+ezetimiba 10 mg• Pitavastatina 2-4 mg+ezetimiba 10 mg• Atorvastatina 10-20 mg+ezetimiba 10 mg• Rosuvastatina 5 mg+ezetimiba 10 mg |
| Reducción moderada (30-49%) | Estatina de potencia intermedia:• Atorvastatina 10-20 mg• Rosuvastatina 5-10 mg• Simvastatina 20-40 mg• Pravastatina 40 mg• Lovastatina 40 mg• Pitavastatina 2-4 mg• Fluvastatina XL 80 mgEstatina baja potencia+ezetimiba:• Simvastatina 10 mg+ezetimiba 10 mg• Pravastatina 20 mg+ezetimiba 10 mg• Lovastatina 20 mg+ezetimiba 10 mg• Fluvastatina 40 mg+ezetimiba 10 mg• Pitavastatina 1 mg+ezetimiba 10 mg |
cLDL: colesterol unido a lipoproteínas de baja densidad.
Ahora bien, antes de plantear cualquier modificación terapéutica, es imprescindible valorar la adherencia al tratamiento e insistir en su importancia para la consecución de los objetivos. Por otra parte, y aunque no debería retrasar la decisión de intensificar el tratamiento hipolipemiante, ante todo paciente con enfermedad CV ateroesclerótica habría que insistir en la dieta adecuada y la práctica regular de actividad física1,6,14,15,25.
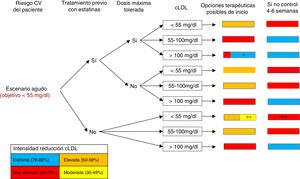
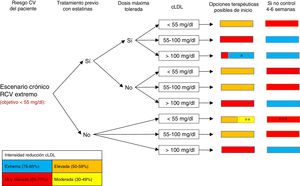
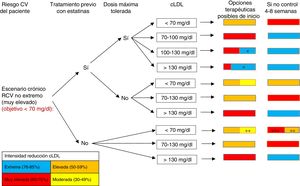
FORMA DE INTERPRETAR LOS ALGORITMOSTeniendo en cuenta los diferentes escenarios clínicos en el paciente con cardiopatía isquémica y el riesgo CV (extremo y no extremo), en este documento se presentan 3 algoritmos diferentes: escenario agudo, escenario crónico de pacientes con un riesgo CV extremo y escenario crónico de pacientes con un riesgo CV no extremo o muy elevado (figura 1, figura 2 y figura 3). La manera de interpretarlos es similar en todos ellos. En la primera columna se identifica el riesgo CV del paciente (extremo frente a no extremo/muy elevado), y con el riesgo CV, el objetivo de cLDL. La segunda y la tercera columnas se centran en el tratamiento hipolipemiante que estuviese tomando el paciente en el momento de la consulta, tanto si tomaba estatinas como si estas eran a las dosis máximas toleradas. En la cuarta columna se incluyen los valores de cLDL en el momento de atender al paciente. Considerando todos estos datos, y valorando la capacidad de los diferentes tratamientos hipolipemiantes para reducir el cLDL mostrados en la tabla 2, en la quinta columna se realiza una serie de recomendaciones de modificación del tratamiento hipolipemiante en el momento de atender al paciente con el objetivo de que la mayoría de los pacientes logren en el menor tiempo posible los objetivos de cLDL. Para facilitar la interpretación de dicha columna, se ha optado por un código de colores, que se corresponde con el de la tabla 2 (rojo: tratamiento hipolipemiante de muy alta intensidad; naranja: tratamiento hipolipemiante de alta intensidad; amarillo: tratamiento hipolipemiante de intensidad media; azul: añadir inhibidores de la PCSK9). En algunos recuadros aparecen 2 colores, ya que se ha considerado que en algunas situaciones específicas se podría optar por 2 opciones terapéuticas válidas (el tamaño que ocupa cada color en el recuadro se corresponde aproximadamente con la probabilidad de lograr los objetivos de cLDL con cada opción). Por otra parte, cuando se requiera una gran reducción de cLDL (50-59%), se podrá optar por emplear estatinas a dosis máximas o emplear estatinas de potencia intermedia junto con ezetimiba, dependiendo de las características de cada paciente (tratamiento previo con estatinas e intensidad de este, posibilidad de efectos adversos con dosis máximas de estatinas, etc.). Consideramos que, tras 4-6/8 semanas de inicio del tratamiento (dependiendo del escenario), habría que repetir una analítica sanguínea, y si no se han alcanzado los objetivos de control de cLDL, habría que intensificar el tratamiento (sexta columna). También se ha empleado el mismo código de colores de la tabla 2 para esta columna. En cambio, si se han alcanzado los objetivos de cLDL, los controles deberían espaciarse.
Algoritmo para el abordaje del tratamiento hipolipemiante. Escenario agudo. cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular. *Población en la que habría que valorar si agregar anti-PCSK9, si se considera que la simple asociación con ezetimiba no logrará los objetivos (individualizar según cLDL y características del paciente). **Considerar estatinas de moderada intensidad en pacientes ancianos, frágiles o con contraindicaciones para el empleo de estatinas de alta intensidad. ***Si no se ha conseguido una reducción ≥ 50% de cLDL.
Algoritmo para el abordaje del tratamiento hipolipemiante. Escenario crónico: paciente con riesgo cardiovascular extremo. cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular; RCV: riesgo cardiovascular. *Población en la que habría que valorar si agregar anti-PCSK9, si se considera que la simple asociación con ezetimiba no logrará los objetivos (individualizar según cLDL y características del paciente). **Considerar estatinas de moderada intensidad en pacientes ancianos, frágiles o con contraindicaciones para el empleo de estatinas de alta intensidad. ***Si no se ha conseguido una reducción ≥ 50% de cLDL.
Algoritmo para el abordaje del tratamiento hipolipemiante. Escenario crónico: pacientes con riesgo cardiovascular no extremo (muy elevado). cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular; RCV: riesgo cardiovascular. *Población en la que habría que valorar si agregar anti-PCSK9, si se considera que la simple asociación con ezetimiba no logrará los objetivos (individualizar según cLDL y características del paciente). **Considerar estatinas de moderada intensidad en pacientes ancianos, frágiles o con contraindicaciones para el empleo de estatinas de alta intensidad. ***Si no se ha conseguido una reducción ≥ 50% de cLDL.
El estudio REPAR ha demostrado que, en las consultas de cardiología en España, el control de cLDL es muy deficitario (26%) y que esto se debe principalmente a una infrautilización de las terapias hipolipemiantes actualmente disponibles (solo el 45% de los pacientes estaban tratados con estatinas de alta intensidad y el 14% con ezetimiba). Además, la inercia terapéutica es muy frecuente, ya que no se intensificaba el tratamiento en el 70% de los casos de control insuficiente31. Y eso a pesar de la evidencia científica tan importante sobre el beneficio CV del tratamiento hipolipemiante, tanto en el empleo de estatinas de alta intensidad, como la atorvastatina, que tiene indicación específica en la prevención de la enfermedad CV, como con la combinación con ezetimiba32. En consecuencia, se hace necesario tomar medidas para romper esta tendencia. Por ello, nos hemos planteado realizar estos algoritmos, con el objetivo de mejorar el control de la hiperlipemia en prevención secundaria en España de una manera sencilla, basándonos en las evidencias científicas actuales y abarcando la mayoría de las posibilidades que nos podemos encontrar ante un paciente con cardiopatía isquémica, tanto en el momento de la hospitalización por el SCA como durante el seguimiento del paciente en el ámbito ambulatorio.
La reducción del cLDL se asocia con reducción de los eventos CV, que es tanto mayor cuanto más bajas son las cifras de cLDL alcanzadas12. Estos beneficios se observan incluso en la población mayor de 75 años33. Sin embargo, a diferencia de lo que ocurre con otros factores de riesgo como la hipertensión arterial o la diabetes, no se ha observado una curva en J con el cLDL, esto es, una cifra por debajo de la cual reducir el cLDL comience a ser perjudicial8,11,23. Por lo tanto, en cuanto a los objetivos de cLDL, se han considerado unos objetivos más estrictos de cLDL (< 55mg/dl) para los pacientes con mayor riesgo CV, dado que, a la luz de la evidencia proveniente de diferentes estudios, un objetivo de cLDL <70mg/dl parece insuficiente para muchos de los pacientes con cardiopatía isquémica8,11,23.
Con respecto a la estratificación del riesgo CV, lo cierto es que en la práctica clínica hay tendencia a subestimarlo, y esto ocurre en todos los ámbitos asistenciales34. Esta situación es importante ya que, en el caso de la hiperlipemia, subestimar el riesgo CV conlleva tener unos objetivos de cLDL inadecuados y, por lo tanto, una insuficiente intensificación del tratamiento hipolipemiante25. En el presente documento se ha tratado de identificar de una manera sencilla a los pacientes con enfermedad CV ateroesclerótica que tienen un riesgo CV extremo, con el objetivo de poder optimizar el tratamiento hipolipemiante y así poder conseguir los objetivos marcados. Para el caso de la hipercolesterolemia familiar se ha desarrollado recientemente en España una ecuación específica de cálculo de riesgo35.
No solo es importante lograr los objetivos de cLDL, sino también la velocidad con que se logran dichos objetivos, de tal forma que cuanto antes se logren y cuanto más tiempo se mantengan los pacientes en objetivos, el beneficio será mayor5,36,37. Uno de los objetivos de los algoritmos propuestos es conseguir que el paciente alcance los objetivos de cLDL lo antes posible. Si no es con el cambio de tratamiento hipolipemiante en el momento de la consulta, sí en el siguiente paso, que no se debería retrasar más allá de las 4-6/8 semanas del primer cambio (según el escenario).
La evidencia actualmente disponible indica que el beneficio clínico en prevención CV no depende tanto del tipo de tratamiento hipolipemiante como del grado de reducción del cLDL al que se llega con dicho tratamiento, pasando de un concepto de empleo de estatinas de alta intensidad a empleo de terapia hipolipemiante de alta intensidad38. Así, el tipo de tratamiento hipolipemiante a emplear se debe adaptar al objetivo de cLDL que se espera alcanzar en un paciente determinado. En este sentido, en las columnas de tratamiento de la tabla 2 se han incluido las diferentes opciones terapéuticas hipolipemiantes con demostrado beneficio CV en prevención secundaria8,11,23, así como la manera de combinarlos, dependiendo de las cifras de cLDL por alcanzar y del tratamiento hipolipemiante previo que llevase el paciente, con el doble objetivo de conseguir las cifras de cLDL recomendadas y en el menor tiempo posible.
Un grupo francés ha publicado recientemente una propuesta con un objetivo parecido, que si bien no ha incluido las últimas evidencias sobre los inhibidores de la PCSK9 ni recomendaciones más allá de las 4-6/8 semanas tras el alta por un SCA15, ha conseguido mejorar el control de cLDL mediante la intensificación del tratamiento hipolipemiante (el 91% de los pacientes estaban tomando estatinas de alta intensidad, el 62% en combinación con ezetimiba, y hasta un 77% logró el objetivo de cLDL <70 mg/dl)39. Es previsible, por lo tanto, que con la aplicación de los algoritmos propuestos en este manuscrito se consigan altas tasas de control del cLDL del paciente con cardiopatía isquémica en los diferentes contextos clínicos y, de manera secundaria, una reducción del riesgo de que se produzcan nuevos eventos CV. Sin embargo, son necesarios estudios específicos que analicen desde un punto de vista de coste-efectividad la aplicación de estos algoritmos en la práctica clínica.
CONCLUSIONESUna prevención secundaria óptima incluye cambios en el estilo de vida con la incorporación de los pacientes a programas de rehabilitación cardiaca, la consecución de objetivos de control de los diferentes factores de riesgo y el empleo de fármacos e intervenciones de reconocido beneficio pronóstico. Aunque es bien conocido que reducir las cifras de cLDL se asocia con un descenso marcado del riesgo de eventos CV, la realidad es que, pese a tener herramientas suficientes para conseguir un control adecuado en la mayoría de los sujetos con cardiopatía isquémica, la mayoría de ellos no logran los objetivos de control establecidos. Si bien esta situación es preocupante en la población con hiperlipemia en general, aún lo es más en el paciente en prevención secundaria. Por estos motivos, desde la Sociedad Española de Cardiología se ha planteado la creación de unos algoritmos de abordaje sencillos y fácilmente aplicables, que abarquen la mayoría de las situaciones clínicas en prevención secundaria.
FINANCIACIÓNEste documento se ha realizado con una beca no condicionada de MSD y Amgen, aunque no intervinieron en modo ni momento alguno en el desarrollo del presente consenso. La opinión y las recomendaciones de los expertos son independientes de dicha financiación.
CONFLICTO DE INTERESESC. Escobar ha recibido honorarios por consultoría y/o ponencias de MSD, Amgen, Mylan, Sanofi, Almirall, Recordati y Esteve. M. Anguita ha recibido honorarios por consultoría y/o ponencias de Amgen y MSD. V. Arrarte ha recibido honorarios por consultoría y/o ponencias de Amgen, Sanofi, MSD, Ferrer, Servier, Pfizer, Esteve y Rovi. V. Barrios ha recibido honorarios por consultoría y/o ponencias de MSD, Amgen, Mylan, Sanofi, Almirall, Recordati, Rovi, Pfizer y Esteve. Á. Cequier ha recibido honorarios por consultoría y/o ponencias de Abbott Vascular, Biosensors, Amgen, Bayer, Biotronik, Boehringer Ingelheim, Ferrer International, Sanofi y Medtronic. J. Cosín-Sales ha recibido honorarios por consultoría y/o ponencias de MSD, Amgen, Ferrer, Mylan, Sanofi y Esteve. E. López de Sa ha recibido honorarios por consultoría y/o ponencias de Sanofi y MSD. L. Masana ha recibido honorarios por consultoría y/o ponencias de Amgen, Sanofi, Daichii/Sankyo, Mylan, Servier y MSD. V. Pallarés ha recibido honorarios por consultoría y/o ponencias de MSD, Almirall, Servier y Esteve. L. Pérez de Isla ha recibido honorarios por consultoría y/o ponencias de Sanofi, MSD y Amgen. X. Pintó ha recibido honorarios por consultoría y/o ponencias de Mylan, Amgen, Sanofi, Esteve, Ferrer, Servier y Rubió. El resto de los autores no tienen conflicto de intereses.