Las posibilidades actuales de la cardiología nuclear hacen posible elegir entre múltiples opciones de técnicas y protocolos de esfuerzo o estrés farmacológico, adquisición y procesamiento de las imágenes, en el campo del diagnóstico y pronóstico de la cardiopatía isquémica y en la valoración de la viabilidad miocárdica.
En el presente capítulo se presenta una descripción de dichas técnicas y protocolos, y se realizan una serie de recomendaciones sobre la presentación de los informes, adaptados a nuestro medio.
Palabras clave
Hay diferentes maniobras para provocar isquemia en el contexto de la tomografía computarizada por emisión de fotón único (SPECT) sincronizada de perfusión miocárdica pero, en general, y si el paciente es capaz de ejercitarse hasta al menos un 80-85% de la frecuencia cardiaca máxima prevista, se prefiere la realización de alguna forma de esfuerzo físico1.
Sin embargo, la valoración previa del paciente permite la elección de la forma más adecuada de estrés, pudiéndose optar por las siguientes alternativas:
- —
Prueba de esfuerzo en tapiz rodante o en bicicleta ergométrica2.
- —
Prueba farmacológica con vasodilatadores (dipiridamol o adenosina) o inotrópicos (dobutamina).
- —
Prueba de esfuerzo más fármacos (dipiridamol o adenosina).
Durante el ejercicio físico se pretende reproducir una situación de estrés que desestabilice el equilibrio oferta- demanda de O2 coronario que, en reposo y a pesar de la presencia de una enfermedad coronaria, puede estar compensado.
Se ha demostrado que el flujo coronario en reposo no está afectado hasta estenosis superiores al 75% de la luz coronaria. Ahora bien, el flujo coronario máximo y la reserva coronaria empiezan a disminuir de forma apreciable a partir de estenosis del 30-45%3. El flujo coronario máximo y la reserva coronaria pueden valorarse mediante la práctica de pruebas de esfuerzo y a través de la administración de fármacos que produzcan vasodilatación coronaria.
La prueba de esfuerzo permite valorar también el consumo máximo de O2 (VO2), que representa la cantidad de O2 transportada y utilizada por el metabolismo celular de una persona cuando realiza un ejercicio dinámico en el que utiliza la mayor parte de su masa muscular y que, en condiciones basales, es de 3,5 ml de O2 por kilogramo de peso y minuto, que equivale a una unidad metabólica (MET). Cuando se realiza una prueba de esfuerzo es fundamental valorar el nivel de consumo de O2 (MET) alcanzado4. El consumo miocárdico de O2 (MO2), a pesar de que está relacionado con el anterior, tiene otros determinantes y, aunque su cuantificación exacta requiere la colocación de catéteres en la arteria coronaria y el seno coronario, desde un punto de vista práctico puede valorarse a través del producto entre la frecuencia cardiaca y la presión arterial sistólica máximas. Con la práctica de ejercicio físico o mediante pruebas farmacológicas (dobutamina) se pretende aumentar este producto entre frecuencia cardiaca y presión arterial y, con ello, la demanda miocárdica de O2, con lo que puede ponerse de manifiesto la presencia de una isquemia miocárdica que en condiciones basales no era detectable.
Ahora bien, también es posible expresar el desequilibrio de perfusión entre diferentes regiones miocárdicas a través de la valoración de la reserva miocárdica. Esto puede conseguirse con la administración de potentes fármacos vasodilatadores coronarios, como el dipiridamol5 o la adenosina6. Este aspecto tiene un enorme interés práctico en los pacientes que no pueden practicar una prueba de esfuerzo convencional. En estos casos, aunque no se logre aumentar significativamente el valor del producto de la frecuencia cardiaca máxima por la presión arterial sistólica máxima, se produce un notable incremento de flujo en las regiones miocárdicas irrigadas por coronarias sanas, en contraste con el escaso o nulo aumento conseguido en los segmentos dependientes de coronarias con estenosis fijas.
Desde el punto de vista diagnóstico, hay dos criterios básicos que deben valorarse durante una prueba de esfuerzo clásica: uno es clínico, la aparición de angina, y el otro electrocardiográfico, la presencia de cambios en la repolarización indicativos de isquemia miocárdica7,8. En general, estos cambios son del tipo de la isquemia subendocárdica (descenso del segmento ST), de modo que una prueba de esfuerzo se considera positiva electrocardiográficamente si hay un desnivel del segmento ST > 0,1 mV a 0,08 segundos del punto J. El segmento ST suele ser horizontal o descendente en los casos con una clara respuesta electrocardiográfica positiva. Siguiendo estos criterios, la sensibilidad y la especificidad de la prueba de esfuerzo son del 68 y el 77%, respectivamente, calculadas en 24.047 pacientes correspondientes a 147 series9.
Las dificultades para interpretar una prueba de esfuerzo se deben, por una parte, a la depresión ascendente del segmento ST puesto que, aunque el ascenso sea lento, en muchos casos, alcanza 0,05-0,1 mV de infradesnivel a 0,08 segundos del punto J y su interpretación es equívoca o indeterminada y, por otra, cuando no se observan cambios electrocardiográficos con una taquicardización insuficiente. De forma arbitraria se considera que para considerar una prueba de esfuerzo como electrocardiográficamente negativa es necesario alcanzar como mínimo una taquicardización del 85% respecto a la máxima teórica según la edad, sin que aparezcan criterios de positividad en el electrocardiograma (ECG); sin embargo, en los casos de pruebas de esfuerzo gammagráficas, una taquicardización del 80% parece ofrecer también valores predictivos suficientemente adecuados1.
Desde el punto de vista pronóstico, es básica la valoración de la capacidad funcional del paciente y del momento de aparición de la sintomatología o de los cambios isquémicos en el ECG.
Las complicaciones de la prueba de esfuerzo son raras si se tienen siempre presentes las contraindicaciones de ésta8; de todos modos, la prueba de esfuerzo debería ser realizada por personal sanitario suficientemente cualificado, con un adecuado entrenamiento y un conocimiento adecuado de la fisiología del ejercicio. Equipamiento, medicación y personal entrenado para proveer resucitación cardiopulmonar avanzada deben estar disponibles rápidamente10.
Preparación del paciente- —
No fumar ni comer durante 3 horas antes de la prueba (se puede beber agua).
- —
Ropa y calzado adecuados.
- —
No realizar ejercicio físico intenso al menos 12 horas antes de la prueba.
- —
Si la prueba se realiza con propósitos diagnósticos se deben suspender los medicamentos que atenúen la respuesta al ejercicio y limiten su interpretación (especialmente betabloqueantes y calcioantagonistas). Igual precaución debe tomarse en el caso de un estrés farmacológico con dobutamina, debiendo suspenderse estos fármacos 24 horas antes de la prueba, siempre que esto sea posible.
- —
Los pacientes en los que se realice una prueba con dipiridamol o adenosina deberán abstenerse 24 horas antes de la prueba de consumir alimentos, bebidas y fármacos que contengan cafeína, aminofilina, teofilina y dipiridamol.
- —
Realizar una breve historia clínica y un examen físico para descartar contraindicaciones a la prueba y detectar signos clínicos importantes como soplos, ritmo de galope, sibilancias o crepitantes pulmonares.
- —
Brindar una detallada explicación de la prueba, subrayando los riesgos y las posibles complicaciones; se debe instruir al paciente sobre cómo realizar la prueba. Si hubiera limitaciones musculares esqueléticas u ortopédicas, el protocolo debería ser modificado a favor de un estrés con fármacos.
- —
Es recomendable cumplimentar el consentimiento informado (anexo 1).
Las pruebas de esfuerzo sobre tapiz rodante y en bicicleta ergométrica (en posición ortostática) son las más empleadas. Son las dos pruebas prototipo de ejercicio dinámico aunque, en realidad, la mayor parte de las pruebas de esfuerzo consisten en formas mixtas de ejercicio dinámico e isométrico, ya que presentan una ventaja clara sobre las pruebas isométricas: la respuesta cardiovascular puede graduarse con más facilidad y el producto frecuencia cardiaca máxima por presión arterial sistólica (PAS) máxima alcanzado es siempre superior.
Hay diferentes protocolos ergométricos con el tapiz rodante que varían en la velocidad, la pendiente y la duración de cada etapa. En general, reciben la denominación de protocolos «tipo Bruce» aquellos en los que se va modificando la pendiente y la velocidad cada 3 minutos, mientras que en los protocolos «tipo Balke» la velocidad es siempre constante y sólo varía la inclinación del tapiz.
Con la bicicleta ergométrica es posible adoptar diferentes grados de carga, así como incrementos de ésta y de la duración de las fases, aunque en general es recomendable que la duración de cada una de ellas no sea inferior a los 2 minutos con la finalidad de que se equilibren la frecuencia cardiaca y la presión arterial. Habitualmente se empieza con una carga entre 50 y 75 vatios, dependiendo de la capacidad física del individuo, y se van incrementando 25 vatios cada 2 o 3 minutos.
Desde el punto de vista diagnóstico siempre se realizan pruebas denominadas «máximas subjetivas» o «limitadas por síntomas» en las que se alcanza el máximo grado de esfuerzo posible hasta el agotamiento físico o la aparición de síntomas. Desde un punto de vista pronóstico, por ejemplo después de un infarto agudo de miocardio, pueden indicarse pruebas de esfuerzo denominadas «submáximas» en las que arbitrariamente se prefija el momento de la finalización del esfuerzo físico, ya sea a través de un determinado grado de taquicardización (p. ej., el 70% de la frecuencia cardiaca máxima teórica) o del consumo de O2 (p. ej., 4–5 MET).
Cuando se realiza la SPECT de perfusión miocárdica puede practicarse cualquier tipo de ejercicio dinámico máximo, debiendo inyectarse el radiofármaco por una vena antecubital previamente canalizada, entre 30 y 60 segundos antes de finalizar el esfuerzo y continuándose éste durante 30–60 segundos.
Estrés farmacológicoEs una buena alternativa al ejercicio dinámico cuando el paciente es incapaz de realizar esfuerzo físico, y es una forma de estrés fiable y reproducible aunque no equivalente a la estrés fisiológico que experimenta el paciente en su vida diaria11.
En general, se recomienda realizar el estrés farmacológico con vasodilatadores (dipiridamol o adenosina) en pacientes con bloqueo de la rama izquierda del haz de His o portadores de marcapasos12, debido a la presencia de falsos positivos en el septo que aparecen con el ejercicio. Algunos autores, sin embargo, postulan el uso de esfuerzo en estos pacientes y subrayan la aparición de defectos apicales como específicos de la etiología coronaria13. La sobrecarga con dobutamina es una buena alternativa cuando hay contraindicaciones al dipiridamol o la adenosina; el uso de otros agentes farmacológicos como inductores de isquemia es actualmente anecdótico, por lo que su descripción queda fuera del alcance de esta revisión.
Protocolos de estrés con fármacosDipiridamol y adenosinaLa administración endovenosa de dipiridamol asociada con la práctica de una SPECT de perfusión miocárdica se utiliza desde el año 1978 con buenos resultados14–16 en los pacientes que no pueden realizar una prueba de esfuerzo convencional o en aquellos en los que está contraindicado el esfuerzo dinámico (aneurisma de aorta abdominal, hipertensión arterial severa), en los pacientes imposibilitados para realizar esfuerzo físico (arteriopatía obliterante de extremidades inferiores, mala capacidad física, enfermedades osteomusculares) y cuando hay dificultades en la interpretación del electrocardiograma de esfuerzo (bloqueo completo de rama izquierda del haz de His, marcapasos) o insuficiencia cronotrópica.
El aumento del flujo en las arterias coronarias sin lesiones con respecto a los vasos con estenosis es el motivo básico que permite detectar diferencias de perfusión en la gammagrafía miocárdica16,17.
Con la administración endovenosa de dipiridamol se producen ligeros incrementos del gasto cardiaco (33%) y la frecuencia cardiaca (20-40%), así como una discreta disminución (4-10%) de la presión arterial sistólica (PAS)17. El flujo coronario medio puede aumentar entre 3 y 5 veces su valor basal durante la administración de dipiridamol, en tanto que con el ejercicio físico este incremento es sólo 2-3 veces superior18.
La dosis empleada con más frecuencia es de 0,14 mg/kg/min durante 4 minutos, aunque parece que en uno de cada 6 pacientes no produce una máxima va- sodilatación19–21. Ésta podría conseguirse con la administración de 0,28 mg/kg suplementarios. Alrededor de un 12% de los pacientes con pruebas ecocardiográficas negativas con las dosis habituales puede responder a dosis de 0,84 mg/kg en 10 minutos21.
Los resultados de un estudio multicéntrico22 en el que participaron 59 hospitales de 19 países y en los que se utilizó dipiridamol endovenoso asociado con los estudios de perfusión miocárdica en 73.806 pacientes han puesto de manifiesto que el riesgo de efectos graves es bajo y similar al descrito en poblaciones de las mismas características con el esfuerzo. Sin embargo, la aparición de efectos indeseables con la administración de dipiridamol no es excepcional y hasta en un 30% de los pacientes se produce angina, en un 12% depresión del segmento ST, en un 11% cefalea y en un 10% sensación de mareo. La administración de aminofilina endovenosa (hasta 250 mg, a razón de 50 mg/min) es, en general, suficiente para el tratamiento de la angina. Se han descrito 2 muertes a causa de infarto de miocardio en pacientes con angina inestable después de la administración oral y endovenosa del fármaco, por lo que en los pacientes con angina en fase de inestabilidad está contraindicada la administración de dipiridamol, así como en los enfermos con broncopatía crónica obstructiva en los que se han descrito algunos casos de parada respiratoria.
El análisis de una serie de 17 estudios proporciona una sensibilidad del 89% y una especificidad del 75% en promedio para la sobrecarga farmacológica con dipiridamol y/o adenosina23, valores similares o incluso superiores a los de la prueba de esfuerzo aunque, es bueno recordarlo, a diferencia de esta última, el estrés farmacológico no permite valorar la capacidad funcional del paciente.
El efecto vasodilatador del dipiridamol es indirecto, puesto que el mediador directo de la dilatación coronaria es la adenosina endógena. Por este motivo, también se utilizan la adenosina24 y el adenosin-trifosfato (ATP)25,26 con resultados muy similares a los del dipiridamol asociado con la práctica de una gammagrafía miocárdica con talio-201 o con compuestos tecneciados27–29. El protocolo de administración consiste en la perfusión de una dosis endovenosa de 140 μg/kg/min durante 5–6 minutos, seguido de la administración del radionúclido al cabo de 3 minutos. La vida media de la adenosina es < 10 segundos, con lo que sus posibles efectos secundarios son rápidamente reversibles al detener la administración del fármaco.
Se han notificado efectos indeseables menores en 81% de casos de un estudio multicéntrico en el que se incluía a más de 9.000 pacientes30 en el que sólo se registró un infarto, 7 episodios de broncoespasmo severo y un edema pulmonar como complicaciones importantes. Se registraron 256 casos de bloqueo auriculoventricular de primer grado, 378 de segundo grado y 72 de tercer grado, aunque todos ellos fueron transitorios y se resolvieron espontáneamente. No hubo ningún caso de bloqueo auriculoventricular mantenido ni ningún fallecimiento.
DobutaminaLa infusión de dobutamina se utiliza habitualmente cuando no es posible realizar un ejercicio dinámico y hay contraindicaciones al dipiridamol o la adenosina31; se administra en perfusión continua, en etapas de 3 minutos, con dosis progresivamente crecientes, comenzando con 5 μg/min y continuando con 10, 20, 30 y 40 μg/kg/min. La frecuencia cardiaca y la presión arterial deben ser registradas al final de cada etapa y se debe realizar un control electrocardiográfico permanente; aunque los efectos secundarios son frecuentes, la prueba es relativamente segura, incluso en ancianos32. Los efectos secundarios no cardiacos más frecuentes, en un estudio de 1.118 pacientes33, fueron náuseas (8%), ansiedad (6%), cefalea (4%) y temblor (4%). La frecuencia de angina de pecho fue de un 20% y las arritmias más comunes fueron extra- sístoles ventriculares (15%), extrasístoles supraventriculares (8%), taquicardia supraventricular y taquicardia ventricular no sostenida (3-4%). El radiofármaco debe ser inyectado cuando se alcanzan el 85% de la frecuencia máxima teórica o la dosis máxima, y la infusión de dobutamina debe continuarse durante 1–2 minutos después de la inyección del radiofármaco. Se puede agregar 1 mg de atropina endovenosa si no se alcanza una adecuada taquicardización; los criterios para detener la infusión de dobutamina son los mismos que en el caso del ejercicio.
PROTOCOLOS DE ADQUISICIÓN DE LA SPECT DE PERFUSIÓN MIOCÁRDICAEn el diseño de los protocolos de uso clínico, los factores más importantes que se deben tener en cuenta son los siguientes: las características de emisión radiactiva del radionúclido empleado, que garantiza la calidad de la SPECT, y la biocinética del trazador34. En ello se fundamentan los intervalos entre inyección y detección, disponer de suficiente flujo fotónico para adquirir una gated-SPECT (gated-SPECT con la onda R del ECG), la posibilidad de repetir una detección, el requerimiento de una segunda dosis, la actividad de trazador que se va inyectar o la capacidad de realizar detecciones tardías. Estos protocolos deben adaptarse en cada centro en función de los equipos disponibles, gammacámaras de uno o 2 cabezales, 2 cabezales adyacentes a 90°, disponibilidad de corrección de la atenuación o equipos híbridos SPECT/TC35 (SPECT/tomografía computarizada).
El talio-201 es un radionúclido análogo del potasio que fue el primero que se empleó tanto para el diagnóstico como para la valoración de viabilidad. Tras la captación inicial flujo-dependiente, el talio redistribuye su actividad para conseguir el equilibrio entre las concentraciones intracelular (miocito) y endovascular, situación que se consigue en 3–4 horas.
Los trazadores tecneciados, 99mTc-MIBI (metoxiisobutil-isonitrilo) y tetrofosmina, son fijados a las células en función de su actividad metabólica, predominantemente mitocondrial, y tienen un comportamiento parecido. Al no redistribuirse, como el talio, requieren una dosis para el estrés y otra para el reposo. Esto permite repetir la adquisición si hay artefactos, o realizar otra adquisición con perfusión continua de dobutamina (a razón de 5 μg/kg/min) para valorar la reserva contráctil.
Protocolos con talio-201 estrés/redistribuciónEl estudio de perfusión miocárdica con talio-201 se inicia con la inyección de 148 megabecquerels (MBq) del radiotrazador en el punto de máximo esfuerzo. La detección de las imágenes posteriores al estrés debe ser lo más precoz posible, sin demorarse más de 15 minutos, y es posible adquirirlas mediante gated-SPECT. Para la detección de las imágenes de redistribución deben esperarse 3–4 horas, y se recomienda no realizar ingesta de sólidos entre ambas detecciones. Hay diversas metodologías para aumentar la sensibilidad de la redistribución, encaminadas a facilitar la difusión del talio-201 a las zonas de miocardio con bajo flujo sanguíneo, ya sea con el aumento del aporte de talio-201 con una nueva dosis (37 MBq) tras la redistribución (reinyección)36 o demorando la detección en el tiempo (12–24 horas) (redistribución tardía), o ambas cosas a la vez35.
Protocolos con tecneciadosProtocolo largo en 2 días: esfuerzo/reposo o reposo/esfuerzoLos estudios de esfuerzo y reposo se realizan en días diferentes. La dosis administrada es la misma durante el esfuerzo y el reposo (740–900 Mbq), con lo que se obtendrán cifras de recuento similares en ambas imágenes, permitiendo adquirir ambos estudios mediante gated- SPECT. Es el método técnicamente más correcto con este tipo de radiotrazadores, dado que se evitan interferencias entre las dosis de esfuerzo y reposo. No obstante, presenta la incomodidad de hacer acudir al paciente 2 días diferentes y prolonga el tiempo total de exploración. Es recomendable realizar una ligera ingesta entre la administración del trazador y la obtención de imágenes para favorecer la eliminación hepatobiliar e incrementar el tránsito intestinal del trazador tecneciado y minimizar su interferencia en las imágenes37.
Protocolo corto en un día: esfuerzo/reposo o reposo/esfuerzoEl protocolo corto, en un día, tiene el inconveniente de que en la segunda detección se encuentra subyacente la actividad residual de la primera dosis (300 MBq). Para mitigar este efecto, la actividad administrada en la segunda dosis debe ser hasta 3 veces superior a la primera (900 MBq). Esta diferencia de actividades genera una cierta discrepancia entre la calidad de las imágenes obtenidas con la primera y la segunda dosis38. En nuestra experiencia, la diferencia en la tasa de cuentas producida por una y otra dosis debe ser corregida adaptando los tiempos de adquisición a cada una de las dosis inyectadas, por ejemplo, 25-30 segundos por imagen con la dosis menor y 18–22 segundos con la mayor, siempre con gated-SPECT en la dosis alta. El tiempo completo de la exploración puede reducirse a 2–3 horas, incluida la prueba de esfuerzo y los tiempos de espera de alrededor de 30–60 minutos entre la inyección y la detección en esfuerzo y reposo39.
Protocolos combinados: talio-201 en el reposo/tecneciado en el esfuerzoSon protocolos diseñados para aprovechar las diferentes cualidades de los trazadores, sobre la base de su diferente biocinética y energía de emisión fotónica: imagen en reposo con talio-201 para valorar la viabilidad y la imagen de esfuerzo con un tecneciado para incrementar la sensibilidad y, sobre todo, la especificidad en el diagnóstico de isquemia40. La dificultad radica al comparar imágenes de características muy diferentes correspondientes al talio-201 y a un trazador tecneciado. Es un protocolo muy corto, muy empleado en Estados Unidos, que se inicia con la inyección en reposo de talio- 201 y su detección con SPECT inmediata, tras la cual puede realizarse el esfuerzo y la inyección del tecneciado. La segunda detección tiene la demora habitual para estos trazadores de 30–60 minutos y suele adquirirse con gated-SPECT.
INTERPRETACIÓN DE LAS IMÁGENESPara una correcta interpretación de las imágenes es importante familiarizarse con las exploraciones normales, conocer las variaciones de la normalidad en función del sexo, de los estudios con y sin corrección de la atenuación, analizar de forma sistemática las características de los defectos de perfusión y tener en cuenta una serie de circunstancias, ya sea relacionadas con problemas técnicos en la adquisición de las imágenes o bien inherentes al propio paciente, que pueden conducir a un diagnóstico erróneo.
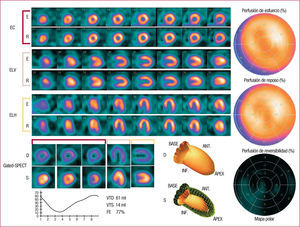
Análisis de las imágenesLa reconstrucción de los cortes tomográficos del corazón debe realizarse con una metodología adecuada al protocolo clínico realizado, ajustando el método de reconstrucción y los filtros empleados hasta obtener una imagen reconstruida de calidad. La presentación de los cortes reconstruidos está estandarizada, tal como se definió por consenso de la American Heart Association,la American College of Cardiology, la American Society of Nuclear Cardiology, la American Society of Nuclear Medicine y otras sociedades de imagen cardiaca41, presentándose tres tipos de planos principales de corte (fig. 1):
- 1.
El eje largo vertical, paralelo al septo interventricular y que sigue el eje largo del corazón. Estos cortes tienen forma de herradura y se presentan con la punta cardiaca hacia la derecha del observador, vistos desde la pared contraria al septo. La cara anterior queda en la parte superior y la diafragmática en la parte inferior.
- 2.
El eje largo horizontal, perpendicular al anterior y similar al de 4 cámaras de la ecocardiografía. Estos cortes también tienen forma de herradura y se presentan con el ápex en la parte superior de la imagen, el septo queda a la izquierda y la cara lateral a la derecha.
- 3.
El eje corto, perpendicular a los 2 anteriores. Estos cortes tienen forma redondeada y se observan desde la punta cardiaca hasta la base. El septo queda a la izquierda, la cara lateral a la derecha, la anterior arriba y la inferior, abajo.
Presentación de los cortes tomográficos postesfuerzo (E) y de reposo (R) de una gated-SPECT de perfusión miocárdica normal. A la derecha se observan los mapas polares de esfuerzo, reposo y reversibilidad, divididos en 17 segmentos. En la parte inferior se exponen los datos de la gated-SPECT, con los cortes en diástole (D) y sístole (S), la curva de volumen y los valores obtenidos, junto con la imagen 3D del contorno endocárdico en diástole y sístole. EC: eje corto; ELH: eje largo horizontal; ELV: eje largo vertical; FE: fracción de eyección; VTD: volumen telediastólico; VTS: volumen telesistólico.
Es importante revisar las imágenes adquiridas en la pantalla, ya sea en el formato de cine antes de procesarlas o presentándolas simultáneamente a los cortes, ya que ello permite detectar la presencia de artefactos42.
Gammagrafía de perfusión miocárdica normalEn una gammagrafía de perfusión normal, la captación del trazador es homogénea en todos sus cortes, tanto de esfuerzo como de reposo. Sin embargo, en algunas ocasiones, el número de cuentas puede estar disminuido en el ápex debido a que en esta zona el miocardio es más delgado. Cuando las imágenes no están corregidas por atenuación, la actividad en el septo suele ser algo menor que la de la pared lateral, y en su porción basal no capta debido a que se trata de una zona membranosa, como también ocurre en la cara inferior, que evidencia una menor captación que la cara anterior. En general también se identifica tenuemente la pared del ventrículo derecho, lo que facilita la valoración de su tamaño y, cuando la calidad de imagen lo permite, detectar la presencia de defectos de perfusión43.
La distribución normal de la actividad ventricular se reparte de forma algo distinta en varones y mujeres debido a la diferente distribución de las atenuaciones fisiológicas. En ambos sexos, la máxima captación se localiza en la pared lateral y la menor, en las regiones anterior e inferior. Al cuantificar la actividad ventricular mediante mapas polares hemos observado que en las mujeres no hay una diferencia significativa entre estos dos territorios, probablemente porque se equilibra la atenuación diafragmática con la mamaria, pero en los varones sí hay una significativa diferencia entre la región anterior e inferior, atribuible a la atenuación del diafragma y a la ausencia del efecto atenuador de la mama en la cara anterior. Estas diferencias tienden a desaparecer cuando se utilizan sistemas de corrección de la atenuación, que corrigen de forma individualizada la actividad procedente del ventrículo izquierdo44,45.
Antes de evaluar la posible presencia de defectos de perfusión, las imágenes tomográficas deben inspeccionarse de forma global, de forma que se obtenga una impresión respecto al tamaño de las cavidades, el grosor del miocardio y la relación de la captación miocárdica respecto a la de las estructuras vecinas.
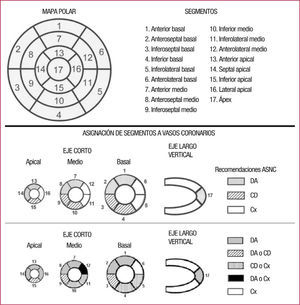
Asociación de territorios y vasos coronariosEs importante tener presente que hay variaciones individuales en la distribución de las arterias coronarias epicárdicas46,47, de forma que, aunque se asignan genéricamente territorios (o segmentos) a vasos coronarios, hay grandes variaciones individuales.
La arteria descendente anterior irriga la pared anterior, el septo y el ápex. La región inferior distal y la porción inferior del septo pueden estar irrigadas por la arteria descendente anterior, cuando ésta es importante, o bien por la descendente posterior, arteria que puede provenir de la circunfleja o de la coronaria derecha. En el 85% de la población, la coronaria derecha es dominante y da lugar a la descendente posterior, que irriga la pared inferior del corazón y la región inferior y basal del septo. En el 15% restante, la descendente posterior proviene de la circunfleja. Cuando la coronaria derecha es dominante, la circunfleja irriga las porciones basales de la cara lateral e inferior, la pared lateral es irrigada por las ramas marginales de esta arteria. Cuando la circunfleja es dominante puede afectar a la mitad inferolateral y anterolateral del ventrículo izquierdo.
En general, pues, la pared anterior y el septo son zonas irrigadas por la descendente anterior y la pared lateral por la circunfleja, pero la cara inferior del corazón puede estar irrigada por la coronaria derecha o la circunfleja. Por otra parte, los defectos del ápex pueden corresponder a cualquiera de las arterias, pero se asigna preferentemente a la arteria descendente anterior47,48.
Valoración de los defectos de perfusiónLos defectos de perfusión se valoran de forma subjetiva sobre los cortes tomográficos teniendo en cuenta las siguientes características: extensión, intensidad, reversibilidad y afectación de uno o más territorios.
Se define una gradación de intensidad de los defectos en 5 grados: 0, normal; 1, hipocaptación ligera; 2, hipocaptación moderada; 3, hipocaptación intensa, y 4, ausencia de captación, donde la captación es igual a la actividad de fondo.
Actualmente, los programas de cuantificación de 17 segmentos sobre mapas polares (fig. 2) llevan asociadas unas tablas de referencia que, por comparación, permiten cuantificar de manera objetiva estos defectos, con el mismo criterio de 5 grados43.
La reversibilidad se cataloga como total, parcial o nula. Los defectos totalmente reversible pueden considerase como patrones isquémicos. Los que no incrementan la actividad en reposo pueden corresponder a diferentes situaciones: si son leves y localizados en la región inferior en varones o en la región anterolateral en mujeres suelen corresponder a atenuación. Cuando son moderados o intensos suelen corresponder a infartos con mayor o menor grado de transmuralidad. También hay otras alteraciones más infrecuentes del tejido miocárdico de carácter permanente: fibrosis, degeneración, masas ocupantes de espacio, etc.
Los defectos parcialmente reversibles se interpretan como áreas en las que coexiste tejido cicatrizal (generalmente zonas de infarto no transmural) y miocardio isquémico, aunque también pueden deberse a la presencia de una isquemia muy intensa que condicione un retraso del fenómeno de redistribución superior a las 34 horas cuando se utiliza talio-201. Si se emplean trazadores tecneciados, las regiones con reducción crítica del flujo coronario también pueden ocasionar una reversibilidad parcial o nula en reposo49,50.
Los criterios para valorar un defecto de captación como significativo pueden variar en función de la sensibilidad y la especificidad que se pretenda obtener. Así, si se toman como significativos los defectos muy leves sin reversibilidad se obtendrán estudios de alta sensibilidad y baja especificidad, útiles en estudios pronósticos. Por el contrario, si sólo se dan como indicativos de isquemia los defectos a partir del grado moderado y que sean reversibles, la especificidad será máxima pero la sensibilidad decrece, lo cual es preferible en los estudios diagnósticos. La mayoría de unidades de cardiología nuclear ha adoptado la norma de considerar los defectos ligeros de los segmentos basales o de la zona de atenuación como equívocos o no diagnósticos.
Patrones paradójicosLos patrones paradójicos se definen como alteraciones de perfusión en reposo mayores o más intensas que las de postesfuerzo. Su significación es muy variable, ya que los factores que condicionan su aparición son múltiples51 , pero nunca corresponden a estenosis moderadas o severas. Deben descartarse factores meramente técnicos (atenuación, actividad extracardiaca, etc.), y en caso de necrosis, suele estar asociado con la permeabilidad del vaso causante
Signos indirectos de enfermedad coronaria graveSi bien la sensibilidad de la perfusion miocardica es elevada en la detección de enfermedad coronaria de los 3 vasos principales, con una sensibilidad para ladeteccion de cardiopatia isquemica mayor cuanto mas extensa es la enfermedad vascular,52 en algunas ocasiones el estudio puede ser falsamente negativo al estar el flujo coronario homogénea y globalmente disminuido. En estos casos, además de tener en cuenta el resultado clínico y electrocardiográfico de la prueba de esfuerzo y la capacidad funcional durante ésta, es útil valorar algunos datos indirectos detectables en el estudio de perfusión, como la captación pulmonar anormal, el enlentecimiento del aclaramiento miocárdico de talio-201, la dilatación ventricular y el descenso de la fracción de eyección del ventrículo izquierdo postesfuerzo, detectables por gated-SPECT, que son signos de gravedad de la cardiopatía isquémica y de mal pronóstico53.
Artefactos secundarios a problemas técnicosPara la valoración de las imágenes deben tenerse en cuenta una serie de posibles artefactos técnicos que pueden alterar el sentido de los resultados42,54, como la falta de uniformidad del detector o centro de rotación fuera de rango, los defectos en la reconstrucción de los cortes, la elección de filtros de reconstrucción inadecuados y las alteraciones en la reorientación ventricular. Recientemente se ha introducido un nuevo artefacto debido al efecto anómalo de la corrección de atenuación, sólo presente cuando se usa esta técnica.
Movimiento del paciente durante la adquisiciónEste problema es el más frecuente en las adquisiciones tomográficas. Puede ser difícil de evitar, dada la posición incómoda con los brazos levantados que debe adoptar, a pesar de que se explique especialmente al paciente que es muy importante para la correcta interpretación de la prueba que no se mueva.
Puede objetivarse en la presentación inicial en modo cine de todas las imágenes adquiridas y en el linograma/sinograma de las imágenes en la reconstrucción. Ante la percepción de movimientos importantes debe repetirse la adquisición. En los cortes tomográficos se manifiesta como un desajuste en la distribución de la actividad, que se suele manifestar como un corrimiento de una parte del ventrículo izquierdo. En los ejes largos se aprecia una desconexión de las paredes ventriculares en el ápex y en los cortes coronales, una rotura del círculo con una parte de la pared superior o inferior sobresaliendo en forma de «flequillo», denominado hurricane sign por su similitud con el símbolo meteorológico del huracán55.
Atenuación por los tejidos blandosEl hemidiafragma izquierdo es una de las causas más frecuentes de interpretación errónea de los estudios de perfusión y da lugar a una hipocaptación progresiva de la perfusión en la cara inferior, más intensa en las porciones basales45. En las mujeres, las mamas de gran tamaño pueden simular un defecto de perfusión de localización ántero-septo-apical. Debe procurarse que su posición sea la misma en la exploración postesfuerzo que en la de reposo ya que, de este modo, el defecto detectado será fijo. Más difíciles de interpretar son los defectos reversibles, ya que en este caso pueden ser debidos a cambios en la posición de la mama izquierda relacionados, simplemente, con el distinto grado de elevación del brazo izquierdo. La obesidad puede ser también una fuente de errores. El tejido adiposo de la pared torácica puede dar lugar a imágenes atenuadas, en especial en la cara lateral.
Concentración del trazador en las vísceras abdominalesGenera un problema de presentación de los cortes (máximo extracardiaco) y/o de superposición con los cortes en la cara inferior. Afecta también a la gated- SPECT, ya que produce un anclaje de la zona que disminuye la motilidad, y por extensión, la fracción de eyección. En algunos casos puede obligar a repetir la adquisición.
Interpretación de la gated-SPECTAparte de las imágenes de perfusión miocárdica, con la gated-SPECT se obtienen imágenes en diferentes fases del ciclo cardiaco, habitualmente de 8 a 16 fases. Con los programas de cuantificación existentes (Cedars, ECT, 4DMSPECT), se puede obtener información adicional a la perfusión, como los volúmenes ventriculares, la función sistólica y diastólica, las imágenes de engrosamiento sistólico y la evaluación del desplazamiento o contractilidad (fig. 1). En la tabla 1 se muestran los valores de referencia para estos parámetros cuantitativos56–58.
Valores de referencia de los parámetros cuantitativos de la gated-SPECT
| Parámetro | Valor referencia |
| Volumen telediastólico | 105 ±20,6 ml |
| Volumen telesistólico | 39 ±11,7 ml |
| Fracción de eyección | 63,7 ± 5,6% |
| Velocidad máxima llenado | 2,62 ± 0,46 VTD/s |
| Tiempo a máxima velocidad llenado | 164,6 ± 21,7 ms |
Con esta técnica, la cuantificación de la contractilidad regional se realiza generalmente mediante la determinación del movimiento de la pared ventricular y el engrosamiento sistólico según el desplazamiento de los bordes ventriculares a lo largo del ciclo cardiaco y del incremento de cuentas por píxel detectado en los radios trazados desde el centro de la cavidad ventricular. La forma de presentación habitual es la de los mapas polares en 2 o 3 dimensiones, que representan la motilidad/contractilidad y el engrosamiento sistólico. En este caso se trata de imágenes paramétricas que representan en cada uno de los 17 segmentos del mapa el valor cuantitativo de cada una de las magnitudes descritas. A la imagen de contractilidad se le añade una malla que representa la zona de la superficie endocárdica en diástole, lo que facilita la interpretación de la motilidad en modo dinámico (cine)43.
Se definen unas gradaciones de intensidad de las alteraciones de engrosamiento y contractilidad en 5 grados: 0, normal; 1, disminución ligera; 2, disminución moderada; 3, disminución intensa, y 4, ausencia de engrosamiento o de contractilidad (acinesia), y es posible determinar también las discinesias, donde se sobrepasa en sístole la malla de telediástole. Los programas de cuantificación referencian estas alteraciones sobre el mapa polar de 17 segmentos de contractilidad y de engrosamiento, y dan la suma de las alteraciones43.
ELABORACIÓN DE LOS INFORMESPara la correcta valoración de los estudios de perfusión miocárdica debemos disponer de un sistema de recogida de datos, no sólo para poder realizar el informe de la prueba, sino también para recuperar a los pacientes en función de algún dato en concreto y poder comparar el estudio actual con anteriores.
La evaluación conjunta de las imágenes de perfusión miocárdica con el aporte de los datos de la prueba de estrés facilita la interpretación del estudio. Deben valorase las imágenes de esfuerzo/reposo, teniendo en cuenta en todas las hipoperfusiones su localización, intensidad, extensión y reversibilidad, así como los datos extraídos del análisis cuantitativo del mapa polar, incluida la valoración de la viabilidad miocárdica en caso de infarto, y de los datos cualitativos (engrosamiento y motilidad) y cuantitativos de la gated-SPECT, sobre todo la fracción de eyección, tanto postesfuerzo como en reposo. La síntesis de todos estos datos permite confeccionar fácilmente un correcto informe de un estudio de perfusión miocárdica. Sobre la base de las recomendaciones de la ASNC59, y adaptándolas a la idiosincrasia de nuestro país, el informe debe constar de unos 5 apartados:
1. Identificación del paciente. Son los datos referentes al paciente y a la solicitud (filiación, datos antropométricos, medicación, servicio y médico solicitante, etc.), y el motivo de la prueba.
- 2.
Descripción de los parámetros de la prueba de esfuerzo: situación basal (ECG, frecuencia cardiaca, presión arterial), tipo de sobrecarga (treadmill, cicloergómetro, farmacológico), duración, consumo máximo de oxígeno (MET), frecuencia cardiaca máxima, presión arterial sistólica máxima, síntomas, cambios en el ECG (tipo, momento de aparición y finalización) y motivo de finalización (cansancio, angina, arritmias, etc.).
- 3.
Tipo de técnica de la SPECT: trazador y dosis, protocolo corto o largo, uso de corrección de atenuación.
- 4.
Descripción de las imágenes en la que se citen la localización, intensidad, extensión y reversibilidad de las hipoperfusiones, pero también de las alteraciones que no sean defectos.
- 5.
Datos cuantitativos y cualitativos de la gated- SPECT (fracción de eyección y volúmenes), alteraciones regionales de la motilidad y/o engrosamiento. La cuantificación de la perfusión, la contractilidad y el engrosamiento debe valorarse en los 17 segmentos del ventrículo izquierdo con una puntuación de 0 a 4.
Al final debe haber una gran claridad y concisión en la conclusión final, y hay que tener en cuenta que la asignación de los diferentes segmentos a arterias coronarias concretas tiene limitaciones en algunos de ellos.