
El papel de la tomografía por emisión de positrones/tomografía computarizada con 18F-fluorodesoxiglucosa ([18F]FDG-PET/CT) en las infecciones de los dispositivos de electroestimulación cardiaca (DEC) requiere una evaluación más precisa. El objetivo del trabajo es determinar su rendimiento en cada región topográfica del DEC, su capacidad en la diferenciación de infecciones locales aisladas y sistémicas, la utilidad de la captación de bazo y médula ósea (MO) para diferenciar entre infecciones locales y sistémicas y su potencial utilidad en el seguimiento de las infecciones de los DEC.
MétodosEstudio retrospectivo unicéntrico de 54 casos de infección de DEC y 54 controles durante 2014-2021. Se estudió el rendimiento diagnóstico en cada región topográfica del DEC. Se evaluó la combinación de la [18F]FDG-PET/CT con el ecocardiograma transesofágico (ETE) para diagnosticar infecciones sistémicas, el papel de la actividad en MO y bazo y su posible utilidad para guiar la duración de la antibioterapia crónica cuando no se retira el DEC.
ResultadosSe incluyeron 13 (24%) infecciones locales aisladas y 41 (76%) infecciones sistémicas. En general, la [18F]FDG-PET/CT mostró un 100% de especificidad y el 85% de sensibilidad, que fue del 79% en el bolsillo, el 57% en el cable subcutáneo, el 22% en el cable endovascular y del 10% en el cable intracardiaco. En las infecciones sistémicas, la [18F]FDG-PET/CT en combinación con ETE aumentó el diagnóstico definitivo del 34 al 56% (p=0,04). Los casos con bacteriemia mostraron hipermetabolismo del bazo (p=0,05) y la MO (p=0,04). Se obtuvo una [18F]FDG-PET/CT de seguimiento de 13 pacientes sin extracción del DEC. No hubo recaídas al suspender la antibioterapia crónica en 6 casos con [18F]FDG-PET/CT negativa.
ConclusionesLa sensibilidad de la [18F]FDG-PET/CT para evaluar infecciones locales es mayor que en infecciones sistémicas y aumenta en las sistémicas en combinación con ETE. En presencia de bacteriemia, el hipermetabolismo del bazo y la MO podría diferenciar entre infecciones locales y sistémicas. Son necesarios estudios prospectivos para determinar la posible utilidad de la [18F]FDG-PET/CT de seguimiento para el ajuste de la antibioterapia crónica en casos de retirada incompleta de DEC.
Palabras clave
Las infecciones de dispositivos de electroestimulación cardiaca (DEC) presentan una amplia variabilidad en su espectro clínico. Pueden manifestarse como infecciones locales (IL) de DEC, solas o junto con infecciones sistémicas (IS). Entre las IS se distinguen tanto las infecciones endovasculares e intracardiacas del cable o electrodo como la endocarditis infecciosa (EI). Por esta gran variabilidad clínica, la aproximación diagnóstica de estas infecciones es compleja y se basa en datos microbiológicos y técnicas de imagen cardiaca, de las que el ecocardiograma transesofágico (ETE) es la piedra angular1–3,5. La introducción de la tomografía por emisión de positrones/tomografía computarizada con 18F-fluorodesoxiglucosa ([18F]FDG-PET/TC) ha mejorado la evaluación diagnóstica de la endocarditis sobre válvula protésica y se ha incorporado como un criterio diagnóstico mayor en las guías de práctica clínica1. Además, recientemente se ha demostrado que el hipermetabolismo del bazo y la médula ósea (MO) detectado por la [18F]FDG-PET/TC puede considerarse un signo indirecto de EI sobre válvulas nativas o protésicas4,6.
A pesar de la evidencia más reciente, la utilidad general de la [18F]FDG-PET/TC en infecciones de DEC requiere una caracterización más detallada. Se han publicado varios estudios de cohortes3,5, que presentan un alto rendimiento diagnóstico por lo que respecta a las infecciones localizadas en la bolsa del generador (IL), pero un rendimiento mucho menor en la infección sistémica relacionada con el cable (IS)7. El ETE también es incapaz de detectar vegetaciones en el cable en muchos pacientes con bacteriemia que probablemente tengan una infección sistémica (IS)2. En este sentido, la [18F]FDG-PET/TC contribuiría a mejorar el diagnóstico en todas las regiones topográficas de los DEC, incluso en el segmento endovascular del cable, al que no puede acceder el ETE.
El objetivo principal de este estudio es determinar el rendimiento diagnóstico de la [18F]FDG-PET/TC en cada una de las diferentes regiones topográficas del DEC: bolsa del generador y segmentos subcutáneo, endovascular e intracardiaco de los cables. Los objetivos secundarios, analizar el rendimiento de la [18F]FDG-PET/TC en comparación con el del ETE en el diagnóstico de IS, definir el valor diagnóstico del hipermetabolismo del bazo y la MO como signo indirecto de IS y evaluar la utilidad potencial de la [18F]FDG-PET/TC en el seguimiento de infecciones de DEC sin la extracción completa del dispositivo y con tratamiento antibiótico supresivo (TAS) para evitar recaídas como guía para determinar la suspensión del tratamiento.
MÉTODOSDiseño del estudioSe realizó un estudio retrospectivo de casos y controles en el Hospital Clínic de Barcelona, centro universitario terciario con cirugía cardiaca y de referencia para el tratamiento de la EI y otras infecciones cardiovasculares, por los miembros del grupo de investigadores de infección cardiovasculares y endocarditis infecciosa del Hospital Clínic de Barcelona (véase la lista de los investigadores en el material adicional) para valorar la utilidad de la [18F]FDG-PET/TC en el diagnóstico de las infecciones de DEC. Todos los casos con sospecha de infección de DEC se han discutido durante las reuniones semanales del equipo de EI desde 19868. El diagnóstico final de cada caso se estableció por consenso mediante la aplicación de los criterios de Duke modificados9 y las guías internacionales de práctica clínica2. Se incluyó a todos los pacientes consecutivos con infección de DEC que cumplían los criterios de inclusión desde enero de 2014 hasta enero de 2021. La información se recopiló a partir de datos de la historia clínica electrónica. Los casos consecutivos se emparejaron con controles por edad (±5 años), sexo, tipo de DEC y año natural. Se realizó un seguimiento de todos los pacientes al menos durante 1 año hasta diciembre de 2021.
Criterios de inclusiónCasos (verdaderos positivos)Las IL e IS se clasificaron según las recomendaciones de los criterios de diagnósticos de la European Heart Rhythm Association (EHRA)2. En los casos sospechosos de EI sobre DEC, se aplicaron los criterios de Duke modificados9. En todos los casos, la IL y la IS se evaluaron con hemocultivos, cultivos de la bolsa del generador del DEC y cultivos de cable (o electrodos) y, además, se realizó la detección del ARN ribosomal (ARNr) de 16S mediante reacción en cadena de la polimerasa (PCR), y ecocardiograma transesofágico. Dado que el objetivo principal de este estudio es evaluar la rentabilidad diagnóstica (sensibilidad, especificidad, valor predictivo positivo y negativo) de la [18F]FDG-PET/TC en las infecciones de DEC, los resultados de la [18F]FDG-PET/TC se excluyeron como criterio diagnóstico. El diagnóstico final de cada caso se estableció por consenso en las reuniones semanales del equipo de EI. Solo se incluyó a pacientes con un diagnóstico definitivo de infección de DEC.
Tipos de infección de DECInfecciones locales solo del dispositivoSignos locales de infección que afectaban a la bolsa del generador con o sin signos de infección en el segmento del cable subcutáneo y/o cultivos positivos de la bolsa del DEC o cable (y PCR positiva del ARNr de 16S cuando se realizó). Este grupo incluyó las definiciones de infección relacionada con DEC, tal y como se especifica en el consenso de la EHRA: infección aislada de la bolsa del generador, erosión aislada de la bolsa, infección del sitio de la bolsa sin bacteriemia/signos sistémicos de infección2.
Se definió IL aislada como la no asociada con signos sistémicos de infección. Los pacientes con sospecha de IS o cultivo del segmento del cable endovascular/intracardiaco positivo fueron excluidos sistemáticamente de este grupo.
Infecciones sistémicasLas IS se produjeron en pacientes con o sin infección local asociada de DEC que también tenían infección del cable endovascular/intracardiaco (incluyendo EI) determinada por signos sistémicos de infección, como fiebre, proteína C reactiva elevada, leucocitosis y hemocultivos positivos o cultivos del cable endovascular/intracardiaco (y PCR positiva del ARNr de 16S cuando se realizó) o la presencia de vegetaciones en los electrodos o la válvula tricúspide diagnosticada por ETE. Este grupo incluyó las definiciones de infección relacionada con DEC como se aclara en el consenso de la EHRA: infección del cable, infección de la bolsa del generador con endocarditis relacionada con el cable/valvular, endocarditis relacionada con DEC sin infección de la bolsa, hemocultivos positivos y vegetaciones en el electrodo o valvulares2. Se excluyó a los pacientes clasificados como con IS posible o probable porque no se los consideró verdaderos positivos definitivos.
Controles: verdaderos negativosSe incluyó como controles a los pacientes con DEC y estudiados con [18F]FDG-PET/TC por neoplasias de órganos sólidos o hematológicas sin ningún tipo de sospecha o signos de infección. Se evaluaron todas las regiones topográficas de los DEC de control, excepto el segmento del cable intracardiaco, ya que ninguno de los controles experimentó supresión de la captación miocárdica10.
Criterios de emparejamientoTodos los casos y controles se emparejaron por edad, sexo, tipo de dispositivo e intervalo de tiempo similar entre el implante/reemplazo de DEC y el rendimiento de la [18F]FDG-PET/TC.
Criterios de exclusiónCasosSe excluyó a los pacientes sin criterios definitivos de infección de DEC. Como ya se ha mencionado, se consideró verdaderos positivos a todos los casos; no hubo falsos positivos.
ControlesSe excluyó a los pacientes con infecciones de DEC previas o cualquier signo clínico o analítico de infección local o sistémica en los 6 meses anteriores o posteriores al momento de adquisición de la [18F]FDG-PET/TC. También se excluyó a los pacientes con vías intravenosas centrales y/o lesiones mediastínicas hipermetabólicas que pudieran interferir en la evaluación.
Consideraciones acerca de la [18F]FDG-PET/TCLas imágenes de la [18F]FDG-PET/TC de cuerpo entero se adquirieron 60min después de la inyección de 18F-FDG (4,0 MBq/kg) en una gammacámara híbrida (Biograph mCT 64S; Siemens, Alemania) con un protocolo de supresión de la captación miocárdica que consistía en un periodo de ayuno de 12 h y la administración intravenosa de 50 UI/kg de heparina no fraccionada 15min antes de la inyección de 18F-FDG. Se trató a los pacientes diabéticos según lo indicado por la guía de práctica clínica de la European Association of Nuclear Medicine/Society of Nuclear Medicine and Molecular Imaging (EANM/SNMMI) sobre el uso de 18F-FDG en casos de inflamación e infección6,10. El consumo de una dieta rica en grasas y baja en hidratos de carbono antes de la exploración con [18F]FDG-PET/TC no se instauró sistemáticamente en todos los pacientes, dado que este protocolo se implementó después de que diseñáramos el estudio.
Análisis visualA todos los pacientes se les realizó una [18F]FDG-PET/TC de cuerpo entero como parte del protocolo del estudio. El objetivo primario fue el resultado de la [18F]FDG-PET/TC, que fue evaluado cualitativamente por dos especialistas en medicina nuclear independientes y desconocedores del estudio. Todas las imágenes fueron interpretadas por separado por los 2 especialistas en medicina nuclear independientes y los desacuerdos se resolvieron por consenso con un tercer lector de medicina nuclear. El criterio de positividad fue la presencia de cualquier captación focal o heterogénea relacionada con cada región topográfica identificada tanto en imágenes con atenuación corregida como no corregida para evitar artefactos por corrección de la atenuación. Los resultados del análisis visual de la [18F]FDG-PET/TC también se compararon con los del ETE en IS.
Análisis semicuantitativoSe realizó un análisis semicuantitativo, supervisado por ambos lectores, de todas las exploraciones de [18F]FDG-PET/TC midiendo el valor de captación estandarizado máximo (VCEmáx) de un volumen de la esfera de interés que incluye la totalidad de la bolsa y un volumen de la esfera de interés colocado en la parte más activa de cada segmento del cable (subcutáneo, endovascular e intracardiaco).
No se realizó ningún análisis semicuantitativo en las regiones del cable intracardiaco de los controles, ya que no se les realizó el protocolo de inhibición miocárdica. Por lo tanto, se excluyó del análisis estadístico el análisis de especificidad del cable intracardiaco.
Metabolismo del bazo y la médula óseaSe obtuvieron los valores de captación estandarizada medios (VCEmedio) del bazo y la médula ósea (MO) para evaluar los signos indirectos de infección/inflamación, como describen Boursier et al.6, tras colocar el volumen esférico de interés en el centro del bazo y en la primera vértebra lumbar, evitando cuidadosamente la inclusión de cualquier área anormal secundaria a posibles lesiones. Como referencia, se calculó el VCEmedio de la acumulación de sangre de la aorta torácica descendente y el VCEmedio del hígado. Las proporciones del VCE se calcularon dividiendo el VCEmáx del área de interés entre el VCEmedio de la acumulación de sangre y del hígado con el objetivo de superar cualquier sesgo relacionado con las fluctuaciones fisiológicas individuales de la distribución de 18F-FDG.
Seguimiento de la [18F]FDG-PET/TCSe realizó al menos 1 estudio de [18F]FDG-PET/TC a todos los pacientes con extracción incompleta del dispositivo en los primeros 6 meses tras el alta. Se programó al menos 1 estudio de [18F]FDG-PET/TC cada 4-6 meses; pudo haberse realizado más de uno en función de la duración del seguimiento durante el estudio. También se analizaron los datos sobre el tratamiento antibiótico supresivo (TAS) y su duración, así como el tipo de infección. Se puede encontrar más detalles sobre la metodología de la [18F]FDG-PET/TC en el material adicional.
Ecocardiografía transesofágicaLa evaluación ecocardiográfica se llevó a cabo mediante ETE en todos los casos utilizando un sistema GE VIVID E95. Se supuso que cualquier masa observada en un cable o electrodo en el ecocardiograma en el contexto de la bacteriemia eran vegetaciones. Todos los ecocardiogramas fueron validados por un segundo investigador y las discordancias adicionales, por un tercer miembro del equipo.
Análisis estadísticosLas variables continuas se presentan como mediana [intervalo intercuartílico] y se compararon mediante la prueba de la U de Mann-Whitney. Las variables cualitativas se presentan como frecuencias (porcentajes) y se compararon mediante la prueba de la χ2 o la prueba de Fisher. En todas las pruebas, la significación estadística se estableció en p <0,05. Los cálculos de validez de la sensibilidad, la especificidad y los valores predictivos positivos y negativos se obtuvieron por medio de tablas de contingencia según los resultados verdaderos positivos y verdaderos negativos, falsos positivos y falsos negativos obtenidos de los resultados de la [18F]FDG-PET/TC. También se realizaron curvas de eficacia diagnóstica a partir de los distintos valores del VCEmáx/VCEmedio para obtener un valor de corte más preciso para el diagnóstico de infección. Los análisis estadísticos se realizaron con STATA 14.0.
Consideraciones éticasLa implementación de este estudio fue aprobada por el comité de ética del Hospital Clínic de Barcelona (Comité de Ética número HCB/2020/1489). Se renunció a la exigencia del consentimiento informado por escrito, dada la naturaleza retrospectiva del estudio. Se codificó la identificación del paciente, cumpliendo con los requisitos de la Ley Orgánica de Protección de Datos 15/1999.
RESULTADOSSe incluyó a 54 casos y 54 controles; las características de los 2 grupos se presentan en la tabla 1. En el 25% de los casos pasaron menos de 152 días entre el implante o reemplazo del DEC y la infección clínica.
Características basales de los casos (infecciones de DEC) y los controles
| Casosn=54 | Controlesn=54 | p | |
|---|---|---|---|
| Variables | |||
| Edad (años) | 78[69,0-85,0] | 83[77,0-88,0] | — |
| Mujeres | 16(29,6) | 10(18,5) | |
| Días entre implante/reemplazo de DEC y [18F]FDG PET/TC | 768,5 [152,0-2.443,0] | 1.389,0 [707,0-3.131,0] | <0,01 |
| Tipo de DEC | |||
| Marcapasos | 41 (75,9) | 44 (81,5) | — |
| DAI | 12 (22,2) | 10 (18,5) | — |
| TRC | 1 (1,9) | 0 | — |
| Resultados de la [18F]FDG-PET/TC | |||
| [18F]FDG-PET/TC positiva | 46 (85,2) | 0 | — |
[18F]FDG-PET/CT, tomografía por emisión de positrones/tomografía computarizada con 18F-fluorodesoxiglucosa; DAI, desfibrilador cardiaco implantable; DEC, dispositivo de electroestimulación cardiaca; TRC, terapia de resincronización cardiaca.
Los datos se expresan como números (%) o mediana [rango intercuartílico].
Comparación entre los casos con infección local aislada y aquellos con infección sistémica o ambos tipos de infección
Los casos se dividieron en IL aislada (n=13) e IS con IL o sin ella (n=41). Las características basales eran semejantes entre los 2 grupos (tabla 2). Hubo signos locales de infección de la bolsa de generador del DEC en el 87% de los casos (47/54): en el 100% (13/13) con IL aislada y el 82,9% (34/41) del grupo de IS (p <0,01). De los pacientes con IS, el 34,1% (14/41) presentó un resultado ecocardiográfico positivo. La positividad microbiológica y la etiología se distribuyeron de manera homogénea en ambos grupos, con predominio de Staphylococcus aureus y estafilococos coagulasa-negativos (ECN) (tabla 1 del material adicional). La clasificación específica de IS desde el punto de vista de los criterios diagnósticos se resume en la tabla 2 del material adicional. Los pacientes con IS se sometieron significativamente más a cirugía de extracción (el 70,7 frente al 38,4%; p=0,04) y aquellos con IL aislada recibieron más TAS (el 61,5 frente al 24,4%; p <0,01). No hubo diferencias estadísticamente significativas entre los pacientes con IL aislada e IS respecto a cirugía de reimplante, mortalidad hospitalaria o recaída. No hubo diferencias en los resultados de la [18F]FDG-PET/TC en el mundo ni en ningún segmento topográfico durante el intervalo entre el implante/reemplazo del DEC y la [18F]FDG-PET/TC (< 3 meses frente a> 3 meses). Todas las características que comparan grupos y resultados de la [18F]FDG-PET/TC se resumen en la tabla 3 del material adicional.
Comparación de pacientes con infección de DEC por infecciones locales aisladas o infecciones sistémicas
| Total | Infecciones locales aisladasn=13 | Infecciones sistémicasn=41 | p | |
|---|---|---|---|---|
| Características basales y emparejamiento | ||||
| Edad (años) | 78[69,0-85,0] | 83,0[75,0-87,0] | 77,0[69,0-85,0] | 0,35 |
| Mujeres | 16(29,6) | 4(30,7) | 12(29,2) | 0,91 |
| Tipo de DEC | ||||
| Marcapasos | 41(75,9) | 9(69,2) | 32(78) | 0,54 |
| DAI | 12(22,2) | 4(30,7) | 8(19,5) | 0,42 |
| TRC | 1(1,9) | 0 | 1(2,4) | 0,31 |
| Signos de infección local | 47(87) | 13(100) | 34(82,9) | <0,01 |
| Ecocardiograma | ||||
| Vegetaciones en ecocardiograma (ETT/ETE)* | 14(25,9) | 0 | 14(34,1) | ND |
| Vegetaciones en electrodo | 14(25,9) | 0 | 14(34,1) | ND |
| Vegetaciones en válvula tricúspide | 2(3,7) | 0 | 2(4,8) | ND |
| Vegetaciones en válvula mitral | 1(1,8) | 0 | 1(2,4) | ND |
| [18]FDG-PET/TC | ||||
| [18F]FDG-PET/TC positiva | 46(85,2) | 11(84,6) | 35(85,3) | 0,94 |
| Bolsa | 37 | 8 | 29 | 0,54 |
| Segmento cable subcutáneo | 27 | 7 | 20 | 0,75 |
| Segmento cable endovascular | 9 | 0 | 9 | ND |
| Segmento cable intracardiaco | 4 | 0 | 4 | ND |
| Émbolos sistémicos | 1(1,8) | 0 | 1(2,4) | ND |
| Émbolos pulmonares | 1(1,8) | 0 | 1(2,4) | ND |
| Intervalo entre el inicio de SAC y la [18F]FDG-PET/TC (días) | 6,0[0,0-14,0] | 6,0[0-15,0] | 8,0[4,0-13,0] | 0,38 |
| Intervalo entre el ingreso hospitalario y la extracción del dispositivo (días) | 8,5[1,5-14,0] | 5,5[1,0-14,0] | 12,5[6,0-14,0] | 0,25 |
[18F]FDG-PET/TC: tomografía por emisión de positrones/tomografía computarizada con 18F-fluorodesoxiglucosa; DAI: desfibrilador cardiaco implantable; DEC: dispositivo de electroestimulación cardiaca; ETE: ecocardiograma transesofágico; ETT: ecocardiograma transtorácico; ND: no disponible; SAC: supresión con antibióticos crónica; TRC: terapia de resincronización cardiaca.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
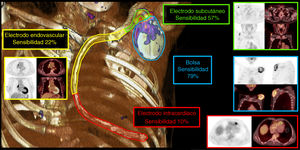
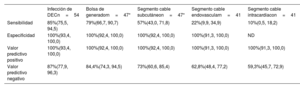
Los principales resultados se muestran en la tabla 3. La sensibilidad general de la [18F]FDG-PET/TC en cuanto a la confirmación de la infección de DEC fue del 85% (46/54). La sensibilidad respecto a la bolsa fue del 79% (37/47); respecto al segmento subcutáneo del cable, del 57% (27/47); respecto al segmento endovascular, del 22% (9/41), y respecto al segmento intracardiaco, del 10% (4/41). Sin embargo, la sensibilidad respecto al segmento de cable intracardiaco podría subestimarse porque el 31,5% (17/54) de los casos mostraron una inhibición miocárdica infructuosa. El valor predictivo negativo fue del 15% (8/54). La mediana del tiempo de tratamiento con antibióticos antes de la adquisición de la [18F]FDG-PET/TC fue de 5 [0-14] días en los casos con resultados positivos y 13 [5-16] días en los casos con resultados negativos (p=0,19). Pese a que hay una tendencia, no se encontraron diferencias significativas respecto al periodo entre el inicio del antibiótico y el rendimiento de la [18F]FDG-PET/TC; 12 casos (22,2%) habían estado en tratamiento con antibióticos antes de la adquisición de la [18F]FDG-PET/TC, con una duración media de 6 [0,0-14,0] días.
Precisión diagnóstica general de la [18F]FDG-PET/TC de acuerdo con las 4 regiones topográficas de la infección de DEC
| Infección de DECn=54 | Bolsa de generadorn=47* | Segmento cable subcutáneon=47* | Segmento cable endovascularn=41 | Segmento cable intracardiacon=41 | |
|---|---|---|---|---|---|
| Sensibilidad | 85%(75,5, 94,5) | 79%(66,7, 90,7) | 57%(43,0, 71,8) | 22%(9,9, 34,9) | 10%(0,5, 18,2) |
| Especificidad | 100%(93,4, 100,0) | 100%(92,4, 100,0) | 100%(92,4, 100,0) | 100%(91,3, 100,0) | ND |
| Valor predictivo positivo | 100%(93,4, 100,0) | 100%(92,4, 100,0) | 100%(92,4, 100,0) | 100%(91,3, 100,0) | 100%(91,3, 100,0) |
| Valor predictivo negativo | 87%(77,9, 96,3) | 84,4%(74,3, 94,5) | 73%(60,6, 85,4) | 62,8%(48,4, 77,2) | 59,3%(45,7, 72,9) |
[18F]FDG-PET/TC: tomografía por emisión de positrones/tomografía computarizada con 18F-fluorodesoxiglucosa; DEC: dispositivo de electroestimulación cardiaca; IL: infección local aislada; IS: infección sistémica; ND: no disponible.
La figura 1 muestra ejemplos positivos de captación de 18F-FDG y valores de sensibilidad de la FDG-PET/TC en una representación visual tridimensional de cada región topográfica de DEC.
Figura central. La figura muestra ejemplos de captación positiva de FDG y valores de sensibilidad de la [18F]FDG-PET/TC en una representación visual tridimensional de cada región topográfica del DEC: bolsa (azul), segmento subcutáneo del cable (verde), endovascular (amarillo) e intravascular (rojo).
En la tabla 4 se compara el rendimiento diagnóstico entre el ETE y la [18F]FDG-PET/TC en pacientes con infección sistémica que presentan fiebre, leucocitosis y proteína C reactiva elevada con hemocultivos positivos o cultivos del cable positivos/detección del ARNr de 16S mediante PCR o eco positivo. En esos pacientes, cuando la [18F]FDG-PET/TC se combinó con el ETE, el índice de diagnóstico definitivo de infección aumentó considerablemente del 34% (14/41) al 56% (23/41) (p=0,04) debido a la detección de afección endovascular, con niveles más altos en la forma bacteriémica (del 38,8 ([7/18] al 66,7% [12/18]) que en la forma no bacteriémica (del 30,4 ([7/23] al 47,8% [11/23]) de las infecciones sistémicas (p=0,37).
Rendimiento diagnóstico de la [18F]FDG-PET/TC
| Tipo de infección sistémica | Ecocardiograma transesofágico | ||
|---|---|---|---|
| Positivo | Negativo | Total | |
| Con bacteriemia (n=18) | |||
| [18F]FDG-PET/TC endovascular | |||
| Positiva | 2a | 5 | 7 (38,9) |
| Negativa | 5a | 6 | 11 |
| Total | 7 (38,8) | 11 | 18 |
| [18F]FDG-PET/TC intracardiaca | |||
| Positiva | 2 | 0 | 2 (11,1) |
| Negativa | 5 | 11 | 16 |
| Total | 7 (38,8) | 11 | 18 |
| Sin bacteriemia (n=23) | |||
| [18F]FDG-PET/TC endovascular | |||
| Positiva | 0 | 2b | 2 (8,7) |
| Negativa | 7a | 14 | 21 |
| Total | 7 (30,4) | 16 | 23 |
| [18F]FDG-PET/CT intracardiaca | |||
| Positiva | 0 | 2b | 2 (8,7) |
| Negativa | 7 | 14 | 21 |
| Total | 7 (30,4) | 16 | 23 |
[18F]FDG-PET/TC: tomografía por emisión de positrones/tomografía computarizada con 18F-fluorodesoxiglucosa.
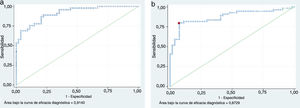
Las curvas de eficacia diagnóstica se analizaron para la mediana del VCEmáx de las 4 regiones topográficas del DEC y la relación entre cada VCEmáx/VCEmedio del hígado y el VCEmedio de la acumulación de sangre. Solo se encontraron valores clínicamente significativos en la captación de la bolsa respecto a los valores VCEmáx y VCEmáx/VCEmedio del hígado (figura 2). Las restantes curvas de eficacia diagnóstica se muestran en las figuras 1-5 del material adicional.
A: curva de eficacia diagnóstica del VCEmáx de la bolsa del DEC, valor de corte: 2,35 (sensibilidad, 79,63%; especificidad, 92,59%). B: curva de eficacia diagnóstica del VCEmáx de la bolsa del DEC/VCEmedio del hígado, valor de corte: 1,28 (sensibilidad, 75,56%; especificidad, 88,89%).
No hubo diferencias en ninguna de las variables semicuantitativas en casos y controles respecto a la captación en bazo o MO, así como entre IL e IS (tabla 4 del material adicional). Sin embargo, en el subgrupo de IS con bacteriemia, los VCEmedio en bazo (p=0,05) y MO (p=0,04) fueron significativamente mayores que en el de IL. Estos datos se resumen en la tabla 5.
Comparación del VCEmedio de bazo y médula ósea en casos de bacteriemia
| VCEmedio de bazo | VCEmedio de médula ósea de la columna lumbar | |
|---|---|---|
| IS con bacteriemia frente a IL frente a controles | ||
| Bacteriemia | 2,00 [1,7-2,3] | 1,75 [0,6-1,9] |
| p frente a IL | 0,05 | 0,04 |
| p frente a controles | 0,43 | 0,71 |
IS: infección local aislada; IS: infección sistémica.
Salvo otra indicación, los valores expresan mediana [intervalo intercuartílico].
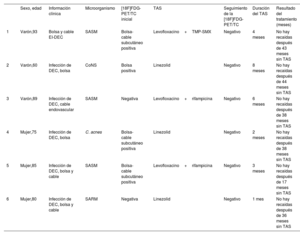
El diagrama general de la cohorte centrado en pacientes con extracción incompleta del dispositivo que recibieron TAS, a quienes se les realizó seguimiento de la [18F]FDG-PET/TC, se muestra en la figura 6 del material adicional. La extracción completa del sistema se realizó en el 66,7% (36/54) de los casos y fue considerablemente mayor (p=0,03) en los pacientes con IS (73,1% [30/41]) que en aquellos con IL aislada (46,2% [6/13]) (tabla 1 del material adicional). Dieciocho casos se clasificaron como sin extracción o extracción incompleta del dispositivo (9/18 y 9/18 respectivamente). Los principales motivos para no extraer los dispositivos fueron la edad avanzada, las comorbilidades graves, la fragilidad del paciente y el alto riesgo quirúrgico. La extracción del dispositivo se realizó en 45/54 pacientes (83,3%). Entre los pacientes a quienes se extrajo el dispositivo, la intervención fue incompleta en 9/45 (20%). En la mayoría de los casos se realizó tracción manual (40/45 [88,9%]), mientras que solo 5/45 casos (11,1%) requirieron cirugía abierta. Después del alta hospitalaria, el seguimiento duró al menos 6 meses en todos los pacientes y se realizó seguimiento de la [18F]FDG-PET/CT en 13 (13/18) (65%). Dos pacientes a los que no se dio seguimiento de la [18F]FDG-PET/TC murieron durante el ingreso hospitalario. A los 3 pacientes restantes se les realizó el seguimiento en otros hospitales sin [18F]FDG-PET/TC. Salvo los 2 pacientes que murieron antes del alta, todos (n=13) recibieron TAS. Las características de los 18 pacientes a quienes no se extrajo el dispositivo se muestran en la tabla 5 del material adicional. Todos los pacientes pasaron por al menos una [18F]FDG-PET/TC; a 4/13 pacientes se les realizaron más de 3 exploraciones con [18F]FDG-PET/TC durante el seguimiento. El número de exploraciones realizadas a cada paciente varió durante el seguimiento, ya que fueron indicadas por el equipo de EI para cada caso individual. Seis pacientes cambiaron de captación de FDG positiva a negativa durante el seguimiento y 4 de ellos (66,7%) detuvieron la TAS con el acuerdo del equipo de EI. Cuatro pacientes con una [18F]FDG-PET/TC negativa previa permanecieron negativos durante el seguimiento; 2 de ellos (50%) suspendieron la TAS con la decisión del equipo de EI. Hasta la fecha, no ha habido signos de recaída en ninguno de estos 6 casos. La mediana de tiempo hasta un resultado negativo de la [18F]FDG-PET/TC fue de 2 [1-5] meses. La mediana de tiempo de seguimiento fue de 38 meses; los pacientes que interrumpieron la TAS se muestran en la tabla 6.
Pacientes con extracción incompleta del DEC
| Sexo, edad | Información clínica | Microorganismo | [18F]FDG-PET/TC inicial | TAS | Seguimiento de la [18F]FDG-PET/TC | Duración del TAS | Resultado del tratamiento (meses) | |
|---|---|---|---|---|---|---|---|---|
| 1 | Varón,93 | Bolsa y cable EI-DEC | SASM | Bolsa-cable subcutáneo positiva | Levofloxacino+TMP-SMX | Negativo | 4 meses | No hay recaídas después de 43 meses sin TAS |
| 2 | Varón,60 | Infección de DEC, bolsa | CoNS | Bolsa positiva | Linezolid | Negativo | 8 meses | No hay recaídas después de 44 meses sin TAS |
| 3 | Varón,89 | Infección de DEC, cable endovascular | SASM | Negativa | Levofloxacino+rifampicina | Negativo | 6 meses | No hay recaídas después de 38 meses sin TAS |
| 4 | Mujer,75 | Infección de DEC, bolsa | C. acnes | Bolsa-cable subcutáneo positiva | Linezolid | Negativo | 2 meses | No hay recaídas después de 38 meses sin TAS |
| 5 | Mujer,85 | Infección de DEC, bolsa y cable | SASM | Bolsa-cable subcutáneo positiva | Levofloxacino+rifampicina | Negativo | 3 meses | No hay recaídas después de 17 meses sin TAS |
| 6 | Mujer,80 | Infección de DEC, bolsa y cable | SARM | Negativa | Linezolid | Negativo | 1 mes | No hay recaídas después de 36 meses sin TAS |
C. acnes: Cutibacterium acnes; DEC-EI: endocarditis infecciosa de dispositivo de electroestimulación cardiaca; CoNS: estafilococos coagulasa-negativos; TAS: tratamiento antibiótico supresivo; SASM: Staphylococcus aureus sensible a la meticilina; SARM: Staphylococcus aureus resistente a meticilina; TMP-SMX: trimetoprim-sulfametoxazol.
Pacientes con extracción incompleta del dispositivo con TAS cuyo tratamiento se interrumpió de acuerdo con el resultado del seguimiento de la [18F]FDG-PET/TC. La extracción general incompleta del dispositivo en pacientes con TAS se resume en la tabla 2 del material adicional.
En los últimos años se han publicado varios estudios de cohortes con infecciones de DEC7,11,12, en los cuales se han observado valores elevados de sensibilidad y especificidad de la [18F]FDG-PET/TC en las infecciones del bolsillo del generador del DEC (IL), pero un menor rendimiento diagnóstico en las infecciones relacionadas con el cable (IS). Sin embargo, hasta la fecha no existe una técnica diagnóstica de referencia para evaluar los segmentos del cable subcutáneo y endovascular en las infecciones de DEC. Además, la diferenciación entre IL e IS puede ser problemática, ya que la contaminación intraoperatoria del cable o electrodo en pacientes con IL podría ocurrir durante la extracción del dispositivo2–4,11.
En nuestro estudio, la [18F]FDG-PET/TC muestra una sensibilidad general en las infecciones de DEC del 85%: el 79% en las infecciones de la bolsa del generador y el 57% en las infecciones del segmento del cable subcutáneo. En cambio, de acuerdo con estudios previos7,12, nuestros resultados mostraron baja sensibilidad en los segmentos del cable endovascular (22%) e intracardiaco (10%). La especificidad de la [18F]FDG-PET/TC fue del 100% en todos los segmentos, salvo el intracardiaco, que no pudo evaluarse, ya que no hubo controles del segmento intracardiaco verdaderos negativos porque a ninguno de los pacientes de control se le realizó el protocolo de supresión de la captación miocárdica.
Se ha planteado la hipótesis de que la propagación de la infección desde la bolsa del generador contaminada a través del segmento del cable subcutáneo hacia el segmento endovascular es el principal mecanismo patógeno en las infecciones de DEC4. Este mecanismo puede explicar el 83% de nuestros casos de IS (34/41). Además, en nuestros datos, la bolsa del generador de DEC fue el área más frecuente de captación positiva de FDG, seguida del segmento de cable subcutáneo. No obstante, Rizwan et al.10 señalan que la infección del cable también puede originarse a partir de un foco distante por siembra hematógena, lo que posiblemente explica los 7 casos restantes (17%), con IS pero sin IL.
En comparación con estudios anteriores, nuestro trabajo muestra valores de sensibilidad y especificidad equivalentes con una muestra de pacientes más amplia. En nuestra cohorte, la curva de eficacia diagnóstica del VCEmáx de la bolsa tuvo un valor de corte de 2,4 con sensibilidad del 79,6% y especificidad del 92,6% (figura 2A). En otros estudios se han publicado resultados semejantes del rendimiento diagnóstico en infecciones de la bolsa de DEC12–15, con baja sensibilidad para las infecciones sistémicas. Sin embargo, los datos del metanálisis de Mahmood et al.7 mostraron mayores valores de sensibilidad y especificidad en IS, probablemente debido a su composición heterogénea, una miscelánea de estudios con un pequeño número de pacientes, diseños distintos y la inclusión de otras infecciones protésicas como las infecciones protésicas vasculares.
En nuestro estudio, 8 de los 47 casos con IL mostraron resultados normales de la [18F]FDG-PET/TC considerados como falsos negativos. A todos los pacientes menos 1, se les había administrado tratamiento antibiótico durante más de 20 días antes de la adquisición de la [18F]FDG-PET/TC. Varios estudios indican que el tratamiento con antibióticos durante más de 7 días antes de la adquisición de la [18F]FDG-PET/TC puede reducir su rendimiento diagnóstico11,12,16. Sin embargo, en nuestra cohorte no se encontraron diferencias significativas en el periodo transcurrido entre el inicio del tratamiento antibiótico y el rendimiento de la [18F]FDG-PET/TC (una mediana de 13 días para los falsos negativos y de 5 días para los verdaderos positivos; p=0,19). No obstante, la significación estadística podría estar enmascarada por el pequeño número de casos. La ausencia de resultados falsos positivos en nuestra cohorte puede explicarse en parte por el periodo más largo entre el implante del DEC y la adquisición de la [18F]FDG-PET/TC en los controles, que fue una mediana de 6,1 [0,05-24,31] años. En el estudio de Jeronimo et al.12, la mediana de tiempo entre el implante del dispositivo y la [18F]FDG-PET/TC fue de 2,3 [0,6-6,4] años. Ese estudio, así como en otros trabajos publicados14,15, se afirma que los resultados falsos positivos podrían estar causados por la actividad inflamatoria posoperatoria.
Aunque el ETE es fundamental en el diagnóstico de la infección del cable, puede ser difícil diferenciar las vegetaciones de los cables del electrodo o los pequeños trombos adheridos16. Está comúnmente aceptado que el ETE se realiza inicialmente a pacientes con sospecha de IS, mientras que la [18]FDG-PET/TC debe ser la técnica principal para confirmar la IS debido a la menor sensibilidad de la técnica en las infecciones de los segmentos endovascular e intracardiaco. De manera acorde, en nuestra cohorte el ETE mostró una mayor precisión en el diagnóstico de infecciones del segmento del cable intracardiaco. Sin embargo, vale la pena señalar que el rendimiento de la [18F]FDG-PET/TC fue mejor en infecciones del cable subcutáneo y endovascular en casos de IS con bacteriemia. Un resultado negativo del ETE no descarta la IS12 y, teniendo en cuenta que Pizzi et al. demostraron una mayor sensibilidad de la [18F]FDG-PET/TC combinada con el ETE17, nuestros resultados indican que es posible que la [18F]FDG-PET/TC no sea la única prueba de elección para confirmar una infección local activa15, sino que también puede ser complementaria al ETE en casos de IS. Nuestros datos mostraron que la [18F]FDG-PET/TC utilizada junto con ETE aumentó considerablemente el índice de diagnóstico definitivo de infección del 30,4 al 56,1% (p=0,04) debido a la detección de captación de 18F-FDG del cable endovascular. Además, la [18F]FDG-PET/TC tiene el valor adicional de detectar embolias sépticas14,18–20, como ocurrió en 2 de nuestros casos de IS. Asimismo, este dato coincide con el publicado por Rodríguez-Alfonso et al.21, que demostró que la [18F]FDG-PET/TC reclasificó correctamente al 57% de los pacientes con sospecha inicial de infección de la bolsa del generador mediante la detección de infección del cable con alto rendimiento diagnóstico, sobre todo en pacientes con sospecha inicial de IL.
Algunos autores señalan que un aumento del índice metabólico del bazo y la MO podría utilizarse como signo indirecto de infección4. Nuestro estudio no pudo corroborar esta hipótesis, ya que el VCEmedio del bazo y el VCEmedio de la MO fueron semejantes en casos y controles y entre IL e IS. Sin embargo, la mayoría de los casos de control fueron pacientes con cáncer, en quienes la captación del bazo o la MO puede estar aumentada por la neoplasia, la quimioterapia u otras alteraciones hematológicas. No obstante, se encontraron diferencias importantes en el metabolismo del bazo y la MO entre los pacientes con IS y bacteriemia confirmada en comparación con los casos de IL. Estos resultados pueden explicarse por la hiperactivación esperada del sistema mononuclear fagocítico en casos de bacteriemia, que podría ser útil para distinguir las infecciones bacteriémicas del electrodo de las IL aisladas.
La extracción completa del dispositivo en la EI sobre DEC es obligatoria para curar la infección4,22; sin embargo, en las últimas décadas, no se ha podido realizar cirugía de extracción completa de DEC a un mayor número de pacientes estando indicada5, debido al aumento de las comorbilidades, la edad avanzada y las infecciones más complejas con elevado riesgo quirúrgico de extracción. En estos casos, se ha propuesto la TAS como una estrategia útil para aumento de supervivencia y prevenir recidivas. En nuestra cohorte, los pacientes con extracción incompleta del dispositivo recibieron TAS de duración indefinida, generalmente de por vida, lo que representa deterioro de la calidad de vida de los pacientes, aumento de consultas hospitalarias, efectos adversos, infecciones resistentes a numerosos fármacos y un elevado coste para el sistema sanitario. Hasta la fecha no existe un recurso que guíe a los médicos sobre la duración apropiada del TAS. En nuestra cohorte, se estudiaron 6 casos en que la [18F]FDG-PET/TC, junto con la evolución clínica y los hallazgos microbiológicos y los resultados analíticos, guio de manera útil a los médicos en su decisión de suspender la TAS a pacientes con retirada incompleta de DEC y en ausencia de recaída durante más de 2 años de seguimiento. A pesar del pequeño número de casos de nuestra cohorte, este estudio propone por primera vez la potencial utilidad de la [18F]FDG-PET/TC como un instrumento fiable, en combinación con otras estrategias clínicas, para interrumpir la TAS de manera segura durante el seguimiento de casos con extracción incompleta del dispositivo23,24, que podría validarse en estudios prospectivos con mayor número de pacientes.
LimitacionesEste estudio presenta algunas limitaciones. En primer lugar, es un estudio retrospectivo, con las consecuentes limitaciones en la interpretación y la obtención de los datos; por ejemplo, no se han logrado datos sobre el tratamiento antibiótico previo al ingreso de todos los casos. En segundo lugar, no se pudo evaluar los segmentos de cable intracardiaco en las imágenes de la [18F]FDG-PET/TC de los controles, ya que no siguieron un protocolo de inhibición miocárdica y, por lo tanto, se excluyó el análisis de especificidad de este segmento. Además, no todos los pacientes siguieron sistemáticamente una dieta alta en grasas y baja en hidratos de carbono antes de la realización de la [18F]FDG-PET/TC. En tercer lugar, las comparaciones entre la captación en el bazo y en la MO se basaron en pequeños subgrupos de pacientes con baja potencia estadística. En cuarto lugar, el implante del dispositivo fue más duradero en los controles que en los casos, por lo que no pudo evaluarse la precisión de la [18F]FDG-PET/TC en los DEC implantados recientemente. Por último, el número de casos en que se suspendió el TAS en función de las exploraciones negativas de [18F]FDG-PET/TC fue pequeño y estos resultados preliminares deben confirmarse en estudios adicionales con un grupo de pacientes más numeroso.
Los principales resultados de este estudio son las altas sensibilidad y especificidad de la [18F]FDG-PET/TC para identificar IL y su papel único en el diagnóstico de la infección del segmento de cable subcutáneo y endovascular, que no se puede evaluar mediante ninguna otra técnica diagnóstica. Este trabajo es el primero en comparar el metabolismo del bazo y la MO y su utilidad potencial en la estratificación de infecciones de DEC, lo que demuestra su papel potencial en la detección de bacteriemia. Además, nuestra cohorte es la mayor serie de casos y controles publicada y el único estudio que evalúa la [18F]FDG-PET/TC en el seguimiento del TAS en pacientes con extracción incompleta del dispositivo.
CONCLUSIONESEl rendimiento diagnóstico de la [18F]FDG-PET/TC es alto en infecciones locales de DEC, pero menor en infecciones del cable endovascular e intracardiaco. Sin embargo, la [18F]FDG-PET/TC es la única técnica disponible para diagnosticar la infección del cable subcutáneo y endovascular, y puede ser complementaria al ETE en casos de bacteriemia, lo que aumenta el diagnóstico definitivo de infecciones sistémicas. Además, el metabolismo del bazo y de la MO pueden contribuir a distinguir entre infecciones bacteriémicas del cable e infecciones localizadas aisladas. Aunque se necesitan más estudios prospectivos, el seguimiento de la [18F]FDG-PET/TC podría ser útil en el seguimiento del TAS cuando no puede llevarse a cabo la extracción completa del dispositivo.
- –
La [18F]FDG-PET/TC ha mejorado el diagnóstico de infecciones de DEC y se ha incorporado como un criterio diagnóstico importante en las guías de práctica clínica de endocarditis sobre válvula protésica.
- –
Aunque el rendimiento diagnóstico de la [18F]FDG-PET/TC es alto en el caso de la bolsa, su precisión en otras regiones topográficas de DEC requiere una caracterización más detallada.
- –
El ETE es la técnica diagnóstica de referencia, pero no diferencia bien entre trombo y vegetación. Muchos pacientes con bacteriemia probablemente tienen una infección del cable endovascular, que el ETE no puede detectar.
- –
Recientemente se ha demostrado que el hipermetabolismo del bazo y la médula ósea detectado por la [18F]FDG-PET/TC es un signo indirecto de endocarditis infecciosa en válvulas nativas o protésicas.
- –
No existen datos sobre la utilidad de la [18F]FDG-PET/TC para guiar la duración del tratamiento antimicrobiano oral crónico en pacientes con infecciones de DEC sin la extracción completa del dispositivo.
- –
La especificidad y la sensibilidad de la [18F]FDG-PET/TC son considerables en infecciones locales de la bolsa del generador, pero su sensibilidad es menor en infecciones sistémicas y otras secciones topográficas del cable de DEC.
- –
Se ha demostrado que la [18F]FDG-PET/TC junto con ETE puede aumentar considerablemente el rendimiento de diagnóstico definitivo en infecciones del cable endovascular e intracardiaco.
- –
El hipermetabolismo del bazo y la médula ósea puede ayudar a distinguir la bacteriemia sistémica de las infecciones locales aislad de DEC.
- –
Cuando no es posible la extracción completa del dispositivo, un seguimiento negativo de la [18F]FDG-PET/TC podría indicar a los médicos que el tratamiento antimicrobiano de supresión oral puede interrumpirse.
JMM cuenta con una beca de investigación de intensificación personal del Instituto de Investigaciones Biomédicas August Pi i Sunyer (IDIBAPS) de 2017 a 2023. MHM tuvo una beca de investigación Río Hortega (CM17/00062) de 2018 a 2020. Todos los demás autores declaran que no recibieron fondos, subvenciones ni ningún otro tipo de apoyo durante la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores contribuyeron al concepto y el diseño, la recopilación de datos, la redacción del artículo, la revisión crítica y la aprobación final del artículo. Los datos en que se basa este artículo se compartirán previa petición razonada al autor para correspondencia (datos disponibles previa petición). MHM y AP contribuyeron por igual como primeros autores. Los miembros del equipo de investigadores de endocarditis infecciosa del Hospital Clínic de Barcelona se enumeran en el material adicional.
CONFLICTO DE INTERESESNinguno de los autores tiene ninguna asociación que pueda plantear un conflicto de intereses en este artículo. JMM, como autor para correspondencia, declara no tener conflictos de intereses. Como autor alternativo para correspondencia, DF afirma no tener conflictos de intereses.
Autores con mérito equivalente como primer autor.
El listado del grupo de trabajo de endocarditis infecciosa del Hospital Clínic de Barcelona se puede consultar en el material adicional.



![Figura central. La figura muestra ejemplos de captación positiva de FDG y valores de sensibilidad de la [18F]FDG-PET/TC en una representación visual tridimensional de cada región topográfica del DEC: bolsa (azul), segmento subcutáneo del cable (verde), endovascular (amarillo) e intravascular (rojo). Figura central. La figura muestra ejemplos de captación positiva de FDG y valores de sensibilidad de la [18F]FDG-PET/TC en una representación visual tridimensional de cada región topográfica del DEC: bolsa (azul), segmento subcutáneo del cable (verde), endovascular (amarillo) e intravascular (rojo).](https://static.elsevier.es/multimedia/03008932/0000007600000012/v2_202401211340/S0300893223001276/v2_202401211340/es/main.assets/thumbnail/gr1.jpeg?xkr=eyJpdiI6IjgrU25nNk9tSXk0TWRWTGJNS3lIbmc9PSIsInZhbHVlIjoiVWxUTUhtbU5jYTFaZmNwMzVQWHNjUTdXbHQ5bXFUTHB1cnl5YVZZL1d4ND0iLCJtYWMiOiIyYzE0MDQxOGFiYjUzY2FiNGM0Nzk2YjRmODhmMjM0NTM1Y2YwYjNmNTVkY2E3NmZjNWE0NjI0YTdkNWZlYjk5IiwidGFnIjoiIn0=)
