El bloqueo de rama izquierda (BRI) es un hallazgo muy frecuente en pacientes con insuficiencia cardiaca (IC), en especial en el seno de miocardiopatía dilatada, con publicaciones que demuestran su presencia en hasta el 31% de los pacientes en el momento inicial del diagnóstico1, y que podría ser incluso mayor en función del momento en el curso de la enfermedad en que se analice. Tradicionalmente se ha considerado una consecuencia de la miocardiopatía subyacente2,3, y no una causa de esta, y se ha asociado con un empeoramiento del pronóstico de los pacientes que lo tienen.
La miocardiopatía inducida por BRI es una entidad de difícil definición y demostración cuya causa es la asincronía electromecánica por el BRI, y no la consecuencia de este. La despolarización anormal origina asincronía mecánica, con un movimiento septal anormal y un balanceo apical asociados con una contracción retrasada de los segmentos posterolaterales. Esta asincronía afecta no solo a la función sistólica, sino también a la diastólica, con un acortamiento del tiempo de llenado del ventrículo izquierdo (VI), los que finalmente condiciona un remodelado ventricular con aumento de volúmenes y reducción de la fracción de eyección del VI (FEVI)4. Parece lógico, al menos desde un punto de vista fisiopatológico, que la corrección del trastorno de conducción mediante terapia de resincronización cardiaca (TRC) o estimulación fisiológica del sistema de conducción más allá del punto de bloqueo lleve a la recuperación de la FEVI en ausencia de daño estructural o ultraestructural subyacente. Es, de hecho, la marcada respuesta a la TRC con completa normalización de la FEVI («hiperrespondedores») lo que llevó a plantear la existencia de esta entidad hace ya más de una década5,6 intentando identificarla e independizarla de otras formas de miocardiopatía7,8. Dicha hiperrespuesta a la TRC característica de la miocardiopatía inducida por BRI ha llevado también a analizar el potencial valor de la estimulación de la rama izquierda para la mejoría de la FEVI y la clase funcional, habiéndose evidenciado también la normalización de la FEVI y la mejora de la clase funcional con la estimulación fisiológica9.
La detección precoz de la miocardiopatía inducida por BRI puede tener implicaciones clínicas y terapéuticas significativas, con un potencial beneficio precoz de la TRC, un mejor curso clínico y un pronóstico mucho más favorable que los condicionados por una alteración primaria en los miocitos. Sería necesario disponer de medios fiables que permitiesen un diagnóstico temprano de miocardiopatía inducida por BRI con adecuada certeza diagnóstica, en lugar de alcanzarlo tras la normalización de la FEVI una vez corregido el trastorno de conducción. Para esa detección precoz, Sanna et al.10 propusieron el empleo combinado de parámetros que actuarían a modo de «banderas rojas»: parámetros de ECG (patrón típico de BRI), ecocardiográficos (grosores normales, sin gran dilatación de cavidades ni hipocinesia global), de resonancia magnética (sin fibrosis o escara significativa), ausencia de antecedentes familiares/genéticos y exclusión de otras potenciales etiologías. Sin embargo, a fecha de hoy, su diagnóstico sigue siendo de exclusión y la certeza se obtiene retrospectivamente. En la publicación de Sanna et al. ya se recomendaba el empleo precoz de TRC, algo parecido a lo propuesto por Wang et al.11 en el estudio NEOLITH II, donde el empleo de TRC en los primeros 9 meses desde el diagnóstico de la disfunción ventricular se asociaba con un adecuado remodelado cardiaco y mayor probabilidad de recuperación de la FEVI por encima del 35%, aunque no con objetivos clínicos ni de mortalidad.
En un trabajo reciente de un centro de referencia español publicado en Rev Esp Cardiol, García-Rodeja Arias et al.12 analizan en retrospectiva a un total de 1.497 pacientes ingresados por IC o evaluados en la unidad de IC por disfunción del VI de novo en un periodo de 2 años. Obtuvieron finalmente a 21 pacientes elegibles con disfunción del VI (FEVI <40%) y en ritmo sinusal con BRI de larga evolución (al menos 2 años y con FEVI >50% al diagnóstico), sin otras causas de cardiomiopatía identificables. Eso ya da una idea de lo infrecuente que llega a ser esta etiología, con solo un 1,4% de pacientes elegibles en un hospital terciario de referencia, así como lo rigurosos que fueron los autores al seleccionar a los participantes incluidos en el registro.
El tiempo desde el primer diagnóstico de BRI hasta la primera evaluación en la unidad de IC fue una media de poco más de 4 años. Se trató a los pacientes con fármacos de manera verdaderamente óptima (el 100% con bloqueadores beta, el 95,2% con inhibidores de la neprilisina y del receptor de la angiotensina II, el 80,9% con antialdosterónicos y solo un 42,9% con cotransportador de sodio-glucosa tipo 2 [SGLT2]), justificable por el momento en que se inició el registro, antes de la publicación de los grandes ensayos clínicos y guías de actuación que hoy establecen los SGLT2 como primera línea de tratamiento. La mejoría de la FEVI desde la primera visita hasta el final de la optimización del tratamiento médico fue de 3,2 puntos porcentuales (del 29,5 al 32,7%; p=0,172), y ningún paciente había recuperado la FEVI por completo al final del seguimiento. Tampoco hallaron mejoría de la clase funcional o el volumen telesistólico del VI. Sin embargo, en esa misma población con tratamiento médico óptimo y sin mejoría de FEVI, tras el implante de un dispositivo de TRC en 8 pacientes, la FEVI mejoró significativamente un 18,1± 6,4% y el volumen telesistólico se redujo en más de 37 ml.
Concluyen que el tratamiento médico optimizado según las guías clínicas parece ser ineficaz para mejorar la FEVI y la clase funcional de los pacientes con IC de novo y cardiomiopatía inducida por BRI, pero que la respuesta positiva a la TRC debería hacer que se considerara un implante precoz. Esta conclusión va en la línea de otros trabajos previos13-15 que han mostrado también una baja tendencia a la mejora de la FEVI tras la optimización del tratamiento médico de pacientes con miocardiopatía dilatada y BRI, que abogan también por un implante precoz de la TRC.
Entre las limitaciones del trabajo se encuentran las asociadas con un estudio retrospectivo observacional con solo 21 pacientes (1 de cada 71 analizados) y sin grupo de control, a lo que se añade la dificultad para definir la miocardiopatía inducida por BRI: ¿qué va antes, el huevo o la gallina?, ¿el BRI induce miocardiopatía (disincronopatía) o la primera manifestación en el curso natural de una miocardiopatía dilatada es la aparición del BRI16? Los propios autores comentan la falta de homogeneidad en la definición y la clasificación de esta miocardiopatía, cuyo diagnóstico es de exclusión en la mayoría de los casos. Solo a 8 de los 21 pacientes se les implantó TRC por diferentes motivos, y los resultados podrían haber sido aún más impresionantes y concluyentes si la cifra hubiera sido mayor. Cabría plantearse si un mayor porcentaje de uso de SGLT2 habría influido en los resultados (solo se prescribió al 43% de los pacientes), aunque parece poco probable por la evidencia disponible hasta la fecha. Por último, solo se hizo coronariografía a 4 pacientes (19%), lo que dificulta descartar con absoluta certeza el potencial papel de la isquemia silente a pesar de explorarse con resonancia magnética cardiaca a la mayoría de ellos.
Si bien ya se ha comentado la dificultad en el diagnóstico de certeza de la miocardiopatía con BRI, sería importante sospecharla pronto en pacientes con BRI conocido de larga evolución que desarrollan IC en el seguimiento. Ponnusamy et al. emplean la siguiente definición: a) BRI conocido desde hace más de 1 año, definido según los criterios de Strauss; b) FEVI> 50% en el momento del diagnóstico del BRI; c) deterioro progresivo de la FEVI y el grado funcional; d) ninguna otra causa identificable de miocardiopatía, y e) evidencia ecocardiográfica de disincronía. A priori sería atractivo plantear el implante precoz de TRC para estos pacientes, pero se ha de tener en mente que, hasta la fecha, ningún estudio controlado y aleatorizado ha mostrado que ganar unos meses en el implante de la TRC se traduzca en mejora pronóstica. Parece sabio seguir la recomendación de las guías: primero optimizar el tratamiento médico para, a continuación, plantear la TRC (si está indicada) lo antes posible, incluso en disfunciones ventriculares no tan graves pero claramente condicionadas por el BRI (verdadera disincronopatía), y no años después, cuando puede haberse perdido el «momento» para el remodelado inverso si los cambios electromecánicos iniciales se han transformado ya en cambios estructurales no reversibles. Muy probablemente la estimulación fisiológica, tan en boga en los últimos años, añada cuerpo de evidencia al tratamiento precoz de la miocardiopatía inducida por BRI.
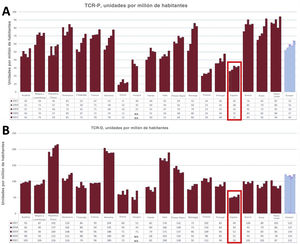
Siguen siendo motivo de reflexión las bajas tasas de implante de TRC en España; según el Registro Español de Marcapasos17, los generadores de TRC totales implantados en España en 2020 han sido 3.850, 1.463 unidades de resincronización de baja energía (TRC-P) y 2.387 de resincronización de alta energía (TRC-D). Según datos de Eucomed18 (figura 1), la tasa de TRC-D en España en 2021 fue de 59 unidades/millón de habitantes y la de TRC-P, 32 unidades/millón. Sin embargo, ese mismo año la media en Europa fue de 122 unidades de TRC-D/millón y 64 de TRC-P/millón, lo que muestra que seguimos por debajo de la mitad del promedio de implantes de TRC en Europa.
Tasas de implante de TRC-P (A) y TRC-D (B) por millón de habitantes en diferentes países europeos y media de Europa (conjunto de barras de la derecha) desde 2017 hasta 2021. Resaltados con un recuadro, los datos de España. Información reproducida con permiso de MedTech Europe18, basada en informes de los principales fabricantes.
Debemos agradecer a los autores su contribución a mejorar nuestro conocimiento y el abordaje de la miocardiopatía inducida por BRI. Su propuesta de un abordaje precoz con TRC sin esperar a la optimización del tratamiento médico, adelantada a la recomendación actual de las guías de práctica clínica, requiere una mejor definición de dicha miocardiopatía desde el primer momento en que se documenta disfunción ventricular, así como estudios prospectivos con un tamaño significativamente mayor que permitan establecer con claridad no solo la respuesta a la TRC, sino la relación temporal de dicha respuesta con el inicio del BRI. ¿Hay un tiempo límite para revertir los cambios electromecánicos inducidos por el BRI? ¿El retraso en el inicio de la TRC podría perder un tiempo crítico para revertir el daño miocárdico progresivo? ¿La resonancia magnética cardiaca permitiría detectar a los pacientes con BRI y potencial miopatía asociada que van a beneficiarse precozmente de la TRC? Estas y otras cuestiones han de resolverse mediante estudios aleatorizados de mayor tamaño antes de recomendar sistemáticamente el implante precoz de TRC o la estimulación fisiológica.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESHonorarios por consultoría de Medtronic y Abbott; honorarios por conferencias, eventos educativos y presentaciones de Metronic, Boston Scientific y Bayer; apoyo para asistencia a congresos de Daiichi Sankyo y Abbot; ninguno relacionado con este artículo.