La exposición a radiación ionizante en los procedimientos de ablación conlleva riesgos para la salud, sobre todo en pacientes pediátricos. Nuestro objetivo es comparar la seguridad y la eficacia de la ablación guiada por un sistema de navegación intracardiaca no fluoroscópica (SNINF) con las de la ablación guiada exclusivamente por fluoroscopia en pacientes pediátricos.
MétodosSe analizaron los resultados de la ablación con catéter en pacientes pediátricos con vías accesorias de riesgo o taquicardias supraventriculares remitidos a nuestro centro en un periodo de 6 años. Se compararon los procedimientos guiados solo por fluoroscopia (grupo A) y los guiados por SNINF (grupo B).
ResultadosSe analizaron 120 procedimientos de ablación en 110 pacientes (edad, 11±3,2 años; el 70% varones), 62 procedimientos en el grupo A y 58 en el grupo B. No se encontraron diferencias significativas entre ambos grupos en éxito del procedimiento (el 95% del grupo A y el 93,5% del grupo B; p=0,53), complicaciones (el 1,7 frente al 1,6%; p=0,23) y recurrencia (el 7,3 frente al 6,9%; p=0,61). Sin embargo, el tiempo de fluoroscopia (mediana, 1,1 frente a 12 min; p<0,0005) y el tiempo de ablación (mediana, 96,5 frente a 133,5 s; p=0,03) fueron menores en el grupo B. La presencia de cardiopatía se comportó como un predictor independiente de recurrencia (p=0,03).
ConclusionesEl SNINF para guiar los procedimientos de ablación en pacientes pediátricos reduce el tiempo de exposición a la radiación ionizante. Su empleo generalizado en las ablaciones pediátricas podría reducir el riesgo atribuido a la radiación.
Palabras clave
La ablación con catéter se ha establecido en los últimos años como el tratamiento de elección de las taquicardias supraventriculares (TSV) en la población pediátrica1,2. Estudios tanto retrospectivos como prospectivos han demostrado que se trata de un método eficaz y seguro incluso en lactantes de menos de 1 año3–7.
La fluoroscopia con radiación ionizante ha permitido guiar los procedimientos de ablación desde sus inicios; sin embargo, se acompaña de efectos perjudiciales tanto para el profesional8 como para el paciente, y la población pediátrica es especialmente sensible10–12. Existe un riesgo definitivo de inducción de cáncer9 para el que no hay una dosis umbral mínima de seguridad, por lo que lo deseable es reducir la dosis de radiación al mínimo posible siguiendo el principio ALARA (as low as reasonably achievable, es decir, tan poca como sea razonablemente posible).
Los sistemas de navegación intracardiaca no fluoroscópica (SNINF) se han demostrado eficaces en procedimientos de ablación con mínimo o nulo empleo de fluoroscopia13. Sin embargo, a pesar de que la población pediátrica es más vulnerable al daño por radiación y de que existen algunos estudios sobre la seguridad y la eficacia del tratamiento de TSV con mínimo o nulo empleo de fluoroscopia14–16, su uso es poco habitual en nuestro medio. Un estudio reciente, en el que participaron electrofisiólogos de 42 centros europeos respondiendo a un cuestionario, pone en evidencia que solo en el 23% de los casos de TSV se utilizó un SNINF17. Recientemente se han publicado los resultados de la serie más larga de ablaciones pediátricas registrada en España, en la que se emplearon SNINF en solo un 20% de los procedimientos18.
El objetivo de nuestro trabajo es comparar, en una serie consecutiva de pacientes pediátricos con preexcitación por vías accesorias (VAC) de riesgo o TSV tratados con ablación, los resultados de seguridad y eficacia del procedimiento guiado con SNINF con los del abordaje convencional.
MÉTODOSEstudio observacional retrospectivo unicéntrico en el que se incluyó a todos los pacientes consecutivos menores de 16 años sometidos a ablación en un centro de referencia regional, durante un periodo de 6 años (enero de 2013 a enero de 2019). El protocolo fue aprobado por el Comité Ético del hospital.
Pacientes y grupos de estudioEl SNINF se empleó para guiar la colocación de catéteres diagnósticos, el mapeo y la ablación. Se utilizó cada vez con más frecuencia a medida que avanzaba la curva de aprendizaje: el 20% de los casos realizados en 2013 y el 100% a partir de 2017. La razón principal para usar los SNINF fue minimizar la fluoroscopia (abordaje con mínima escopia) o eliminarla por completo (abordaje sin fluoroscopia).
Todos los procedimientos los realizó un mismo operador con amplia experiencia en ablación pediátrica.
Se registraron las características sociodemográficas del paciente, su peso, la presencia o ausencia de cardiopatía, el sustrato abordado, el SNINF elegido, los tiempos de procedimiento (desde el inicio de punciones hasta la retirada de catéteres), de fluoroscopia y de ablación (que se obtuvo de la suma de los segundos de cada aplicación con radiofrecuencia o crioenergía hasta que se obtuvo éxito o se dio por finalizado el procedimiento por fracaso), así como la fuente de energía utilizada, el éxito del procedimiento, las complicaciones y las recurrencias a corto (6 meses) y largo plazo (hasta el final del seguimiento). Se compararon los procedimientos guiados solo por fluoroscopia (grupo A) y los guiados con un SNINF (grupo B).
Estudio electrofisiológicoTodos los procedimientos se realizaron con anestesia general. Se canalizó la vena braquial izquierda para la introducción del catéter de seno coronario y la vena femoral para los demás catéteres, excepto en caso de que el sustrato abordado fuera una VAC derecha de localización paraseptal superior derecha, en las que se utilizó como primera opción la vía de acceso yugular19.
Se emplearon 2 catéteres diagnósticos decapolares, uno para el seno coronario y otro posicionado en el ápex del ventrículo derecho para registro simultáneo del hisiograma. El SNINF empleado fue el sistema CARTO3 (Biosense Webster, Estados Unidos).
En los casos con ECG que indicara un sustrato arrítmico en cavidades derechas (taquicardia intranodular [TIN], taquicardia auricular [TA] derecha, presencia de VAC de probable localización derecha), se planificó el procedimiento con abordaje sin fluoroscopia. El catéter de ablación, que dispone de sensor magnético y se visualiza durante todo el trayecto del sistema vascular, crea una matriz eléctrica sobre la cual se consigue visualizar los catéteres sin sensor una vez alcanzan dicha matriz. El catéter de ablación realizó una reconstrucción tridimensional de aurícula derecha, venas cavas y seno coronario que facilitaba la colocación de los catéteres sin sensor.
Se planificó un procedimiento con mínima escopia en los casos con preexcitación asintomática o clínica de palpitaciones sin taquicardia documentada, en los que podría no precisarse la ablación, con la finalidad de evitar el uso innecesario de un catéter de ablación. Todas las VAC izquierdas se abordaron por vía retroaórtica y la fluoroscopia se empleó para atravesar la válvula aórtica. En todos los procedimientos se estableció un tiempo de espera de 30 min tras la aplicación de éxito.
AblaciónEl sustrato arrítmico se clasificó como VAC auriculoventricular, TIN o TA. Se empleó como catéter de ablación con radiofrecuencia uno no irrigado con punta de 4 mm, y se aplicó radiofrecuencia con potencia entre 20 y 40W. Para la crioablación se empleó un catéter de 6 mm con criomapeo entre –30 y –50°C y crioablación a –70°C. El catéter de crioablación no tiene sensor magnético, por lo que el procedimiento requirió de inicio utilizar un catéter de ablación con radiofrecuencia con sensor para hacer la reconstrucción electroanatómica, marcar el punto con mayor precocidad y grabar la sombra del catéter como referencia. Posteriormente se intercambiaba por el catéter de crioablación configurado como catéter diagnóstico en el navegador para poder visualizarlo sobre el mapa ya creado.
Los criterios habituales sirvieron para determinar el éxito agudo del procedimiento: en el caso de la TIN, la supresión o modulación de la vía lenta (se aceptó la presencia de hasta 1 eco nodular); para las TA, la ausencia de inducibilidad y en las VAC, la ausencia de conducción bidireccional tras infusión de adenosina trifosfato (ATP)20,21.
SeguimientoSe dio de alta a los pacientes al día siguiente de la ablación tras realizarles un electrocardiograma para descartar complicaciones o recurrencias precoces en caso de síndrome de Wolff-Parkinson-White.
Al tratarse de un centro de referencia, las visitas de seguimiento dependieron del centro de procedencia, pero en todos los casos se realizó una visita al año en la consulta de cardiología pediátrica de nuestro hospital. La recurrencia se definió como la reaparición sintomática con documentación electrocardiográfica de la taquiarritmia o la reaparición de la preexcitación ventricular.
Se registraron como recurrencias precoces las que ocurrieron en los 6 meses posteriores a la ablación y como recurrencias tardías, las ocurridas desde esa fecha hasta el final del seguimiento.
Análisis estadísticoLa comparación de variables cualitativas se hizo mediante la prueba de la χ2 o la prueba exacta de Fisher y el estudio de variables cuantitativas, con la prueba de la t de Student en caso de que siguieran una distribución normal o el test de Mann-Whitney en otro caso. Se consideró significativo un valor de p <0,05. Para establecer predictores de recurrencia, se seleccionaron las variables relacionadas con un episodio recurrencia en los primeros 6 meses tras la ablación (p <0,1) y se contrastaron mediante regresión logística multivariable, incluyendo todas las variables significativas en el análisis multivariante y utilizando un método stepwise para seleccionar el modelo que incluya únicamente las variables significativas. El uso de SNINF se incluyó en dicho análisis por ser la variable principal del estudio. Para el análisis de resultados se empleó el programa estadístico SPSS, versión 21.0 (Estados Unidos).
RESULTADOSCaracterísticas basalesDesde enero de 2013 hasta abril de 2019, se realizaron 120 procedimientos de ablación en 110 pacientes pediátricos con VAC de riesgo o TSV, el 70% varones. La media de edad fue 11±3,2 (intervalo, 0,1-15,9) años; la del peso, 45,5±16,5 (2,5-83) kg. El 5,8% de los niños eran menores de 5 años y el 4,2% pesaba menos de 15kg. Siete procedimientos fueron redo. El 10% tenía cardiopatía estructural: valvulopatía aórtica bicúspide (n=2), prolapso mitral (n=2), anomalía de Ebstein (n=2), miocardiopatía no compactada, miocardiopatía hipertrófica (n=2), ventrículo único intervenido y comunicación interventricular subaórtica cerrada quirúrgicamente (n=2). El 42,5% había recibido algún fármaco antiarrítmico; los más frecuentes fueron los bloqueadores beta (38%).
El sustrato más frecuentemente ablacionado fueron las VAC (74,2%), seguidas de las TIN (20,8%) y las TA (5%). Respecto a la localización de las VAC, 50 (56,2%) fueron vías izquierdas, 23 (25,8%) septales (12 [10%] VAC paraseptal inferior derecha, 4 [3,3%] VAC paraseptal inferior derecha decremental, 2 [1,7%] VAC medioseptales y 5 [4,2%] VAC paraseptal superior derecha) y 16 (18%) derechas, una de ellas tipo Mahaim. Los diferentes sustratos abordados se exponen en la tabla 1.
Características basales, sustratos abordados, energía aplicada para la ablación y localización de las VAC de ambos grupos
| Todas las ablaciones (n=120) | Ablaciones con fluoroscopia (n=58) | Ablaciones con mínimo o nulo empleo de fluoroscopia (n=62) | p | |
|---|---|---|---|---|
| Características demográficas | ||||
| Varones | 70 (58,3) | 29 (50,0) | 41 (6,1) | 0,10 |
| Edad (años) | 11±3,2 | 10,5±2,9 | 11,4±3,4 | 0,15 |
| Edad <5 años | 7 (5,8) | 4 (6,9) | 3 (4,8) | 0,71 |
| Peso (kg) | 45,5±16,5 | 43,8±14,6 | 47,1±18,1 | 0,26 |
| Peso <15 kg | 5 (4,2) | 3 (5,1) | 2 (3,2) | 0,67 |
| Cardiopatía | 12 (10) | 6 (10,3) | 6 (9,6) | 0,57 |
| Fármacos previos a la ablación | ||||
| Algún fármaco | 51 (42,5) | 26 (44,8) | 25 (40,3) | 0,71 |
| Bloqueadores beta, digoxina | 46 (38,3) | 24 (41,3) | 22 (35,5) | 0,57 |
| Flecainida | 14 (11,7) | 9 (15,5) | 5 (8) | 0,26 |
| Sustrato | ||||
| TIN | 25 (20,8) | 16 (27,5) | 9 (14,5) | 0,11 |
| TA (TAF o TAMR) | 6 (5) | 0 (0) | 6 (9,6) | 0,03 |
| VAC manifiestas derechas | 28 (23,3) | 12 (20,6) | 16 (25,8) | 0,52 |
| VAC ocultas derechas | 11 (9,2) | 4 (6,9) | 7 (11,2) | 0,53 |
| VAC manifiestas izquierdas | 25 (20,8) | 12 (20,6) | 13 (21) | 0,57 |
| VAC ocultas izquierdas | 25 (20,8) | 14 (24,1) | 11 (17,7) | 0,50 |
| Energía | ||||
| Radiofrecuencia | 110 (91,7) | 54 (93,1) | 56 (90,3) | 0,52 |
| Crioablación | 10 (8,3) | 6 (10,3) | 4 (6,4) | 0,52 |
TA: taquicardia auricular; TAF: taquicardia auricular focal; TAMR: taquicardia auricular macrorreentrante; TIN: taquicardia intranodular; VAC: vía accesoria.
Los resultados se expresan en n (%) y media±desviación estándar.
La mayoría de las ablaciones se realizaron con radiofrecuencia (91,7%). Se realizó crioablación en 10 procedimientos: 5 TIN, 3 VAC paraseptales superiores derechas, una VAC medioseptal y una VAC paraseptal inferior derecha decremental.
El procedimiento se guio exclusivamente con fluoroscopia en 58 casos (grupo A), se empleó un SNINF en 62 (grupo B), con intención de mínima fluoroscopia en 31 y sin fluoroscopia en 31; en 4 casos hubo que recurrir a la fluoroscopia, por lo que finalmente se completaron sin escopia 27 procedimientos.
Las características basales, los fármacos empleados y la energía aplicada para la ablación fueron similares en los 2 grupos (tabla 1). La crioablación se empleó en 6 pacientes (10,9%) del grupo A y en 7 (6,7%) del B (p=0,52). En todas las TA se utilizó un SNINF para la cartografía. El abordaje de cada uno de los sustratos se muestra en la tabla 2.
Sustratos de ablación realizados con fluoroscopia, con mínima fluoroscopia o sin escopia
| Ablaciones con fluoroscopia (n=58) | Ablaciones con mínima fluoroscopia (n=35) | Ablaciones sin fluoroscopia (n=27) | p | |
|---|---|---|---|---|
| TIN | 16 (27,5) | 1 (2,8) | 8 (29,6) | 0,003 |
| TA (TAF o TAMR) | 0 (0) | 4 (11,4) | 2 (7,4) | 0,013 |
| VAC manifiestas derechas | 12 (20,6) | 3 (8,5) | 13 (48,1) | 0,002 |
| VAC ocultas derechas | 4 (6,9) | 3 (8,5) | 4 (14,8) | 0,506 |
| VAC manifiestas izquierdas | 12 (20,6) | 13 (37,1) | 0 | <0,001 |
| VAC ocultas izquierdas | 14 (24,1) | 11 (31,4) | 0 | 0,002 |
TA: taquicardia auricular; TAF: taquicardia auricular focal; TAMR: taquicardia auricular macrorreentrante; TIN: taquicardia intranodular; VAC: vía accesoria.
Los resultados se expresan en n (%).
No se encontraron diferencias significativas en el porcentaje de éxito agudo (el 95% del grupo A y el 93,5% del grupo B; p=0,53). Asimismo, el porcentaje de complicaciones no fue diferente: el 1,7% en el grupo A, en el que se produjo un bloqueo auriculoventricular de primer grado durante la ablación con radiofrecuencia de una VAC medioseptal que no precisó tratamiento, y el 1,6% en el B, en el que un paciente con miocardiopatía hipertrófica sufrió un derrame pericárdico ligero sin repercusión hemodinámica ni necesidad de drenaje durante la ablación de una VAC oculta posterior izquierda (p=0,23) (tabla 3).
Comparación de los tiempos de procedimiento, fluoroscopia y ablación y tasas de éxito, recurrencias y complicaciones en ambos grupos
| Ablaciones con fluoroscopia (n=58) | Ablaciones con mínimo o nulo empleo de fluoroscopia (n=62) | p | |
|---|---|---|---|
| Éxito agudo | 55 (95) | 58 (93,5) | 0,530 |
| Complicaciones | 1 (1,7) | 1 (1,6) | 0,237 |
| Tiempo de procedimiento (min) | 116,1±50,7 | 128,4±53,6 | 0,202 |
| Tiempo de escopia (min) | 12 [5-23] | 1,1 [0-3] | <0,001 |
| Tiempo de ablación (s) | 196,5 [96-388,7] | 133,5 [83,7-206] | 0,032 |
Los resultados se expresan en n (%), media±desviación estándar o mediana [intervalo intercuartílico].
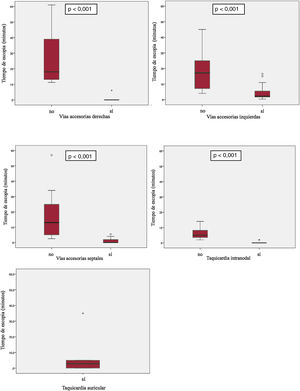
El SNINF redujo tanto el tiempo de escopia —mediana, 1,1 [0-3] frente a 12 [5-23] min (p <0,0005)— como el tiempo de ablación —96,5 [96-388,7] frente a 133,5 [83,7-206] s (p=0,03)— (figura 1 y tabla 3) sin modificar la duración del procedimiento (116,1±50,7min en el grupo A frente a 128,4±53,6min en el B; p=0,2). Los tiempos de escopia para cada sustrato en ambos grupos se recogen en la figura 2. Para los realizados con crioablación, en el grupo A la mediana de tiempo de escopia fue de 6,25 [3,6-12,7] frente a 0 [0-2,2] min en el grupo B.
Para el análisis de las recurrencias se excluyeron los procedimientos que no habían tenido éxito (7 casos en 4 pacientes), por lo que el análisis fue sobre 113 procedimientos.
El seguimiento medio fue de 40,9±21,6 meses, más largo en el grupo A que en el B (56,5±13,8 frente a 26,3±16,8 meses; p <0,0005).
Todas las recurrencias tras la ablación con éxito ocurrieron en los primeros 6 meses, similar entre ambos grupos, 4 de 55 (7,3%) en el grupo A y 4 de 59 (6,9%) en el B (p=0,61).
La tasa de recurrencia con la crioablación fue similar que con radiofrecuencia: en el grupo de crioablación hubo solo 1 (10%) y 7 de 103 (6,79%) en el grupo de radiofrecuencia (p=0,535).
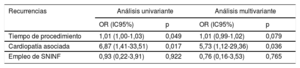
Predictores de recurrenciasEn el análisis univariante se observó una mayor tasa de recurrencias en los pacientes con cardiopatía (odds ratio [OR]=6,87; intervalo de confianza del 95% [IC95%], 1,41-33,51; p=0,017) y en las ablaciones con tiempos de procedimiento más largos (OR=1,01; IC95%, 1,00-1,03; p=0,049).
Se realizó un análisis multivariante (tabla 4) para establecer predictores de recurrencia, en el que la única variable asociada de manera independiente con las recurrencias tras la ablación fue la presencia de cardiopatía estructural (OR=5,73; IC95%, 1,12-29,36; p=0,036).
Análisis univariable y multivariable. Factores asociados con recurrencia en los primeros 6 meses tras la ablación
| Recurrencias | Análisis univariante | Análisis multivariante | ||
|---|---|---|---|---|
| OR (IC95%) | p | OR (IC95%) | p | |
| Tiempo de procedimiento | 1,01 (1,00-1,03) | 0,049 | 1,01 (0,99-1,02) | 0,079 |
| Cardiopatía asociada | 6,87 (1,41-33,51) | 0,017 | 5,73 (1,12-29,36) | 0,036 |
| Empleo de SNINF | 0,93 (0,22-3,91) | 0,922 | 0,76 (0,16-3,53) | 0,765 |
IC95%: intervalo de confianza del 95%; NS: no significativo; OR: odds ratio; SNINF: sistema de navegación intracardiaca no fluoroscópica.
En este estudio se muestran los resultados de la ablación en pacientes pediátricos en una serie consecutiva a lo largo de 6 años en un centro terciario de referencia regional, con una tasa de éxito muy elevada y baja tasa de complicaciones. Confirma en la población pediátrica que el SNINF para la ablación con mínimo o nulo empleo de escopia es eficaz y seguro, con tasas de éxito y complicaciones similares a las de ablación guiada por fluoroscopia. Esta técnica aporta además varias ventajas respecto a la técnica convencional: una importante reducción de la radiación ionizante y los tiempos de ablación.
Ablación en pacientes en edad pediátricaEstos resultados son similares a los publicados en otras series en población pediátrica22–25. Pese a que hoy en día la ablación con catéter en edad pediátrica es el tratamiento de elección2,26, la cifra de ablaciones en nuestro medio continúa siendo baja. En el año 2018 en España se realizaron en total 353 ablaciones pediátricas, lo que supone el 2,1% del total de ablaciones en nuestro país. Además, se han realizado dichas ablaciones en un total de 46 centros, pese a la recomendación actual de agruparlas en centros de referencia que intervengan un gran número de casos cada año, tengan experiencia en anestesia y cirugía cardiovascular infantil y estén equipados con SNINF4. En nuestro centro, en consonancia con las series europeas más recientes7,18,27, se vienen realizando más de 20 ablaciones pediátricas al año, dentro de un volumen total en torno a las 400 ablaciones, donde es sistemático el uso de SNINF y los procedimientos sin escopia en adultos y niños.
Ablación en niños con mínimo o nulo empleo de escopiaEste estudio demuestra la factibilidad, la seguridad y la eficacia de realizar las ablaciones con mínimo o nulo empleo de fluoroscopia en población pediátrica, una técnica más extendida en las ablaciones de adultos. En la ablación pediátrica, los SNINF se emplean en apenas el 20% de los casos17,18, aun cuando el riesgo asociado con la radiación es mayor que en los adultos9. Este hecho no encuentra fácil explicación, quizá simplemente haya poca conciencia y se asumen tiempos de fluoroscopia largos en los niños; así, entre los criterios de calidad para designación CSUR como de referencia del Sistema Nacional de Salud Español se encuentra un tiempo medio de radiación <30 min28.
A partir de 2015, alineados con el principio ALARA y una vez finalizada la curva de aprendizaje, en nuestro laboratorio se decidió optar sistemáticamente por una estrategia de mínimo o nulo empleo de escopia mediante SNINF. Se comprobó la factibilidad y la eficacia de este abordaje, con unos resultados equiparables a los de la técnica convencional en la ablación de TIN y flutter auricular común13,29,30.
En este trabajo se extiende la experiencia a la ablación pediátrica, una población especialmente vulnerable a los efectos estocásticos de las radiaciones ionizantes. Al comparar con el grupo convencional, se observa que el abordaje con mínimo o nulo empleo de escopia, sin prolongar los tiempos de procedimiento, redujo significativamente el tiempo de exposición a la radiación ionizante durante el procedimiento de ablación, con lo que se minimizan las graves consecuencias ligadas a la radiación, entre las que destaca el riesgo de cáncer31 a lo largo de la vida, un periodo que lógicamente es mayor para los niños. El uso sistemático de SNINF beneficia también a los profesionales, por el impacto en la dosis acumulada de radiación a lo largo de su vida profesional y por prevenir el riesgo de lesiones graves de columna que conlleva portar delantales plomados durante los procedimientos32.
Los resultados a medio plazo se mantienen, en ambos grupos son similares las tasas de éxito, complicaciones y recurrencias a los 6 meses.
El tiempo de ablación fue menor en el grupo con mínimo o nulo empleo de escopia, en consonancia con lo reportado en estudios previos en población adulta y pediátrica33.
No tenemos constancia de que se haya comunicado esta reducción en el tiempo de ablación empleando SNINF para guiar la ablación en población pediátrica. Creemos que es un hallazgo relevante, puesto que un menor tiempo de ablación conllevaría menos extensión de las lesiones producidas en el endocardio, ya que se ha publicado que en los niños el tejido miocárdico está aún en desarrollo, y el tamaño de la lesión aumenta a medida que crecen34, con potenciales efectos negativos. Esta es una razón más a favor de una mayor seguridad de la ablación con mínimo o nulo empleo de escopia que debería llevar a que esta técnica se incorpore a la rutina de todos los centros que practiquen ablaciones en población pediátrica35.
Los resultados de eficacia y seguridad concuerdan con los estudios previos, tanto si las ablaciones se guían por escopia como si no7,18,36. Nuestra serie presenta un alto porcentaje de éxito agudo y una baja tasa de recurrencias, de las que es factor predictor la presencia de cardiopatía estructural, un dato ya reportado en la literatura18.
LimitacionesSe trata de un estudio retrospectivo con las limitaciones que le son propias, si bien se han incluido todos los casos consecutivos. En este periodo en nuestro centro no se realizó ablación pediátrica de ninguna arritmia ventricular. Además, el hecho de que el seguimiento en el grupo con mínimo o nulo empleo de escopia sea más corto que en el grupo convencional impide tener certeza sobre las recurrencias a largo plazo, aunque es cierto que en el grupo de fluoroscopia todas las recurrencias ocurrieron precozmente, antes de los 6 meses de seguimiento, lo que hace pensar que no debe de haber más recurrencias tardías en el grupo con mínimo o nulo empleo de escopia. Los procedimientos realizados con crioablación fueron pocos, lo que podría justificar que no se observara una mayor tasa de recurrencias en comparación con la radiofrecuencia. En esta serie de casos consecutivos, en ningún caso se empleó el abordaje transeptal para la ablación de sustratos izquierdos, por lo que los resultados no son extrapolables a ablaciones por esa vía.
CONCLUSIONESLa ablación pediátrica en pacientes con VAC de riesgo o TSV guiada por un SNINF es factible y reduce significativamente los tiempos de escopia y de ablación sin incrementar el tiempo de procedimiento, además de mantener unas tasas de éxito y complicaciones comparables a las de la ablación guiada por fluoroscopia.
El SNINF para guiar los procedimientos de ablación en pacientes pediátricos reduce el tiempo de exposición a la radiación ionizante. Su uso generalizado en las ablaciones pediátricas podría reducir el riesgo atribuido a la radiación.
CONFLICTO DE INTERESESNinguno.
- –
Se ha demostrado que la ablación con catéter con mínimo o nulo empleo de escopia disminuye los tiempos de fluoroscopia y ablación mientras mantiene una eficacia y una seguridad similares a las de la ablación guiada por fluoroscopia en población adulta.
- –
Sin embargo, hay pocos datos de esta práctica aplicada a la población pediátrica.
- –
Este estudio demuestra que la ablación con mínimo o nulo empleo de escopia es igualmente factible en pacientes en edad pediátrica.
- –
La ablación con mínimo o nulo empleo de escopia disminuye los tiempos de fluoroscopia y ablación con tasas de éxito y complicaciones comparables a las de la ablación guiada por fluoroscopia.
- –
Los resultados son equiparables a los de la población adulta.