Los primeros ensayos clínicos han demostrado que la terapia celular puede mejorar el proceso de recuperación cardiaca tras la fase aguda del infarto de miocardio y la función cardiaca en la cardiopatía isquémica crónica. Sin embargo, algunos estudios han mostrado resultados contradictorios y aún existen dudas acerca de los mecanismos de acción y sobre la estrategia de tratamiento ideal para conseguir una mayor reparación cardiaca. En este capítulo se revisa la evidencia disponible actualmente, se analizan los ensayos clínicos de fases I y II y sus limitaciones, se discuten los puntos clave para el diseño de futuros estudios y se anticipa el futuro de los nuevos campos de investigación en este fascinante campo de la investigación cardiovascular traslacional.
Palabras clave
Los últimos avances en las estrategias de reperfusión han reducido espectacularmente la mortalidad de los pacientes con infarto agudo de miocardio (IAM). Como consecuencia, se ha observado un incremento de la incidencia del síndrome de insuficiencia cardiaca congestiva (ICC) entre los supervivientes. El tratamiento médico óptimo y la implantación de dispositivos como los desfibriladores o la resincronización cardiaca han mejorado el pronóstico y la calidad de vida de estos pacientes. Sin embargo, las tasas de mortalidad y los índices de reingresos de estos pacientes aún son altos y conllevan un elevadísimo coste económico y de recursos para los sistemas sanitarios.
El campo de la terapia celular aplicada a las enfermedades cardiovasculares ha surgido como otra alternativa en respuesta a esta necesidad, y ha tenido un rápido progreso. Su objetivo final, restaurar el miocardio dañado y mejorar la función cardiaca, es un auténtico reto, ya que la pérdida de cardiomiocitos tras un IAM es del orden de 1 billón de células, porque las células madre administradas precisan de células y sustancias de soporte, y debido a que las señales moleculares del miocardio que guían a las células hacia la diferenciación cardiaca o la secreción de factores paracrinos pueden estar ausentes en un tejido dañado por la isquemia1.
Los estudios realizados en los últimos 15 años han mostrado efectos beneficiosos en menor o mayor medida, y los resultados de la terapia celular analizados en conjunto son alentadores. Los ensayos clínicos de fases I y II indican que la terapia celular es un tratamiento seguro que puede mejorar la función cardiaca después de un IAM y en la fase crónica de la enfermedad arterial coronaria (EAC) aterosclerótica. Sin embargo, los resultados de los ensayos clínicos no son uniformes, y esto se debe a: a) la falta de estandarización y optimización de los protocolos de aislamiento y administración celular; b) la ausencia de una nomenclatura común universalmente aceptada y la existencia de una terminología imprecisa, y c) el gran número de tipos celulares en investigación en diferentes situaciones clínicas. Sin embargo, estas incertidumbres mecanicistas no deben impedir el desarrollo de nuevos ensayos clínicos, ya que son los únicos estudios capaces de ayudarnos a identificar y desentrañar los aspectos desconocidos observados en nuestros subóptimos modelos preclínicos.
Se puede reducir o evitar estas discordancias si seguimos la metodología científica clásica con rigor. Aunque se considera a la investigación en terapia celular un nuevo y novedoso campo de investigación, no debe apartarse del camino del método científico, descrito hace más de dos mil años y reafirmado en los tiempos de Aristóteles como un método de formular y responder cuestiones a partir de observaciones y basado en la experimentación. Esta metodología incluye una serie de fases: a) formular una pregunta; b) recopilar el conocimiento existente; c) construir una hipótesis de trabajo; d) comprobar la hipótesis mediante un experimento; e) analizar los datos obtenidos y extraer una conclusión, y f) comunicar los resultados.
En el caso de la terapia celular, los ensayos clínicos comenzaron preguntándose si existe la posibilidad de reparar el corazón después de diferentes tipos de daño tisular. La evidencia disponible ha demostrado ya que esta posibilidad existe a través de la administración de células madre en varios modelos preclínicos de miocardiopatías. Por lo tanto, a la hora de diseñar nuevos ensayos clínicos en humanos, las cuestiones clave son: a) formular una hipótesis adecuada; b) seleccionar la población ideal, el tipo celular adecuado y el método de administración más eficiente, y c) diseñar un protocolo de investigación correcto y preciso. Estos parámetros deben definirse a la luz de la evidencia disponible y con una mentalidad traslacional, en la que los datos experimentales/preclínicos ayuden a diseñar nuevos ensayos clínicos y viceversa, que los resultados de los estudios en humanos devuelvan nuevas cuestiones e hipótesis al laboratorio y a los modelos animales.
Escenarios Clínicos en Terapia Celular Aplicada al Miocardio. Evidencia ActualLa terapia celular ha acumulado gran cantidad de evidencia en diferentes escenarios fisiopatológicos en modelos preclínicos con animales pequeños y grandes, pero la investigación en humanos se ha reducido casi exclusivamente a la cardiopatía isquémica por enfermedad arterial coronaria (EAC) aterosclerótica. Este artículo se centra exclusivamente en los ensayos clínicos aleatorizados en humanos (tablas 1–4), ya que los modelos animales escapan al objetivo de esta revisión y los estudios observacionales no aleatorizados no aportan el mismo grado de evidencia. A través del análisis de los ensayos clínicos más relevantes y con mayor número de pacientes, se muestran sus limitaciones y las variables asociadas a los procedimientos que determinan los resultados.
Ensayos clínicos aleatorizados con células madre en pacientes con infarto agudo de miocardio (administración intracoronaria).
| Estudio (año) | n | Tipo celular | Células | Días tras IAM | Objetivo principal (seguimiento) | Comentarios |
| Chen et al11 (2004) | 69 | CM | 9 × 109 | 18 | Mejora de la FEVI a los 6 meses | FEVI por ecocardiografía |
| BOOST2 (2004) | 60 | CMMO | 2 × 109 | 6 ± 1 | Mejora de la FEVI a los 6 meses | Disminución del efecto tras 18 y 61 meses |
| REPAIR-AMI3 (2006) | 187 | CMMO | 2 × 108 | 3–6 | Mejora de la FEVI a los 4 meses | FEVI por ventriculografía |
| Janssens et al6 (2006) | 66 | CMMO | 2 × 108 | 1 | Sin cambios de la FEVI a los 4 meses | Mejora de la contractilidad regional y el tamaño del infarto |
| ASTAMI7 (2006) | 97 | CMMO | 7 × 107 | 6 ± 1 | Sin cambios de la FEVI a los 6 meses | Aumento de FEVI del 8% por SPECT y el 1% por RM |
| TCT-STAMI36 (2006) | 20 | CMMO | 4 × 107 | 1 | Mejora de la FEVI a los 6 meses | FEVI por ecocardiografía |
| FINCELL4 (2008) | 77 | CMMO | 4 × 108 | 3 | Mejora de la FEVI a los 6 meses | FEVI por ventriculografía |
| Meluzin et al37 (2006) | 66 | CMMO | 1 × 107 (dosis bajas); 1 × 108 (dosis altas) | 7 | Mejora de la FEVI a los 3 meses con dosis altas | FEVI por SPECT |
| Penicka et al38 (2007) | 27 | CMMO | 3 × 109 | 9 | Sin cambios de la FEVI a los 4 meses | FEVI por ecocardiografía |
| HEBE8 (2008) | 189 | CMMO frente a CMC | – | 3–8 | Sin cambios en la función general o regional del VI | Resultados finales pendientes |
| REGENT5 (2009) | 117 | CMMO (no seleccionadas, CD34+/CXCR4+) | 2 × 108 (no seleccionadas); 2 × 106 (CD34+) | 3–12 | Mejora de la FEVI con ambos tipos celulares | FEVI por RM (en 117 de 200 pacientes) |
CM: células mesenquimales (de médula ósea); CMC: células madre circulantes; CMMO: células mononucleares de médula ósea; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; RM: resonancia magnética; SPECT: tomografía computarizada por emisión monofotónica; VI: ventrículo izquierdo.
Ensayos clínicos aleatorizados con factor estimulador de las colonias de granulocitos en pacientes con infarto agudo de miocardio (administración subcutánea).
| Estudio (año) | n | Dosis | Tiempo tras IAM (ICP) | Seguimiento | Comentarios |
| Valgimigli et al39 (2005) | 20 | 5μg/kg 4 días | 1 día | Sin cambios de la FEVI a los 6 meses | FEVI por SPECT |
| FIRSTLINE-AMI13 (2005) | 50 | 10μg/kg 6 días | 90min | Mejora de la FEVI a los 4 meses | FEVI por ecocardiografía |
| REVIVAL-240 (2006) | 114 | 10μg/kg 5 días | 5 días | Sin cambios de la FEVI a los 5 meses | FEVI por RM |
| STEMMI41 (2006) | 78 | 10μg/kg 6 días | 28h | Sin cambios de la FEVI a los 6 meses | FEVI por ecocardiografía y RM |
| G-CSF-STEMI42 (2006) | 44 | 10μg/kg 5 días | 35h | Sin cambios de la FEVI a los 3 meses | FEVI por RM |
| Ellis et al43 (2006) | 18 | 5μg/kg 5 días (dosis baja); | |||
| 10 μg/kg 5 días (dosis alta) | < 30h | Mejora de la FEVI a los 30 días | FEVI por ecocardiografía | ||
| RIGENERA14 (2007) | 41 | 10μg/kg 5 días | 5 días | Mejora de la FEVI a los 6 meses | FEVI por ecocardiografía |
| Takano et al15 (2007) | 40 | 2,5μg/kg 5 días | 1 día | Mejora de la FEVI a los 6 meses | FEVI por SPECT |
| MAGIC16 (2004)* | 27 | 10μg/kg 4 días; CMC, 1 × 109 | 1 día | Sin cambios de la FEVI a los 6 meses | FEVI por SPECT |
| MAGIC 3-DES17 (2006)* | 50 | 10μg/kg 3 días; CMC, 2 × 109 | 1 día | Mejora de la FEVI a los 6 meses | FEVI por RM |
CMC: células madre circulantes; FEVI: fracción de eyección del ventrículo izquierdo; RM: resonancia magnética; SPECT: tomografía computarizada por emisión monofotónica.
Ensayos clínicos aleatorizados en pacientes con insuficiencia cardiaca crónica de origen isquémico.
| Estudio | n | Tipo celular | Técnica | Tiempo tras IAM | Objetivo primario | Comentarios |
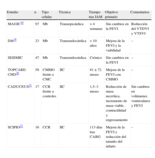
| MAGIC18 | 97 | Mb | Transepicárdica | > 4 semanas | Sin cambios en la FEVI | Reducción del VTDVI y VTSVI |
| Dib19 | 23 | Mb | Transendocárdica | > 10 años | Mejora de la FEVI y la viabilidad | – |
| SEISMIC | 47 | Mb | Transendocárdica | Crónico | Sin cambios en la FEVI | – |
| TOPCARE-CHD20 | 58 | CMMO frente a CMC | IIC | 81 ± 72 meses | Mejora de la FEVI con CMMO | – |
| CADUCEUS21 | 17 | CCR frente a controles | IIC | 1,5–3 meses | Reducción de masa necrótica, incremento de masa viable, contractilidad y engrosamiento | Sin cambios en volúmenes ventriculares y FEVI |
| SCIPIO22 | 16 | CCR | IIC | 113 días tras CABG | Mejora de la FEVI y reducción del tamaño del infarto | – |
CABG: cirugía de revascularización coronaria; CCR: células madre cardiacas residentes; CMC: células madre circulantes; CMMO: células mononucleares de médula ósea; FEVI: fracción de eyección del ventrículo izquierdo; IIC: inyección intracoronaria; Mb: mioblastos esqueléticos; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
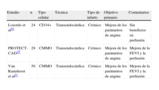
Ensayos clínicos aleatorizados en pacientes con isquemia miocárdica crónica.
| Estudio | n | Tipo celular | Técnica | Tipo de infarto | Objetivo primario | Comentarios |
| Losordo et al44 | 24 | CD34+ | Transendocárdica | Crónico | Mejora de los parámetros de angina | Sin beneficios en perfusión |
| PROTECT-CAD45 | 28 | CMMO | Transendocárdica | Crónico | Mejora de los parámetros de angina | Mejora de la FEVI y la perfusión |
| Van Ramshorst et al21 | 50 | CMMO | Transendocárdica | Crónico | Mejora de los parámetros de angina | Mejora de la FEVI y la perfusión |
CMMO: células mononucleares de médula ósea; FEVI: fracción de eyección del ventrículo izquierdo.
La historia natural de la cardiopatía isquémica se puede dividir en una fase aguda (infarto agudo de miocardio [IAM]) y una fase crónica (cardiopatía isquémica crónica). En esta la terapia celular se ha estudiado en dos casos bien diferenciados: la ICC de origen isquémico con disfunción ventricular y la isquemia miocárdica crónica (angina refractaria).
En los pacientes para los que la recuperación de la función contráctil es el objetivo clínico -como aquellos con ICC de origen isquémico en fase terminal o aquellos en la fase temprana tras el infarto-, la prioridad sería la administración de células con potencial contráctil. En este caso, las células de estirpe miogénica (p. ej., los mioblastos esqueléticos, los cardiomiocitos o cualquier progenitor celular derivado de una estirpe muscular) parecerían los candidatos ideales. Sin embargo, por un lado, la formación de nueva masa miocárdica solo se ha demostrado en sentido estricto en el caso de las células madre embrionarias, y se trata de un proceso que se ha conseguido en pocos estudios y en muy pequeños porcentajes con células madre adultas. Y por otro lado, la mayoría de los estudios después de un IAM han utilizado células madre de la médula ósea (CMMO) como fuente de células adultas progenitoras debido a su fácil obtención.
En situaciones donde predomina la isquemia miocárdica crónica, el potencial angiogénico de las células parece a priori de más importancia. En este caso las CMMO, los progenitores endoteliales, los progenitores vasculares, los progenitores multipotentes derivados de la circulación periférica o las células mesenquimales (CM) parecen mejores candidatos que las células de estirpe miogénica.
Terapia celular después de un infarto agudo de miocardioVarios estudios han evaluado los efectos de la terapia celular después de un IAM. Aunque todos ellos eran estudios de fase I diseñados para estudiar la seguridad de la terapia celular en este contexto, también analizaron la eficacia del tratamiento, algunos con resultados positivos y otros con resultados neutros. Todos ellos utilizaron la vía intracoronaria, una vez restaurado el flujo en la arteria epicárdica origen del infarto, y la mayoría se realizaron con administración de la fracción mononuclear de la médula ósea (tabla 1). Hasta el momento se han publicado cuatro ensayos clínicos con resultados positivos. En el estudio BOOST2, las CMMO mejoraron la contractilidad del ventrículo izquierdo (VI) en la región adyacente al infarto, y la fracción de eyección del VI (FEVI) global en un 6%. Sin embargo, solo los pacientes con infartos extensos mantuvieron estos beneficios en términos de FEVI en el seguimiento a largo plazo (18 meses). En el estudio REPAIR-AMI3, la inyección de CMMO produjo un incremento de la FEVI del 2,8% a los 12 meses. El estudio FINCELL4 observó un incremento del 5% en la FEVI después de la administración de las CMMO. Por último, en el estudio REGENT5, los pacientes tratados con CMMO y con células CXCR4+/CD34+ de la médula ósea mostraron un incremento del 3% en la FEVI que no se observó en el grupo control, pero estas diferencias no eran significativas entre los pacientes tratados y los controles a los 6 meses de seguimiento. Este estudio estuvo limitado por la variabilidad de la FEVI basal y por un seguimiento incompleto.
Por otro lado, tres ensayos clínicos han mostrado hallazgos neutros. Janssens et al6 publicaron un estudio en el que no hubo cambios de la FEVI después de la infusión de CMMO, pero sí observaron una reducción del tamaño del infarto y una mejoría de la contractilidad regional en los casos con infartos transmurales más extensos. En el estudio ASTAMI7 no se demostraron efectos significativos en la FEVI, los volúmenes ventriculares o en el tamaño del infarto después de la administración celular. El pequeño número de células utilizadas y ciertas diferencias en el proceso de aislamiento celular se propusieron como posibles explicaciones a esta falta de eficacia de las CMMO. En el último estudio realizado, presentado en las AHA-Scientific Sessions de 2008, el estudio HEBE8, tampoco se encontraron diferencias en la función sistólica general y regional del VI tras la administración de CMMO y de células mononucleares aisladas de la circulación periférica.
Hasta el momento, no se han documentado problemas de seguridad después de la administración intracoronaria de CMMO. El riesgo de una mayor tasa de reestenosis en el stent no se ha confirmado en un estudio con ese objetivo como el FINCELL4 ni tampoco en los dos metanálisis publicados9,10. Con respecto a otro posible riesgo de la utilización de células madre como la aparición de arritmias malignas, tampoco se ha observado en ninguno de los ensayos clínicos con CMMO1.
Dos estudios han utilizado CM después de un IAM. El estudio de Chen et al11 demostró un incremento de la FEVI y de la perfusión miocárdica tras la inyección de estas células por vía intracoronaria, pero estos resultados no se han reproducido en estudios posteriores. Hare et al12 administraron CM alogénicas por vía intravenosa en pacientes con IAM, sin una mayor tasa de eventos adversos cardiacos y con beneficios en términos de FEVI.
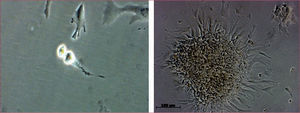
Están en estudio otros tipos celulares, como las células madre derivadas del tejido adiposo (CMA) (fig. 1). Hasta el momento no hay evidencias en humanos, pero el primer ensayo clínico realizado con liberación intracoronaria de CMA frescas (sin cultivar) en el IAM (el estudio APOLLO) se ha completado ya y está pendiente de publicación.
Células madre autólogas derivadas del tejido adiposo durante la mitosis (izquierda) y creciendo en colonias en el sexto día de cultivo (ampliación ×10, derecha). Estas células se obtuvieron y se cultivaron a partir de la fracción vascular del estroma del tejido adiposo en condiciones de good manufacturing practice en la Unidad de Producción Celular de nuestro centro (Hospital Gregorio Marañón, Madrid).
Otra estrategia de terapia celular tras un IAM es la movilización de células desde la médula ósea con la administración subcutánea de factor estimulador de colonias de granulocitos (FECG). Se han publicado varios ensayos clínicos, con unos resultados en general menos alentadores que con células (tabla 2). Solo tres estudios han mostrado resultados positivos. En los estudios FIRSTLINE-AMI13, RIGENERA14 y el de Takano et al15, se observaron mejorías significativas de la FEVI, pero los demás estudios tuvieron resultados negativos.
Por último, el ensayo clínico MAGIC utilizó una combinación de FECG e inyección intracoronaria de células progenitoras de circulación periférica. En un primer estudio no se demostraron diferencias en la FEVI, y sin embargo se observó una mayor tasa de reestenosis del stent, si bien se trató a los pacientes con FECG antes del implante de stents no farmacoactivos16. Posteriormente, los investigadores modificaron el diseño del estudio y utilizaron stents farmacoactivos, y en el estudio MAGIC 3-DES sí que observaron resultados positivos en la FEVI tras movilización, aislamiento e inyección de células17.
Terapia celular para la cardiopatía isquémica crónicaInsuficiencia cardiaca congestiva de origen isquémico con disfunción ventricularLos mioblastos esqueléticos y las CMMO se han utilizado en pacientes con ICC de origen isquémico (tabla 3). El estudio MAGIC18, con inyección transepicárdica de mioblastos en el mismo acto que la cirugía de revascularización miocárdica, no observó cambios en la contractilidad global y regional. Sin embargo, sí se evidenció una reducción de los volúmenes ventriculares telediastólico y telesistólico en los pacientes tratados con la mayor dosis de células. Además, hubo tendencia a una mayor tasa de arritmias ventriculares en los pacientes tratados. Dib et al19 demostraron una mejoría de la FEVI y de la viabilidad tras la inyección transendocárdica de mioblastos en este tipo de pacientes, en contraposición con el estudio SEISMIC (presentado por Serruys en el congreso del American College of Cardiology [ACC] de 2008), que no mostró beneficio alguno a los 6 meses de seguimiento con el mismo procedimiento.
En el estudio TOPCARE-CHD20, la administración intracoronaria de CMMO en la arteria coronaria que irrigaba la porción más discinética del VI produjo una mejoría de la FEVI del 2,9%, mientras que la utilización de células progenitoras circulantes y los controles no tuvieron ningún cambio positivo. En este estudio no se observaron eventos adversos cardiacos mayores (MACE).
Recientemente se han publicado dos estudios con células madre cardiacas residentes (CCR) en este tipo de pacientes. En el estudio CADUCEUS21, pacientes tratados con infusión intracoronaria de CCR entre 1,5 y 3 meses después de un IAM mostraron reducciones de la masa necrótica e incrementos en la masa miocárdica viable, la contractilidad regional y el engrosamiento sistólico, sin cambios en los volúmenes ventriculares o la FEVI. En el estudio SCIPIO22, la inyección de CCR durante la cirugía de revascularización mejoró la FEVI y el tamaño del infarto.
Isquemia miocárdica crónica (angina refractaria)Los pacientes con estadios avanzados de la EAC aterosclerótica en los que se han descartado todas las posibilidades de revascularización (los también llamados pacientes «sin opción») también se han estudiado en cuatro ensayos clínicos de terapia celular (tabla 4). Tres de ellos se realizaron utilizando la vía transendocárdica después de cartografía electromecánica del VI, con CMMO o con progenitores aislados a partir de la circulación periférica. Losordo et al23 utilizaron las células CD34+ aisladas de la sangre periférica tras la movilización con FECG. De esta manera los pacientes mejoraron su número de crisis de angina y su tiempo de ejercicio libre de síntomas, pero no se observaron cambios evidentes en la perfusión miocárdica. En el estudio PROTECT-CAD24, las inyecciones de CMMO mejoraron la clase funcional de la New York Heart Association (NYHA), el tiempo de ejercicio, la FEVI, el engrosamiento miocárdico y los defectos de perfusión inducidos por el ejercicio. Por último, Van Ramshorst et al21 observaron mejorías de la FEVI, la perfusión miocárdica, la clase funcional para angina, la capacidad de ejercicio y la calidad de vida tras la administración de CMMO.
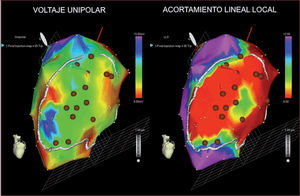
Las CMA también se han estudiado en este tipo de pacientes. El ensayo clínico a doble ciego PRECISE aleatorizó a 27 pacientes con EAC avanzada sin opción de revascularización y con disfunción ventricular moderada-grave a recibir CMA frescas o placebo en una proporción de 3:1. Las células se administraron con inyecciones transendocárdicas después de cartografía electromecánica del VI con la plataforma NOGA XPTM (BDS, Cordis Corporation, Johnson and Johnson) (fig. 2), y los resultados están pendientes de publicación.
Mapa electromecánico del ventrículo izquierdo con la plataforma NOGA XPTM (BDS, Cordis Corporation, Johnson and Johnson) perteneciente a un paciente incluido en el ensayo clínico PRECISE en nuestro centro. Las áreas de miocardio con alteraciones de la contractilidad y voltaje endocárdico reducido se identifican como viables y se preparan para la inyección celular (puntos marrones).
Como con cualquier nueva intervención o tratamiento médico, en el caso de la terapia celular se plantea la dicotomía ética entre la necesidad de nuevos enfoques terapéuticos y una rigurosa evidencia científica acerca de la seguridad y la eficacia de dichos procedimientos.
Debido a su naturaleza altamente innovadora, la terapia con células madre debe centrarse en un alto perfil de seguridad sin aumentar los riesgos del procedimiento en pacientes habitualmente de alto riesgo de por sí, y a la vez proporcionar rigurosamente evidencias acerca de su seguridad y su eficacia. Así, los requerimientos éticos fundamentales incluyen un balance riesgo/beneficio aceptable, un consentimiento informado voluntario y una adecuada y equitativa selección de pacientes22. En el caso del trasplante de células pluripotentes (p. ej., las células embrionarias o las células progenitoras inducidas), se precisan medidas adicionales de seguridad debido a la naturaleza innovadora de estos tipos celulares, las diferencias entre la fisiopatología animal y la humana, la escasa experiencia con ellas en humanos y las grandes esperanzas depositadas por los pacientes en este tratamiento, la mayoría de ellos desestimados para cualquier otro tipo de actuación terapéutica alternativa efectiva.
Existen algunas recomendaciones éticas específicas dadas para los ensayos clínicos con células madre, entre ellas26:
- 1.
Los ensayos clínicos de fase I-II deberían incluir a pacientes en estadios avanzados de su enfermedad cardiovascular, como los pacientes con síntomas refractarios, pero sin un grado de la enfermedad tan avanzado que los exponga a un riesgo inaceptable de sufrir eventos adversos.
- 2.
Se debería utilizar siempre un grupo control, para poder evaluar con precisión los efectos beneficiosos del tratamiento y discernir los posibles eventos adversos derivados exclusivamente del uso de células madre. Una vez terminado el ensayo clínico, se puede ofrecer la terapia a los pacientes controles si los resultados a corto plazo son beneficiosos (técnica de cross-over).
- 3.
Se debe utilizar objetivos de evaluación con sentido clínico (véase más adelante).
- 4.
Debe haber buena coordinación entre los comités científicos y éticos, de manera que se evalúen correctamente el potencial beneficio clínico del tratamiento y la justificación científica del ensayo incluyendo «pruebas de principio» y datos preclínicos de seguridad y dosis.
- 5.
Se debe verificar en cada caso que los pacientes comprenden las características del estudio. Dado que un consentimiento informado bien redactado no evita en muchas ocasiones las interpretaciones erróneas, se debe ofrecer información adicional a los pacientes con dudas o conceptos mal entendidos acerca del estudio. En concreto, los participantes deben comprender que el tratamiento pudiera no ser beneficioso, que los estudios en animales pudieran no predecir los efectos en humanos y que pudieran aparecer eventos adversos no esperados.
- 6.
Es obligatorio publicar los resultados, incluidos los negativos. Por el interés de los pacientes, los investigadores y las entidades financiadoras, no se debe dejar sin publicación los estudios con resultados negativos.
Los pacientes con infartos más extensos y transmurales o los pacientes con disfunción ventricular grave y volúmenes de eyección muy deprimidos son los que más parecen beneficiarse del tratamiento con CMMO1. Por el contrario, los pacientes con obstrucción microvascular después de un IAM podrían no beneficiarse tanto de la inyección intracoronaria de células madre. Por lo tanto, la selección de los pacientes antes de comenzar un ensayo clínico debe tener en cuenta las bases fisiopatológicas de la enfermedad cardiovascular en tratamiento y las características basales de los pacientes. Por ejemplo, se ha demostrado que la edad, los factores de riesgo cardiovascular y la situación de ICC previa tienen efecto negativo en la potencialidad y la capacidad funcional de las células.
Métodos de aplicaciónPor otro lado, también es de máximo interés el desarrollo de nuevos métodos de administración celular, dado el bajo porcentaje de retención, anidamiento y supervivencia celular con las técnicas actuales. Los nuevos dispositivos en desarrollo incluyen la administración de células en el espacio perivascular, las mejoras en el diseño de los catéteres de inyección transendocárdica y la fusión de diferentes técnicas de imagen para una administración celular más precisa (p. ej., radioscopia o resonancia magnética en conjunción con sistemas de navegación y cartografía del VI en el mismo procedimiento).
El tejido huésped y su interacción con las células administradasLos dos determinantes principales de la reparación cardiovascular son las células madre y el tejido miocárdico dañado en el que se depositan las células. Ambos son centrales para establecer la eficacia del tratamiento, y el conocimiento de los mecanismos moleculares y celulares, junto con sus interacciones, es crucial a la hora de diseñar nuevos ensayos clínicos de terapia celular.
Tras un IAM, si el flujo sanguíneo no se restaura rápidamente, la muerte celular y la necrosis miocárdica son definitivas. Esto activa la cascada del complemento y la formación de radicales libres y citocinas que reclutan leucocitos e inician la respuesta inflamatoria. Dicha inflamación, aunque tiene efectos perjudiciales para los cardiomiocitos, es necesaria para eliminar detritos (limpieza de células necróticas) y orquestar los mecanismos de curación y reparación del miocardio. Células inflamatorias crónicas como los macrófagos y las células cebadas segregan citocinas y factores de crecimiento que, finalmente, activan los fibroblastos para su proliferación y para la síntesis de colágeno, el componente más importante de la escara que reemplaza a los cardiomiocitos perdidos. Además, las células inflamatorias estimulan el proceso de neovascularización mediante la liberación de factores de crecimiento. Posteriormente, el proceso de remodelado de la escara continúa durante meses y hasta años, dependiendo de la extensión de daño isquémico inicial27.
El proceso de remodelado del VI, definido como el conjunto de cambios en la estructura de la pared ventricular, la geometría de las cámaras y la función de bomba, se debe principalmente a los cambios que suceden en la matriz extracelular (MEC). La MEC no solo alinea los cardiomiocitos para mantener una relación mecánica fundamental mediante la cual el acortamiento de los sarcómeros se traduce en fuerza de contracción muscular, sino que también cumple funciones de señalización. De hecho, la MEC es un reservorio de factores de crecimiento, hormonas y citocinas, y utiliza integrinas para comunicarse con las células27. Todas estas funciones se pierden tras la isquemia miocárdica por la liberación de metaloproteinasas y citocinas de las células inflamatorias y las células endógenas. Las metaloproteinasas degradan la MEC, destruyen las integrinas y estimulan la fibrosis reparadora. Citocinas como el factor de necrosis tumoral alfa y las interleucinas (IL) como IL-1 e IL-6 inducen la síntesis de metaloproteinasas y se han relacionado con el desarrollo de disfunción ventricular, edema de pulmón, disfunción endotelial y apoptosis de cardiomiocitos23.
Estos procesos celulares y de señalización que constituyen la fase proliferativa de la reparación miocárdica tras el infarto determinan el destino de las células implantadas. El miocardio isquémico es un microambiente inflamatorio hostil para las células, y carece de nutrientes y oxígeno, las señales de la MEC y las interacciones fisiológicas intercelulares. Por ello, solo una pequeña proporción de las células administradas sobrevive en esas condiciones. Algunos estudios han demostrado que las células madre pueden mejorar o contrarrestar esta situación. El trasplante intramiocárdico de células madre endoteliales después de un IAM induce un incremento significativo de los factores angiogénicos, antiapoptóticos y quimiotácticos, que expresan en mayor intensidad tanto las células inyectadas como las células huésped (p. ej., el factor de crecimiento vascular endotelial-A [VEGF-A], el factor de crecimiento de fibroblastos-2 [FGF-2], la angiopoyetina 1, la angiopoyetina 2, el factor de crecimiento placentario, el factor de crecimiento de los hepatocitos [HGF], el factor de crecimiento seudoinsulínico 1 [IGF-1], el factor de crecimiento derivado de las plaquetas B [PDGF-B] y el factor derivado de las células estromales 1 [SDF-1])24. Estos factores humorales proporcionan un microambiente favorable a la neovascularización y la reparación del miocardio isquémico. Además, la comunicación entre el corazón y la médula ósea a través de efectos humorales podría mejorar este proceso, comunicación que se ve favorecida también por las células madre: se ha demostrado que el trasplante de células endoteliales moviliza más CMMO hacia la circulación periférica que finalmente llegan al miocardio isquémico24.
Teniendo todos estos procesos en consideración, se están desarrollando nuevas líneas de investigación para mejorar las tasas de supervivencia celular en el miocardio isquémico como, por ejemplo1:
- 1.
Precondicionamiento del miocardio para retener un mayor número de células: se ha demostrado que el tratamiento con ondas de choque de baja energía, la destrucción de microburbujas en las arterias coronarias con ultrasonidos y el tratamiento extracorpóreo con ondas de choque mejoran la retención de células endoteliales, CMMO y CM. La última de estas técnicas se está investigando en el estudio Cellwave.
- 2.
Activación o incremento de factores quimiotácticos para atraer células al área dañada: el factor de alta movilidad del grupo box-1, el SDF-1 o su receptor CXCR4, la integrina β2 y la sintasa de óxido nítrico endotelial se pueden activar para mejorar la tasa de anidamiento de diferentes tipos celulares (p. ej., las células progenitoras de la circulación periférica o las células endoteliales).
Con respecto a las células madre administradas al miocardio, como hemos comentado, su actividad funcional está determinada por la edad y los factores de riesgo cardiovascular. Como consecuencia, los futuros ensayos clínicos de terapia celular de fase II-III explorarán estrategias para el incremento de su potencial terapéutico. Entre las que están en investigación en este momento, se encuentran1:
- 1.
El pretratamiento de los pacientes con fármacos para estimular la potencialidad de las células: las estatinas, la rosiglitazona y el potenciador de la óxido nítrico sintasa AVE9488 pueden mejorar la capacidad de migración y neovascularización de las células endoteliales.
- 2.
Estrategias para prolongar la supervivencia celular: con este fin se está investigando el uso de una serie de factores de crecimiento combinados para estimular la expresión de genes cardiomiocíticos en las CM (como en el ensayo clínico C-Cure), el uso de choque de calor para aumentar la resistencia de las células a las agresiones externas y el pretratamiento de cardiomiocitos derivados de células embrionarias con choque de calor y con una mezcla de factores de crecimiento.
- 3.
Modificaciones genéticas de las células antes de administrarlas: mediante ingeniería genética celular, se pueden sobreexpresar genes antiapoptóticos o se puede manipular genéticamente las células para mantener su funcionalidad (p. ej., su capacidad para secretar mediadores paracrinos, comunicarse con el medio ambiente huésped o diferenciarse en células cardiacas especializadas).
- 4.
Inyección combinada de células y biomateriales: la encapsulación de CMMO en matrices biocompatibles (parches epicárdicos) o la utilización de nanofibras de péptidos son otras estrategias que precisan más estudio.
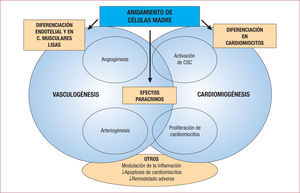
Hoy se cree que la terapia con células madre da lugar a la reparación cardiaca a través de tres mecanismos de acción diferentes (fig. 3): a) diferenciación de las células administradas en los tejidos constituyentes del corazón (a través de procesos de cardiomiogénesis y vasculogénesis) o, menos probablemente, a través de la fusión de las células madre con las células de la propia víscera; b) liberación de factores con propiedades de señalización paracrina desde las células administradas, y c) estimulación de la reparación endógena mediante la activación de los nichos de células madre cardiacas25.
Mecanismos de acción propuestos para las células madre tras su anidamiento en el miocardio dañado. Los procesos de diferenciación y los efectos paracrinos desencadenan una cascada de eventos que interactúan activamente para la creación de nuevos vasos sanguíneos y cardiomiocitos, con el objetivo final de la reparación funcional de la víscera cardiaca. CSC: células madre cardiacas.
Mientras que en los primeros estudios de principios de la década pasada la (trans)diferenciación de las CMMO en cardiomiocitos, células musculares lisas y células endoteliales se postuló como el principal mecanismo de acción que podría explicar la recuperación cardiaca tras la terapia celular, este fenómeno se ha observado en muy escasa proporción en estudios más recientes. Con respecto a la fusión celular de las células administradas con las células huésped, actualmente no hay evidencia suficiente para apoyar esta hipótesis.
Efectos paracrinosDado que el debate de la diferenciación sigue sin respuesta y que el número de nuevos cardiomiocitos y vasos sanguíneos que se incorporan a la víscera cardiaca es demasiado bajo para explicar los beneficios funcionales, la hipótesis paracrina se considera en este momento la más plausible. Según esta hipótesis, dichos beneficios de las células madre se deberían a la secreción de factores solubles que, de una manera paracrina, protegerían el corazón del remodelado adverso, inducirían la neovascularización y promoverían la reparación o regeneración cardiaca26. Se ha demostrado claramente que las CMMO y las CM sintetizan y secretan una amplia variedad de citocinas y factores de crecimiento, entre ellos VEGF, FGF, HGF, IGF, adrenomedulina, timosina beta 4 (TB4), PDGF, SDF y angiopoyetina. Estos mediadores paracrinos se expresan y liberan en una secuencia temporal y espacial determinada, y ejercen diferentes efectos en función de las características del microambiente miocárdico tras los diferentes tipos de daño miocárdico. Además, estos factores liberados también podrían tener acciones autocrinas en la biología de las propias células madre26.
Los factores paracrinos ejercen sus efectos en las células adyacentes a través de una serie de mecanismos:
- 1.
Protección miocárdica: las CM y las CMMO en un medio isquémico liberan moléculas citoprotectoras que aumentan la supervivencia de los cardiomiocitos (VEGF, FGF, HGF, IGF-1, TB4, SDF-1, PDGF e IL-1).
- 2.
Neovascularización: las CMMO, las CM y las células endoteliales pueden dar lugar a estructuras vasculares. Los procesos moleculares que median en la angiogénesis y la arteriogénesis incluyen factores como óxido nítrico, VEGF, SDF-1, FGF, HGF y angiopoyetina.
- 3.
Remodelado cardiaco: los factores paracrinos secretados por las células trasplantadas modifican la matriz extracelular (p. ej., inhibiendo la proliferación de fibroblastos cardiacos y la síntesis de colágeno tipos I y III), lo que resulta en un remodelado tras el infarto más favorable y en una mayor resistencia de la escara. Las células madre (p. ej., las CM) también producen moléculas que limitan la inflamación local y reducen el proceso de remodelado.
- 4.
Contractilidad y metabolismo cardiaco: se ha demostrado que la terapia celular limita el tamaño del infarto y previene la disfunción ventricular. Por otro lado, las CM y las CMMO secretan factores inotrópicos (como IGF-1) que modulan de forma positiva la contractilidad celular y reducen las profundas anomalías bioenergéticas de la zona de miocardio en el borde del infarto.
- 5.
Regeneración cardiaca: como hemos visto, la diferenciación y la fusión celular con cardiomiocitos ocurren en una proporción muy baja tras la administración celular. Por lo tanto, se cree que la terapia celular activa células madre cardiacas residentes y/o estimula la replicación de cardiomiocitos de forma paracrina. Factores secretados por las CMMO, las CM y las células endoteliales, entre los que se incluyen el HGF, el SDF-1, el VEGF y el IGF-1, promueven proliferación, movilización, diferenciación, supervivencia y funcionalidad de las células madre cardiacas o incluso la recuperación de los nichos celulares cardiacos en los que se encuentran.
Por último, ya se han aislado y cultivado células madre cardiacas clonogénicas y autorreplicantes a partir de corazones humanos. Estas células, que se localizan en nichos celulares cardiacos, tienen la capacidad de diferenciarse en células endoteliales, células musculares lisas y cardiomiocitos. Aunque son insuficientes para una reparación completa del miocardio tras cualquier tipo de daño, las pueden activar las células extracardiacas administradas. Así, se ha observado que CM alogénicas inyectadas en el miocardio participan en el mantenimiento de los nichos cardiacos y, a través de interacciones intercelulares y no solo por mecanismos paracrinos, pueden restaurar constituyentes celulares perdidos (diferenciación) y también los propios nichos cardiacos, dada la capacidad de autorreplicarse25.
Objetivos de los estudiosLos objetivos de valoración de los ensayos clínicos (endpoints) se pueden dividir en directos e indirectos. Los primeros incluyen objetivos clínicos como la supervivencia, la supervivencia libre de enfermedad o la mejoría de parámetros funcionales medibles y relacionados con la enfermedad, y son los que pueden cambiar la práctica clínica y las guías de actuación. Los segundos se definen como parámetros o signos físicos utilizados como sustitutos de un objetivo con significado clínico que mide la calidad de vida o la mortalidad27. En otras palabras, son marcadores intermedios o variables de respuesta que pueden sustituir a un objetivo «verdadero» con el propósito de comparar intervenciones o tratamientos específicos.
Los objetivos directos o clínicos tienen una relación directa con el pronóstico y la supervivencia. Incluyen por ejemplo la mortalidad por cualquier causa, la mortalidad cardiaca, el reinfarto, la necesidad de nuevas revascularizaciones, los reingresos por ICC o los accidentes cerebrovasculares, considerados individualmente o en conjunto («objetivos combinados»). La terapia celular solo entrará a formar parte del espectro de tratamientos para las enfermedades cardiovasculares si se puede demostrar de manera precisa y rigurosa que mejora la calidad de vida y la supervivencia. De hecho, las variables clínicas deben ser obligatoriamente los objetivos primarios de los futuros ensayos clínicos de fase III.
Los únicos estudios que han utilizado objetivos directos en terapia celular son el REPAIR-AMI3 y el BALANCE28. Ninguno de ellos fue diseñado con la potencia suficiente para demostrar diferencias en este tipo de parámetros (se consideraron objetivos secundarios), y el segundo ni siquiera estaba aleatorizado. Sin embargo, en el REPAIR-AMI el objetivo combinado de muerte, reinfarto o necesidad de nueva revascularización se redujo significativamente en el grupo tratado con CMMO comparado con el grupo de placebo a los 12 meses. También se redujo el objetivo combinado de muerte, IAM e ingreso por ICC. En el estudio BALANCE, el tratamiento con CMMO después del IAM se asoció a una reducción significativa de la mortalidad a los 5 años de seguimiento. Además, en dos amplios metanálisis9,10 también se demostró tendencia a la reducción de la mortalidad, el reinfarto y los reingresos por ICC.
Una vez dicho esto, los objetivos indirectos han sido una necesidad en los ensayos clínicos con células madre, porque el tamaño muestral necesario para obtener una potencia estadística suficiente para demostrar diferencias en la mortalidad es muy difícil de conseguir29. Por esta razón, y aunque se han utilizado en estudios de fase I para reducir el tamaño muestral y el seguimiento, los objetivos indirectos no deben ser los objetivos primarios de los estudios de fases II y III.
Los parámetros utilizados como sustitutos para determinar los efectos de la terapia celular en la supervivencia de los pacientes con cardiopatía isquémica tienen que cumplir tres requisitos: a) deben correlacionarse con la supervivencia; b) los cambios de dichos parámetros deben reflejar cambios en el pronóstico, y c) debe haber una relación fisiopatológica de base que explique ambas relaciones30. Así, hay varias variables que se han utilizado como objetivos sustitutos, básicamente de imagen cardiaca (parámetros de metabolismo, perfusión y contractilidad) y determinaciones de laboratorio.
Parámetros de imagen cardiacaMuchos de los objetivos indirectos utilizados en investigación clínica cardiovascular se obtienen con técnicas de imagen cardiaca, y el más utilizado es la FEVI. Debido a que el tamaño muestral depende de la desviación estándar del objetivo indirecto que se mide (que varía con la variabilidad de la técnica de imagen), cuanto mayor sea la resolución espacial y temporal de dicha técnica, menor será la variabilidad, especialmente si su cuantificación es automática27. Por ello las técnicas de elección para medir la FEVI en estudios de terapia celular son la resonancia magnética (RM), la tomografía computarizada por emisión monofotónica (SPECT) y la ecocardiografía con contraste. Las mismas técnicas son las mejores para evaluar la contractilidad regional.
Si el estudio se realiza en pacientes que han sufrido un IAM, es esencial conocer el tamaño del infarto y el grosor y el engrosamiento de la pared infartada. Para este propósito, la RM (con las secuencias de realce tardío de gadolinio) y la SPECT son las mejores herramientas. En pacientes con disfunción ventricular, se debe utilizar técnicas que midan la FEVI y los volúmenes telesistólico y telediastólico (es decir, RM y ecocardiografía con contraste).
Finalmente, en los pacientes con EAC avanzada no revascularizable, se debe utilizar técnicas que estudien la perfusión miocárdica (RM y SPECT). En todas las fases de la cardiopatía isquémica, se puede estudiar el metabolismo cardiaco con tomografía por emisión de positrones (PET) en combinación con SPECT, pero la RM también ofrece información relevante.
Otros parámetros indirectos más experimentales son la evaluación de la microcirculación con realce tardío de gadolinio, la respuesta inotrópica en la RM con estrés (dobutamina), el estudio de la angiogénesis y la arteriogénesis (primer paso del gadolinio) y nuevas técnicas de función metabólica, como la detección del metabolismo de alta energía del fosfato y la tensión de oxígeno de la sangre con RM (la llamada «RM dependiente de la concentración de oxígeno en la sangre»)29.
Sin embargo, a pesar de todo este importante repertorio de pruebas, los ensayos clínicos de terapia celular aún están limitados por la inexistencia de técnicas de imagen celular y que permitan el seguimiento del destino de las células. De esta manera, el desarrollo de la imagen molecular (con RM, PET, SPECT, tomografía computarizada y ecocardiografía), junto con mejores herramientas celulares que permitan reconstrucciones tridimensionales, será necesario en los próximos años para la investigación clínica31. Como hemos mencionado, solo los ensayos clínicos con objetivos directos establecerán definitivamente el papel de la terapia celular en la cardiopatía isquémica: en este sentido, no debemos olvidar que las técnicas de imagen no pueden sustituir a los datos clínicos.
Parámetros de laboratorioVarias determinaciones de laboratorio se han utilizado como objetivos sustitutos en terapia celular. Marcadores de inflamación, de daño miocárdico y de ICC son los más utilizados. Entre ellos, la proteína C reactiva, las troponinas I y T, la creatincinasa y el propéptido natriurético cerebral están ya disponibles de forma universal. También se han utilizado las citocinas, las IL y los factores de crecimiento.
Consenso Del Grupo de Trabajo de la Sociedad Europea de Cardiología. Direcciones FuturasEl Grupo de Trabajo de la Sociedad Europea de Cardiología de Terapia Celular y Reparación Cardiaca se creó en 2006 para investigar y regular el papel de las células madre y progenitoras en el tratamiento de la enfermedad cardiovascular. Por lo tanto, hace ya 7 años que este grupo de expertos y líderes de opinión definió el tipo de ensayos clínicos que eran necesarios32:
- 1.
Nuevos ensayos clínicos a doble ciego con más pacientes para estudiar el papel de las CMMO en el IAM. La población de estudio debe ser el grupo de pacientes con IAM de menos de 12h de evolución tratados con estrategias inmediatas de reperfusión, bien trombolisis, bien angioplastia primaria.
- 2.
Ensayos clínicos a doble ciego con CMMO autólogas en pacientes con infartos de más de 12h de evolución o pacientes en los que las estrategias de reperfusión fracasan (es decir, en los casos de angioplastia de rescate). Aunque este subgrupo representa una pequeña proporción de todos los pacientes con IAM, su pronóstico es especialmente malo.
- 3.
Ensayos clínicos a doble ciego con CMMO autólogas o con mioblastos esqueléticos en el tratamiento de la ICC de origen isquémico. En algún momento, se deberá estudiar también el papel de las células madre autólogas en otras miocardiopatías (en concreto, la miocardiopatía dilatada).
- 4.
Son necesarios estudios bien diseñados y no con un número elevado de pacientes para profundizar en los mecanismos de acción de las células madre (p. ej., estudios sobre los mecanismos paracrinos o autocrinos). Las hipótesis a comprobar deben surgir de los estudios experimentales y preclínicos.
- 5.
Estudios para confirmar el riesgo/beneficio del uso de citocinas (p. ej., FECG) como tratamiento único o en combinación con células progenitoras.
Ese grupo de trabajo también ha subrayado la necesidad de comenzar a realizar ensayos clínicos con objetivos clínicos, MACE, beneficios subjetivos y análisis económicos32. Otro punto clave es la «estandarización» tanto en la medida de los resultados como en el procesado celular (que se debe realizar en centros especializados y en condiciones de good manufacturing practice [GMP]), con el objetivo de poder realizar comparaciones significativas. Como estos estudios necesitarán incluir a miles de pacientes, deberán ser multicéntricos y paneuropeos. Por otro lado, el grupo de trabajo destacó que se debe evitar los estudios pequeños no controlados con CMMO, ya que es improbable que añadan información nueva relevante en la investigación con células madre. Para terminar, hay nuevas direcciones en la investigación sobre terapia celular que debemos mencionar:
- 1.
El estudio del conjunto de moléculas bioactivas secretadas por las células que se ha demostrado que inducen la neovascularización, modulan la inflamación, la fibrogénesis, el metabolismo cardiaco y la contractilidad, incrementan la proliferación de cardiomiocitos y activan las células cardiacas residentes. El análisis exhaustivo de estos «secretomos» de las CMMO, las CM o las células endoteliales nos conducirá a una mejor comprensión de sus mecanismos de acción y a una hipotética terapia basada en la administración de proteínas de forma ampliamente disponible, no invasiva, sistémica e incluso repetida.
- 2.
El uso de otras fuentes de células pluripotentes, como las células embrionarias, las células derivadas de las espermatogonias y los ovocitos. Una nueva era ha comenzado tras la demostración de la posibilidad de reprogramar células adultas (p. ej., fibroblastos cutáneos) hacia un estado indiferenciado pluripotente mediante la transfección con retrovirus33,34. Estas llamadas «células madre pluripotentes inducidas» muestran las características de las células embrionarias y pueden diferenciarse en cardiomiocitos. Se están desarrollando nuevos vectores virales e incluso vectores no virales para reducir el riesgo de mutagénesis, y se ha propuesto el uso de genes suicidas para reducir el riesgo de formación de tumores tras la administración de las células.
- 3.
La creación de corazones bioartificiales después de un proceso de «descelularización» con detergentes, con lo que se obtiene una matriz extracardiaca (la arquitectura cardiaca) que luego se repuebla con células madre35. El corazón «acelular» después se puede perfundir con diferentes tipos de células madre, y se ha demostrado ya capacidad contráctil del nuevo órgano en modelos animales. Este avance en bioingeniería tisular ha abierto una fascinante nueva era en la medicina cardiovascular.
Aunque con los primeros ensayos clínicos en terapia celular se han obtenido resultados no uniformes, la evidencia disponible actualmente indica que estos procedimientos son factibles y seguros tanto en la fase aguda como en la crónica de la cardiopatía isquémica. Tras los ensayos clínicos de fase I y II, está demostrado que la administración de CMMO tras un IAM mejora la recuperación de la función sistólica del VI más allá de lo que se consigue con los tratamientos convencionales. En la cardiopatía isquémica crónica, se ha demostrado también que los mioblastos esqueléticos y las CMMO mejoran la contractilidad y la perfusión miocárdica.
Las direcciones futuras en este campo de la investigación traslacional incluyen el uso de nuevos tipos celulares (como CMA y células inducidas), la mejora de las técnicas de administración celular y de imagen, el desarrollo de estrategias para aumentar la potencialidad celular o mejorar el microambiente proinflamatorio miocárdico y la creación de corazones bioartificiales.
Por último, se han iniciado ensayos clínicos controlados y a doble ciego a gran escala de fase III, con estrictas medidas de seguridad, para comprobar los beneficios clínicos del tratamiento, incluida la mejora de la supervivencia. Estos estudios establecerán definitivamente la eficacia de la terapia celular en la mejora de parámetros clínicos y confirmarán el potencial real de la medicina regenerativa cardiaca.
AgradecimientosLos autores quieren agradecer el apoyo de la Red Temática de Investigación Cooperativa en Enfermedades Cardiovasculares (RECAVA) y de la Red Temática de Terapia Celular del Instituto de Salud Carlos III (TERCEL). También queremos reconocer el esfuerzo de los miembros del Grupo de Trabajo de Terapia Celular y Reparación Cardiaca de la Sociedad Europea de Cardiología, y agradecer a las enfermeras de investigación del Hospital Universitario Gregorio Marañón (María José Lorenzo, Alexandra Vázquez y Lucía Fernández) y a Ana Fernández-Baza todo su trabajo, su entusiasmo y su inestimable ayuda.
Conflicto de InteresesNinguno.