La estrategia farmacoinvasiva es una alternativa atractiva a la angioplastia primaria. Valoramos mediante resonancia magnética cardiaca la afección del ventrículo izquierdo tras un infarto de miocardio con elevación del segmento ST tratado con estas estrategias de reperfusión.
MétodosEstudiamos con resonancia magnética cardiaca, realizada 1 semana y 6 meses después de un infarto, a dos cohortes consecutivas de pacientes incluidas en un registro prospectivo de infarto de miocardio con elevación del ST en un hospital universitario. Durante el periodo 2004-2006, se trató a 151 pacientes con estrategia farmacoinvasiva (trombolisis seguida de angioplastia sistemática no inmediata). Durante el periodo 2007-2008, se trató con angioplastia primaria a 93 pacientes. Se estudió un subgrupo ajustado mediante propensity score.
ResultadosLa resonancia magnética cardiaca en la primera semana mostró una extensión de área en riesgo similar para la estrategia farmacoinvasiva y la angioplastia primaria (el 29%±15% frente al 29%±17%; p=0,9). No se observaron diferencias significativas en cuanto a tamaño de infarto, miocardio rescatado, obstrucción microvascular, fracción de eyección e índices de volumen telediastólico y telesistólico entre ambas estrategias en la resonancia magnética cardiaca realizada en la primera semana y en el sexto mes (p>0,2 en todos los casos). La tasa de eventos cardiacos adversos al año (muerte o reinfarto) fue del 6% en la estrategia farmacoinvasiva y del 7% en la angioplastia primaria (p=0,7).
ConclusionesLa estrategia farmacoinvasiva es una alternativa ampliamente disponible y logísticamente atractiva con resultados similares a los de la angioplastia primaria en cuanto a afección del ventrículo izquierdo a corto y largo plazo valorado por resonancia magnética cardiaca.
Palabras clave
La angioplastia primaria (AP) ha pasado a ser el tratamiento preferido en la reperfusión del infarto agudo de miocardio con elevación del ST (IAMCEST). Sin embargo, la disponibilidad de la AP no es universal y la trombolisis continúa siendo el tratamiento de reperfusión predominante en muchos países occidentales1,2,3.
Una estrategia farmacoinvasiva (FI), mediante trombolisis seguida de angioplastia de rescate en caso necesario o de angioplastia sistemática (pero no inmediata tras la trombolisis), constituye un enfoque ampliamente accesible y fácil de aplicar. Esta política resulta especialmente útil en zonas alejadas de los hospitales terciarios y teóricamente combina los efectos beneficiosos de una reperfusión aplicada con rapidez mediante fármacos trombolíticos con los de la resolución de la estenosis coronaria residual mediante una angioplastia temprana, pero no inmediata2,3,4. En registros recientes se ha puesto de manifiesto que con la FI y la AP se obtiene una evolución comparable de los pacientes5,6,7,8 y ambas estrategias han sido aceptadas en las guías actuales para el tratamiento de los pacientes con IAMCEST9,10.
Cabría proponer que la equivalencia entre las estrategias FI y de AP respecto a la evolución clínica de los pacientes pudiera deberse a un efecto comparable en cuanto a función sistólica, dilatación ventricular izquierda, tamaño del infarto, miocardio rescatado y obstrucción microvascular. La resonancia magnética cardiaca (RMC) permite evaluar, en una sola sesión, de manera completa y con los métodos más actuales, todos estos parámetros en pacientes con IAMCEST11,12. Hasta el momento, no se ha llevado a cabo una comparación directa de los resultados obtenidos con la FI y la AP en los parámetros de RMC del ventrículo izquierdo.
El objetivo del presente estudio es comparar, mediante el empleo de la RMC, la repercusión a corto y a largo plazo de las estrategias FI y de AP en el ventrículo izquierdo.
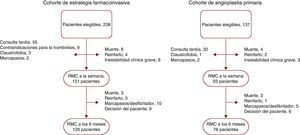
MétodosEntre enero de 2004 y diciembre de 2008, incluimos prospectivamente en el estudio a 375 pacientes ingresados en nuestro centro durante las horas de trabajo regular con un primer IAMCEST, que fueron tratados con terapias de reperfusión y evaluados mediante RMC antes del alta. Los criterios de exclusión fueron los siguientes: contraindicaciones para la RMC (n=8), muerte (n=12), reinfarto (n=6), inestabilidad clínica grave (n=9), consulta tardía (> 12h después del inicio del dolor torácico, n=87) y contraindicaciones para la trombolisis (n=9). Formaron el grupo de estudio final 244 pacientes con un primer IAMCEST que recibieron tratamientos de reperfusión y fueron examinados con una RMC antes del alta (Figura 1).
Figura 1. Diagrama de flujo de los pacientes incluidos en las cohortes de tratamiento farmacoinvasivo y de angioplastia primaria. RMC: resonancia magnética cardiaca.
Según el protocolo de tratamiento de pacientes con IAMCEST de nuestro centro durante el horario regular, en el periodo 2004-2006 se aplicó una estrategia FI, mientras que la AP ha sido el método utilizado habitualmente a partir de 2007. Con objeto de evaluar los efectos de las terapias de reperfusión, se realizó sistemáticamente una RMC antes del alta y a los 6 meses a todos los pacientes asignados a la política de tratamiento establecida en cada periodo.
El tratamiento médico se dejó a criterio del cardiólogo encargado. Se registraron las características basales y los datos clínicos en todos los casos. Se calculó la puntuación de riesgo Thrombolysis In Myocardial Infarction (TIMI) para el IAMCEST en todos los pacientes, como indicador indirecto del riesgo clínico basal13. Se determinó el porcentaje de resolución del sumatorio de elevación del segmento ST a los 90 min del tratamiento de reperfusión, utilizando una metodología previamente validada14. Se efectuaron determinaciones seriadas de la troponina I (Dimension; Dade Behring, Newark, Estados Unidos) y se determinaron los valores máximos de troponina I. Se registró el tiempo transcurrido desde el inicio del dolor torácico y desde el momento del diagnóstico hasta la revascularización (infusión del tratamiento trombolítico en la FI, hinchado del balón en la AP).
El protocolo de investigación fue aprobado por el comité ético local. Se obtuvo el consentimiento informado por escrito de todos los participantes.
Cohortes de estudioCohorte de estrategia invasivaEntre enero de 2004 y diciembre de 2006, la estrategia de reperfusión consistió en la administración de dosis plenas de tenecteplasa más enoxaparina en un plazo de 12 h tras el inicio del dolor torácico. En caso de persistencia del dolor torácico o de una resolución del segmento ST<70% 90 min después del tratamiento trombolítico, se realizaba una angioplastia de rescate. Si el resultado del tratamiento trombolítico era satisfactorio, es decir, ausencia de dolor torácico y resolución del segmento ST > 70% 90 min después del tratamiento trombolítico, se realizaba sistemáticamente una angioplastia después de transcurridas al menos 3 h. De los 238 pacientes ingresados por un IAMCEST durante el periodo de FI, se incluyó a 151 en la cohorte final de FI. A los 6 meses, se evaluó de nuevo a 126 pacientes con una RMC. El diagrama de flujo de los pacientes se presenta en la Figura 1.
Cohorte de angioplastia primariaEntre enero de 2007 y diciembre de 2008, la AP fue la estrategia de reperfusión utilizada habitualmente en nuestro centro. De los 137 pacientes ingresados por un IAMCEST durante el periodo de AP, 93 fueron incluidos en la cohorte final de AP. A los 6 meses, 78 pacientes fueron evaluados de nuevo con una RMC. El diagrama de flujo de los pacientes se presenta en la Figura 1.
Cateterismo cardiacoEl tratamiento médico y el tratamiento invasivo en el laboratorio de cateterismo quedaron a criterio del cardiólogo intervencionista encargado. Las intervenciones se realizaron en un centro de cateterismo cardiaco de alto volumen, con disponibilidad ininterrumpida de revascularización percutánea, a cargo de tres especialistas con experiencia (más de 1.000 intervenciones de revascularización percutánea realizadas por cada uno; más de 300 de ellas en pacientes con IAMCEST). Un observador experimentado determinó luego el grado de flujo TIMI y el grado de opacificación (blush) miocárdica con el empleo de un programa informático estándar offline (Integris HM3000, Philips, Best, Países Bajos). Se consideró normal un grado de flujo TIMI 3 y un grado de blush miocárdico 2-3.
Resonancia magnética cardiovascularSe obtuvo una RMC (escáner de 1,5 T, Sonata Magnetom, Siemens, Erlangen, Alemania) 7±1 y 181±11 días después del IAMCEST, según lo establecido en el protocolo de nuestro laboratorio y en las recomendaciones actuales11,12,15. Se utilizaron secuencias de precesión libre de estado estable para las imágenes de cine; se aplicó una secuencia de turbo-spin-eco con recuperación de inversión de τ corta y ponderación T2 de sangre oscura para determinar el área de riesgo (con edema), y se utilizó una secuencia de precesión libre de estado estable, con recuperación de inversión segmentada para las imágenes tardías con contraste. Puede consultarse una información más detallada sobre nuestro protocolo de RMC en otra publicación11,12. La adquisición de todas las imágenes se realizó con una espiral de superficie corporal con matriz en fase, en apnea y con sincronización desencadenada por el ECG.
Las exploraciones de RMC se analizaron luego por un observador experimentado, que no conocía ningún dato de los pacientes, utilizando un programa informático offline específicamente diseñado para ello (QMASS RM 6.1.5, Medis, Leiden, Países Bajos).
Se cuantificó el índice de volumen telediastólico (ml/m2), el índice de volumen telesistólico (ml/m2), la fracción de eyección (%) y la masa ventricular izquierda (g/m2) mediante una definición manual de los bordes endocárdico y epicárdico de todos los cortes de eje corto en las imágenes de cine (Figura 2). Para los análisis dicotómicos, el índice de volumen telediastólico y el índice de volumen telesistólico se consideraron dilatados y la fracción de eyección se consideró reducida en función de los valores de referencia aceptados según el sexo, la edad y el área de superficie corporal16.
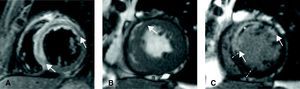
Figura 2. Imágenes de resonancia magnética cardiovascular obtenidas al cabo de 1 semana en un paciente con un infarto de miocardio extenso de cara anterior. A: la secuencia con ponderación T2 mostró un gran área en riesgo (con edema, entre las flechas). B: las imágenes de cine mostraron una hipocinesia en el área anterior (flecha). C: imagen con contraste tardío que permite definir el tamaño del infarto (miocardio con hiperintensificación, entre las flechas) y la obstrucción microvascular (área oscura en el centro del tejido infartado, asterisco). Mediante la comparación del área en riesgo y el tamaño del infarto, el miocardio rescatado se consideró como la correspondiente al área en riesgo que no mostraba captación tardía de contraste (entre las líneas).
El área en riesgo (con edema) se definió cuantitativamente en las imágenes con ponderación T2, como el porcentaje de la masa ventricular izquierda con una intensidad de señal 2 desviaciones estándar por encima de la media de señal obtenida en el miocardio remoto no infartado (Figura 3).
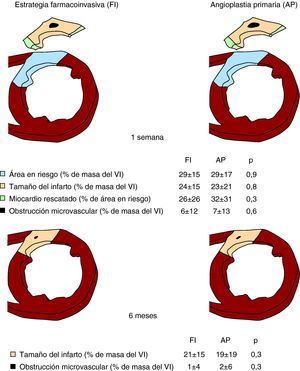
Figura 3. Esquema de ponderación T2 a la semana y a los 6 meses e imagen de captación tardía de contraste en el grupo de estudio completo. Área en riesgo, tamaño del infarto, miocardio rescatado y obstrucción microvascular en pacientes tratados con la estrategia farmacoinvasiva (izquierda) y con angioplastia primaria (derecha). Arriba: primera semana. Abajo: 6 meses. Área en riesgo, tamaño del infarto y obstrucción microvascular expresados como porcentaje de la masa ventricular izquierda. Miocardio rescatado expresado como porcentaje del área en riesgo. AP: angioplastia primaria; FI: estrategia farmacoinvasiva; VI: ventrículo izquierdo.
En las imágenes tardías con contraste, el tamaño del infarto se determinó cuantitativamente como el porcentaje de la masa ventricular izquierda con una intensidad de señal 2 desviaciones estándar por encima de la media de señal obtenida en el miocardio remoto no infartado (Figura 2, Figura 3). El operador examinó visualmente el área en riesgo y el tamaño del infarto, y se corrigieron manualmente en caso necesario.
El miocardio rescatado se valoró mediante el porcentaje del área en riesgo que no mostraba captación tardía de contraste (Figura 2, Figura 3).
La obstrucción microvascular se definió, mediante planimetría manual, como el porcentaje de la masa ventricular izquierda que presentaba una falta de captación de contraste en el núcleo de una zona que mostraba una captación tardía (Figura 2, Figura 3).
En nuestro laboratorio, la variabilidad en el observador para los índices de volúmenes ventriculares izquierdos, fracción de eyección, área en riesgo, tamaño del infarto, miocardio rescatado y obstrucción microvascular es < 5%17.
Variables de valoraciónLa variable de valoración primaria fue la comparación del área en riesgo, el tamaño del infarto, el miocardio rescatado, la obstrucción microvascular, el índice de volumen telediastólico, el índice de volumen telesistólico y la fracción de eyección en las cohortes de FI y de AP en la RMC obtenida al cabo de 1 semana.
La variable de valoración secundaria fue la comparación del tamaño del infarto, la obstrucción microvascular, el índice de volumen telediastólico, el índice de volumen telesistólico y la fracción de eyección en las cohortes de FI y AP en la RMC obtenida a los 6 meses.
Seguimiento clínicoEn este estudio no incluimos variables de valoración clínicas. Se calculó la tasa de eventos adversos cardiacos (EAC) (muerte tras el alta o reinfarto, optando de entre ellos por el que se produjera antes), hemorragias mayores y reingresos por insuficiencia cardiaca en un seguimiento de 1 año. Tres cardiólogos revisaron todos los eventos y se exigió un consenso para considerarlos eventos clínicos.
Análisis estadísticoSe aplicó la prueba de Kolmogorov-Smirnov para evaluar la normalidad de la distribución. Las variables continuas se expresaron en forma de media±1 desviación estándar o mediana [intervalo intercuartílico], según fuera apropiado. Para las variables continuas de distribución normal, las comparaciones se calcularon con la prueba de la t para datos no emparejados y la prueba de ANOVA de una vía. Para las variables continuas de distribución no normal, los cálculos de las comparaciones se realizaron con la prueba de la U de Mann-Whitney. Los porcentajes de los grupos se compararon mediante la prueba de la χ2 o la prueba exacta de Fisher, según fuera apropiado. Las distribuciones de supervivencia relativas al tiempo hasta la aparición de EAC en los pacientes tratados con FI o AP se estimaron con el método de Kaplan-Meier y log rank test. Se tomó como criterio de significación estadística un valor de p bilateral < 0,05. Se utilizó el programa estadístico SPSS (versión 13.0, SPSS Inc., Chicago, Illinois, Estados Unidos).
Dado el diseño observacional del estudio y con objeto de reducir al mínimo todo posible sesgo, repetimos todas las comparaciones en una población igualada en proporción 1:1 establecida mediante una puntuación de propensión, que incluía a 80 pacientes con FI y 80 pacientes con AP. Para estimar la puntuación de propensión, realizamos un análisis de regresión logística con la AP como variable dependiente. Los pacientes igualados que presentaban el mismo valor en el modelo de regresión logística fueron incluidos en este subestudio. Se utilizó el módulo Psmatch2 (STATA 11, StataCorp, College Station, Texas, Estados Unidos) para este fin.
ResultadosLas características basales de los 151 pacientes tratados con FI y de los 93 tratados con AP se muestran en la Tabla 1. Con la excepción de las diferencias esperadas en cuanto a un mayor tiempo hasta la revascularización, las tasas más altas de grados normales de flujo TIMI y de blush miocárdico en la primera angiografía (antes de la implantación de stent) y el menor uso de inhibidores de la glucoproteína IIb/IIIa en los pacientes tratados con FI, las cohortes de FI y AP eran comparables (Tabla 1). El tiempo hasta la revascularización (mediana [intervalo intercuartílico]) fue de 180 [35-610] min en la cohorte de FI y 212 [50-710] min en la cohorte de AP (p<0,001).
Tabla 1. Características de los pacientes tratados con la estrategia farmacoinvasiva (FI) y con angioplastia primaria (AP) *
| FI | AP | p | |
| Pacientes | 151 | 93 | |
| Características basales | |||
| Edad (años) | 58±11 | 60±13 | 0,2 |
| Varones | 128 (85) | 75 (81) | 0,5 |
| Diabetes mellitus | 22 (15) | 14 (15) | 1 |
| Hipertensión | 66 (44) | 43 (46) | 0,8 |
| Hipercolesterolemia | 56 (37) | 40 (43) | 0,4 |
| Fumadores | 93 (62) | 50 (54) | 0,2 |
| Infarto de cara anterior | 86 (57) | 47 (51) | 0,4 |
| Frecuencia cardiaca (lat/min) | 81±22 | 80±17 | 0,6 |
| Presión sistólica (mmHg) | 126±27 | 125±26 | 0,8 |
| Clase de Killip I | 134 (89) | 84 (90) | 1 |
| Clase de Killip II | 13 (9) | 7 (8) | 0,9 |
| Clase de Killip III | 4 (2) | 2 (2) | 1 |
| Clase de Killip IV | 0 | 0 | 1 |
| Tiempo hasta la reperfusión (min) | 180 [120-270] | 212 [140-394] | < 0,001 |
| Diagnóstico a reperfusión (min) | 60 [37-93] | 76 [42-124] | < 0,001 |
| Puntuación de riesgo TIMI | 3±2 | 3±2 | 1 |
| Pico de troponina I (ng/ml) | 82 [44-100] | 77 [38-99] | 0,7 |
| Resolución del segmento ST | 78±21 | 82±23 | 0,1 |
| Cateterismo cardiaco | |||
| Descendente anterior izquierda proximal | 40 (27) | 27 (29) | 0,7 |
| Enfermedad de vasos múltiples | 33 (20) | 19 (20) | 1 |
| Tratamiento con stent | 132 (87) | 89 (96) | 1 |
| Grado de flujo TIMI 0 antes del stent | 19 (13) | 50 (54) | < 0,001 |
| Grado de flujo TIMI 1 antes del stent | 20 (13) | 21 (22) | 0,09 |
| Grado de flujo TIMI 2 antes del stent | 18 (12) | 11 (12) | 1 |
| Grado de flujo TIMI 3 antes del stent | 94 (62) | 11 (12) | < 0,001 |
| Grado de flujo TIMI 3 después del stent | 136 (90) | 85 (91) | 0,8 |
| Grado de blush 2-3 antes del stent | 74 (49) | 8 (9) | < 0,001 |
| Grado de blush 2-3 después del stent | 118 (78) | 67 (72) | 0,3 |
| Tratamiento médico en el hospital | |||
| Ácido acetilsalicílico | 151 (100) | 93 (100) | 1 |
| Clopidogrel | 151 (100) | 93 (100) | 1 |
| Inhibidores de la glucoproteína IIb/IIIa | 35 (24) | 86 (92) | < 0,001 |
| Bloqueadores beta | 85 (57) | 48 (52) | 0,5 |
| IECA | 79 (53) | 38 (40) | 0,09 |
| Estatinas | 113 (76) | 65 (70) | 0,4 |
| Diuréticos | 14 (9) | 14 (15) | 0,2 |
IECA: inhibidores de la enzima de conversión de la angiotensina; TIMI: Thrombolysis in Myocardial Infarction.
* Los datos expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
En todos los casos de FI se realizó una angiografía coronaria en las primeras 48 h. De los 151 pacientes, 35 (23%) fueron tratados con una angioplastia de rescate (202±129 min después del tratamiento trombolítico) y 97 (64%), con una angioplastia programada después de la trombolisis (mediana, 18 [3-47] h después del tratamiento trombolítico). En total, 132 pacientes tratados con FI (87%) fueron tratados con stents en los primeros 2 días. Un total de 19 pacientes (13%) no fueron tratados con stents debido a un fallo de la angioplastia (n=4), ausencia de estenosis residual significativa en la arteria relacionada después de la trombolisis (n=12) o revascularización quirúrgica (n=3).
En la estrategia de AP, se implantaron stents a 89 pacientes (96%); 3 pacientes no fueron tratados con stents a causa de un fallo de la AP en dos casos y a una revascularización quirúrgica en uno.
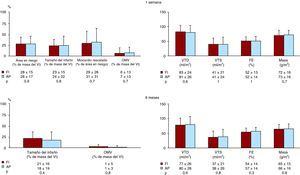
Resonancia magnética cardiovascular a 1 semanaLas características de RMC en los pacientes tratados con FI y con AP se muestran en las Figura 4. En la RMC obtenida al cabo de 1 semana, los valores de área en riesgo, tamaño del infarto, miocardio rescatado, obstrucción microvascular, índice de volumen telediastólico, índice de volumen telesistólico y fracción de eyección fueron similares en los pacientes tratados con FI y con AP. Se detectó una obstrucción microvascular en 69 pacientes (46%) de la cohorte de FI y 43 (47%) de los pacientes tratados con AP (p=0,9).
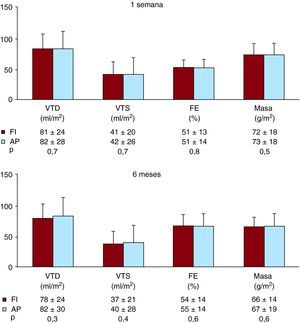
Figura 4. Esquema de resonancia magnética cardiovascular a la semana y a los 6 meses en el grupo de estudio completo. Volúmenes ventriculares izquierdos, fracción de eyección (FE) y masa en pacientes tratados con la estrategia farmacoinvasiva (FI) y con angioplastia primaria (AP). Arriba: primera semana. Abajo: 6 meses. VTD: volumen telediastólico; VTS: volumen telesistólico.
Aplicando valores de corte previamente validados, los pacientes tratados con FI (n=151) y los tratados con AP (n=93) presentaban unas tasas similares de dilatación en el índice de volumen telediastólico (el 24 frente al 24%; p=1), dilatación en el índice de volumen telesistólico (el 44 frente al 44%; p=1) y reducción de la fracción de eyección (el 62 frente al 59%; p=0,8) en el examen realizado al cabo de 1 semana.
Resonancia magnética cardiovascular a los 6 mesesLas características de RMC de los 126 pacientes tratados con FI y los 78 tratados con AP que fueron examinados de nuevo a los 6 meses se presentan en las Figura 3, Figura 4. A los 6 meses ninguno de los pacientes presentó edema miocárdico (área en riesgo). En total, no se detectaron diferencias significativas entre ambas cohortes de pacientes en cuanto a tamaño del infarto, obstrucción microvascular, índice de volumen telediastólico, índice de volumen telesistólico y fracción de eyección en la RMC obtenida a los 6 meses.
De forma paralela a lo observado en la RMC obtenida al cabo de 1 semana, los pacientes tratados con FI o con AP presentaron unas tasas similares de dilatación en el índice de volumen telediastólico (el 19 frente al 21%; p=0,7), dilatación en el índice de volumen telesistólico (el 37 frente al 38%; p=0,9) y disminución de la fracción de eyección (el 51 frente al 46%; p=0,4) a los 6 meses.
Angioplastia de rescateLos pacientes tratados con angioplastia de rescate (n=35) fueron evaluados por separado (Tabla 2). La angioplastia de rescate se asociaba a unos índices de RMC más alterados que los observados con la trombolisis satisfactoria (n=116) o la angioplastia primaria (n=93).
Tabla 2. Características de resonancia magnética cardiaca (RMC) de los pacientes tratados eficazmente con trombolisis, angioplastia de rescate a causa de trombolisis ineficaz o angioplastia primaria *
| Trombolisis eficaz | Angioplastia primaria | Angioplastia de rescate | p para la tendencia | |
| Número de pacientes | 116 | 93 | 35 | |
| RMC a la semana | ||||
| Fracción de eyección (%) | 53±13 | 51±14 | 45±12 | 0,01 |
| Volumen telediastólico (ml/m2) | 80±23 | 82±28 | 85±25 | 0,5 |
| Volumen telesistólico (ml/m2) | 39±19 | 42±26 | 48±22 | 0,09 |
| Masa del VI (g/m2) | 70±16 | 73±20 | 78±24 | 0,05 |
| Área en riesgo (% de masa del VI) | 27±15 | 29±17 | 36±16 | 0,01 |
| Tamaño del infarto (% de masa del VI) | 22±15 | 23±21 | 31±15 | 0,03 |
| Miocardio rescatado (% de área en riesgo) | 28±27 | 32±31 | 19±22 | 0,08 |
| Obstrucción microvascular (% de masa del VI) | 5±12 | 7±13 | 11±12 | 0,06 |
| RMC a los 6 meses | ||||
| Fracción de eyección (%) | 55±14 | 55±14 | 50±13 | 0,2 |
| Volumen telediastólico (ml/m2) | 75±23 | 82±30 | 87±24 | 0,07 |
| Volumen telesistólico (ml/m2) | 35±20 | 40±28 | 46±22 | 0,08 |
| Masa del VI (g/m2) | 65±14 | 67±19 | 68±14 | 0,2 |
RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
* Los datos expresan media±desviación estándar.
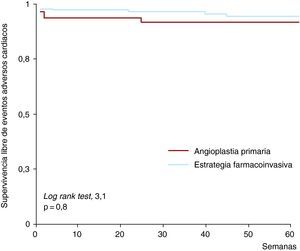
En el seguimiento realizado a 1 año, no se observaron diferencias significativas entre los pacientes tratados con FI y los tratados con AP en cuanto a las tasas de mortalidad cardiaca (5/151 [3%] frente a 5/93 [5%]; p=0,3), reinfarto (5/151 [3%] frente a 4/93 [4%]; p=0,7) y primeros EAC (9/151 [6%] frente a 6/93 [7%]; p=0,8) (Figura 5). Las tasas de hemorragias mayores (2/151 [1%] frente a 1/93 [1%]; p=0,8) y de reingresos por insuficiencia cardiaca (13/151 [9%] frente a 6/93 [7%]; p=0,6) fueron similares en los pacientes tratados con FI y con AP.
Figura 5. Estrategias de reperfusión y eventos cardiacos adversos. Distribuciones de Kaplan-Meier de supervivencia sin eventos cardiacos adversos (muerte o infarto de miocardio no mortal) en pacientes tratados con la estrategia farmacoinvasiva y con angioplastia primaria.
Subanálisis con igualación mediante puntuación de propensiónNo hubo diferencias significativas en cuanto a las características basales, los datos angiográficos tras la intervención o el tratamiento intrahospitalario (con la excepción de un uso más frecuente de inhibidores de la glucoproteína IIb/IIIa en los pacientes de la cohorte de AP) en los 80 pacientes tratados con AP y los 80 tratados con FI igualados uno a uno (Tabla 3).
Tabla 3. Características de los pacientes incluidos en el subanálisis de pacientes igualados según la puntuación de propensión y tratados con la estrategia farmacoinvasiva (FI) y con angioplastia primaria (AP) *
| FI | AP | p | |
| Número de pacientes | 80 | 80 | |
| Características basales | |||
| Edad (años) | 58±11 | 60±13 | 0,3 |
| Varones | 69 (86) | 64 (80) | 0,4 |
| Diabetes mellitus | 10 (13) | 13 (16) | 0,7 |
| Hipertensión | 28 (35) | 40 (50) | 0,08 |
| Hipercolesterolemia | 31 (39) | 34 (43) | 0,7 |
| Fumadores | 49 (61) | 45 (56) | 0,6 |
| Infarto de cara anterior | 45 (56) | 41 (51) | 0,6 |
| Frecuencia cardiaca (lat/min) | 81±21 | 78±16 | 0,5 |
| Presión sistólica (mmHg) | 129±29 | 126±27 | 0,3 |
| Clase de Killip I | 72 (90) | 70 (87) | 0,9 |
| Clase de Killip II | 6 (7) | 7 (9) | 0,9 |
| Clase de Killip III | 2 (2) | 3 (4) | 0,7 |
| Clase de Killip IV | 0 | 0 | 1 |
| Tiempo hasta la reperfusión (min) | 180 [136-286] | 192 [132-207] | 0,07 |
| Diagnóstico a reperfusión (min) | 60 [35-98] | 76 [42-129] | 0,01 |
| Puntuación de riesgo TIMI | 3±2 | 3±2 | 1 |
| Pico de troponina I (ng/ml) | 78 [43-100] | 80 [39-100] | 0,7 |
| Resolución del segmento ST | 78±23 | 81±23 | 0,3 |
| Cateterismo cardiaco | |||
| Descendente anterior izquierda proximal | 21 (26) | 23 (29) | 0,9 |
| Enfermedad de vasos múltiples | 16 (20) | 15 (19) | 1 |
| Tratamiento con stent | 76 (96) | 77 (96) | 1 |
| Grado de flujo TIMI 0 antes del stent | 11 (14) | 40 (50) | < 0,001 |
| Grado de flujo TIMI 1 antes del stent | 9 (11) | 19 (24) | 0,08 |
| Grado de flujo TIMI 2 antes del stent | 12 (15) | 10 (12) | 0,8 |
| Grado de flujo TIMI 3 antes del stent | 48 (60) | 11 (14) | < 0,001 |
| Grado de flujo TIMI 3 después del stent | 67 (84) | 72 (90) | 0,4 |
| Grado de blush 2-3 antes del stent | 35 (43) | 8 (10) | < 0,001 |
| Grado de blush 2-3 después del stent | 62 (78) | 60 (75) | 0,9 |
| Tratamiento médico | |||
| Ácido acetilsalicílico | 80 (100) | 80 (100) | 1 |
| Clopidogrel | 80 (100) | 80 (100) | 1 |
| Inhibidores de la glucoproteína IIb/IIIa | 17 (21) | 72 (90) | < 0,001 |
| Bloqueadores beta | 45 (56) | 40 (50) | 0,5 |
| IECA | 44 (55) | 33 (41) | 0,1 |
| Estatinas | 64 (80) | 54 (67) | 0,1 |
| Diuréticos | 10 (13) | 11 (14) | 1 |
IECA: inhibidores de la enzima de conversión de la angiotensina; TIMI: Thrombolysis in Myocardial Infarction.
* Los datos expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Los valores de área en riesgo, tamaño del infarto, miocardio rescatado, obstrucción microvascular, índice de volumen telediastólico, índice de volumen telesistólico y fracción de eyección obtenidos al cabo de 1 semana y a los 6 meses fueron casi idénticos en los pacientes tratados con FI y con AP (Figura 6).
Figura 6. Resonancia magnética cardiovascular en los grupos igualados según la puntuación de propensión. Área en riesgo, tamaño del infarto, miocardio rescatado, obstrucción microvascular, volúmenes ventriculares izquierdos, fracción de eyección (FE) y masa en pacientes tratados con la estrategia farmacoinvasiva (FI) y con angioplastia primaria (AP). Arriba: primera semana. Abajo: 6 meses. VTD: volumen telediastólico; VTS: volumen telesistólico; OMV: obstrucción microvascular; VI: ventrículo izquierdo.
Las tasas a 1 año de mortalidad cardiaca (el 6 frente al 6%; p=1), reinfarto (el 4 frente al 4%; p=1), primeros EAC (el 9 frente al 8%; p=0,5), hemorragias mayores (el 1 frente al 1%; p=1) y reingresos por insuficiencia cardiaca (el 7 frente al 5%; p=0,7) fueron similares en los paciente tratados con FI o con AP.
DiscusiónEl resultado principal del presente estudio es que la estrategia FI basada en un tratamiento trombolítico y una angioplastia programada no inmediata proporciona unos resultados a corto y a largo plazo que son equivalentes a los de la estrategia de AP en cuanto a la repercusión ventricular izquierda evaluada mediante la RMC.
Estrategias de reperfusiónCon base en los múltiples ensayos clínicos aleatorizados que ponen de manifiesto una superioridad de la AP rápida respecto a la trombolisis, la AP ha pasado a ser el enfoque preferido para el tratamiento del IAMCEST1,9,10. Sin embargo, en muchos pacientes no se cumplen los criterios necesarios para un uso apropiado de la AP. Los factores relacionados con el retraso en la reperfusión a causa del traslado del paciente, la falta de disponibilidad permanente de grupos de intervención capacitados o las limitaciones presupuestarias explican que la trombolisis continúe siendo la terapia de reperfusión frecuente en muchas zonas2,3,4. Incluso en centros como el nuestro, con un programa de angioplastia primaria, este tratamiento implica un retraso inherente en comparación con el tratamiento trombolítico.
La trombolisis se asocia a un mayor riesgo de reinfarto y a una menor probabilidad de alcanzar un flujo TIMI 3, y ello constituye su talón de Aquiles, en comparación con la AP2,3. Con objeto de combinar la rapidez en la obtención de la reperfusión coronaria que proporciona la trombolisis con la efectividad de la angioplastia a la hora de resolver por completo la estenosis residual y sellar las placas inestables, se han ensayado diversas combinaciones2,3,4,5,6,7,8,9,10.
La angioplastia facilitada es una estrategia atractiva desde el punto de vista fisiopatológico, que consiste en una trombolisis seguida por una angioplastia inmediata2,3,18. Sin embargo, el estudio más amplio realizado hasta la fecha para comparar la angioplastia facilitada con la AP (ASSENT-4 PCI)18 se interrumpió prematuramente debido a un aumento de la mortalidad hospitalaria en el grupo de tratamiento facilitado (el 6 frente al 3%). Estos resultados desalentadores podrían haberse debido a que la revascularización percutánea muy temprana de placas muy inestables con una importante carga trombótica pudiera agravar el flujo coronario que se había recuperado satisfactoriamente con la trombolisis2,3,4. Por consiguiente, la angioplastia facilitada no puede recomendarse en el tratamiento de los pacientes con IAMCEST9,10.
Estrategia farmacoinvasivaEstudios recientes en los que se ha utilizado una estrategia FI, consistente en una infusión trombolítica temprana seguida de una angioplastia programada no inmediata, han obtenido unos resultados excelentes, comparables a los de la AP, en cuanto a la evolución clínica de los pacientes. A diferencia de los primeros estudios en los que se comparó la AP con la trombolisis (en los que se utilizaba con poca frecuencia la angioplastia posterior), en las nuevas series de estrategia FI más del 80% de los pacientes son tratados con angioplastia antes del alta5,6,7,8. A la vista de los malos resultados de la angioplastia facilitada y del resultado alentador obtenido con la estrategia FI, parece que el periodo comprendido entre 3 y 24h después de la trombolisis es el momento ideal para practicar una angioplastia programada tras la trombolisis9,10. Teóricamente, la FI combina los efectos beneficiosos de una rápida reperfusión con fármacos trombolíticos con los de la resolución de la estenosis coronaria residual mediante la angioplastia de una placa en la que la inestabilidad y la carga trombótica son menores que en el caso de la angioplastia facilitada2,3,4.
Estudiamos dos cohortes consecutivas incluidas en un registro prospectivo de IAMCEST. La primera cohorte la formaron 151 pacientes con IAMCEST tratados con una estrategia FI que incluyó una trombolisis en el hospital seguida de angiografía en los 2 días siguientes en todos los casos y una revascularización percutánea en el 87% (angioplastia de rescate en un 23%). La cohorte de AP la formaron 93 pacientes y un 96% de ellos fueron tratados con stents. Aunque los resultados clínicos no fueron el objetivo del presente estudio, observamos que la tasa de EAC a 1 año era casi idéntica con ambas estrategias (FI, 6%; AP, 7%). Así pues, nuestros datos respaldan el concepto de que, por lo que respecta a las variables de valoración clínicas, una estrategia FI que incluya un uso amplio de revascularizaciones previas al alta puede alcanzar unos resultados similares a los de la AP.
La trombolisis ineficaz es la principal limitación de la estrategia FI. A pesar de que la angioplastia de rescate sea una práctica común en estos casos, sus efectos beneficiosos en cuanto a la repercusión ventricular izquierda continúan sin estar claros. De hecho, en nuestra serie, los pacientes tratados con angioplastia de rescate fueron los que presentaron las alteraciones más graves en los índices de la RMC, tanto a la semana como a los 6 meses.
Repercusión ventricular izquierda en los pacientes tratados con la estrategia farmacoinvasiva o con angioplastia primariaEl objetivo último de todas las estrategias de reperfusión es reducir al mínimo la lesión miocárdica y preservar, en última instancia, la función sistólica limitando el remodelado ventricular izquierdo1,2,3. Los efectos nocivos de la depresión de la función sistólica y la dilatación de los volúmenes ventriculares izquierdos en la evolución clínica de los pacientes se han demostrado de manera concluyente9,10,19.
Los datos de comparación de la repercusión ventricular izquierda de la estrategia FI con la que tiene la estrategia de AP son escasos. En el estudio GRACIA-2, Fernández-Avilés et al7 describieron unos valores similares de fracción de eyección, volúmenes ventriculares izquierdos y disfunción sistólica regional en la angiografía realizada a las 6 semanas en los pacientes tratados con la estrategia FI y en los tratados con AP.
La RMC permite efectuar en una sola sesión una evaluación completa de una amplia gama de índices y se considera actualmente la técnica estándar de referencia para la evaluación no invasiva de los pacientes con IAMCEST11,15,19. El presente estudio es el primero que compara la repercusión ventricular izquierda de la estrategia FI con la de la estrategia de AP mediante la RMC.
La RMC es la única técnica que permite actualmente la determinación del área que estaba en riesgo durante la oclusión coronaria, es decir, el territorio que muestra un edema en las secuencias con ponderación T212. El área en riesgo fue idéntica (29%) en las cohortes de FI y de AP; estos datos confirman la semejanza entre estos dos grupos y permiten realizar una comparación directa de sus efectos beneficiosos en cuanto al miocardio rescatado.
La RMC con contraste tardío ha surgido como el método más fiable para cuantificar de manera no invasiva el tamaño del infarto y la obstrucción microvascular11,15. Tanto nosotros como otros autores hemos demostrado recientemente que, en pacientes con IAMCEST, el tamaño del infarto determinado mediante RMC constituye el índice con una relación más significativa con el pronóstico19,20. Ante un área en riesgo idéntica, los pacientes tratados con FI o con AP presentaron unos resultados comparables en cuanto a miocardio rescatado y tamaño del infarto. De igual modo, el grado de obstrucción microvascular no presentó diferencias entre ambas estrategias.
La efectividad equivalente de las estrategias FI y de AP en cuanto a tamaño del infarto, miocardio rescatado y obstrucción microvascular explica los resultados casi idénticos observados en la fracción de eyección y los volúmenes ventriculares izquierdos. Clásicamente, se ha considerado a estas variables los principales determinantes del pronóstico en los pacientes con IAMCEST1,9,10. A su vez, estos resultados podrían subyacer en la equivalencia de las estrategias de FI y AP en cuanto a los eventos clínicos.
Los pacientes tratados con FI y con AP presentaron unos resultados similares en la RMC obtenida a los 6 meses, lo cual resalta los efectos favorables de la estrategia FI en una perspectiva a largo plazo.
LimitacionesLa principal limitación de este estudio es que no fue aleatorizado. Las series de pacientes tratados con cada estrategia no fueron simultáneas. En consecuencia, la comparación puede verse confundida por factores clínicos, tanto permanentes como variables en el tiempo, que podrían diferir entre estas series.
Se excluyó a los pacientes que no fueron tratados con estrategias de reperfusión en las primeras 12 h siguientes al inicio del dolor torácico. Los eventos clínicos mayores o la inestabilidad clínica grave que impidieran la RMC fueron también criterios de exclusión. Por consiguiente, el grupo de estudio final incluía una población con riesgo bajo a intermedio y nuestros resultados sólo pueden considerarse válidos en poblaciones con IAMCEST similares a la nuestra.
Así pues, debe considerarse que se trata de un estudio de generación de hipótesis. Sería necesario un diseño de no inferioridad para descartar de manera definitiva la existencia de diferencias significativas entre los pacientes tratados con FI o con AP en cuanto a los índices de RMC. Sin embargo, un enfoque de este tipo requeriría un tamaño muestral enorme. Por ejemplo, según los resultados obtenidos en este estudio, debería incluirse a 11.100 pacientes para confirmar la equivalencia de FI y AP en cuanto al tamaño del infarto (α=0,05; potencia estadística=0,09; datos obtenidos con STATA 11, StataCorp, College Station, Texas, Estados Unidos).
ConclusionesUna estrategia FI que incluya el empleo de trombolisis, angioplastia de rescate en caso necesario y revascularización percutánea programada pero no inmediata constituye un enfoque logísticamente atractivo que, en pacientes sin complicaciones graves en los primeros días siguientes a la reperfusión, proporciona unos resultados iguales a los de la AP en lo relativo a los valores de obtenidos en la RMC de miocardio rescatado, tamaño del infarto, obstrucción microvascular, fracción de eyección y volúmenes ventriculares izquierdos a corto y a largo plazo tras el infarto.
FinanciaciónEl presente estudio fue financiado por el Instituto de Salud Carlos III (subvenciones PI080128 y Heracles).
Conflicto de interesesNinguno.
Recibido 24 Agosto 2010
Aceptado 15 Octubre 2010
Autor para correspondencia: Departamento de Cardiología, Hospital Clínico Universitario, INCLIVA, Blasco Ibáñez 17. 46010 Valencia, España. vicentbodi@hotmail.com