Describir nuestra experiencia en la corrección quirúrgica del origen anómalo de la arteria coronaria izquierda del tronco de la arteria pulmonar (ALCAPA), con énfasis en la técnica del reimplante coronario y sus resultados.
MétodosSe realizó un estudio descriptivo, longitudinal y retrospectivo de los pacientes con ALCAPA operados con técnica de reimplante coronario en un periodo de 19 años. Se exponen tres técnicas del reimplante coronario, dependiendo de la situación de la coronaria izquierda anómala, y la evolución postoperatoria en términos de morbimortalidad.
ResultadosSe analizó a 15 pacientes (el 86% mujeres) con una media de edad de 6,2 años (2 meses-24 años). El 80% se hospitalizó por insuficiencia cardiaca. El 67% tenía disfunción ventricular izquierda y el 27%, insuficiencia mitral importante o grave. Se practicó cirugía valvular mitral concomitante en 4 pacientes. Las principales complicaciones postoperatorias inmediatas fueron bajo gasto cardiaco (38%), derrame pleural (17%) e isquemia transitoria (13%). No hubo mortalidad operatoria ni a medio plazo.
ConclusionesEl reimplante coronario es la opción quirúrgica de elección para el manejo de los pacientes con ALCAPA por su excelente supervivencia posquirúrgica y su baja morbilidad operatoria.
Palabras clave
Las anomalías de las arterias coronarias constituyen el 2,2% de las cardiopatías congénitas, de las que la más frecuente es el origen anómalo de la arteria coronaria izquierda del tronco de la arteria pulmonar (ALCAPA, por sus siglas en inglés: anomalous origin of left coronary artery from pulmonary artery). La incidencia de esta entidad varía desde 1/30.000 a 1/300.000 recién nacidos1; la gran mayoría muere antes del primer año de vida por insuficiencia cardiaca grave de no recibir el adecuado tratamiento2, 3, 4, 5.
La cirugía es el tratamiento de elección en la etapa neonatal o de lactancia por sus buenos resultados, capaces de modificar la historia natural de la enfermedad6, 7, 8. Se han desarrollado varias técnicas quirúrgicas, pero las más útiles son las encaminadas a restituir la circulación cardiaca bicoronariana. La más difundida es la del reimplante coronario5, que ha sido adoptada por muchos centros como la técnica de elección7.
El objetivo del estudio es exponer nuestra experiencia en el tratamiento quirúrgico del ALCAPA con reimplante coronario, con énfasis en la técnica quirúrgica y los resultados obtenidos en el postoperatorio en cuanto a morbimortalidad.
MétodosDiseño del estudio y evaluación preoperatoriaSe realizó un estudio descriptivo, longitudinal y retrospectivo de los pacientes sometidos a cirugía de reimplante coronario por ALCAPA desde enero de 1987 a junio de 2010. Se excluyó a los pacientes con cirugía extrainstitucional y los corregidos con otra técnica que no fuera el reimplante coronario. La evaluación preoperatoria comprendió: datos demográficos, tiempo de evolución de los síntomas y diagnóstico de ingreso, clase funcional según la clasificación de la New York Heart Association (NYHA) (para escolares y adolescentes)9 y la modificación de Ross et al10 (para neonatos, lactantes y preescolares). Se catalogó el grado de insuficiencia cardiaca como descompensada (cuando se usó inotrópicos endovenosos y/o ventilación mecánica en el preoperatorio, con clase funcional clínica III o IV), compensada (cuando el paciente se encontraba en clase funcional I o II con medicación oral con diuréticos, digital y/o vasodilatadores) o ausente (si el paciente no requirió de medicación y en clase funcional I).
Los métodos para el diagnóstico fueron electrocardiografía, radiografía de tórax, ecocardiografía y cateterismo cardiaco. Ninguno de los pacientes fue sometido a angiotomografía helicoidal. En la electrocardiografía se buscaron signos de isquemia o infarto y su localización. En la radiografía de tórax se buscó la presencia de cardiomegalia y signos de congestión y/o edema agudo pulmonar. La cardiomegalia se catalogó según el índice cardiotorácico en leve (≥ 0,55 y < 0,65), moderada (≥ 0,65 y < 0,75) o grave (≥ 0,75). En la ecocardiografía se evaluó la función ventricular y la presencia y la gravedad de la insuficiencia mitral. Se estimó el grado de insuficiencia mitral mediante un método semicuantitativo basado en el largo y el ancho máximo del chorro regurgitante respecto a la aurícula izquierda, de la siguiente forma: 0 (sin regurgitación), grado 1 (leve), grado 2 (moderada), grado 3 (importante) y grado 4 (grave)11. El grado de disfunción ventricular se catalogó mediante la medición de la fracción de eyección del ventrículo izquierdo (FEVI) según el método de Simpson, considerando como valor normal del 65 al 70%, disfunción leve ≥ 45 a < 65%, moderada 30 a < 45% y grave < 30%12. En el estudio hemodinámico, se definió la posición de la coronaria izquierda anómala y se midió la presión telediastólica del ventrículo izquierdo (PD2VI), tomando 14 mmHg como valor máximo de normalidad.
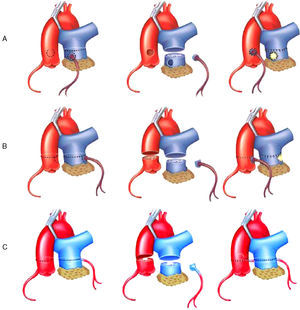
Técnica quirúrgicaEl abordaje quirúrgico se realizó mediante esternotomía media. Se estableció el circuito de derivación cardiopulmonar a través de una canulación aórtica y bicaval. Tras el pinzamiento aórtico, se realizó protección miocárdica con hipotermia y administración de solución cardiopléjica. Una vez obtenida la parada del corazón, se procedió a identificar la posición del origen de la arteria coronaria izquierda anómala y se distinguieron tres variantes: interna, lateral y posterior. La estrategia para el reimplante coronario fue diferente para cada una de estas variedades. En todas ellas se realizó una transección del tronco de la arteria pulmonar (TAP) por encima del origen de la coronaria izquierda anómala. Cuando esta fue en posición interna del TAP (Figura 1A), se resecó el botón coronario en forma circular, cerrando el defecto de la pared pulmonar con un parche de pericardio bovino. Se movilizó el botón coronario hasta encontrar el lugar más apropiado de la pared aórtica anterior evitando su distorsión, se elaboró un sacabocados de 4 o 5 mm en la pared aórtica y se reimplanto el botón coronario con sutura continua de monofilamento no absorbible. Cuando la coronaria anómala se originaba de la pared lateral (Figura 1B), debido a la mayor dificultad para movilizarla, se realizó transección tanto del tronco pulmonar como del aórtico. Se resecó el botón coronariano del tronco pulmonar en forma de D invertida, en forma similar a la utilizada para el switch arterial. Después de cerrar el defecto del TAP con un parche de pericardio, se procedió a la anastomosis terminoterminal de los dos troncos arteriales transectados. Finalmente, en la variedad de origen posterior (Figura 1C), se realizó una transección pulmonar para resecar el botón coronariano de forma similar a lo descrito para la segunda variedad, pero con la diferencia de que el tronco aórtico se incidió transversalmente en los dos tercios de su circunferencia. En el segmento posterior se elaboró un sacabocados en el sitio más conveniente para el reimplante. Finalmente se completó la aortorrafia y la anastomosis pulmonar terminoterminal. En los casos de insuficiencia mitral de grado 3 o 4, se realizó anuloplastia. En caso de fallo de la plastia mitral o anatomía mitral desfavorable, se procedió al cambio valvular protésico. Tras el procedimiento valvular mitral, se realizó una ecocardiografía transesofágica intraoperatoria (ETEI) para valorar la función del ventrículo izquierdo y de la prótesis implantada o de la válvula mitral reparada.
Figura 1. Técnica quirúrgica de corrección de origen anómalo de la arteria coronaria izquierda del tronco de la arteria pulmonar mediante reimplante coronario según el patrón de origen de la arteria coronaria anómala del tronco de la pulmonar. A: posición interna. B: posición lateral. C: posición posterior.
Estrategias de seguimiento postoperatorio inmediato y análisis estadísticoSe consideró mortalidad operatoria a todos los fallecidos hasta 30 días después de la cirugía o durante la misma hospitalización. Los eventos de morbilidad operatoria ocurridos se definieron según la nomenclatura internacional13. También se registraron los tiempos de hospitalización total, estancia en terapia intensiva, ventilación mecánica y estancia posquirúrgica.
La información obtenida de los expedientes clínicos se procesó en una hoja de cálculo Excel. Los datos se presentan como media, intervalo de variabilidad y porcentaje de la población en riesgo. Todos los pacientes contaron con consentimiento informado de los familiares para la realización de la cirugía. El estudio de esta serie clínica se realizó con autorización del comité de ética de nuestra institución.
ResultadosResultados de la evaluación preoperatoriaSe incluyó a 15 pacientes en este estudio: 13 mujeres (86%) y 2 varones (14%), con una relación de 6:1. La media de edad fue 6,2 años (2 meses-24 años), con una moda de 1,7 años. La media de peso fue 19,4 (3,6-47) kg; la talla, 98,8 (52-176) cm, y la superficie corporal, 0,69 (0,22-1,8) m2. El 80% de nuestros pacientes con ALCAPA (12 casos) eran menores de 12 años.
La edad de inicio de los síntomas fue 14 (1-72) meses, pero la mayoría de los pacientes (70%) presentaron síntomas antes de los 8 meses de vida. A su ingreso al hospital, el 20% (3 casos) no tenía insuficiencia cardiaca, el 67% (10 casos) tenía insuficiencia cardiaca compensada y sólo 2 (13%) sufrían insuficiencia cardiaca descompensada. En estos últimos 2 pacientes, se usó dobutamina los 2 días previos a la cirugía y uno de ellos requirió ventilación mecánica preoperatoria durante 48 h.
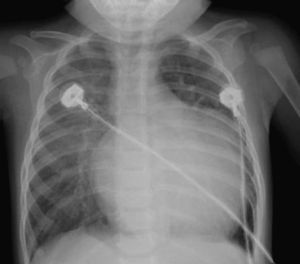
En la Tabla 1 están las características de los exámenes preoperatorios. La radiografía de tórax mostró cardiomegalia por dilatación de cavidades izquierdas en 12 casos (Figura 2), y sólo 2 pacientes (13%) tenían cardiomegalia grave con congestión pulmonar asociada; en ningún caso se observó edema pulmonar agudo.
Tabla 1. Exámenes preoperatorios de los pacientes con origen anómalo de la arteria coronaria izquierda del tronco de la arteria pulmonar
| Examen preoperatorio | Resultados | Pacientes, n (%) |
| Electrocardiograma | Sin signos de lesión isquémica o infarto | 4 (27) |
| Isquemia de pared anterior | 2 (13) | |
| Isquemia de pared lateral izquierda y posterior | 7 (47) | |
| Infarto lateral izquierdo y posterior | 2 (13) | |
| Radiografía de tórax | Sin cardiomegalia (ICT, 0,5-0,55) | 3 (20) |
| Cardiomegalia leve (ICT, ≥ 0,55-< 0,65) | 4 (27) | |
| Cardiomegalia moderada (ICT, ≥ 0,65-< 0,75) | 6 (40) | |
| Cardiomegalia grave (ICT, ≥ 0,75) | 2 (13) | |
| Dilatación de cavidades izquierdas | 12 (80) | |
| Congestión pulmonar | 2 (13) | |
| Ecocardiografía transtorácica | Función del VI normal (FEVI, 65-70%) | 5 (33) |
| Disfunción del VI leve (FEVI, ≥ 45-< 65%) | 6 (40) | |
| Disfunción del VI moderada (FEVI, ≥ 30-< 45%) | 3 (20) | |
| Disfunción del VI grave (FEVI < 30%) | 1 (7) | |
| Sin insuficiencia mitral | 6 (40) | |
| Insuficiencia mitral grado 1 (leve) | 4 (27) | |
| Insuficiencia mitral grado 2 (moderada) | 1 (7) | |
| Insuficiencia mitral grado 3 (importante) | 1 (7) | |
| Insuficiencia mitral grado 4 (grave) | 3 (20) | |
| Cateterismo cardiaco | PD2VI ≤ 14 mmHg | 6 (40) |
| PD2VI > 14 mmHg | 9 (60) | |
| Origen coronario de la pared posterior del TAP | 9 (60) | |
| Origen coronario de la pared interna del TAP | 4 (27) | |
| Origen coronario de la pared lateral del TAP | 2 (13) |
FEVI: fracción de eyección del ventrículo izquierdo; ICT: índice cardiotorácico; PD2VI: presión telediastólica del ventrículo izquierdo; TAP: tronco de la arteria pulmonar; VI: ventrículo izquierdo.
Figura 2. Imagen radiológica característica de paciente con origen anómalo de la arteria coronaria izquierda del tronco de la arteria pulmonar. Destaca la cardiomegalia a expensas de cavidades izquierdas.
A la ecocardiografía, 5 pacientes (33%) presentaron FEVI normal, en 6 (40%) se encontró disfunción leve; en 3 (20%), moderada y sólo en 1 caso, severa. En 6 pacientes (40%), la ecocardiografía no mostró insuficiencia mitral, mientras que en los restantes 9 (60%) era de grado 1 (n=4; 27%), grado 2 (n=1; 7%), grado 3 (n=1; 7%) y grado 4 (n=3; 20%). Cabe destacar que 4 de los casos (27%) presentaban insuficiencia mitral de grado 3 o 4 secundaria a disfunción ventricular moderada o grave. Finalmente, en el cateterismo, se evidenció aumento de la PD2VI en 9 casos (60%). El sitio de origen de la coronaria izquierda fue, en orden de frecuencia: pared posterior del TAP (60%, 9 casos), interna (27%, 4 casos) y lateral (13%, 2 casos).
De los 15 pacientes estudiados, en sólo 5 (33%) se llegó al diagnóstico inicial de ALCAPA. En el 67% restante (10 casos), se realizó un diagnóstico presuntivo diferente: insuficiencia mitral (33%, 5 casos), miocardiopatía (17%, 4 casos) y fístula coronaria (8%, 1 caso). Se encontraron dos lesiones asociadas: una comunicación interauricular tipo seno venoso superior y una fístula coronaria a ventrículo derecho.
Resultados intraoperatoriosLa protección miocárdica se realizó mediante hipotermia moderada a una media de 27°C y cardioplejia anterógrada en 7 casos (47%), o anterógrada combinada con retrógrada en 8 casos (53%). En 8 de los pacientes se usó cardioplejia sanguínea, y en 7 de ellos se usó cardioplejia cristaloide. La media de tiempo de circulación extracorpórea fue 115 (77-214) min y el de pinzamiento aórtico, 77 (44-138) min. El procedimiento quirúrgico se realizó con las variantes descritas para cada grupo: 9 casos (60%) con técnica para origen en la pared posterior (Figura 1C), 4 casos (27%) con origen interno (Figura 1A) y 2 casos (13%) con técnica de pared lateral del TAP (Figura 1B). En todos los casos la coronaria anómala se reimplantó sin distorsión ni tensión en la anastomosis. En los 4 pacientes con insuficiencia mitral de grado 3 o 4 secundaria a disfunción ventricular moderada o severa (27%), se realizó algún procedimiento sobre la válvula mitral. En 3 pacientes (20%) se hizo anuloplastía mitral y, en el caso restante, no fue posible realizar una reparación mitral, por lo que se optó por el cambio valvular con una prótesis mecánica n°23 en posición supraanular. Como procedimientos asociados, se realizaron cierre de comunicación interauricular con parche de pericardio bovino y cierre de fístula ventriculocoronariana en otro caso.
Antes de la descanulación, se realizó ETEI de control a todos los pacientes sometidos a cirugía mitral concomitante (4 casos, 27%). En 2 casos, la ETEI informó ausencia de insuficiencia mitral. Otro paciente quedó con insuficiencia mitral moderada residual, pero con estabilidad hemodinámica que permitió el destete de la circulación extracorpórea, por lo que no se realizó una nueva revisión mitral. En el paciente que requirió cambio valvular mitral, la ETEI mostró adecuada función protésica.
Al momento del destete de circulación extracorpórea, se presentaron arritmias en el 47% de los pacientes. Cinco de ellos presentaron fibrilación ventricular y 2, taquicardia ventricular. Al finalizar la cirugía, se trató a 3 pacientes (20%) con esternón abierto: 2 de ellos por hemorragia que requería empaquetamiento y 1 por inestabilidad hemodinámica al intento de cierre. Se los reoperó a todos ellos para realizar el cierre esternal a los 2 días, sin complicaciones. Por último, se extubó a 2 pacientes (13%) en sala operatoria.
Resultados en el postoperatorio inmediatoMortalidad: todos los pacientes recibieron corrección a una media de edad de 74 meses (6,2 años) (intervalo, 2 meses-24 años). No hubo mortalidad operatoria en esta serie.
Morbilidad: se presentaron eventos de morbilidad en 9 de los pacientes (Tabla 2). Requirieron algún procedimiento quirúrgico 5 pacientes (33%): 1 caso requirió reexploración por hemorragia postoperatoria, y fue necesario instalar drenaje pleural por derrame en 4 casos. En 3 casos (20%), se utilizó nitroglicerina por signos electrocardiográficos de isquemia. Puesto que los signos de isquemia e insuficiencia cardiaca secundaria cedieron en promedio a las 24 h del inicio de la terapia vasodilatadora, se consideró que la etiología más probable de estos eventos fue un espasmo coronario transitorio. Excluyendo a los 2 casos extubados en sala operatoria (13%), la duración de la ventilación mecánica fue: ≤ 24 h en 8 pacientes (53%), de 1 a 5 días en 1 (7%), de 5 a 7 días en 3 (20%) y ≥ 7 días en 1 (7%). La media de estancia en terapia intensiva fue de 5 (intervalo, 2-11; moda, 3) días y la posquirúrgica, 10 (intervalo, 6-21; moda, 6) días.
Tabla 2. Morbilidad operatoria posquirúrgica inmediata de origen anómalo de la arteria coronaria izquierda del tronco de la arteria pulmonar con reimplante coronario
| Complicaciones | Pacientes, n (%) |
| Bajo gasto cardiaco postoperatorio | 9 (38) |
| Derrame pleural | 4 (17) |
| Isquemia transitoria | 3 (13) |
| Taquiarritmia postoperatoria | 2 (8) |
| Hemorragia mediastínica postoperatoria inmediata | 1 (4) |
| Acidosis postoperatoria | 1 (4) |
| Bloqueo auriculoventricular completo transitorio | 1 (4) |
| Derrame pericárdico sin deterioro hemodinámico | 1 (4) |
| Infección respiratoria | 1 (4) |
| Déficit neurológico transitorio | 1 (4) |
| Total | 24 (100) |
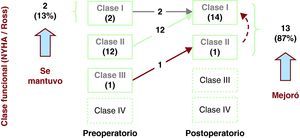
Tenemos un seguimiento clínico del 100%, con una media de 4±3 (1-12) años; todos ellos están vivos y en clase funcional I (NYHA/Ross). La Figura 3 muestra la evolución clínica de los pacientes; 13 de ellos (87%) mejoraron su clase funcional a medio plazo y 2 (13%) la mantuvieron. El único caso en clase funcional II correspondió a un paciente al que se realizó anuloplastía valvular mitral concomitantemente al reimplante coronario. Si bien inicialmente estuvo asintomático con el uso de diuréticos, su estado clínico fue deteriorándose y el ecocardiograma evidenció insuficiencia mitral grave e insuficiencia tricuspídea moderada. Se lo reoperó a los 4 meses para cambio valvular por prótesis mecánica St. Jude 23HP aórtica, que se colocó invertida en posición mitral, además de una plastia tricuspídea de Kay. La evolución postoperatoria fue satisfactoria y está en clase funcional I. Otro de estos casos, pese a estar asintomático, presentó signos de isquemia anteroseptoapical por electrocardiograma, por lo que se lo sometió a un estudio que incluyó: prueba de esfuerzo, angiotomografía, coronariografía y perfil lipídico. Se llegó a la conclusión de que sufría enfermedad coronaria aterosclerótica adquirida secundaria a dislipemia familiar sin lesiones coronarias críticas. Se indicó tratamiento médico con estatinas y fibratos, con los que se mantiene controlado hasta el momento. Actualmente todos los pacientes están en protocolo de seguimiento, que incluye electrocardiografía, angiotomografía helicoidal, gammagrafía de perfusión miocárdica y cateterismo cardiaco para documentar su estado de perfusión miocárdica.
Figura 3. Evolución a medio plazo de la clase funcional de los pacientes sometidos a corrección quirúrgica de origen anómalo de la arteria coronaria izquierda del tronco de la arteria pulmonar con reimplante coronario. NYHA: New York Heart Association.
DiscusiónEl ALCAPA fue descrito por Brooks en 1866 y el primer informe clínico y de autopsia fue el de Bland et al en 193313, 14, 15, 16. Wesselhoeft et al2 describieron en 1968 dos formas de presentación de ALCAPA: la infantil (la más frecuente: el 82%) y la forma del adulto (18%)2, 3, 4, 5. En nuestra serie, los porcentajes de ambas formas son similares a lo descrito por Wesselhoeft et al2. Creemos que la elevada cifra de ALCAPA del adolescente se debe a una referencia tardía y al desconocimiento de esta afección, lo cual hace que no se sospeche el diagnóstico o se confunda con otras entidades como la miocardiopatía dilatada y la insuficiencia mitral congénita17, 18, 19.
La ecocardiografía es el estándar de diagnóstico, ya que, además de demostrar la anomalía, determina la función ventricular, la presencia de insuficiencia mitral y signos de fibroelastosis subendocárdica12, 20, 21. El mecanismo de la insuficiencia mitral en el ALCAPA es por disfunción del músculo papilar (habitualmente el posterior) por isquemia, pero principalmente es consecuencia de la dilatación del anillo mitral secundaria a la configuración esferoidal que adopta el ventrículo izquierdo isquémico, lo que origina defecto de coaptación de los velos mitrales22. La gammagrafía de perfusión miocárdica con talio-201 es muy sensible y muestra hipocaptación de la región isquémica de la pared anterolateral del ventrículo izquierdo. Por otro lado, la angiotomografía helicoidal ha ido ganando terreno en el diagnóstico de ALCAPA, ya que su sensibilidad y su especificidad son altas. La posibilidad de reconstrucción tridimensional es otra ventaja del método y es también una alternativa útil en el seguimiento.
Los intentos de corrección quirúrgica en ALCAPA se iniciaron en 1953 cuando Potts llevó a cabo una anastomosis aortopulmonar para aumentar la saturación de oxígeno en el TAP23, 24. Mustard publicó una anastomosis terminoterminal de la arteria carótida izquierda a la coronaria izquierda anómala25. El primer manejo quirúrgico exitoso fue descrito en 1960 por Sabiston et al; consistió en la ligadura de la coronaria en el sitio del origen anómalo23. En 1968, Meyer et al26 anastomosaron la arteria subclavia izquierda a la coronaria izquierda anómala. Los intentos posteriores de corrección del ALCAPA se centraron en establecer un doble sistema coronario y surgieron alternativas como la de Takeuchi8 y la del reimplante coronario5. Los resultados registrados con la técnica de Takeuchi han sido alentadores, ya que varias series comunican mínimas complicaciones y baja mortalidad. Sin embargo, en el seguimiento a largo plazo se registran complicaciones: insuficiencia aórtica, estenosis pulmonar supravalvular y obstrucción del parche27. En la década pasada, la experiencia acumulada con la corrección tipo Jatene para la transposición de grandes arterias ha redundado en los pacientes con ALCAPA. Según los cirujanos se han ido familiarizando con la transferencia del ostium coronario, la implantación directa a la aorta se ha vuelto el procedimiento de elección para la mayoría de los pacientes con ALCAPA. La mortalidad operatoria de este procedimiento varía entre el 0 y el 23%, y la supervivencia a largo plazo es excelente28, 29, 30, 31, 32, 33. Una de las experiencias más importantes es la de Azakie et al7, quienes comunicaron una serie de 67 pacientes, de los que se llevó a reimplante de la coronaria izquierda a 47, con supervivencia del 92%. La mortalidad operatoria de nuestra serie se compara favorablemente con esos resultados. A pesar de que no ponemos énfasis en la descripción de los resultados tardíos, podemos afirmar que la evolución postoperatoria a medio plazo es satisfactoria desde el punto de vista clínico, y quedan pendientes los resultados funcionales de perfusión miocárdica, motivo de nuestro protocolo de seguimiento en curso.
Uno de los aspectos técnicos que considerar durante la corrección de ALCAPA es la posición de la coronaria anómala. Cuando se origina en situación interna, el reimplante es posible sin mayor movilización del sistema coronario. El origen del ALCAPA en situación posterior o lateral hace que la implantación tenga un mayor grado de dificultad, por la necesidad de movilizar significativamente el sistema coronario y la posibilidad de torsión del árbol coronario durante el reimplante. No es infrecuente que la longitud coronaria sea insuficiente para lograr una anastomosis libre de tensión. En estos casos se han ideado técnicas de extensión coronariana, como las del flap pulmonar34, que no están exentas de eventos isquémicos capaces de incrementar la mortalidad operatoria.
Otro aspecto de controversia en la corrección del ALCAPA es el relacionado con la conducta quirúrgica en la insuficiencia mitral. En la mayoría de los pacientes con ALCAPA y disfunción ventricular y/o insuficiencia mitral, se puede esperar la recuperación posterior al restablecimiento del flujo coronario. Sin embargo, es difícil precisar cuándo el ventrículo podrá recuperarse y mejorará la insuficiencia mitral secundaria. Según la experiencia de Azakie et al7, tras la corrección de ALCAPA en etapa neonatal o de lactancia hay una mejoría significativa de la FEVI a partir del primer año. Por ello recomienda no realizar ningún procedimiento asociado a la corrección de ALCAPA. Cuando la disfunción ventricular es grave y/o la insuficiencia mitral es de grado 3 o 4, es recomendable hacer una plastia o un cambio valvular protésico, dependiendo de la anatomía del aparato valvular mitral. Nuestro grupo concuerda con esta conducta y por esa razón sólo se realizó algún procedimiento valvular mitral agregado en pacientes en esa condición hemodinámica. Pensamos que el procedimiento de elección es la anuloplastia mitral, cuyos resultados deben evaluarse en sala operatoria con ETEI, optando por el cambio valvular protésico en casos de fracaso de la plastia o anatomía mitral desfavorable, como la del único paciente de nuestra serie que recibió una prótesis mecánica.
ConclusionesEl reimplante de la coronaria izquierda es una opción quirúrgica adecuada para el manejo de los pacientes con ALCAPA, con una excelente supervivencia a medio plazo y una morbilidad baja. Se debe realizar un profundo análisis clínico y ecocardiográfico de todo paciente con insuficiencia cardiaca secundaria a insuficiencia mitral congénita o a miocardiopatía, con el fin de descartar esta anomalía coronaria.
Conflicto de interesesNinguno.
Recibido 7 Febrero 2011
Aceptado 19 Abril 2011
Autor para correspondencia: Departamento de Cirugía Cardiaca Pediátrica y Cardiopatías Congénitas, Instituto Nacional de Cardiología Ignacio Chávez, Juan Badiano 1, Edificio H, 6.o piso, Colonia Sección XVI, Delegación Tlalpan, 14080 México D.F., México. pcuricuri001@gmail.com