El retrasplante cardiaco (ReTC) representa un tema controvertido actualmente. Nuestro objetivo es describir y analizar los resultados del ReTC en España.
MétodosAnálisis retrospectivo del Registro Español de Trasplante Cardiaco de 1984 a 2018. Se recogieron datos sobre donante, receptor, cirugía, inmunosupresión y supervivencia. La mortalidad por todas las causas o la necesidad de ReTC postrasplante fueron el objetivo principal. Se estudiaron diferencias en supervivencia según indicación, tiempo entre trasplantes y época del ReTC.
ResultadosSe estudiaron en total 7.592 trasplantes cardiacos (TxC) y 173 (2,3%) ReTC (mediana de edad, 52,0 y 55,0 años respectivamente). La enfermedad vascular del injerto fue la indicación de ReTC más frecuente (42,2%) y 59 pacientes (80,8%) recibieron el ReTC más de 5 años después del trasplante inicial. El rechazo agudo y el fallo primario del injerto disminuyeron como indicaciones durante el periodo estudiado. La insuficiencia renal, la hipertensión, la necesidad de ventilación mecánica o balón intraaórtico y la mayor duración de la isquemia fría fueron más frecuentes en el ReTC. La mediana de seguimiento del ReTC fue 5,8 años. El ReTC tuvo peor supervivencia que el TxC (HR ponderado=1,43; IC95%, 1,17-1,44; p<0,001). El rechazo agudo (HR=2,49; IC95%, 1,45-4,27; p<0,001) se relacionó con el peor resultado. El ReTC más allá de 5 años del trasplante inicial presagia resultados similares a los del TxC primario (HR ponderado=1,14; IC95%, 0,86-1,50; p<0,001).
ConclusionesEl ReTC se asoció con mayor mortalidad que el TxC, especialmente por rechazo agudo. El pronóstico del ReTC realizado más de 5 años después es similar al del TxC primario.
Palabras clave
El retrasplante cardiaco (ReTC) supone un porcentaje muy pequeño del total de trasplantes cardiacos (TxC). En 2014, la International Society for Heart and Lung Transplantation publicó las características y los resultados del ReTC basándose en la experiencia de múltiples centros de diferentes países, incluidos algunos hospitales de España. Según la investigación, el ReTC se mantuvo estable a lo largo de todo el periodo de estudio, con una frecuencia del 2 al 4%1–5.
Las listas de espera se han ido haciendo cada vez más largas y puede que sigan aumentando gradualmente en todo el mundo. En consecuencia, parece esencial determinar los factores relacionados con esta situación. Se han llevado a cabo esfuerzos para aumentar el número de donantes a través de programas de donación tras muerte cardiaca o admitiendo donantes con unas características marginales, por ejemplo. Sin embargo, un alto porcentaje de los trasplantes se hacen en situaciones agudas, como consecuencia del aumento de la asistencia circulatoria mecánica, lo que podría tener repercusión en las listas de espera. Cuándo y a quién trasplantar no solo ha pasado a ser una decisión clínica importante, sino que también un dilema ético. El ReTC es viable y probablemente sea la única opción terapéutica para pacientes con disfunción grave del injerto6,7, por lo que es esencial identificar al paciente idóneo al que podría aportar un beneficio.
El objetivo del presente análisis es describir las características y la supervivencia de los pacientes sometidos a ReTC en un registro de trasplantes de ámbito nacional8.
MÉTODOSSe hizo un análisis de cohorte retrospectivo basado en los datos del Registro Español de Trasplante Cardiaco (RETC), una base de datos prospectiva multicéntrica promovida por la Asociación de Insuficiencia Cardiaca de la Sociedad Española de Cardiología, desde 1984 hasta diciembre de 2018. Esta base de datos se ha descrito en otra publicación9 y contiene información clínica detallada de todas las intervenciones de TxC practicadas en España desde 1984 hasta la actualidad. El registro se actualiza anualmente con los datos suministrados por todos los centros de trasplante de España. El uso de datos anonimizados para fines de investigación recibió la aprobación de los comités de ética locales de todos los centros participantes. Para los fines de este estudio, se recogieron los datos de los pacientes de edad >16 años en el momento del trasplante, relativos a las características del receptor y del donante en situación basal, de la intervención quirúrgica, la inmunosupresión y la supervivencia. Se excluyó a los pacientes con trasplantes de múltiples órganos.
Se compararon las características clínicas basales y la supervivencia a largo plazo después del TxC de los pacientes sometidos a ReTC entre 1987 y 2018 con los datos de los pacientes a los que se practicó un primer TxC (grupo sin ReTC). Respecto al primer grupo, se usaron para el análisis las características en el momento del segundo TxC. Dada la alta correlación entre el código urgente de la lista de espera y el empleo de asistencia circulatoria antes del TxC, solo se utilizó esta última variable para evitar la colinealidad. La disfunción renal se definió por una concentración sérica de creatinina > 2 mg/dl o necesidad de diálisis. En el parámetro de serología del citomegalovirus del donante, había un gran porcentaje de datos no disponibles, por lo que no se incluyó en el análisis. La causa de la muerte y la causa principal del ReTC se basaron en lo establecido localmente por cada centro participante. La causa del ReTC se clasificó como: fallo primario de injerto (FPI) (principalmente como resultado de una disfunción temprana del aloinjerto sin que hubiera signos claros de rechazo), rechazo del aloinjerto (RA) (tanto el rechazo agudo celular como el mediado por anticuerpos), vasculopatía de aloinjerto (VAC) (disfunción del aloinjerto secundaria a una coronariopatía significativa según la declaración de consenso de la International Society for Heart and Lung Transplantation10 o infarto de miocardio según los signos electrocardiográficos y ecocardiográficos); y fallo inespecífico del injerto (FII) (sin un diagnóstico definitivo de rechazo agudo o VAC). Dadas las similitudes existentes en las características basales clave de la VAC y el FII como indicaciones para el ReTC (), se combinaron los 2 grupos para el presente estudio. Según la cronología, el ReTC se clasificó como temprano si se producía en un plazo <1 año, a medio plazo si se hacía en 1-5 años o tardío transcurridos más de 5 años desde el trasplante anterior.
Objetivo principalEl objetivo principal fue la mortalidad postrasplante por cualquier causa o la necesidad de ReTC. El ReTC refleja un segundo trasplante en el grupo de ReTC.
Análisis estadísticoLas variables continuas se resumen mediante la mediana [intervalo intercuartílico] y se compararon con la prueba de la U de Mann-Whitney o la prueba de Kruskal-Wallis, según procediera. Las variables discretas se resumen mediante números (porcentajes) y se compararon con la prueba de la χ2 o la prueba exacta de Fisher, según procediera.
La modelización del tiempo transcurrido hasta el evento (muerte o segundo TxC) se basó en las medias de regresión paramétrica con una distribución de Weibull. Para evitar el sesgo de inmortalidad derivado de que los receptores de un ReTC debían haber continuado con vida hasta el segundo TxC, lo cual constituía un tiempo adicional no disponible en el caso de los pacientes sin ReTC11, se utilizaron modelos estructurales marginales en todos los análisis12. La contribución de cada paciente se ponderó mediante el inverso de su función de densidad de probabilidad de haber sido tratado con un ReTC condicionada por las covariables del estudio. Además, para evitar que hubiera una gran variabilidad en las ponderaciones como consecuencia de la intensa asociación existente entre el ReTC y algunas covariables (), se aplicaron ponderaciones estabilizadas13, definidas como Probabilidad(ReTC) / Probabilidad(ReTC / covariables), donde las probabilidades se estimaron mediante regresión logística. Tanto en el numerador como en el denominador, la probabilidad fue P (ReTC) para los pacientes con ReTC y 1 – P (ReTC) para los pacientes sin ReTC.
El modelo de regresión logística multivariable destinado a obtener la probabilidad de ReTC se ajustó con todas las variables que tenían una asociación significativa con el criterio de valoración del estudio (). Los antecedentes de esternotomía previa eran un predictor perfecto del ReTC, por lo que no se pudo introducirlos en el modelo. Para el ajuste, esta variable se introdujo en la regresión paramétrica de supervivencia como factor independiente, junto con una ponderación estabilizada. De igual modo, se ajustó un segundo modelo de regresión logística que excluía la inducción en el momento del TxC y luego sirvió para calcular una ponderación estabilizada diferente destinada a realizar un análisis de sensibilidad específico. Se llevó a cabo también otro análisis de sensibilidad excluyendo la esternotomía previa del análisis de regresión de supervivencia.
Para los datos no disponibles () se hicieron imputaciones múltiples con el método de especificación plenamente condicional, y se generaron 10 series de datos imputados utilizando todas las variables de ajuste aplicables y el criterio de valoración como predictores. Para el análisis, se consideró el promedio de las 10 series de datos imputados obtenido según las reglas de Rubin14. Para la imputación, se utilizaron modelos de las variables discretas y continuas mediante regresión logística y regresión lineal respectivamente.
Todas las pruebas estadísticas fueron bilaterales y se consideró significativo un valor de p <0,05. Los análisis estadísticos se hicieron con el programa SPSS 25.0 (SPSS Inc, Estados Unidos) y el programa Stata 16.1 (StataCorp, Estados Unidos).
RESULTADOSEn total, se identificó a 7.592 pacientes en la base de datos del RETC, 173 de ellos (2,3%) con ReTC una mediana de 4,9 [0,04-11,5] años tras el trasplante inicial. En la figura 1A se muestra la distribución de los pacientes según la indicación para el ReTC y el tiempo transcurrido desde el trasplante inicial. Globalmente, la VAC fue la indicación más frecuente para el ReTC (73 pacientes, 42,2%), una mediana de 9,1 [5,7-13,1] años tras el trasplante inicial. En 59 de los 73 pacientes (80,8%), el retrasplante tuvo lugar más de 5 años después del trasplante inicial. El RA motivó el ReTC en 16 pacientes (9,2%), tras una mediana de 0,6 [0,3-1,2] años, y la mayoría de los pacientes (75%) fueron retrasplantados durante el primer año tras el trasplante inicial. El FII fue la indicación para el ReTC en 43 pacientes (24,9%), tras una mediana de 9,0 [1,7-12,8] años. En 26 (60,5%) y 11 (25,6%) de estos pacientes, el retrasplante se hizo más de 5 años y entre 1 y 5 años después del trasplante inicial. El diagnóstico fue un FPI en 41 pacientes (23,7%). En todos ellos el ReTC ocurrió el primer año tras el TxC. Además, tanto el RA como el FPI disminuyeron como indicaciones para el ReTC a lo largo del periodo de observación, mientras que hubo un aumento de la VAC y el FII (figura 1B).
Distribución de los pacientes según la indicación para el retrasplante y el tiempo transcurrido tras el trasplante inicial (A) e indicaciones para el retrasplante según la época del trasplante (B). FII: fallo inespecífico del injerto; FPI: fallo primario del injerto; RA: rechazo agudo; VAC: vasculopatía de aloinjerto cardiaco.
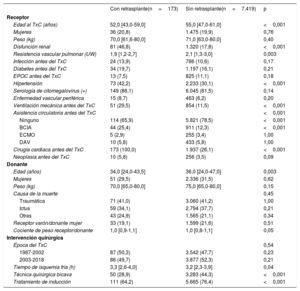
En la tabla 1 se presentan las características demográficas de los pacientes. Los pacientes sometidos a ReTC eran de menos edad (mediana, 52,0 frente a 55,0 años) y mostraron una mayor probabilidad pretrasplante de disfunción renal (el 46,8 frente al 17,8%), hipertensión (el 42,2 frente al 30,1%), ventilación mecánica (el 29,5 frente al 11,5%), esternotomía previa (el 100 frente al 26,1%) y necesidad de asistencia circulatoria con balón de contrapulsación intraaórtico (el 25,4 frente al 12,3%) y más tiempo de isquemia fría (mediana, 3,3 frente a 3,2 h). En cambio, los pacientes con un retrasplante mostraron menor resistencia vascular pulmonar (mediana, 1,9 frente a 2,1 UW) y una menor probabilidad de técnica bicava (el 28,9 frente al 44,3%). La edad del donante fue también inferior (mediana, 34,0 frente a 36,0 años).
Características basales de la población por grupos de estudio
| Con retrasplante(n=173) | Sin retrasplante(n=7.419) | p | |
|---|---|---|---|
| Receptor | |||
| Edad al TxC (años) | 52,0 [43,0-59,0] | 55,0 [47,0-61,0] | <0,001 |
| Mujeres | 36 (20,8) | 1.475 (19,9) | 0,76 |
| Peso (kg) | 70,0 [61,6-80,0] | 71,0 [63,0-80,0] | 0,40 |
| Disfunción renal | 81 (46,8) | 1.320 (17,8) | <0,001 |
| Resistencia vascular pulmonar (UW) | 1,9 [1,2-2,7] | 2,1 [1,3-3,0] | 0,003 |
| Infección antes del TxC | 24 (13,9) | 786 (10,6) | 0,17 |
| Diabetes antes del TxC | 34 (19,7) | 1.197 (16,1) | 0,21 |
| EPOC antes del TxC | 13 (7,5) | 825 (11,1) | 0,18 |
| Hipertensión | 73 (42,2) | 2.233 (30,1) | <0,001 |
| Serología de citomegalovirus (+) | 149 (86,1) | 6.045 (81,5) | 0,14 |
| Enfermedad vascular periférica | 15 (8,7) | 463 (6,2) | 0,20 |
| Ventilación mecánica antes del TxC | 51 (29,5) | 854 (11,5) | <0,001 |
| Asistencia circulatoria antes del TxC | <0,001 | ||
| Ninguno | 114 (65,9) | 5.821 (78,5) | <0,001 |
| BCIA | 44 (25,4) | 911 (12,3) | <0,001 |
| ECMO | 5 (2,9) | 255 (3,4) | 1,00 |
| DAV | 10 (5,8) | 433 (5,8) | 1,00 |
| Cirugía cardiaca antes del TxC | 173 (100,0) | 1.937 (26,1) | <0,001 |
| Neoplasia antes del TxC | 10 (5,8) | 256 (3,5) | 0,09 |
| Donante | |||
| Edad (años) | 34,0 [24,0-43,5] | 36,0 [24,0-47,0] | 0,003 |
| Mujeres | 51 (29,5) | 2.336 (31,5) | 0,62 |
| Peso (kg) | 70,0 [65,0-80,0] | 75,0 [65,0-80,0] | 0,15 |
| Causa de la muerte | 0,45 | ||
| Traumática | 71 (41,0) | 3.060 (41,2) | 1,00 |
| Ictus | 59 (34,1) | 2.794 (37,7) | 0,21 |
| Otras | 43 (24,9) | 1.565 (21,1) | 0,34 |
| Receptor varón/donante mujer | 33 (19,1) | 1.599 (21,6) | 0,51 |
| Cociente de peso receptor/donante | 1,0 [0,9-1,1] | 1,0 [0,8-1,1] | 0,05 |
| Intervención quirúrgica | |||
| Época del TxC | 0,54 | ||
| 1987-2002 | 87 (50,3) | 3.542 (47,7) | 0,23 |
| 2003-2018 | 86 (49,7) | 3.877 (52,3) | 0,21 |
| Tiempo de isquemia fría (h) | 3,3 [2,6-4,0] | 3,2 [2,3-3,9] | 0,04 |
| Técnica quirúrgica bicava | 50 (28,9) | 3.283 (44,3) | <0,001 |
| Tratamiento de inducción | 111 (64,2) | 5.665 (76,4) | <0,001 |
BCIA: balón de contrapulsación intraaórtico; DAV: dispositivo de asistencia ventricular; ECMO: oxigenador extracorpóreo de membrana; EPOC: enfermedad pulmonar obstructiva crónica; TxC: trasplante cardiaco.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
La mediana de seguimiento fue de 5,8 [0,8-12,8] años, con un seguimiento significativamente más corto en los pacientes retrasplantados que en aquellos con TxC primario (mediana, 2,0 [0,1-9,3] frente a 5,9 [0,9-12,8] años; p < 0,001).
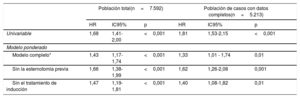
Retrasplante y resultadosEn total, hubo 123 muertes (71,1%) y 4 segundos retrasplantes (2,3%) en el grupo de ReTC en comparación con 4.300 muertes (58,0%) en el grupo sin ReTC (p <0,001). Los pacientes retrasplantados mostraron también mayor probabilidad de muerte en 1 año (el 43,9 frente al 22,9%; p <0,001). En el análisis univariable (), el ReTC mostró una supervivencia peor que la del TxC primario (hazard ratio [HR] sin ajustar = 1,81; intervalo de confianza del 95% [IC95%], 1,53-2,15; p <0,001). En el modelo ponderado, el ReTC continuó mostrando una asociación significativa con un resultado peor que el obtenido en los pacientes a los que se practicó un primer y único TxC (HR ponderada = 1,43; IC95%, 1,17-1,44; p <0,001) (tabla 2).
Análisis para evaluar el riesgo de mortalidad postrasplante en el retrasplante cardiaco, en comparación con la población sin retrasplante (modelo estructural marginal)
| Población total(n=7.592) | Población de casos con datos completos(n=5.213) | |||||
|---|---|---|---|---|---|---|
| HR | IC95% | p | HR | IC95% | p | |
| Univariable | 1,68 | 1,41-2,00 | <0,001 | 1,81 | 1,53-2,15 | <0,001 |
| Modelo ponderado | ||||||
| Modelo completo* | 1,43 | 1,17-1,74 | <0,001 | 1,33 | 1,01 - 1,74 | 0,01 |
| Sin la esternotomía previa | 1,66 | 1,38-1,99 | <0,001 | 1,62 | 1,26-2,08 | 0,001 |
| Sin el tratamiento de inducción | 1,47 | 1,19-1,81 | <0,001 | 1,40 | 1,08-1,82 | 0,01 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Modelo estructural marginal con ponderación estabilizada de probabilidad inversa y con la esternotomía previa. La ponderación de probabilidad inversa incluyó características del receptor (edad al trasplante, sexo, peso, disfunción renal, resistencia vascular pulmonar, infección, diabetes, enfermedad pulmonar obstructiva crónica, hipertensión, serología de citomegalovirus, enfermedad vascular periférica, ventilación mecánica, apoyo circulatorio, neoplasia), características del donante (edad, sexo, peso, causa de la muerte, donante mujer/receptor varón, cociente de peso de receptor/donante), características de la intervención quirúrgica (época del trasplante, tiempo de isquemia fría, técnica quirúrgica) y el tratamiento de inducción al hacer el trasplante.
Los modelos estructurales marginales se repitieron tras la exclusión de la esternotomía previa y el tratamiento de inducción aplicado en el momento del trasplante. En el análisis ponderado sin la esternotomía previa, el ReTC mostró una asociación significativa con la mortalidad por cualquier causa/ReTC (HR = 1,66; IC95%, 1,38-1,99; p <0,001). Igualmente, en el análisis ponderado sin el tratamiento de inducción en el momento del trasplante, los pacientes tratados con un ReTC mostraron un peor pronóstico (HR = 1,47; IC95%, 1,19-1,81; p <0,001) (tabla 2).
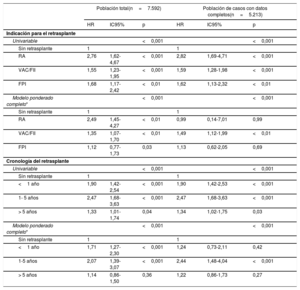
Efectos de la indicación y la cronología del retrasplanteEn todo el análisis, no hubo diferencias significativas de las tasas de mortalidad/ReTC en función de la indicación para el ReTC: el 87,5% para el RA, el 72,6% para la VAC, el 73,2% para el FPI y el 69,8% para el FII (p=0,58). Se obtuvieron resultados similares para la mortalidad/ReTC al año del trasplante (el 56,3, el 35,6, el 51,2 y el 46,5% respectivamente; p=0,26). En comparación con el grupo sin ReTC, la regresión univariable mostró un riesgo de mortalidad superior para todas las indicaciones, en especial en los pacientes sometidos a ReTC por un RA (HR sin ponderar = 2,76; IC95%, 1,62-4,67; p <0,001). En cambio, los pacientes tratados con un ReTC a causa de una VAC/FII presentaron menos riesgo (HR sin ponderar = 1,55; IC95%, 1,23-1,95; p <0,001) (tabla 3). En el análisis ponderado, el efecto en el riesgo de muerte/ReTC en comparación con el grupo sin ReTC se redujo, pero continuó siendo sumamente significativo, en especial para el RA y la VAC/FII (tabla 3).
Análisis para evaluar el riesgo de mortalidad postrasplante en el retrasplante cardiaco, en comparación con la población sin retrasplante (modelo estructural marginal) según la indicación para el retrasplante y la cronología del retrasplante
| Población total(n=7.592) | Población de casos con datos completos(n=5.213) | |||||
|---|---|---|---|---|---|---|
| HR | IC95% | p | HR | IC95% | p | |
| Indicación para el retrasplante | ||||||
| Univariable | <0,001 | <0,001 | ||||
| Sin retrasplante | 1 | 1 | ||||
| RA | 2,76 | 1,62-4,67 | <0,001 | 2,82 | 1,69-4,71 | <0,001 |
| VAC/FII | 1,55 | 1,23-1,95 | <0,001 | 1,59 | 1,28-1,98 | <0,001 |
| FPI | 1,68 | 1,17-2,42 | <0,01 | 1,62 | 1,13-2,32 | <0,01 |
| Modelo ponderado completo* | <0,001 | <0,001 | ||||
| Sin retrasplante | 1 | 1 | ||||
| RA | 2,49 | 1,45-4,27 | <0,01 | 0,99 | 0,14-7,01 | 0,99 |
| VAC/FII | 1,35 | 1,07-1,70 | <0,01 | 1,49 | 1,12-1,99 | <0,01 |
| FPI | 1,12 | 0,77-1,73 | 0,03 | 1,13 | 0,62-2,05 | 0,69 |
| Cronología del retrasplante | ||||||
| Univariable | <0,001 | <0,001 | ||||
| Sin retrasplante | 1 | 1 | ||||
| <1 año | 1,90 | 1,42-2,54 | <0,001 | 1,90 | 1,42-2,53 | <0,001 |
| 1- 5 años | 2,47 | 1,68-3,63 | <0,001 | 2,47 | 1,68-3,63 | <0,001 |
| > 5 años | 1,33 | 1,01-1,74 | 0,04 | 1,34 | 1,02-1,75 | 0,03 |
| Modelo ponderado completo* | <0,001 | <0,001 | ||||
| Sin retrasplante | 1 | 1 | ||||
| <1 año | 1,71 | 1,27-2,30 | <0,001 | 1,24 | 0,73-2,11 | 0,42 |
| 1-5 años | 2,07 | 1,39-3,07 | <0,001 | 2,44 | 1,48-4,04 | <0,001 |
| > 5 años | 1,14 | 0,86-1,50 | 0,36 | 1,22 | 0,86-1,73 | 0,27 |
FII: fallo inespecífico del injerto; FPI: fallo primario del injerto; HR: hazard ratio; IC95%: intervalo de confianza del 95%; RA: rechazo agudo; VAC: vasculopatía de aloinjerto cardiaco.
Modelo estructural marginal con ponderación estabilizada de probabilidad inversa y con la esternotomía previa. La ponderación de probabilidad inversa incluyó características del receptor (edad al trasplante, sexo, peso, disfunción renal, resistencia vascular pulmonar, infección, diabetes, enfermedad pulmonar obstructiva crónica, hipertensión, serología de citomegalovirus, enfermedad vascular periférica, ventilación mecánica, apoyo circulatorio, neoplasia), características del donante (edad, sexo, peso, causa de la muerte, donante mujer/receptor varón, cociente de peso de receptor/donante), características de la intervención quirúrgica (época del trasplante, duración de la isquemia fría, técnica quirúrgica) y el tratamiento de inducción al hacer el trasplante.
Respecto a la cronología del ReTC, las tasas de mortalidad/ReTC fueron del 78,3, el 96,3 y el 62,8% de los pacientes sometidos a ReTC menos de 1 año, de 1 a 5 años o más de 5 años después del trasplante inicial respectivamente (p=0,002). En comparación con el grupo sin ReTC, la regresión univariable mostró un riesgo significativamente mayor en los 3 grupos de cronologías diferentes (tabla 3). En el modelo con ponderación, se observaron asociaciones significativas en los pacientes en los que el ReTC se hizo menos de 1 año después del primer TxC (HR = 1,71; IC95%, 1,27-2,30) o entre 1 y 5 años después del primer TxC (HR = 2,07; IC95%, 1,39-3,07; ambos, p <0,001) (tabla 3). Sin embargo, el ReTC más de 5 años después del primer TxC no mostró un riesgo significativamente distinto que el del grupo sin ReTC (tabla 3).
DISCUSIÓNEn general, los resultados del presente estudio indicaron que el ReTC se asociaba con un resultado peor que el del trasplante primario. Estos resultados deben interpretarse teniendo en cuenta las características de la población de nuestro estudio. La tasa de ReTC en nuestro país parece ser inferior a la observada en otros estudios, en especial los de Norteamérica15.
En 2008, Atluri et al.16 describieron una mejor supervivencia tras el ReTC en comparación con lo indicado en estudios previos y mencionaron el tratamiento perioperatorio cuidadoso como uno de los principales pilares para explicar este hallazgo. Años más tarde, un análisis de la base de datos de United Network for Organ Sharing4 indicó que los posibles factores para producir una supervivencia más prolongada eran la selección de los candidatos, la asistencia perioperatoria, la técnica quirúrgica y los avances en los tratamientos médicos. En este contexto, la relación entre los plazos e indicaciones para el ReTC y los resultados se ha estudiado por múltiples grupos1–4,17–27. Tres publicaciones3,25,26 aparecidas entre los años 2000 y 2005 señalaron que los retrasplantes hechos en un plazo de 6 meses tras un TxC se asociaban con tasas de supervivencia decrecientes, que mejoraban significativamente cuando se tenía en cuenta la cronología y las indicaciones. Según estos estudios, el intervalo óptimo para el retrasplante era de más de 2 años después del TxC inicial y era preciso excluir a los pacientes con un RA incontrolable en los primeros 6 meses o con una disfunción del injerto a causa de un FPI. El Working Group on Heart Retransplantation2 resumió estos datos, junto con los de otras experiencias previas, en que la vasculopatía crónica grave del aloinjerto cardiaco no tratable médica ni quirúrgicamente y la disfunción crónica del injerto con insuficiencia cardiaca progresiva en ausencia de un rechazo activo fueron las únicas indicaciones para el ReTC aceptadas. Goerler et al.17 compararon la mortalidad a 30 días tras el retrasplante. Su política de ReTC había sido objeto de una revisión años antes, tomando el fallo agudo del injerto como criterio de exclusión para el ReTC. El ReTC temprano se definió como un retrasplante en el primer mes tras el TxC e incluyó a los pacientes con RA, insuficiencia cardiaca derecha, insuficiencia biventricular o fallo agudo del injerto de origen desconocido. La mortalidad a 30 días en este grupo fue 3 veces superior a la del grupo de retrasplante tardío. En nuestra serie se obtuvieron resultados similares, según los cuales los retrasplantes hechos entre 1 y 5 años después del trasplante fueron los que se asociaron con una mayor mortalidad. No obstante, los ReTC más de 5 años después del primer TxC no se asociaron con un peor resultado. Esto podría explicarse por varios factores, pero probablemente los más importantes sean las indicaciones para el ReTC y la época del trasplante. La VAC y el FII supusieron más del 60% de los retrasplantes, y la mayoría de ellos se hicieron más de 5 años después del TxC. En cambio, el FPI y el RA fueron más frecuentes en la primera época de nuestro estudio, de tal manera que todos los retrasplantes por FPI y más de la mitad de los debidos a RA se produjeron en el primer año después del TxC. Ese cambio de tendencia parece ser coherente con la progresiva concienciación clínica respecto a los malos resultados que se dan con el RA y la elevada mortalidad de los pacientes con ReTC en el primer año en comparación con el TxC que han observado otros grupos. Para estos pacientes, los dispositivos de asistencia circulatoria durante un tiempo corto parecen un enfoque razonable para alcanzar la estabilidad hemodinámica. En nuestro análisis, se observa que tanto el RA como la VAC tienen repercusión en el pronóstico, de tal manera que el RA se asocia con un riesgo de mortalidad muy elevado. Es posible que la explicación exacta de la VAC como factor de riesgo requiera un mayor estudio, ya que podrían intervenir otros factores, como la época del trasplante, los factores relacionados con el donante, etc.
No se puede negar que una selección exhaustiva de los mejores candidatos también es esencial. Hasta el momento se han descrito varios factores que pueden relacionarse con un mayor riesgo de mala evolución en el retrasplante3,4,18,21,22,28; los más frecuentes son la edad del receptor y la necesidad de oxigenador extracorpóreo de membrana o ventilación mecánica. Para Kilic et al.28, de entre los posibles factores de riesgo, los significativos fueron la edad, la necesidad de ventilación mecánica y la enfermedad renal crónica. La presencia de estos 3 factores aumentó el riesgo de disfunción del injerto hasta un 32% a los 5 años. En nuestro análisis de sensibilidad, la exclusión de la esternotomía previa aumentó la fuerza de la asociación entre el ReTC y la mortalidad, pero el uso del tratamiento de inducción de anticuerpos mantuvo la fuerza de esa asociación en el análisis ponderado. Estos resultados parecen respaldar el concepto de que la cirugía previa podría ser, al menos en parte, el factor que confiera el peor pronóstico del ReTC. Según Miller et al.15, de entre los varios factores que podrían influir en la supervivencia después de un ReTC, la esternotomía previa fue el más factor más importante asociado con los resultados después de un retrasplante tardío.
No obstante, el papel del estado inmunológico previo al trasplante es una cuestión de interés que requerirá mayor investigación, tal como se ha comentado ya en la literatura15. Además, no hay recomendaciones específicas por lo que respecta a la pauta de inmunosupresión en el ReTC, tal como señalaron ya Johnson et al.2 en 2007. En nuestra serie, el tratamiento de inducción se ha empleado con menor frecuencia en el ReTC que en el TxC. Es necesario un tratamiento de inmunosupresión personalizado, tras establecer un equilibrio entre riesgos y beneficios en el retrasplante, puesto que los pacientes están ya inmunodeprimidos. Parece razonable reservar el tratamiento de inducción para los pacientes con alto riesgo de fallo temprano del injerto (pacientes que están más sensibilizados, dependiendo de la indicación para el ReTC, la edad del receptor, etc.) y sin efectos adversos importantes previos asociados con la inmunosupresión. Por otra parte, la exposición breve a los efectos adversos de una inmunosupresión prolongada podría explicar los mejores resultados observados en los pacientes con retrasplante en el primer año siguiente al trasplante inicial. Al establecer un equilibrio entre riesgos y beneficios de la inmunosupresión, el cáncer constituye un motivo de preocupación importante. Los pacientes con ReTC tuvieron más comorbilidades que aquellos con un TxC, incluida una mayor proporción de tumores aparecidos probablemente en relación con la exposición al tratamiento inmunosupresor.
Nuestro estudio tiene las limitaciones inherentes a todos los estudios retrospectivos observacionales. Ni con métodos multivariables fue posible eliminar por completo la posibilidad de que persistieran sesgos ocultos. Uno de los sesgos más frecuentes y sutiles que suele estar presente en este tipo de estudios es el de tiempo o de inmortalidad. Existen varios métodos, como los modelos estructurales marginales empleados en nuestro estudio, para abordar este sesgo, lo cual es mprescindible en este tipo de estudios. El pequeño tamaño muestral debido al análisis de subgrupos de población podría reducir la potencia estadística de algunos análisis. La ausencia de información fiable respecto a la presencia de alosensibilización constituye una limitación importante de nuestro estudio, ya que los pacientes retrasplantados presentan una mayor sensibilización y esta implica mayor riesgo tras el trasplante. De hecho, se observó que el tratamiento de inducción de anticuerpos confería a los pacientes retrasplantados un riesgo postrasplante similar al de los pacientes con un trasplante primario. Para introducir un ajuste respecto a la posible falta de datos, se utilizó el método de imputación múltiple. La imputación múltiple es una técnica ampliamente aceptada para abordar los datos no disponibles que se emplea habitualmente en las series de datos basadas en registros. En nuestro estudio, los resultados obtenidos en la serie de datos con imputación y los de la población con datos completos no mostraron incoherencias de interés, más allá de las atribuibles al menor tamaño muestral de esta última. Además, este es el primer estudio de la morbilidad y mortalidad en el que se analiza la situación del ReTC en España, con un número de casos muy grande, comparable al de experiencias internacionales.
CONCLUSIONESNuestros resultados confirman que el retrasplante se asocia con peor supervivencia. El RA y un intervalo entre los trasplantes de 1-5 años parecen presagiar un riesgo especialmente alto de un mal resultado. En conjunto, estos resultados podrían ser útiles para asignar adecuadamente los aloinjertos en una época de escasez de donantes.
- –
El retrasplante cardiaco supone un porcentaje bajo del total de pacientes con trasplante cardiaco.
- –
En la literatura médica pertinente se ha descrito repetidas veces que la supervivencia de los pacientes retrasplantados es escasa.
- –
Este es el primer estudio de las características y los resultados del retrasplante cardiaco en España.
- –
Aunque los pacientes sometidos a retrasplante eran de menos edad, presentaron una incidencia superior de enfermedad renal, necesidad de asistencia ventricular o ventilación mecánica y más tiempo de isquemia fría.
- –
La mortalidad fue mayor en el grupo de retrasplante, y el rechazo agudo mostró una especial asociación con un mal resultado clínico.
- –
El retrasplante 5 años después del primer trasplante tiene un pronóstico similar al del trasplante cardiaco primario.
Ninguno.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores participaron por igual en el diseño, la redacción y el desarrollo de esta investigación.
CONFLICTO DE INTERESESNinguno que declarar en relación con este artículo.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2021.06.010