La insuficiencia cardiaca (IC) afecta aproximadamente al 2% de la población adulta. Conlleva grandes mortalidad, riesgo de hospitalizaciones y costes sanitarios. A pesar de que el paciente pueda presentar momentos de cierta estabilidad clínica, la IC es una enfermedad progresiva, que cursa con descompensaciones agudas y exige un tratamiento integral. La etiopatogenia de la IC es compleja, e incluye la activación de vías deletéreas (sistema renina-angiotensina-aldosterona, sistema nervioso simpático, SGLT2) y la inhibición de vías protectoras (péptidos natriuréticos, guanilato ciclasa). Por lo tanto, solo mediante el tratamiento integral de las diferentes vías neurohormonales que se encuentran implicadas en la etiopatogenia de la IC es posible mejorar el pronóstico y reducir la carga de la enfermedad. En este contexto, las guías de práctica clínica han pasado de recomendar un tratamiento secuencial (en el que se va modificando/añadiendo el tratamiento para la IC si el paciente permanece sintomático, lo que suponía un retraso en la implementación de los tratamientos modificadores de la enfermedad) a un planteamiento más holístico, mediante el inicio precoz de todos los fármacos con beneficio clínico demostrado que son capaces de modificar el curso de la enfermedad.
Palabras clave
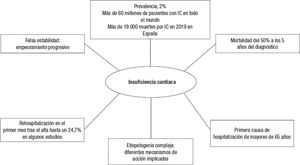
La insuficiencia cardiaca (IC) es un síndrome clínico que se caracteriza por síntomas o signos como disnea, edemas o fatiga, como consecuencia de alteraciones estructurales o funcionales del corazón, que producen un incremento de las presiones intracardiacas o un gasto cardiaco insuficiente para las necesidades del organismo1. La IC es una entidad frecuente, que afecta a más de 60 millones de personas en todo el mundo, que pueden ser atendidas en diferentes ámbitos sanitarios (consultas, hospital de día, unidad de IC, hospitalización convencional, urgencias hospitalarias, unidad de cuidados cardiológicos agudos, etc.) y por distintos especialistas (atención primaria, cardiología, medicina interna, urgencias, etc.), por lo que es muy importante reconocerla y tratarla de manera adecuada1-3. Aunque con algunas diferencias en función de la población analizada4, se calcula que aproximadamente un 2% de los mayores de 18 años sufren IC5, cifra similar a la reportada recientemente por 2 estudios en población española (figura 1)).6-7. Sin embargo, es posible que esta cifra sea mayor, ya que la IC se encuentra infradiag- nosticada en la práctica clínica8,9. Por otra parte, es muy posible que en los próximos años el número de pacientes con IC aumente de manera considerable, no solo porque la población será más anciana, sino porque también será mayor el número de hipertensos y diabéticos, conocidos factores de riesgo de IC, así como por el mejor tratamiento de los eventos cardiovasculares agudos, tanto del síndrome coronario agudo como de las descompensaciones de IC10-12.
A pesar de que los tratamientos tradicionalmente empleados para el paciente con IC y fracción de eyección reducida (IC-FEr), como los inhibidores del sistema renina-angiotensina-aldosterona (inhibidores de la enzima de conversión de la angiotensina [IECA], antagonistas del receptor de la angiotensina II [ARA-II] y antagonistas de la aldoste- rona) y los bloqueadores beta han tenido un impacto positivo en el pronóstico de estos pacientes13-15, lo cierto es que la mortalidad sigue siendo muy elevada. Así, en un metanálisis publicado en 2013, la mortalidad fue del 40% a los 2,5 años de seguimiento16. Datos más recientes muestran que la mortalidad puede alcanzar a la mitad de los pacientes tras 5 años desde el diagnóstico de IC3. En España murieron por IC más de 19.000 personas en 2019 (figura 1)17.
Asimismo, las descompensaciones agudas (empeoramiento clínico, visitas a urgencias y hospitalizaciones) son frecuentes en los sujetos con IC. De hecho, aproximadamente 1 de cada 6 pacientes con IC sufrirá una descompensación en los primeros 18 meses tras el diagnóstico, que además serán más frecuentes conforme aumente el número de descompensaciones previas, lo que indica la necesidad de evitar que estas se produzcan18. Incluso esta cifra podría ser mayor, ya que datos recientes muestran que en España, tras 1 año de seguimiento, hasta el 30% de los pacientes se hospitalizaron por IC, con un 8% de mortalidad durante el ingreso6. Y es que la IC es la causa más frecuente de ingresos de mayores de 65 años25. Además, el número de
pacientes que ingresan por IC cada vez es mayor26. Incluso para los pacientes con diabetes, la IC supone una causa de ingreso hospitalario mucho más frecuente que la cardiopatía isquémica27. Asimismo, el riesgo de reingreso y muerte a los 30 días de la hospitalización por IC es elevado, con cifras que llegan al 20 y el 56% respectivamente en algunos estudios (figura 1 )18,19,20,28. Con cada reingreso el pronóstico empeora, lo que implica la necesidad de optimizar pronto el tratamiento, sobre todo si ya ha habido un evento28,29. No es solo que la IC tenga altas morbilidad y mortalidad, sino que los costes sanitarios asociados son ingentes, de los cuales la hospitalización por IC es el factor más importante, por lo que el tratamiento adecuado de la IC no solo se va a traducir en un mejor pronóstico y un menor riesgo de descompensación, sino que también va a reducir los costes y, en consecuencia, va a suponer un ahorro para el Sistema Nacional de Salud30,31.
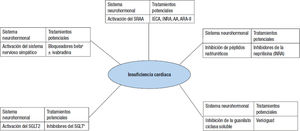
Etiopatogenia de la insuficiencia cardiacaClásicamente se había implicado de manera predominante en la génesis de la IC a la activación de los sistemas renina-angiotensina- aldosterona y el sistema nervioso simpático1,32 y, en consecuencia, estas eran las principales dianas terapéuticas en los pacientes con IC- FEr33. Sin embargo, la etiopatogenia de la IC es mucho más compleja, y además de la activación de sistemas que acaban siendo deletéreos, interviene también la inhibición de vías protectoras, como la de los péptidos natriuréticos o el sistema de la guanilato ciclasa (figura 1)21,22. Así, por ejemplo, la activación del sistema óxido nítrico-guani- lato ciclasa soluble-guanosina monofosfato cíclico (GMPc) permite mejorar la función miocárdica y vascular y reducir el remodelado car-diaco, la fibrosis y la inflamación. Sin embargo, en la IC esta vía se encuentra alterada y disfuncionante, por lo que es necesario mejorarla e incluso normalizarla22,34. Por otra parte, se ha observado que los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2) tienen un efecto positivo en el desarrollo y la evolución de la IC. Sin embargo, en este caso no se conoce bien el mecanismo por el cual serían beneficiosos, y de hecho se han implicado varios mecanismos como factores hemodinámicos, disminución de la estimulación simpática, reducción de la fibrosis y el remodelado cardiaco, modulación de las concentraciones citosólicas de sodio y calcio y mejora de las alteraciones en las adipocinas y el gasto cardiaco (figura 2.)35,36.
Sistemas neurohormonales implicados en la etiopatogenia de la insuficiencia cardiaca y tratamientos potenciales. Figura elaborada con datos de McDonagh1, Triposkiadis32, Hubers21 y la ficha técnica de vericiguat37. AA: antagonistas de la aldosterona; ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y del receptor de la angiotensina; SGLT2: cotransportador de sodio-glucosa tipo 2; SRAA: sistema renina-angiotensina-aldosterona.
a Bisoprolol, carvedilol, metoprolol succinato, nebivolol.
b Dapagliflozina, empagliflozina.
En definitiva, la etiopatogenia de la IC es muy compleja e intervienen la activación de vías deletéreas (sistema renina-angiotensina- aldosterona, sistema nervioso simpático, SGLT2) y la inhibición de vías protectoras (péptidos natriuréticos, guanilato ciclasa). Por lo tanto, para lograr un abordaje más integral y completo, se debe dar un tratamiento integral con fármacos que inhiban los primeros (IECA, ARA-II, antagonistas de la aldosterona y bloqueadores beta) y activen los segundos (inhibidores de la neprilisina y vericiguat) (figura 2). Solo desde este punto de vista más holístico se podrá conseguir un beneficio clínico más completo37-39.
Necesidad de inicio precoz de tratamientos modificadores del curso clínicoA pesar de que puede haber periodos de falsa estabilidad, lo cierto es que sin el tratamiento adecuado, la IC es una enfermedad progresiva, con un agravamiento continuo, que cursa con periodos de descompensación aguda (figura 1) 18,23,24. En consecuencia, el objetivo del tratamiento no debería ser que el paciente se mantenga en la misma clase funcional, en situación de aparente estabilidad, sino pautar desde el inicio tratamientos modificadores de la enfermedad con el fin de evitar que se produzcan remodelado y fibrosis del corazón que reduzcan la eficacia de los tratamientos potencialmente beneficiosos1,40,41. Es necesario el inicio temprano de los tratamientos modificadores del curso clínico, esto es, con demostrado beneficio en la mortalidad cardiovascular o la hospitalización por IC.
En un reciente análisis combinado de los estudios de pacientes con IC-FEr EMPHASIS-HF (eplerenona frente a placebo), PARADIGM-HF (sacubitrilo-valsartán frente a placebo) y DAPA-HF (dapagliflozina frente a placebo) (fármacos añadidos al tratamiento estándar de la IC), se compararon de manera indirecta los efectos del tratamiento convencional (IECA o ARA-II más bloqueadores beta) frente al tratamiento integral modificador de la enfermedad (sacubitrilo-valsartán, más bloqueadores beta, antagonistas de la aldosterona e inhibidor del SGLT2). En comparación con el tratamiento convencional, el tratamiento integral modificador de la enfermedad se asoció con reducciones significativas de la variable combinada de muerte cardiovascular u hospitalización por IC, del 62% (hazard ratio [HR] = 0,38; intervalo de confianza del 95% [IC95%], 0,30–0,47), el 50% de las muertes cardiovasculares (HR = 0,50; IC95%, 0,37–0,67), el 68% de las hospitalizaciones por IC (HR = 0,32; IC95%, 0,24–0,43) y el 47% de las muertes por cualquier causa (HR = 0,53; IC95%, 0,40–0,70). Esto supone un beneficio aproximado de 8,3 y 2,7 años adicionales en sujetos de 55 y 80 años, respectivamente, con respecto a la variable combinada hospitalización por IC o muerte cardiovascular, y de 6,3 y 1,4 años en cuanto a la supervivencia42.
Por lo tanto, no se trata solo de prescribir los fármacos que se han demostrado más beneficiosos para el tratamiento de la IC, sino también de hacerlo lo antes posible para disminuir la progresión de la enfermedad y favorecer el remodelado inverso, ya que cuanto más avanzada esté la enfermedad, menos beneficios se van a obtener de los fármacos38. Así por ejemplo, en el estudio PARADIGM-HF el beneficio del sacubitrilo-valsartán fue mayor en los pacientes en clase funcional de la New York Heart Association (NYHA) I-II que en los pacientes en NYHA III-IV con respecto a la variable primaria del estudio (pinteracción = 0,03)43. Lo mismo se objetivó en el estudio DAPA-HF con dapagliflozina (NYHA II frente a III-IV)44.
Esto ha hecho que las guías de práctica clínica hayan cambiado de paradigma. En la guía de la Sociedad Europea de Cardiología (ESC) 2016 sobre el diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica se recomendaba un abordaje terapéutico secuencial de los pacientes con IC-FEr, se iba añadiendo/modificando la medicación en función de la persistencia de los síntomas. Así, en el primer escalón se situaría el tratamiento con IECA o ARA-II junto con los bloqueadores beta. Si tras ajustar a las dosis máximas toleradas el paciente permanecía con síntomas, se añadiría un antagonista de la aldosterona, y si con esto no era suficiente, se podían plantear 3 alternativas, que podían ser complementarias, cambiar de IECA/ARA-II a sacubitrilo-valsartán, añadir ivabradina o terapia de resincronización cardiaca45. Este planteamiento no solo supone un retraso evidente en la implementación de tratamientos modificadores de la enfermedad, sino que facilita la inercia terapéutica46,47.
¿Qué dice la última guía de práctica clínica de insuficiencia cardiaca?Con el doble objetivo de que el paciente se beneficie lo antes posible de los tratamientos de los que se ha demostrado que modifican el curso de la enfermedad (disminución del riesgo de hospitalización por IC o mortalidad cardiovascular), las guías de práctica clínica internacionales han cambiado este planteamiento secuencial para transformarlo en un abordaje horizontal más integral (figura 3).)1,48,49.
Recomendaciones de diferentes guías de práctica clínica sobre los tratamientos modificadores de la enfermedad para pacientes sintomáticos con insuficiencia cardiaca y fracción de eyección reducida. Figura elaborada con datos de McDonagh1, Maddox48 y McDonald49. AA: antagonistas de la aldosterona; ACC: American College of Cardiology; ARA-II: antagonistas del receptor de la angiotensina II; BB: bloqueadores beta; ESC: Sociedad Europea de Cardiología; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y del receptor de la angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2.
En la tabla 1). se resumen los ensayos clínicos más importantes en los que se basan las recomendaciones de la guía ESC 2021 de IC43,44,50-60. En cuanto al algoritmo terapéutico, como tratamiento de primera línea se encontrarían los IECA/sacubitrilo-valsartán, los bloqueadores beta (bisoprolol, carvedilol, metoprolol succinato, nebivolol), los antagonistas de la aldosterona y los inhibidores del SGLT2 (dapagliflo- zina o empagliflozina) y como tratamientos de segunda línea, los ARA-II (en caso de que no se pueda emplear los IECA o el sacubitrilo- valsartán) ivabradina y vericiguat1. Salvo contraindicación o intolerancia, todo paciente con IC-FEr debería tomar los fármacos de primera línea (en las dosis máximas toleradas). Cabe destacar que en esta guía los IECA están indicados para disminuir el riesgo de hospitalización IC y muerte, al igual que el sacubitrilo-valsartán en lugar de los IECA, con el mismo nivel de recomendación. También se recomienda como tratamiento de segunda línea el vericiguat si el paciente continúa sintomático, con empeoramiento de IC a pesar del tratamiento médico de primera línea, para reducir el riesgo de hospitalización por IC o muerte cardiovascular (figura 3)1.
Principales ensayos clínicos sobre fármacos para el tratamiento de la insuficiencia cardiaca con fracción de eyección reducida y recomendaciones de la guía europea de 2021
| Estudio | Grupos comparadores (seguimiento) | Criterios de inclusión | Resultados | Recomendaciones ESC 2021 | |
|---|---|---|---|---|---|
| IECA | Para disminuir el riesgo de hospitalización por IC y muerte (I A) | Tratamiento de primera línea | |||
| SOLVD-Treatment | Enalapril frente a placebo (3,5 años) | FEVI ≤ 35%, NYHA I-IV (el 90% en II-III) | El enalapril redujo en un 16% (p = 0,004) la mortalidad por cualquier causa y un 26% (p < 0,0001) el riesgo de muerte u hospitalización por IC | ||
| ATLAS | Dosis alta lisinopril frente a dosis baja (3,8 años) | FEVI ≤ 30%, NYHA II-IV | Las dosis altas se asociaron con una reducción del 15% (p < 0,0001) en el riesgo de muerte u hospitalización por IC | ||
| Bloqueadores beta | Para disminuir el riesgo de hospitalización por IC y muerte (I A) | ||||
| COPERNICUS | Carvedilol frente a placebo (0,9 años) | FEVI < 25%, NYHA IV | El carvedilol redujo la mortalidad un 35% (p < 0,001) y el riesgo de muerte y cualquier hospitalización un 24% (p < 0,001) | ||
| CIBIS-II | Bisoprolol frente a placebo (1,3 años) | FEVI ≤ 35%, NYHA III-IV | El bisoprolol redujo la mortalidad un 34% (p < 0,001) y el riesgo de muerte cardiovascular u hospitalización cardiovascular un 21% (p < 0,001) | ||
| SENIORS | Nebivolol frente a placebo (1,8 años) | Edad ≥ 70 años, hospitalización por IC en el último año o FEVI ≤ 35% en los últimos 6 meses | El nebivolol redujo un 14% (p = 0,04) el riesgo de muerte u hospitalización cardiovascular | ||
| Antagonistas de la aldosterona | Para disminuir el riesgo de hospitalización por IC y muerte (I A) | ||||
| RALES | Espironolactona frente a placebo (2,0 años) | FEVI ≤ 35%, NYHA III-IV e IC > 6 semanas | La espironolactona redujo en un 30% (p < 0,001) el riesgo de muerte y un 35% (p < 0,001) las hospitalizaciones de causa cardiaca | ||
| EMPHASIS-HF | Eplerenona frente a placebo (1,8 años) | NYHA II, FEVI < 30% o FEVI 30-35% con QRS > 130 ms, hospitalización cardiovascular en los últimos 6 meses o péptidos natriuréticos elevados | La eplerenona redujo un 37% (p < 0,001) el riesgo de muerte cardiovascular u hospitalización por IC, un 24% (p = 0,008) el riesgo de muerte, un 24% (p = 0,01) el riesgo de muerte cardiovascular y un 42% (p < 0,001) el riesgo de hospitalizaciones por IC | ||
| INRA | Para disminuir el riesgo de hospitalización IC y muerte, en lugar IECA (IB) | ||||
| PARADIGM-HF | Sacubitrilo-valsartán frente a enalapril (2,3 años) | NYHA II-IV, FEVI ≤ 40% (enmienda a ≤ 35%), péptidos natriuréticos elevados | El sacubitrilo-valsartán redujo un 20% (p < 0,001) el riesgo de muerte cardiovascular o primera hospitalización por IC, un 16% (p < 0,001) el riesgo de muerte, un 20% (p < 0,001) la mortalidad cardiovascular y un 21% (p < 0,001) las hospitalizaciones por IC | ||
| Inhibidores del SGLT2 | Para disminuir el riesgo de hospitalización por IC y muerte (I A) | ||||
| DAPA-HF | Dapagliflozina frente a placebo (1,5 años) | FEVI ≤ 40%, NYHA II-IV | La dapagliflozina redujo un 26% el riesgo de muerte cardiovascular o empeoramiento de la IC (p < 0,001) y un 18% el riesgo de muerte cardiovascular | ||
| EMPEROR- REDUCED | Empagliflozina frente a placebo (1,3 años) | FEVI ≤ 40%, NYHA II-IV | La empagliflozina redujo un 25% (p < 0,001) el riesgo de muerte cardiovascular o empeoramiento de la IC y un 30% el número de hospitalizaciones por IC | ||
| Inhibidor de los canales If | Si el paciente con FEVI ≤ 35%, en ritmo sinusal y con FC ≥ 70 lpm continúa sintomático a pesar del tratamiento médico óptimo añadido a bloqueadores beta (IIa B) o si no se puede prescribir bloqueadores beta (IIa C), para reducir el riesgo de hospitalización por IC o muerte cardiovascular | Tratamiento de segunda línea | |||
| SHIFT | Ivabradina frente a placebo (1,9 años) | FEVI ≤ 35%, NYHA II-IV, hospitalización por IC en los últimos 12 meses, ritmo sinusal, FC ≥ 70 lpm | La ivabradina redujo un 18% el riesgo de muerte cardiovascular u hospitalización por IC (p < 0,001) y un 26% (p < 0,001) el riesgo de hospitalización por IC | ||
| ARA-II | Para pacientes que no puedan tomar IECA o INRA, para reducir el riesgo de hospitalización por IC o muerte cardiovascular (I B) | ||||
| CHARM-Alternative | Candesartán frente a placebo (2,8 años) | FEVI ≤ 40%, NYHA II-IV, intolerancia a los IECA | El candesartán redujo el riesgo de muerte cardiovascular u hospitalización por IC un 23% (p < 0,001) | ||
| Estimulador de la guanilato ciclasa soluble | Paciente que continúa sintomático, con empeoramiento de la IC a pesar del tratamiento médico óptimo, para reducir el riesgo de hospitalización por IC o muerte cardiovascular (IIb B) | ||||
| VICTORIA | Vericiguat frente a placebo (0,9 años) | FEVI ≤ 45%, NYHA II-IV, hospitalización reciente por IC | El vericiguat redujo el riesgo de muerte cardiovascular u hospitalización por IC un 10% (p = 0,02) | ||
Tabla elaborada con datos de McMurray43,44, Yusuf50, Packer51,52, CIBIS-II Investigators and Committees53, Flather54, Pitt55, Zannad56, Packer57, Swedberg58, Granger59 y Armstrong60. ARA-II: antagonistas del receptor de la angiotensina II; ESC: Sociedad Europea de Cardiología; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; NYHA: clase funcional de la New York Heart Association; SGLT2: cotransportador de sodio-glucosa tipo 2.
En cuanto a la actualización de 2021 de las recomendaciones del American College of Cardiology, de primera línea son los IECA, los ARA-II y el sacubitrilo-valsartán, preferiblemente estos últimos, junto con los bloqueadores beta. De segunda línea serían, dependiendo de las características clínicas de los pacientes, los antagonistas de la aldosterona, los inhibidores del SGLT2 o la ivabradina (figura 3)%48. Por lo tanto, en este caso, aunque existen ciertas modificaciones respecto a las guías anteriores, se recomienda la optimización del tratamiento con los fármacos modificadores de la enfermedad en 2 pasos, a diferencia de las guías europea o canadiense, lo que supondría cierto retraso en el abordaje terapéutico de estos pacientes. En el caso del vericiguat, aunque se resume el resultado principal del estudio VICTORIA (reducción significativa de la variable combinada de mortalidad cardiovascular o primera hospitalización por IC)%60 y se lo considera un tratamiento emergente, no está incluido en el algoritmo general de tratamiento, posiblemente porque ambas publicaciones se encuentran muy próximas en el tiempo%48.
La guía canadiense de 2021 muestra un planteamiento transversal de inicio, comenzando directamente con los fármacos modificadores de la enfermedad: sacubitrilo-valsartán (o IECA/ARA-II), bloqueado- res beta, antagonistas de la aldosterona e inhibidores del SGLT2. De segunda línea serían la ivabradina y el vericiguat (figura 3)%49. Por lo tanto, estas guías son bastante parecidas a lo que recomienda la guía europea de IC%1.
ConclusionesEn los últimos tiempos se ha observado un cambio significativo en el abordaje del paciente con IC-FEr. Esto se debe, por un lado, a un mayor conocimiento de la etiopatogenia de la IC como una entidad progresiva en la que intervienen numerosos sistemas neurohormonales (activación de sistemas deletéreos e inhibición de vías protectoras); por otro, los resultados de recientes ensayos clínicos que demuestran la necesidad de tratar precozmente con fármacos modificadores de la enfermedad con el objetivo de obtener el máximo beneficio desde el principio. Por lo tanto, es necesario cambiar el plantea-miento hacia un tratamiento holístico de la IC-FEr para disminuir la carga de enfermedad.
Contribución de los autoresTodos los autores han contribuido significativamente al trabajo presentado en este artículo, contribuyendo en la concepción, diseño o adquisición de información, o en el análisis e interpretación de datos. Todos los autores han participado en la redacción y revisión del manuscrito y aceptan su publicación.
Conflictos de interesesJ.L. Zamorano ha recibido honorarios por ponencias de Bayer y Daiichi- Sankyo. Luis Manzano ha recibido compensaciones por asesoría y ponencias de Novartis, Bayer, AstraZeneca y Pfizer. J. Comín- Colet ha recibido honorarios como ponente de Bayer, sin relación con el presente artículo. M. Anguita Sánchez ha recibido compensaciones por asesoría y ponencias de Bayer, Daiichi- Sankyo y Pfizer. J.R. Gonzá- lez-Juanatey ha recibido compensaciones por asesoría y ponencias de Amgen, AstraZeneca, Bayer, Boehringer-Ingelheim, MSD, Daichii- Sankyo, Ferrer International, Novartis, Lilly, Sanofi y Servier.
AgradecimientosContent Ed Net (Madrid) proporcionó asistencia editorial en la redacción de este manuscrito con financiación de Bayer Hispania.