Introducción
Tector ha descrito la técnica de revascularización arterial completa usando múltiples anastomosis con ambas arterias mamarias internas. Para reducir la morbimortalidad quirúrgica nos hemos propuesto realizar esta técnica sin circulación extracorpórea.
Pacientes y Métodos
Desde abril de 1998 hemos realizado revascularización «tipo Tector» sin circulación extracorpórea en 92 pacientes, 74 varones (80%) y 18 mujeres (20%), con una edad media de 64,9 ± 8,1 años (rango, 42-78). La angiografía preoperativa puso de manifiesto que diecinueve (20,5%) pacientes tenían lesión significativa de tronco común y 58 (63%) triple vaso. Cuarenta pacientes (43,5%) presentaban angina inestable, 24 (26%) enfermedad vascular periférica significativa y 26 (28%) diabetes. Ambas mamarias fueron disecadas sin pedículo, y anastomosadas como injerto en «Y» o «T». La permeabilidad de las anastomosis se evaluó con Doppler intraoperatorio en 24 (26%) pacientes mediante estudio angiográfico.
Resultados
Se han realizado 274 anastomosis distales, 122 (45%) en la cara lateral y/o inferior del corazón y 69 (25%) de tipo secuencial, con una media de 2,98 bypass por paciente. En el 59,8% de los pacientes se realizó bypass triple, en el 22% bypass doble, en el 17% bypass cuádruple, y en un paciente bypass quíntuple. El 64,9% de los pacientes fue extubado en las primeras 6 h. Sólo un paciente (1,1%) precisó balón intraaórtico, y 3 (3,2%) inotrópicos durante el período postoperatorio. La mortalidad hospitalaria fue de 3 (3,2%) pacientes. Un paciente (1,1%) fue reoperado por sangrado, y el 78,3% no se transfundieron. Tres pacientes (3,2%) sufrieron mediastinitis. No se presentaron eventos neurológicos. Tras 7,77 ± 2,8 meses de seguimiento, todos los pacientes se encuentran asintomáticos y la tasa de permeabilidad global es del 94%.
Conclusión
Esta técnica posibilita una revascularización arterial completa y una reducción en la morbimortalidad quirúrgica.
Palabras clave
Cirugía
Revascularización
INTRODUCCIÓN
La estrategia de usar la arteria mamaria interna izquierda (AMII) como injerto a la arteria descendente anterior (DA) se ha convertido, desde los años ochenta, en la parte básica de la cirugía coronaria. El bypass de AMII-DA tiene unas altas tasas de permeabilidad a largo plazo y es muy infrecuente que desarrolle arterioesclerosis. Numerosos estudios clínicos han demostrado que estos pacientes presentan una mayor supervivencia a largo plazo, menor número de eventos cardíacos y menor necesidad de nuevos procedimientos de revascularización 1-3.
Si bien la lógica parece dictar que el incremento de injertos arteriales, mediante el uso de la arteria mamaria interna derecha (AMID), debería mejorar los resultados a largo plazo, este aspecto es motivo de controversia en la literatura médica. Aunque algunos grupos no han encontrado que el uso bilateral de la arteria mamaria interna (AMI) produzca beneficio adicional, en términos de supervivencia, respecto a los pacientes con AMII-DA 4,5, en los últimos tres años, diversas publicaciones, entre ellas algunas de centros con gran experiencia en cirugía coronaria, como la Cleveland Clinic o la Clínica Mayo, han comunicado beneficios en cuanto a la supervivencia, ausencia de nueva revascularización y disminución de eventos cardíacos, mediante el uso de ambas AMI 3,6-12.
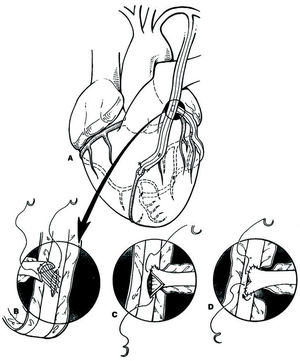
El uso expansivo de ambas AMI, en el intento de lograr la mayor revascularización arterial posible, ha llevado a múltiples posibilidades técnicas. Mills et al y Sauvage et al 13 introdujeron el uso de la AMID, como injerto libre, anastomosado a la AMII en «T». Esta técnica ha sido popularizada por Alfred Tector 14,15, a principios de los noventa, para conseguir una revascularización arterial completa (fig. 1).
Fig. 1. A: Injerto en «T», descrito por Tector, mediante anastomosis de la arteria mamaria interna derecha (AMID) libre en la cara posterior de la arteria mamaria interna izquierda (AMII) in situ, a nivel de la orejuela izquierda. La AMII se encuentra anastomosada de forma secuencial a la arteria diagonal y la descendente anterior (DA). La AMID es el injerto para el ramo mediano, obtusa marginal y arteria descendente posterior. B-D: técnica de anastomosis perpendicular latero-terminal para construir el injerto en «T»14,15.
La revascularización miocárdica sin circulación extracorpórea (CEC) es una estrategia quirúrgica que ha sido usada desde el comienzo de la cirugía coronaria. El interés por eliminar la morbimortalidad derivada de la CEC ha puesto de actualidad estas técnicas. A pesar de sus buenos resultados en amplias series de pacientes 16-25, su indicación es motivo de controversia, tanto por sus dificultades técnicas, máxime si queremos mantener una revascularización arterial de las caras lateral y posterior del corazón, como por la incertidumbre en los resultados angiográficos. El desarrollo tecnológico, con la introducción de los «estabilizadores epicárdicos», que nos permiten la exposición e inmovilización regional de la arteria coronaria diana, ha posibilitado la realización de meticulosas suturas arteriales.
Nuestro objetivo ha sido reducir la agresión quirúrgica, mediante la eliminación de la CEC y el clampaje aórtico, manteniendo la revascularización arterial completa con ambas AMI, siguiendo la técnica de Tector, para no disminuir la calidad de la revascularización. La evolución de nuestra técnica y los resultados clínicos y angiográficos iniciales son el objeto del presente estudio. PACIENTES Y MÉTODOS
Pacientes
Desde la introducción en nuestro servicio de los dispositivos de estabilización epicárdica para la cirugía coronaria sin CEC en enero de 1997, se han intervenido 683 pacientes de revascularización coronaria aislada, de los cuales 198 (29%) fueron sin CEC. La introducción de esta técnica ha sido progresiva, representando para el año 1998 el 36,6% del total de la cirugía coronaria y en los primeros siete meses de 1999 el 50%.
En abril de 1998 se comenzó la revascularización arterial completa, sin CEC, con doble arteria mamaria interna, como injertos en «Y» o «T», habiéndose intervenido con esta técnica 92 pacientes, lo que supone el 52% de la cirugía sin CEC y el 25% del total de revascularización coronaria aislada realizada en ese período de tiempo.
Tras la indicación quirúrgica y la asignación del paciente a un cirujano, quedó a su criterio personal la realización de la cirugía con o sin CEC. Tras la visualización de la angiografía y la exploración intraoperatoria se han considerado buenas condiciones para la cirugía coronaria sin CEC:
1. Arteria coronaria epicárdica, no calcificada y de un calibre interno superior a 1,2 mm.
2. Estabilidad eléctrica y hemodinámica que permitan la manipulación del corazón
3. Arterias obtusas marginales largas y de buen calibre en su porción media, lugar donde generalmente se realiza la anastomosis.
4. Una fracción de eyección deprimida no se ha considerado por sí solo criterio de exclusión, pero debe tenerse en cuenta que en los corazones muy dilatados es difícil exponer la cara lateral.
En los pacientes en los que se presuponía una importante morbilidad a consecuencia de la CEC, como aquellos mayores de 75 años, con síndrome metadiabético, arteriopatías periféricas severas, discrasias sanguíneas etc., se indicó cirugía coronaria sin CEC, aun en ausencia de condiciones anatómicas óptimas.
Las características preoperatorias del grupo de pacientes en estudio, con una edad media de 64,9 ± 8,1 años (rangos, 42-78) aparecen resumidas en la tabla 1; así mismo, su riesgo quirúrgico preoperatorio, calculado según la escala de Parsonnet (1995), era del 4,5 ± 3,02%.
Técnica quirúrgica
La monitorización del paciente realizada correspondió a la convencional en cirugía coronaria. Si bien en las primeras fases la técnica anestésica era convencional, posteriormente se ha evolucionado hacia técnicas que facilitan la extubación precoz, incluso intraoperatoria, de los pacientes, como son la combinación de fentanilo y propofol y, más recientemente, catéter epidural torácico y remifentanilo. No se realizó de forma rutinaria la infusión intravenosa de fármacos vasodilatadores ni betabloqueantes.
Ambas AMI eran disecadas sin pedículo (skeletonization technique) mediante lupas de magnificación (×3,5 a ×5,5) con el objeto de preservar la vascularización del esternón, mejorar su calibre y longitud y facilitar la construcción del injerto en «T» y las anastomosis secuenciales 26-32. Realizamos la heparinización, inicialmente con 1,5 mg/kg de peso, necesaria para alcanzar un tiempo de coagulación activado (TCA) superior a 300 s, manteniéndose esta cifra durante todo el período en el que se realizaron oclusiones arteriales. Ambas AMI fueron irrigadas con suero salino caliente y solución salina de papaverina 1:30, no realizándose de forma rutinaria manipulación farmacológica intraarterial. Se exploran las arterias coronarias diana y se confirmó la estrategia quirúrgica.
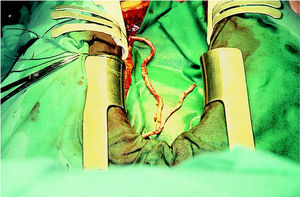
Tras seccionar con clips metálicos la porción proximal de la AMID, se realizó la construcción del injerto en «T» (anastomosis término-lateral perpendicular) o en «Y» (anastomosis término-lateral en paralelo), según el plan quirúrgico, suturando la AMID sobre la AMII a la altura de la orejuela izquierda, tras pasar esta última por una incisión lateral del pericardio. La anastomosis término-lateral, de unos 8 mm de longitud, se realizó con sutura continua de monofilamento de 8-0 y se comprobó la pulsatilidad o flujo de ambos brazos del injerto (fig. 2). En casos seleccionados fue necesario construir un segundo injerto en «Y», con un segmento de AMII o AMID de 2-4 cm de longitud, sobre una porción más distal de la AMII, para la revascularización de ramos diagonales que discurren casi perpendiculares a la DA.
Fig. 2. Imagen intraoperatoria de un injerto en «T» con ambas arterias mamarias internas esqueletizadas.
Siempre realizamos en primer lugar la revascularización de la cara anterior del corazón, comenzando, si era preciso, por las arterias diagonales y a continuación la arteria descendente anterior. Posteriormente, se realizaron las anastomosis de la cara lateral, poste-rolateral e inferior, por este orden. En la mayoría de los pacientes se realizó la revascularización de la DA con la AMII, pero en algunos pacientes, en los que se precisó mayor longitud o mejor calidad del injerto a este territorio, se prefirió usar la AMID.
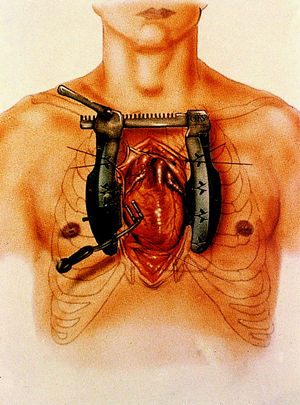
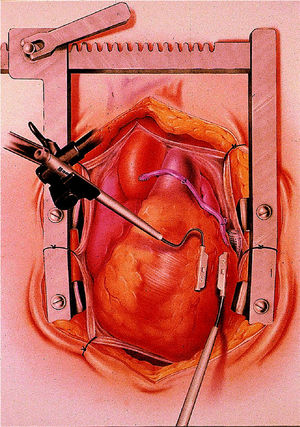
En los primeros casos, la estrategia de exposición de las arterias coronarias fue la descrita por Calafiore et al 22, basada en el uso de cuatro cintas de algodón, dos que se pasan por el seno transverso y otras dos por debajo de la vena cava inferior para la elevación del corazón, y del dispositivo de inmovilización regional CTS-MV (CardioThoracic System, Cupertino, CA). Posteriormente modificamos la técnica de elevación y rotación del corazón para acceder a la cara lateral, posterolateral e inferior del mismo, adoptando la técnica descrita por Lima 33,34. Se basa en la colocación de 3 o 4 puntos de seda para elevar el lado izquierdo del pericardio, el primero por encima de la vena pulmonar superior izquierda, el segundo próximo a la vena pulmonar inferior izquierda, el tercero entre esta vena y la vena cava inferior y el cuarto en la vecindad de la vena cava inferior. Con la tracción alternativa o simultánea de estos puntos se consigue elevar y rotar hacia la derecha la base del corazón y colocar el ápex fuera del tórax. Esta posición genera una dificultad al llenado del ventrículo derecho que es compensada con un Trendelenburg de 20º, con lo que se consigue una adecuada estabilidad hemodinámica 35,36. A lo largo de esta experiencia se han utilizado diversos inmovilizadores, que han aparecido en el mercado con mejoras tecnológicas, utilizándose en la actualidad el CTS Ultima (CardioThoracic System, Cupertino, CA) representado en la figura 3, y el Octopus-2 (Medtronic Inc, Minneapolis, Minn). En la figura 4 se aprecia el mecanismo de inmovilización, por succión, de la generación de inmovilizadores Octopus.
Fig. 3. Separador-Inmovilizador CTS Access Ultima System para cirugía coronaria sin circulación extracorpórea por estenotomía media.
Fig. 4. Inmovilizador Octopus 1 situado en el territorio de la arteria descendente anterior.
Una vez conseguida una adecuada exposición e inmovilización de la arteria coronaria diana con una buena hemodinámica, se procedió a la oclusión de la arteria coronaria mediante un torniquete de monofilamento de 4-0 apoyado en un trozo de silicona para no dañar la arteria. Sólo excepcionalmente se realizó oclusión distal de las arterias coronarias y no se emplean oclusores o shunts intravasculares.
Todas las anastomosis se realizaron con una sutura continua de monofilamento de 8-0 (Surgipro, Autosuture, EE.UU.), lupas de magnificación (×3,5 a ×5,5), y eliminando la sangre de la arteriotomía mediante un «soplador» de aire húmedo (Clear View Blower/Mister, Medtronic DLP, Grand Rapids, MI). Según la posición de las arterias coronarias y la longitud del injerto (AMI) hemos usado tanto anastomosis látero-laterales (secuenciales) en paralelo o perpendiculares (diamante), como término-laterales igualmente en paralelo o perpendiculares. En general, preferimos las anastomosis en paralelo, pues con las anastomosis en «diamante», sobre todo si las AMI son finas, se pueden generar distorsiones en la anastomosis que comprometan el flujo distal.
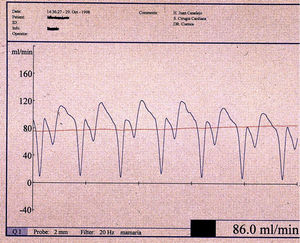
Al finalizar cada anastomosis se realiza una evaluación cuantitativa y cualitativa mediante un medidor de flujo (Transonic System, Ithaca NY). La presencia, cerca de la anastomosis, de una onda diastólica dominante se ha correlacionado angiográficamente con una anastomosis permeable y no restrictiva 37-39 (fig. 5).
Fig. 5. Registro de flujo (Transonic HT 311) en el tronco común de un injerto en «T» con doble arteria mamaria interna a descendente anterior, obtusa marginal y descendente posterior. Se observa la predominante onda diastólica, dato de permeabilidad de una anastomosis, y el flujo medio de la arteria.
En general, la heparinización fue revertida parcialmente con 50 mg de protamina al finalizar la intervención. Tan sólo en los pacientes con malos lechos distales o aquellos que habían presentado cambios electrocardiográficos durante la intervención ésta no se neutralizó. En los últimos pacientes, y tras la publicación de Mariani et al 40, en la que se demuestra la existencia de una actividad procoagulante en la cirugía coronaria sin CEC, similar a la existente en otras cirugías mayores, hemos pasado a no neutralizar la heparina (considerando que el paciente tenga un tiempo de coagulación activado [TCA] de 200 s a la salida de quirófano) y administrar heparina cálcica subcutánea y antiagregantes, a la llegada del paciente a la unidad de postoperatorio y posteriormente cada 24 h.
Curso postoperatorio
Si el paciente se encontraba hemodinámicamente estable y sin cambios electrocardiográficos, se realizó extubación, movilización precoz y retirada de líneas y drenajes, pasando a planta en la mañana del primer día postoperatorio.
Sólo se ha usado diltiazem oral o intravenoso en pacientes hipertensos, o que al menos mantuvieran una presión arterial media superior a 70 mmHg.
Seguimiento clínico y angiográfico
El seguimiento clínico se realizó en consultas externas al mes, 6 meses y al año de la intervención.
Se solicitó autorización para control angiográfico a todos los pacientes asintomáticos tras 6 meses de la intervención o a los pacientes que presentaran síntomas, tanto angina de pecho típica o atípica como disnea, en cualquier período del seguimiento. Se desestimó la realización de la angiografía de control durante el ingreso hospitalario por haberse descrito en la bibliografía defectos angiográficos precoces reversibles, tanto en los conductos como en la anastomosis 22, y debido a que los resultados a 6 meses aportan mejor información respecto a la incidencia de oclusión precoz de los injertos. Aquellos pacientes asintomáticos portadores de prótesis aortobifemoral, en los que fue necesario realizar el cateterismo diagnóstico por vía braquial, fueron desestimados para angiografía de control, realizándose prueba de esfuerzo.
Análisis estadístico
Todos los datos se expresan como medias ± desviación estándar. RESULTADOS
Detalles técnicos
Se han realizado un total de 274 anastomosis distales, lo que supone una media de 2,98 ± 0,66 anastomosis/paciente (rango, 2-5). En 7 pacientes (7,6%), sobre todo al principio de la experiencia y en pacientes con corazones dilatados, no se pudo conseguir la revascularización arterial completa con ambas AMI, siendo necesario, para alcanzar la arteria descendente posterior, prolongar la AMID con 4-5 cm de vena safena en 5 pacientes (5,4%), y en 2 (2,2%) utilizar la arteria gastroepiploica. En ningún caso se realizó manipulación de la aorta ascendente.
Veinte pacientes (21,7%) recibieron dos anastomosis, 55 (59,8%) tres, 16 (17,4%) cuádruple bypass, y en sólo 1 paciente (1,1) se realizaron cinco anastomosis.
En 2 pacientes (2,2%) se realizó cirugía carotídea combinada.
La localización de las anastomosis distales y su distribución por injertos se encuentran resumidas en la tabla 2.
Mortalidad precoz
La mortalidad hospitalaria ha sido de 3 pacientes (3,2%). Dos pacientes varones fallecieron a consecuencia de sepsis y fracaso multiorgánico tras mediastinitis, uno de ellos diabético insulinodependiente y el otro de 76 años de edad con arteriopatía periférica severa y EPOC en tratamiento con corticoides orales. La tercera paciente falleció a la hora de su llegada a la unidad de postoperatorio por fibrilación ventricular refractaria a medidas de reanimación, sin haber presentado problemas hemodinámicos ni electrocardiográficos durante la intervención y con buenos registros de flujos en las anastomosis.
Evolución postoperatoria
Tan sólo 3 pacientes (3,2%) precisaron soporte inotrópico con catecolaminas y uno (1,1%) balón de contrapulsación. Siete pacientes (7,6%) fueron extubados en quirófano. El tiempo medio de intubación postoperatoria fue de 7,7 ± 7,8 horas, siendo extubado el 64,9% de los pacientes en las primeras 6 h. En 4 pacientes (4,3%) se diagnosticó necrosis perioperatoria por presentar cambios electrocardiográficos o enzimáticos. El sangrado medio en las primeras 24 h ha sido de 762,3 ± 354,7 ml y el porcentaje de pacientes transfundidos del 21,7%. Ningún paciente presentó accidente cerebrovascular agudo (ACVA) y en 11 casos (11,9%) se observó un empeoramiento de la función renal respecto a la preoperatoria que no precisó medidas especiales. Tres pacientes (3,2%) presentaron mediastinitis, que precisó reintervención, dos de los cuales, como se ha descrito con anterioridad, fallecieron posteriormente por fracaso multiorgánico. La estancia media en la unidad de postoperatorio fue de 1,8 ± 1,4 días, con 43 pacientes (46,7%) con una estancia inferior a 24 h. La estancia postoperatoria media fue de 6,7 ± 4,1 días, con 33 pacientes (35,9%) dados de alta antes de los 5 días.
Otros datos de morbilidad postoperatoria se resumen en la tabla 3.
Resultados clínicos
El período de seguimiento clínico fue de 1 a 16 meses, con una media de 7,77 ± 2,8 meses. Un paciente (1,1%) falleció por causa no relacionada (traumatismo), no produciéndose otras muertes tardías ni pérdidas para el seguimiento.
Ningún paciente presentó eventos cardiológicos ni fue preciso realizar nuevos procedimientos de revascularización.
Un paciente (1,1%) presentó a los 6 meses dolores torácicos atípicos, y al ser portador de un bypass axilobifemoral, se indicó prueba de esfuerzo en vez de control angiográfico, resultando una prueba máxima negativa clínica y electrocardiográfica. El resto de los pacientes se encontraron asintomáticos.
Angiografía postoperatoria
De forma consecutiva, a todos los pacientes se les planteó el control angiográfico tras 6 meses de seguimiento. En el momento actual, 24 pacientes (26%) han aceptado el control postoperatorio, con un intervalo medio respecto a la intervención de 6,7 ± 2,6 meses. Se han evaluado las 24 anastomosis entre ambas AMI y 72 anastomosis distales, 19 (26%) de ellas secuenciales, y se han clasificado las tasas de permeabilidad según la clasificación de Fitzgibbon 41.
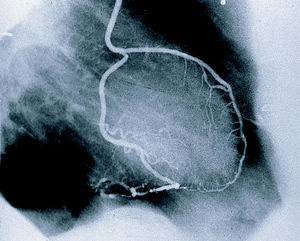
Las 24 anastomosis (100%) en «Y» o «T» entre ambas AMI estaban permeables y sin lesiones (grado A). Dos pacientes portadores de doble injerto en «Y» presentan todas las anastomosis permeables. La tasa total de permeabilidad (grado A + B) es del 94,4%, siendo del 100% para las 34 anastomosis de la cara anterior (DA y diagonal), 8 (23,5%) de ellas secuenciales, y del 89,5% para las caras lateral e inferior, con 11 (28%) anastomosis secuenciales (fig. 6).
Fig. 6. Imagen angiográfica de un paciente con revascularización arterial completa con un injerto en «T» de ambas arterias mamarias internas. La arteria mamaria interna izquierda revasculariza de forma secuencial las arterias diagonal-descendente anterior y la arteria mamaria interna derecha y la obtusa marginal-descendente anterior.
Los resultados clasificados por la localización de las anastomosis distales se encuentran en la tabla 4.
DISCUSIÓN
Este trabajo aporta la serie más amplia publicada de revascularización miocárdica arterial sólo con doble AMI, dispuestas como injerto en «Y» o «T», sin uso de CEC. Entre las series más recientes publicadas de revascularización arterial sin CEC encontramos la de Calafiore et al 22, con uso de múltiples injertos arteriales además de la AMI, un uso de injertos en «Y» del 18% y de anastomosis secuenciales del 4%. Cartier et al 23 han publicado una serie de 140 pacientes con uso en la mayoría de los pacientes de una sola AMI; el 93% de los pacientes recibieron vena safena, el 8% arteria radial, y tan sólo en 3 pacientes se realizaron anastomosis secuenciales. En la serie de Jansen et al 21, de 42 pacientes hay un uso amplio de la doble AMI pero in situ, con 1 solo paciente con injerto en «Y», completándose la revascularización de la cara inferior del corazón con arteria gastroepiploica.
Por otro lado, las series amplias publicadas de revascularización arterial completa con doble AMI en injerto compuesto, principalmente por Tector, han sido realizadas con CEC 13-15,32.
Por tanto, confluyen en nuestra serie dos cuestiones de relevancia clínica, en cuanto a que debemos considerar si aportamos algún beneficio a nuestros pacientes, tanto con una revascularización arterial completa como con la eliminación de la circulación extracorpórea y el clampaje aórtico.
En cuanto a la repercusión de la revascularización arterial completa, debemos considerar que se han realizado muy pocos estudios prospectivos aleatorizados sobre diferentes estrategias quirúrgicas en la cirugía coronaria. Sin embargo, a partir de estudios observacionales se ha confirmado la superioridad del bypass de AMI-DA, en términos de supervivencia y reducción de eventos, respecto al de vena safena 1-2. Tras estos datos pareció lógico ampliar, en pacientes seleccionados, el número de injertos de AMI, usándola de forma bilateral. La idea de que esta estrategia resultaría beneficiosa a largo plazo no había sido apoyada de forma convincente por los datos clínicos 4,5.
El mayor problema de los estudios sobre el beneficio relativo de la doble AMI respecto a la AMI única es la selección de los pacientes, pero existen muchas dificultades para la realización de un estudio prospectivo aleatorizado sobre ambas técnicas.
El método más frecuente para crear grupos de pacientes comparables no aleatorizados es el del emparejamiento (matching) mediante un número determinado de variables, por lo que se necesita un amplio núme-ro de pacientes en ambos grupos. Este aspecto proporciona un valor añadido a los estudios observacionales que están publicando centros con reconocido prestigio y experiencia en cirugía coronaria, como la Clínica Mayo 10 o la Cleveland Clinic 12. En el trabajo publicado por Lytle et al 12 se concluye que los pacientes que reciben dos AMI tienen menor riesgo de muerte, reoperación y angioplastia; estos autores cifran la diferencia porcentual, a 12 años de seguimiento, de estar libre del evento muerte en el 6,3% (rango, 4,2-8,7), libre de reoperación del 8,3% (rango, 6,5-11) y libre de angioplastia del 3,9% (rango, 2,5-5,6).
La mayor probabilidad de complicaciones esternales con el uso de la AMI bilateral 42-44, ampliamente descrita en la bibliografía, es compensada con su disección sin pedículo 26-32, lo que permite preservar mejor la circulación colateral del esternón, reduciendo la incidencia de complicaciones a cifras habituales por el uso de una AMI, o incluso de la cirugía valvular.
Nuestra experiencia con el uso de ambas AMI sin pedículo, y los buenos resultados angiográficos precedentes de la AMID como injerto libre 45,46, nos lleva a considerar a la arteria radial como injerto arterial de segunda elección.
Diversos factores han sido implicados en la morbilidad y mortalidad de la cirugía coronaria, casi todos derivados del uso de la CEC, del clampaje de la aorta y del daño isquémico durante la parada cardíaca. A pesar de estos aspectos adversos, la estrategia esencial de esta cirugía, si exceptuamos la protección miocárdica, no ha sufrido cambios en los últimos 25 años. De especial importancia en el capítulo de la morbilidad son las complicaciones neurológicas 47-51, cifradas en un 6,1% por Roach et al, en un reciente estudio multicéntrico prospectivo con 2.108 pacientes 47. Estas complicaciones son atribuidas a embolias de placas de ateroma por manipulación de la aorta ascendente 52, a microembolias o a bajas presiones de perfusión cerebral durante la CEC. La tendencia a operar a pacientes de cada vez mayor edad hace previsible una exacerbación de estas complicaciones. Roach et al concluyen en su publicación: «las complicaciones cerebrales tras la cirugía coronaria son relativamente frecuentes y serias, están asociadas con un incremento sustancial en la mortalidad, mayor estancia hospitalaria y consumo de recursos sanitarios a medio y largo plazo. Deben desarrollarse nuevas estrategias diagnósticas y terapéuticas para disminuir estas complicaciones».
La cirugía coronaria sin CEC, como nueva estrategia quirúrgica, está dando adecuada respuesta a esta demanda, presentando una significativa reducción en todas las causas de morbilidad si tenemos en cuenta las numerosas publicaciones recientes 53-59, lo que la hace, en el momento actual, la técnica de elección en los pacientes de alto riesgo.
En nuestra opinión, para reducir verdaderamente la morbimortalidad de la cirugía de revascularización miocárdica con CEC no sólo debe prescindirse de ésta, sino que debe eliminarse el clampaje lateral de la aorta en la mayoría de los pacientes y no sólo en los pacientes con la aorta «macroscópicamente enferma».
El razonamiento anteriormente expuesto se ve reflejado en la técnica de revascularización miocárdica arterial con doble AMI, dispuestas como injerto en «Y» o «T» sin CEC, cuyos resultados iniciales son el objeto de nuestra publicación. Si bien inicialmente los pacientes con buenas condiciones anatómicas y hemodinámicas eran adscritos a esta nueva técnica quirúrgica, la intención por parte de los cirujanos que la realizan de evaluarla como una técnica de rutina y la asignación a la revascularización sin CEC de los pacientes con importante morbilidad añadida han hecho que el grupo de pacientes en los que se realizó esta técnica sea muy representativo de nuestra población general de pacientes coronarios. Si observamos los valores porcentuales que se recogen en la tabla 1, podemos reconocer una distribución típica de la cirugía coronaria en nuestro medio. Tan sólo existen importantes diferencias respecto a los pacientes intervenidos con carácter emergente y a los pacientes con cirugía previa, para los que no son extrapolables, por el momento, las conclusiones de este trabajo. Sin embargo, ninguna de las dos situaciones anteriormente expuestas se consideran, de entrada, contraindicación absoluta para esta técnica, realizándose en este momento una indicación individualizada, a la espera de los resultados.
Tanto el número de anastomosis por paciente, con una media de casi 3, como el 44,6% de anastomosis en la cara lateral e inferior del corazón, se encuentran dentro del rango más alto de las cifras publicadas en la bibliografía respecto a la cirugía sin CEC. El número de anastomosis secuenciales, del 25,2%, de mayor complejidad técnica, es el más alto publicado, siendo casi anecdótico en el resto de las series. Todos estos datos reflejan nuestra intención clara de realizar una revascularización arterial completa, conseguida en el 94,6% de los pacientes, en una población con enfermedad mayoritaria de triple vaso. En el 100% de los pacientes no se manipuló la aorta ascendente.
La complicación más importante en esta serie ha sido la mediastinitis, que ocurrió en 3 pacientes (3,2%), por haber generado la causa más importante de mortalidad (2 casos), si bien nuestra incidencia global de mediastinitis en más de 250 pacientes intervenidos con doble AMI con o sin CEC es del 1,8%. Dos de los pacientes que desarrollaron mediastinitis eran pacientes diabéticos insulinodependientes, con un difícil control de la glucemia postoperatoria. Estos datos nos confirman que en este grupo de pacientes debe realizarse una cuidadosa disección de ambas AMI, intentando preservar al máximo la circulación colateral del esternón, así como un estricto control de la glucemia postoperatoria.
La morbilidad postoperatoria ha sido en general baja, destacando la ausencia de eventos neurológi-cos, baja reintervención por sangrado y transfusión, y una baja incidencia de fibrilación auricular postoperatoria (8,7%), complicación postoperatoria más frecuente, el 20-30% según las series, en la cirugía coronaria convencional.
La mayoría de los pacientes con control angiográfico pertenecen a la primera mitad de nuestra experiencia, por lo que reflejan los resultados en plena curva de aprendizaje. Es de destacar que no se ha detectado ningún problema en la anastomosis entre ambas AMI y que el 100% de las anastomosis AMII-DA están permeables y perfectamente funcionantes. Estos pacientes con angiografía son representativos del grupo total, pues son portadores de un 26% de anastomosis secuenciales y de un 52% de anastomosis en la cara lateral e inferior del corazón. Consideramos buena una tasa de permeabilidad (grado A + B) del 94,4%, aunque se encuentra por debajo del 98% publicado por Calafiore et al 22, si bien esta serie está realizada a 33 días de media tras la intervención, sólo contiene 3 anastomosis secuenciales, un 41,6% de anastomosis en la cara lateral e inferior y un uso mayor de vena safena desde la aorta. CONCLUSIÓN
Nuestros datos confirman que se puede realizar, en un gran número de pacientes, revascularización arterial completa sin circulación extracorpórea con ambas arterias mamarias internas, como injerto en «T», con buenos resultados clínicos y angiográficos, lo que puede contribuir, manteniendo los resultados a largo plazo de la revascularización arterial, a una reducción en la morbimortalidad de la cirugía coronaria de la que se beneficiarán principalmente los pacientes de alto riesgo quirúrgico.
La estrategia de usar la arteria mamaria interna izquierda (AMII) como injerto a la arteria descendente anterior (DA) se ha convertido, desde los años ochenta, en la parte básica de la cirugía coronaria. El bypass de AMII-DA tiene unas altas tasas de permeabilidad a largo plazo y es muy infrecuente que desarrolle arterioesclerosis. Numerosos estudios clínicos han demostrado que estos pacientes presentan una mayor supervivencia a largo plazo, menor número de eventos cardíacos y menor necesidad de nuevos procedimientos de revascularización 1-3.
Si bien la lógica parece dictar que el incremento de injertos arteriales, mediante el uso de la arteria mamaria interna derecha (AMID), debería mejorar los resultados a largo plazo, este aspecto es motivo de controversia en la literatura médica. Aunque algunos grupos no han encontrado que el uso bilateral de la arteria mamaria interna (AMI) produzca beneficio adicional, en términos de supervivencia, respecto a los pacientes con AMII-DA 4,5, en los últimos tres años, diversas publicaciones, entre ellas algunas de centros con gran experiencia en cirugía coronaria, como la Cleveland Clinic o la Clínica Mayo, han comunicado beneficios en cuanto a la supervivencia, ausencia de nueva revascularización y disminución de eventos cardíacos, mediante el uso de ambas AMI 3,6-12.
El uso expansivo de ambas AMI, en el intento de lograr la mayor revascularización arterial posible, ha llevado a múltiples posibilidades técnicas. Mills et al y Sauvage et al 13 introdujeron el uso de la AMID, como injerto libre, anastomosado a la AMII en «T». Esta técnica ha sido popularizada por Alfred Tector 14,15, a principios de los noventa, para conseguir una revascularización arterial completa (fig. 1).
Fig. 1. A: Injerto en «T», descrito por Tector, mediante anastomosis de la arteria mamaria interna derecha (AMID) libre en la cara posterior de la arteria mamaria interna izquierda (AMII) in situ, a nivel de la orejuela izquierda. La AMII se encuentra anastomosada de forma secuencial a la arteria diagonal y la descendente anterior (DA). La AMID es el injerto para el ramo mediano, obtusa marginal y arteria descendente posterior. B-D: técnica de anastomosis perpendicular latero-terminal para construir el injerto en «T»14,15.
La revascularización miocárdica sin circulación extracorpórea (CEC) es una estrategia quirúrgica que ha sido usada desde el comienzo de la cirugía coronaria. El interés por eliminar la morbimortalidad derivada de la CEC ha puesto de actualidad estas técnicas. A pesar de sus buenos resultados en amplias series de pacientes 16-25, su indicación es motivo de controversia, tanto por sus dificultades técnicas, máxime si queremos mantener una revascularización arterial de las caras lateral y posterior del corazón, como por la incertidumbre en los resultados angiográficos. El desarrollo tecnológico, con la introducción de los «estabilizadores epicárdicos», que nos permiten la exposición e inmovilización regional de la arteria coronaria diana, ha posibilitado la realización de meticulosas suturas arteriales.
Nuestro objetivo ha sido reducir la agresión quirúrgica, mediante la eliminación de la CEC y el clampaje aórtico, manteniendo la revascularización arterial completa con ambas AMI, siguiendo la técnica de Tector, para no disminuir la calidad de la revascularización. La evolución de nuestra técnica y los resultados clínicos y angiográficos iniciales son el objeto del presente estudio. PACIENTES Y MÉTODOS
Pacientes
Desde la introducción en nuestro servicio de los dispositivos de estabilización epicárdica para la cirugía coronaria sin CEC en enero de 1997, se han intervenido 683 pacientes de revascularización coronaria aislada, de los cuales 198 (29%) fueron sin CEC. La introducción de esta técnica ha sido progresiva, representando para el año 1998 el 36,6% del total de la cirugía coronaria y en los primeros siete meses de 1999 el 50%.
En abril de 1998 se comenzó la revascularización arterial completa, sin CEC, con doble arteria mamaria interna, como injertos en «Y» o «T», habiéndose intervenido con esta técnica 92 pacientes, lo que supone el 52% de la cirugía sin CEC y el 25% del total de revascularización coronaria aislada realizada en ese período de tiempo.
Tras la indicación quirúrgica y la asignación del paciente a un cirujano, quedó a su criterio personal la realización de la cirugía con o sin CEC. Tras la visualización de la angiografía y la exploración intraoperatoria se han considerado buenas condiciones para la cirugía coronaria sin CEC:
1. Arteria coronaria epicárdica, no calcificada y de un calibre interno superior a 1,2 mm.
2. Estabilidad eléctrica y hemodinámica que permitan la manipulación del corazón
3. Arterias obtusas marginales largas y de buen calibre en su porción media, lugar donde generalmente se realiza la anastomosis.
4. Una fracción de eyección deprimida no se ha considerado por sí solo criterio de exclusión, pero debe tenerse en cuenta que en los corazones muy dilatados es difícil exponer la cara lateral.
En los pacientes en los que se presuponía una importante morbilidad a consecuencia de la CEC, como aquellos mayores de 75 años, con síndrome metadiabético, arteriopatías periféricas severas, discrasias sanguíneas etc., se indicó cirugía coronaria sin CEC, aun en ausencia de condiciones anatómicas óptimas.
Las características preoperatorias del grupo de pacientes en estudio, con una edad media de 64,9 ± 8,1 años (rangos, 42-78) aparecen resumidas en la tabla 1; así mismo, su riesgo quirúrgico preoperatorio, calculado según la escala de Parsonnet (1995), era del 4,5 ± 3,02%.
Técnica quirúrgica
La monitorización del paciente realizada correspondió a la convencional en cirugía coronaria. Si bien en las primeras fases la técnica anestésica era convencional, posteriormente se ha evolucionado hacia técnicas que facilitan la extubación precoz, incluso intraoperatoria, de los pacientes, como son la combinación de fentanilo y propofol y, más recientemente, catéter epidural torácico y remifentanilo. No se realizó de forma rutinaria la infusión intravenosa de fármacos vasodilatadores ni betabloqueantes.
Ambas AMI eran disecadas sin pedículo (skeletonization technique) mediante lupas de magnificación (×3,5 a ×5,5) con el objeto de preservar la vascularización del esternón, mejorar su calibre y longitud y facilitar la construcción del injerto en «T» y las anastomosis secuenciales 26-32. Realizamos la heparinización, inicialmente con 1,5 mg/kg de peso, necesaria para alcanzar un tiempo de coagulación activado (TCA) superior a 300 s, manteniéndose esta cifra durante todo el período en el que se realizaron oclusiones arteriales. Ambas AMI fueron irrigadas con suero salino caliente y solución salina de papaverina 1:30, no realizándose de forma rutinaria manipulación farmacológica intraarterial. Se exploran las arterias coronarias diana y se confirmó la estrategia quirúrgica.
Tras seccionar con clips metálicos la porción proximal de la AMID, se realizó la construcción del injerto en «T» (anastomosis término-lateral perpendicular) o en «Y» (anastomosis término-lateral en paralelo), según el plan quirúrgico, suturando la AMID sobre la AMII a la altura de la orejuela izquierda, tras pasar esta última por una incisión lateral del pericardio. La anastomosis término-lateral, de unos 8 mm de longitud, se realizó con sutura continua de monofilamento de 8-0 y se comprobó la pulsatilidad o flujo de ambos brazos del injerto (fig. 2). En casos seleccionados fue necesario construir un segundo injerto en «Y», con un segmento de AMII o AMID de 2-4 cm de longitud, sobre una porción más distal de la AMII, para la revascularización de ramos diagonales que discurren casi perpendiculares a la DA.
Fig. 2. Imagen intraoperatoria de un injerto en «T» con ambas arterias mamarias internas esqueletizadas.
Siempre realizamos en primer lugar la revascularización de la cara anterior del corazón, comenzando, si era preciso, por las arterias diagonales y a continuación la arteria descendente anterior. Posteriormente, se realizaron las anastomosis de la cara lateral, poste-rolateral e inferior, por este orden. En la mayoría de los pacientes se realizó la revascularización de la DA con la AMII, pero en algunos pacientes, en los que se precisó mayor longitud o mejor calidad del injerto a este territorio, se prefirió usar la AMID.
En los primeros casos, la estrategia de exposición de las arterias coronarias fue la descrita por Calafiore et al 22, basada en el uso de cuatro cintas de algodón, dos que se pasan por el seno transverso y otras dos por debajo de la vena cava inferior para la elevación del corazón, y del dispositivo de inmovilización regional CTS-MV (CardioThoracic System, Cupertino, CA). Posteriormente modificamos la técnica de elevación y rotación del corazón para acceder a la cara lateral, posterolateral e inferior del mismo, adoptando la técnica descrita por Lima 33,34. Se basa en la colocación de 3 o 4 puntos de seda para elevar el lado izquierdo del pericardio, el primero por encima de la vena pulmonar superior izquierda, el segundo próximo a la vena pulmonar inferior izquierda, el tercero entre esta vena y la vena cava inferior y el cuarto en la vecindad de la vena cava inferior. Con la tracción alternativa o simultánea de estos puntos se consigue elevar y rotar hacia la derecha la base del corazón y colocar el ápex fuera del tórax. Esta posición genera una dificultad al llenado del ventrículo derecho que es compensada con un Trendelenburg de 20º, con lo que se consigue una adecuada estabilidad hemodinámica 35,36. A lo largo de esta experiencia se han utilizado diversos inmovilizadores, que han aparecido en el mercado con mejoras tecnológicas, utilizándose en la actualidad el CTS Ultima (CardioThoracic System, Cupertino, CA) representado en la figura 3, y el Octopus-2 (Medtronic Inc, Minneapolis, Minn). En la figura 4 se aprecia el mecanismo de inmovilización, por succión, de la generación de inmovilizadores Octopus.
Fig. 3. Separador-Inmovilizador CTS Access Ultima System para cirugía coronaria sin circulación extracorpórea por estenotomía media.
Fig. 4. Inmovilizador Octopus 1 situado en el territorio de la arteria descendente anterior.
Una vez conseguida una adecuada exposición e inmovilización de la arteria coronaria diana con una buena hemodinámica, se procedió a la oclusión de la arteria coronaria mediante un torniquete de monofilamento de 4-0 apoyado en un trozo de silicona para no dañar la arteria. Sólo excepcionalmente se realizó oclusión distal de las arterias coronarias y no se emplean oclusores o shunts intravasculares.
Todas las anastomosis se realizaron con una sutura continua de monofilamento de 8-0 (Surgipro, Autosuture, EE.UU.), lupas de magnificación (×3,5 a ×5,5), y eliminando la sangre de la arteriotomía mediante un «soplador» de aire húmedo (Clear View Blower/Mister, Medtronic DLP, Grand Rapids, MI). Según la posición de las arterias coronarias y la longitud del injerto (AMI) hemos usado tanto anastomosis látero-laterales (secuenciales) en paralelo o perpendiculares (diamante), como término-laterales igualmente en paralelo o perpendiculares. En general, preferimos las anastomosis en paralelo, pues con las anastomosis en «diamante», sobre todo si las AMI son finas, se pueden generar distorsiones en la anastomosis que comprometan el flujo distal.
Al finalizar cada anastomosis se realiza una evaluación cuantitativa y cualitativa mediante un medidor de flujo (Transonic System, Ithaca NY). La presencia, cerca de la anastomosis, de una onda diastólica dominante se ha correlacionado angiográficamente con una anastomosis permeable y no restrictiva 37-39 (fig. 5).
Fig. 5. Registro de flujo (Transonic HT 311) en el tronco común de un injerto en «T» con doble arteria mamaria interna a descendente anterior, obtusa marginal y descendente posterior. Se observa la predominante onda diastólica, dato de permeabilidad de una anastomosis, y el flujo medio de la arteria.
En general, la heparinización fue revertida parcialmente con 50 mg de protamina al finalizar la intervención. Tan sólo en los pacientes con malos lechos distales o aquellos que habían presentado cambios electrocardiográficos durante la intervención ésta no se neutralizó. En los últimos pacientes, y tras la publicación de Mariani et al 40, en la que se demuestra la existencia de una actividad procoagulante en la cirugía coronaria sin CEC, similar a la existente en otras cirugías mayores, hemos pasado a no neutralizar la heparina (considerando que el paciente tenga un tiempo de coagulación activado [TCA] de 200 s a la salida de quirófano) y administrar heparina cálcica subcutánea y antiagregantes, a la llegada del paciente a la unidad de postoperatorio y posteriormente cada 24 h.
Curso postoperatorio
Si el paciente se encontraba hemodinámicamente estable y sin cambios electrocardiográficos, se realizó extubación, movilización precoz y retirada de líneas y drenajes, pasando a planta en la mañana del primer día postoperatorio.
Sólo se ha usado diltiazem oral o intravenoso en pacientes hipertensos, o que al menos mantuvieran una presión arterial media superior a 70 mmHg.
Seguimiento clínico y angiográfico
El seguimiento clínico se realizó en consultas externas al mes, 6 meses y al año de la intervención.
Se solicitó autorización para control angiográfico a todos los pacientes asintomáticos tras 6 meses de la intervención o a los pacientes que presentaran síntomas, tanto angina de pecho típica o atípica como disnea, en cualquier período del seguimiento. Se desestimó la realización de la angiografía de control durante el ingreso hospitalario por haberse descrito en la bibliografía defectos angiográficos precoces reversibles, tanto en los conductos como en la anastomosis 22, y debido a que los resultados a 6 meses aportan mejor información respecto a la incidencia de oclusión precoz de los injertos. Aquellos pacientes asintomáticos portadores de prótesis aortobifemoral, en los que fue necesario realizar el cateterismo diagnóstico por vía braquial, fueron desestimados para angiografía de control, realizándose prueba de esfuerzo.
Análisis estadístico
Todos los datos se expresan como medias ± desviación estándar. RESULTADOS
Detalles técnicos
Se han realizado un total de 274 anastomosis distales, lo que supone una media de 2,98 ± 0,66 anastomosis/paciente (rango, 2-5). En 7 pacientes (7,6%), sobre todo al principio de la experiencia y en pacientes con corazones dilatados, no se pudo conseguir la revascularización arterial completa con ambas AMI, siendo necesario, para alcanzar la arteria descendente posterior, prolongar la AMID con 4-5 cm de vena safena en 5 pacientes (5,4%), y en 2 (2,2%) utilizar la arteria gastroepiploica. En ningún caso se realizó manipulación de la aorta ascendente.
Veinte pacientes (21,7%) recibieron dos anastomosis, 55 (59,8%) tres, 16 (17,4%) cuádruple bypass, y en sólo 1 paciente (1,1) se realizaron cinco anastomosis.
En 2 pacientes (2,2%) se realizó cirugía carotídea combinada.
La localización de las anastomosis distales y su distribución por injertos se encuentran resumidas en la tabla 2.
Mortalidad precoz
La mortalidad hospitalaria ha sido de 3 pacientes (3,2%). Dos pacientes varones fallecieron a consecuencia de sepsis y fracaso multiorgánico tras mediastinitis, uno de ellos diabético insulinodependiente y el otro de 76 años de edad con arteriopatía periférica severa y EPOC en tratamiento con corticoides orales. La tercera paciente falleció a la hora de su llegada a la unidad de postoperatorio por fibrilación ventricular refractaria a medidas de reanimación, sin haber presentado problemas hemodinámicos ni electrocardiográficos durante la intervención y con buenos registros de flujos en las anastomosis.
Evolución postoperatoria
Tan sólo 3 pacientes (3,2%) precisaron soporte inotrópico con catecolaminas y uno (1,1%) balón de contrapulsación. Siete pacientes (7,6%) fueron extubados en quirófano. El tiempo medio de intubación postoperatoria fue de 7,7 ± 7,8 horas, siendo extubado el 64,9% de los pacientes en las primeras 6 h. En 4 pacientes (4,3%) se diagnosticó necrosis perioperatoria por presentar cambios electrocardiográficos o enzimáticos. El sangrado medio en las primeras 24 h ha sido de 762,3 ± 354,7 ml y el porcentaje de pacientes transfundidos del 21,7%. Ningún paciente presentó accidente cerebrovascular agudo (ACVA) y en 11 casos (11,9%) se observó un empeoramiento de la función renal respecto a la preoperatoria que no precisó medidas especiales. Tres pacientes (3,2%) presentaron mediastinitis, que precisó reintervención, dos de los cuales, como se ha descrito con anterioridad, fallecieron posteriormente por fracaso multiorgánico. La estancia media en la unidad de postoperatorio fue de 1,8 ± 1,4 días, con 43 pacientes (46,7%) con una estancia inferior a 24 h. La estancia postoperatoria media fue de 6,7 ± 4,1 días, con 33 pacientes (35,9%) dados de alta antes de los 5 días.
Otros datos de morbilidad postoperatoria se resumen en la tabla 3.
Resultados clínicos
El período de seguimiento clínico fue de 1 a 16 meses, con una media de 7,77 ± 2,8 meses. Un paciente (1,1%) falleció por causa no relacionada (traumatismo), no produciéndose otras muertes tardías ni pérdidas para el seguimiento.
Ningún paciente presentó eventos cardiológicos ni fue preciso realizar nuevos procedimientos de revascularización.
Un paciente (1,1%) presentó a los 6 meses dolores torácicos atípicos, y al ser portador de un bypass axilobifemoral, se indicó prueba de esfuerzo en vez de control angiográfico, resultando una prueba máxima negativa clínica y electrocardiográfica. El resto de los pacientes se encontraron asintomáticos.
Angiografía postoperatoria
De forma consecutiva, a todos los pacientes se les planteó el control angiográfico tras 6 meses de seguimiento. En el momento actual, 24 pacientes (26%) han aceptado el control postoperatorio, con un intervalo medio respecto a la intervención de 6,7 ± 2,6 meses. Se han evaluado las 24 anastomosis entre ambas AMI y 72 anastomosis distales, 19 (26%) de ellas secuenciales, y se han clasificado las tasas de permeabilidad según la clasificación de Fitzgibbon 41.
Las 24 anastomosis (100%) en «Y» o «T» entre ambas AMI estaban permeables y sin lesiones (grado A). Dos pacientes portadores de doble injerto en «Y» presentan todas las anastomosis permeables. La tasa total de permeabilidad (grado A + B) es del 94,4%, siendo del 100% para las 34 anastomosis de la cara anterior (DA y diagonal), 8 (23,5%) de ellas secuenciales, y del 89,5% para las caras lateral e inferior, con 11 (28%) anastomosis secuenciales (fig. 6).
Fig. 6. Imagen angiográfica de un paciente con revascularización arterial completa con un injerto en «T» de ambas arterias mamarias internas. La arteria mamaria interna izquierda revasculariza de forma secuencial las arterias diagonal-descendente anterior y la arteria mamaria interna derecha y la obtusa marginal-descendente anterior.
Los resultados clasificados por la localización de las anastomosis distales se encuentran en la tabla 4.
DISCUSIÓN
Este trabajo aporta la serie más amplia publicada de revascularización miocárdica arterial sólo con doble AMI, dispuestas como injerto en «Y» o «T», sin uso de CEC. Entre las series más recientes publicadas de revascularización arterial sin CEC encontramos la de Calafiore et al 22, con uso de múltiples injertos arteriales además de la AMI, un uso de injertos en «Y» del 18% y de anastomosis secuenciales del 4%. Cartier et al 23 han publicado una serie de 140 pacientes con uso en la mayoría de los pacientes de una sola AMI; el 93% de los pacientes recibieron vena safena, el 8% arteria radial, y tan sólo en 3 pacientes se realizaron anastomosis secuenciales. En la serie de Jansen et al 21, de 42 pacientes hay un uso amplio de la doble AMI pero in situ, con 1 solo paciente con injerto en «Y», completándose la revascularización de la cara inferior del corazón con arteria gastroepiploica.
Por otro lado, las series amplias publicadas de revascularización arterial completa con doble AMI en injerto compuesto, principalmente por Tector, han sido realizadas con CEC 13-15,32.
Por tanto, confluyen en nuestra serie dos cuestiones de relevancia clínica, en cuanto a que debemos considerar si aportamos algún beneficio a nuestros pacientes, tanto con una revascularización arterial completa como con la eliminación de la circulación extracorpórea y el clampaje aórtico.
En cuanto a la repercusión de la revascularización arterial completa, debemos considerar que se han realizado muy pocos estudios prospectivos aleatorizados sobre diferentes estrategias quirúrgicas en la cirugía coronaria. Sin embargo, a partir de estudios observacionales se ha confirmado la superioridad del bypass de AMI-DA, en términos de supervivencia y reducción de eventos, respecto al de vena safena 1-2. Tras estos datos pareció lógico ampliar, en pacientes seleccionados, el número de injertos de AMI, usándola de forma bilateral. La idea de que esta estrategia resultaría beneficiosa a largo plazo no había sido apoyada de forma convincente por los datos clínicos 4,5.
El mayor problema de los estudios sobre el beneficio relativo de la doble AMI respecto a la AMI única es la selección de los pacientes, pero existen muchas dificultades para la realización de un estudio prospectivo aleatorizado sobre ambas técnicas.
El método más frecuente para crear grupos de pacientes comparables no aleatorizados es el del emparejamiento (matching) mediante un número determinado de variables, por lo que se necesita un amplio núme-ro de pacientes en ambos grupos. Este aspecto proporciona un valor añadido a los estudios observacionales que están publicando centros con reconocido prestigio y experiencia en cirugía coronaria, como la Clínica Mayo 10 o la Cleveland Clinic 12. En el trabajo publicado por Lytle et al 12 se concluye que los pacientes que reciben dos AMI tienen menor riesgo de muerte, reoperación y angioplastia; estos autores cifran la diferencia porcentual, a 12 años de seguimiento, de estar libre del evento muerte en el 6,3% (rango, 4,2-8,7), libre de reoperación del 8,3% (rango, 6,5-11) y libre de angioplastia del 3,9% (rango, 2,5-5,6).
La mayor probabilidad de complicaciones esternales con el uso de la AMI bilateral 42-44, ampliamente descrita en la bibliografía, es compensada con su disección sin pedículo 26-32, lo que permite preservar mejor la circulación colateral del esternón, reduciendo la incidencia de complicaciones a cifras habituales por el uso de una AMI, o incluso de la cirugía valvular.
Nuestra experiencia con el uso de ambas AMI sin pedículo, y los buenos resultados angiográficos precedentes de la AMID como injerto libre 45,46, nos lleva a considerar a la arteria radial como injerto arterial de segunda elección.
Diversos factores han sido implicados en la morbilidad y mortalidad de la cirugía coronaria, casi todos derivados del uso de la CEC, del clampaje de la aorta y del daño isquémico durante la parada cardíaca. A pesar de estos aspectos adversos, la estrategia esencial de esta cirugía, si exceptuamos la protección miocárdica, no ha sufrido cambios en los últimos 25 años. De especial importancia en el capítulo de la morbilidad son las complicaciones neurológicas 47-51, cifradas en un 6,1% por Roach et al, en un reciente estudio multicéntrico prospectivo con 2.108 pacientes 47. Estas complicaciones son atribuidas a embolias de placas de ateroma por manipulación de la aorta ascendente 52, a microembolias o a bajas presiones de perfusión cerebral durante la CEC. La tendencia a operar a pacientes de cada vez mayor edad hace previsible una exacerbación de estas complicaciones. Roach et al concluyen en su publicación: «las complicaciones cerebrales tras la cirugía coronaria son relativamente frecuentes y serias, están asociadas con un incremento sustancial en la mortalidad, mayor estancia hospitalaria y consumo de recursos sanitarios a medio y largo plazo. Deben desarrollarse nuevas estrategias diagnósticas y terapéuticas para disminuir estas complicaciones».
La cirugía coronaria sin CEC, como nueva estrategia quirúrgica, está dando adecuada respuesta a esta demanda, presentando una significativa reducción en todas las causas de morbilidad si tenemos en cuenta las numerosas publicaciones recientes 53-59, lo que la hace, en el momento actual, la técnica de elección en los pacientes de alto riesgo.
En nuestra opinión, para reducir verdaderamente la morbimortalidad de la cirugía de revascularización miocárdica con CEC no sólo debe prescindirse de ésta, sino que debe eliminarse el clampaje lateral de la aorta en la mayoría de los pacientes y no sólo en los pacientes con la aorta «macroscópicamente enferma».
El razonamiento anteriormente expuesto se ve reflejado en la técnica de revascularización miocárdica arterial con doble AMI, dispuestas como injerto en «Y» o «T» sin CEC, cuyos resultados iniciales son el objeto de nuestra publicación. Si bien inicialmente los pacientes con buenas condiciones anatómicas y hemodinámicas eran adscritos a esta nueva técnica quirúrgica, la intención por parte de los cirujanos que la realizan de evaluarla como una técnica de rutina y la asignación a la revascularización sin CEC de los pacientes con importante morbilidad añadida han hecho que el grupo de pacientes en los que se realizó esta técnica sea muy representativo de nuestra población general de pacientes coronarios. Si observamos los valores porcentuales que se recogen en la tabla 1, podemos reconocer una distribución típica de la cirugía coronaria en nuestro medio. Tan sólo existen importantes diferencias respecto a los pacientes intervenidos con carácter emergente y a los pacientes con cirugía previa, para los que no son extrapolables, por el momento, las conclusiones de este trabajo. Sin embargo, ninguna de las dos situaciones anteriormente expuestas se consideran, de entrada, contraindicación absoluta para esta técnica, realizándose en este momento una indicación individualizada, a la espera de los resultados.
Tanto el número de anastomosis por paciente, con una media de casi 3, como el 44,6% de anastomosis en la cara lateral e inferior del corazón, se encuentran dentro del rango más alto de las cifras publicadas en la bibliografía respecto a la cirugía sin CEC. El número de anastomosis secuenciales, del 25,2%, de mayor complejidad técnica, es el más alto publicado, siendo casi anecdótico en el resto de las series. Todos estos datos reflejan nuestra intención clara de realizar una revascularización arterial completa, conseguida en el 94,6% de los pacientes, en una población con enfermedad mayoritaria de triple vaso. En el 100% de los pacientes no se manipuló la aorta ascendente.
La complicación más importante en esta serie ha sido la mediastinitis, que ocurrió en 3 pacientes (3,2%), por haber generado la causa más importante de mortalidad (2 casos), si bien nuestra incidencia global de mediastinitis en más de 250 pacientes intervenidos con doble AMI con o sin CEC es del 1,8%. Dos de los pacientes que desarrollaron mediastinitis eran pacientes diabéticos insulinodependientes, con un difícil control de la glucemia postoperatoria. Estos datos nos confirman que en este grupo de pacientes debe realizarse una cuidadosa disección de ambas AMI, intentando preservar al máximo la circulación colateral del esternón, así como un estricto control de la glucemia postoperatoria.
La morbilidad postoperatoria ha sido en general baja, destacando la ausencia de eventos neurológi-cos, baja reintervención por sangrado y transfusión, y una baja incidencia de fibrilación auricular postoperatoria (8,7%), complicación postoperatoria más frecuente, el 20-30% según las series, en la cirugía coronaria convencional.
La mayoría de los pacientes con control angiográfico pertenecen a la primera mitad de nuestra experiencia, por lo que reflejan los resultados en plena curva de aprendizaje. Es de destacar que no se ha detectado ningún problema en la anastomosis entre ambas AMI y que el 100% de las anastomosis AMII-DA están permeables y perfectamente funcionantes. Estos pacientes con angiografía son representativos del grupo total, pues son portadores de un 26% de anastomosis secuenciales y de un 52% de anastomosis en la cara lateral e inferior del corazón. Consideramos buena una tasa de permeabilidad (grado A + B) del 94,4%, aunque se encuentra por debajo del 98% publicado por Calafiore et al 22, si bien esta serie está realizada a 33 días de media tras la intervención, sólo contiene 3 anastomosis secuenciales, un 41,6% de anastomosis en la cara lateral e inferior y un uso mayor de vena safena desde la aorta. CONCLUSIÓN
Nuestros datos confirman que se puede realizar, en un gran número de pacientes, revascularización arterial completa sin circulación extracorpórea con ambas arterias mamarias internas, como injerto en «T», con buenos resultados clínicos y angiográficos, lo que puede contribuir, manteniendo los resultados a largo plazo de la revascularización arterial, a una reducción en la morbimortalidad de la cirugía coronaria de la que se beneficiarán principalmente los pacientes de alto riesgo quirúrgico.
Bibliografía
[1]
Long-term (5-12 years) serial studies of internal mammary artery and safenous vein coronary bypass grafts. J Thorac Cardiovasc Surg 1985; 89: 248-258.
[2]
Influence of the internal-mammary-artery graft on 10-year survival and other cardiac events. N Engl J Med 1986; 314: 1-6.
[3]
Coronary bypass surgery with internal-mammary-artery grafts. Effects on survival over a 15-year period. N Engl J Med 1996; 334: 216-219.
[4]
Validation and interdependence with patients -variables of the influence of procedural variables on early and late survival after CABG. K.U. Leaven Coronary Surgery Program. Eur J Cardiothorac Surg 1997; 12: 1-19.
[5]
Does it make sense to use two internal thoracic arteries? Ann Thorac Surg 1995; 59: 1456-1463.
[6]
Does bilateral internal mammary artery grafting increase surgical risk? J Thoracic Cardiovasc Surg 1988; 95: 850-856.
[7]
Results of internal thoracic artery grafting over 15 years: single versus double grafts. Ann Thorac Surg 1990; 49: 202-209.
[8]
Clinical evaluation of single versus multiple mammary artery bypass. Circulation 1990; 82 (Supl 4): 214-223.
[9]
Improved survival with multiple left-sided bilateral internal thoracic artery grafts. Ann Thorac Surg 1997; 64: 9-15.
[10]
Single versus bilateral internal Mammary artery grafts: 10-year outcome analysis. Ann Thorac Surg 1997; 64: 599-605.
[11]
Bilateral Internal Thoracic Artery grafting may improve outcome of coronary artery surgery. Risk-adjusted survival. Circulation 1998; 98: 1-6.
[12]
Two internal thoracic artery grafts are better than one. J Thorac Cardiovasc Surg 1999; 117: 855-872.
[13]
Healing basis and surgical techniques for complete revascularization of the left ventricle using only the internal mammary arteries. Ann Thorac Surg 1986; 42: 449-465.
[14]
Complete revascularization with internal thoracic artery grafts. Sem Thorac Cardiovasc Surg 1996; 8: 29-41.
[15]
Total revascularization with T-graft. Ann Thorac Surg 1994; 57: 33-39.
[16]
Direct myocardial revascularization without extracorporeal circulation. Experience in 700 patients. Chest 1991; 100: 312-316.
[17]
Coronary artery bypass surgery without cardiopulmonary bypass. Ann Thorac Surg 1996; 61: 63-66.
[18]
Coronary artery bypass grafting without cardiopulmonary bypass. Ann Thorac Surg 1996; 62: 623.
[19]
Coronary artery bypass grafting on the beating heart. Ann Thor Surg 1997; 63: 988-992.
[20]
Coronary artery bypass grafting without cardiopulmonary bypass and without interruption of native coronary flow using a novel anastomosis site restraining device («Octopus»). J Am Coll Cardiol 1996; 27: 1356-1364.
[21]
Coronary artery bypass grafting without cardiopulmonary bypass using the octopus method: results in the first one hundred patients. J Thorac Cardiovasc Surg 1998; 116: 60-67.
[22]
Multiple arterial conduits without cardiopulmonary bypass: early angiographic results. Ann Thorac Surg 1999; 67: 450-456.
[23]
Triple coronary artery revascularization on the stabilized beating heart. Can J Surg 1998; 41: 283-288.
[24]
Coronary artery bypass with and without the heart-lung machine: a case matched 6 year follow up [resumen]. Circulation 1996; 94 (Supl 1): 293.
[25]
Cirugía coronaria sin circulación extracorpórea: 5 años de experiencia. Rev Esp Cardiol 1998; 51: 136-140.
[26]
Anatomic study of the collatral blood supply of the sternum. Ann Thorac Surg 1995; 59: 163-168.
[27]
The effects of different techniques of internal mammary artery harvesting on sternal blood flow. J Thorac Cardiovasc Surg 1992; 104: 1303-1307.
[28]
Skeletonized and pedicle internal thoracic artery grafts: effect on free flow during bypass. Ann Thorac Surg 1996; 61: 909-913.
[29]
Considerations in the skeletonization technique of internal thoracic artery dissection. Ann Thorac Surg 1992; 54: 947-951.
[30]
Seventeen-years experience with bilateral internal mammary artery grafts. Ann Thorac Surg 1990; 49: 195-201.
[31]
Bilateral internal mammary artery grafting: midterm results of pedicle versus skeletonized conduits. Ann Thorac Surg 1999; 67: 1637-1642.
[32]
Routine use of bilateral skeletonized internal mammary arteries for myocardial revascularization. Ann Thorac Surg 1999; 68: 406-412.
[33]
Technical aspects of total revascularization in off-pump coronary bypass via sternotomy approach. Ann Thorac Surg 1999; 67: 1653-1658.
[34]
Off-pump revascularization of the circunflex artery: technical aspect and short-term results. Ann Thorac Surg 1999; 68: 94-99.
[35]
Hemodynamic changes during displacement of the beating heart by the Utrecht Octopus method. Ann Thorac Surg 1997; 63: S88-S92.
[36]
Hemodynamic changes during beating heart surgery. Can J Cardiol 1998; 14: 127.
[37]
Comparison of phasic blood flow velocity characteristics of arterial and venous coronary artery bypass conduits. Circulation 1993; 88: 133-140.
[38]
Noninvasive assessment of left internal mammary artery graft patency using transthoracic echocardiography. Circulation 1995; 92: 25-30.
[39]
Noninvasive assessment of left internal mammary graft patency using duplex doppler echocardiography from supraclavicular fossa. J Am Coll Cardiol 1993; 22: 1647-1652.
[40]
Procoagulant activity after off-pump coronary operation: Is the current anticoagulation adequate? Ann Thorac Surg 1999; 67: 1370-1375.
[41]
Coronary bypass graft fate and patient outcome: angiografic follow-up of 5,065 grafts related to survival and reoperation in 1,388 patients during 25 years. J Am Coll Cardiol 1996; 28: 616-626.
[42]
Sternal wound infections and use of internal mammary artery grafts. J Thorac Cardiovasc Surg 1991; 102: 342-347.
[43]
Risk factors for operative mortality and sternal wound infectin in bilateral internal mammary artery grafting. J Thorac Cardiovasc Surg 1994; 107: 196-202.
[44]
Risks of bilateral internal mammary artery bypass grafting. Ann Thorac Surg 1990; 49: 210-219.
[45]
Angiografic follow-up of internal thoracic artery for free bypass grafting. Ann Thorac Surg 1998; 65: 731-734.
[46]
Midterm results of free internal thoracic artery grafting for myocardial revascularization. Ann Thorac Surg 1998; 65: 951-954.
[47]
Adverse cerebral outcomes after coronary bypass surgery. N Engl J Med 1996; 335: 1857-1863.
[48]
Influence of cardiopulmonary bypass perfusion temperature on neurologic and hematologic function after coronary artery bypass grafting. Ann Thorac Surg 1999; 67: 1547-1556.
[49]
Stroke in cardiac surgical patients: determinants and outcome. AnnThorac Surg 1999; 68: 391-398.
[50]
Determinants of cognitive change after coronary artery bypass surgery: a multifactorial problem. Ann Thorac Surg 1999; 67: 1669-1676.
[51]
Individualized surgical strategy for the reduction of stroke risk in patients undergoing coronary artery bypass grafting. Ann Thorac Surg 1999; 67: 1246-1253.
[52]
Ultrasonographic evaluation of the ascending aorta. Ann Thorac Surg 1999; 67: 478-483.
[53]
Primary coronary artery bypass grafting without cardiopulmonary bypass in impaired left ventricular function. Ann Thorac Surg 1997; 63: S44-S47.
[54]
Off-pump revascularization of multivessel coronary artery disease has a decreased myocardial infarction rate. Eur J Cardiothorac Surg 1998; 14: S20-S24.
[55]
Coronary artery bypass grafting without cardiopulmonary bypass - An attractive alternative in high risk patients. Eur J Cardiothor Surg 1997; 11: 876-880.
[56]
Release of S100B during coronary artery bypass grafting is reduced by off-pump surgery. Ann Thorac Surg 1999; 67: 1721-1725.
[57]
Avoiding cardiopulmonary bypass in multivessel CABG reduces cytokine response and myocardial injury. Ann Thorac Surg 1999; 68: 52-57.
[58]
Myocardial metabolism and hemodinamics during coronary surgery without cardiopulmonary bypass. Ann Thorac Surg 1999; 67: 683-688.
[59]
On-pump versus Off-pump coronary revascularization: evaluation of renal function. Ann Thorac Surg 1999; 68: 493-498.