La fibrilación auricular es la arritmia cardiaca más prevalente en la población general y su presencia aumenta 5 veces el riesgo de que se produzcan fenómenos tromboembólicos. El tratamiento antitrombótico disminuye ese riesgo; sin embargo, aumenta la posibilidad de fenómenos hemorrágicos, de los que la hemorragia intracraneal es la complicación más temida. El riesgo no es homogéneo en todos los pacientes, por lo cual en los últimos años se han desarrollado diferentes escalas de riesgo tromboembólico (las escalas CHADS2, CHA2DS2-VASc y ATRIA); de ellas, la escala CHA2DS2-VASc es la recomendada por las guías de práctica clínica para optimizar el tratamiento antitrombótico de los pacientes con fibrilación auricular. Las mismas guías recomiendan valorar no solo el riesgo trombótico, sino también el hemorrágico. Se han propuesto distintos esquemas de riesgo que valoran el riesgo hemorrágico del paciente (HEMORR2HAGES, HAS-BLED, ATRIA y ORBIT-AF), pero actualmente no se recomienda ninguno de forma explícita en la guía de práctica clínica de la Sociedad Europea de Cardiología. Es fundamental evaluar el beneficio clínico neto del tratamiento anticoagulante, en el cual el beneficio esperado con el tratamiento anticoagulante excede el daño esperado por una posible hemorragia.
Información sobre el suplemento: este artículo forma parte del suplemento titulado «Actualización en el tratamiento de los pacientes con fibrilación auricular sometidos a intervención coronaria», que ha sido patrocinado por Boehringer Ingelheim.
Palabras clave:
La fibrilación auricular (FA) se asocia con un aumento de hasta 5 veces del riesgo de ictus y eventos tromboembólicos1, con el incremento de mortalidad y morbilidad que conlleva. El tratamiento antitrombótico disminuye la tasa de eventos trombóticos, con reducciones de las tasas de ictus del 64% y de la mortalidad del 26% en comparación con placebo2. Sin embargo, el tratamiento anticoagulante se asocia con un aumento del riesgo de complicaciones hemorrágicas, y destaca el incremento de la tasa de hemorragia intracraneal. Dado que los riesgos embólico y hemorrágico no son homogéneos en todos los pacientes, es fundamental evaluar individualmente el beneficio de la reducción del riesgo tromboembólico frente al aumento del riesgo hemorrágico de los pacientes con FA y seleccionar así el inicio del tratamiento antitrombótico más adecuado3. Con los anticoagulantes orales, se ha demostrado una marcada reducción de los eventos embólicos, así como una mejora en la supervivencia. Por otra parte, los ensayos fundamentales han puesto de manifiesto el beneficio clínico de los anticoagulantes orales de acción directa (ACOD), que se ha visto confirmado en amplios registros de pacientes3. Este riesgo es incluso mayor en los pacientes con FA y cardiopatía isquémica que precisan una intervención coronaria, dado que, además de valorar el riesgo embólico y hemorrágico, se debe valorar el riesgo isquémico. En estos pacientes la complejidad aumenta, por lo que es fundamental determinar cuál es la mejor opción terapéutica, con particular interés en el uso de los antiagregantes y los anticoagulantes4.
Estratificación del Riesgo TromboembólicoHay un gran número de factores que se asocian con el riesgo tromboembólico de los pacientes con FA. La combinación de estos factores de riesgo se ha utilizado para generar escalas de estratificación del riesgo tromboembólico con el objetivo inicial de identificar a los pacientes con alto riesgo candidatos a iniciar un tratamiento anticoagulante5,6.
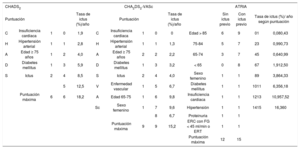
La escala de riesgo CHADS2 (insuficiencia cardiaca, hipertensión, edad > 75 años, diabetes mellitus e ictus [doble]) es una de las más simples, y se ha usado habitualmente para guiar el tratamiento antitrombótico desde que se propusiera y validara en 2001 en los estudios AFI y SPAF7,8(tabla 1). Permite clasificar el riesgo trombótico en bajo (CHADS2 = 0), moderado (CHADS2 = 1) y alto (CHADS2 ≥ 2)8. Sin embargo, mientras la escala CHADS2 clasifica bien a los pacientes con alto riesgo, genera un gran grupo en riesgo intermedio (> 60%) y la puntuación CHADS2 = 0 no identifica realmente a los pacientes que tienen verdadero bajo riesgo trombótico, ya que se observó que estos pacientes presentaban una tasa anual de riesgo trombótico > 3,2%9. Además, esta escala no incluye otros muchos factores de riesgo que favorecen la aparición de eventos trombóticos. Por todo ello, en 2009 el grupo de Birmingham propuso la nueva escala de riesgo CHA2DS2- VASc (insuficiencia cardiaca, hipertensión, edad ≥ 75 años [doble], diabetes mellitus, ictus [doble], enfermedad vascular, edad 65-74 años y sexo femenino), derivada de la población del Euro Heart Survey on Atrial Fibrillation10. La escala CHA2DS2-VASc añade 3 factores de riesgo a la anterior escala: la importancia de la edad, asignando 2 puntos a los pacientes con FA y edad ≥ 75 años y 1 punto si tiene entre 65 y 74 años; 1 punto a la presencia de enfermedad vascular (infarto de miocardio, enfermedad arterial periférica o placa aórtica complicada), y otro punto si el sexo es femenino (no lo puntúa si es el único factor de riesgo presente). La escala CHA2DS2-VASc se demostró mejor que la CHADS2 en la identificación de pacientes con verdadero bajo riesgo, aquellos que no se beneficiarían de iniciar un tratamiento anticoagulante11-14. Así, en un estudio de validación del esquema CHA2DS2- VASc en 4.670 pacientes15, la escala reclasificó a los pacientes con CHADS2 = 1. El 26% de los pacientes presentaban una puntuación CHA2DS2-VASc = 1, con un riesgo anual de ictus del 0,9%, y se reclasificó al 74% de los pacientes con CHADS2 = 1 en una puntuación CHA2DS2-VASc ≥ 2, con un riesgo anual de ictus o embolia sistémica del 2,1%.
Principales esquemas de riesgo tromboembólico y tasa anual de ictus según la puntuación
| CHADS2 | CHA2DS2-VASc | ATRIA | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Puntuación | Tasa de ictus (%)/año | Puntuación | Tasa de ictus (%)/año | Sin ictus previo | Con ictus previo | Tasa de ictus (%)/ año según puntuación | ||||||||
| C | Insuficiencia cardiaca | 1 | 0 | 1,9 | C | Insuficiencia cardiaca | 1 | 0 | 0 | Edad > 85 | 6 | 9 | 01 | 0,080,43 |
| H | Hipertensión arterial | 1 | 1 | 2,8 | H | Hipertensión arterial | 1 | 1 | 1,3 | 75-84 | 5 | 7 | 23 | 0,990,73 |
| A | Edad ≥ 75 años | 1 | 2 | 4,0 | A | Edad ≥ 75 años | 2 | 2 | 2,2 | 65-74 | 3 | 7 | 45 | 0,640,99 |
| D | Diabetes mellitus | 1 | 3 | 5,9 | D | Diabetes mellitus | 1 | 3 | 3,2 | < 65 | 0 | 8 | 67 | 1,912,50 |
| S | Ictus | 2 | 4 | 8,5 | S | Ictus | 2 | 4 | 4,0 | Sexo femenino | 1 | 1 | 89 | 3,864,33 |
| 5 | 12,5 | V | Enfermedad vascular | 1 | 5 | 6,7 | Diabetes mellitus | 1 | 1 | 1011 | 6,356,18 | |||
| Puntuación máxima | 6 | 6 | 18,2 | A | Edad 65-75 | 1 | 6 | 9,8 | Insuficiencia cardiaca | 1 | 1 | 1213 | 10,957,52 | |
| Sc | Sexo femenino | 1 | 7 | 9,6 | Hipertensión | 1 | 1 | 1415 | 16,360 | |||||
| 8 | 6,7 | Proteinuria | 1 | 1 | ||||||||||
| Puntuación máxima | 9 | 9 | 15,2 | ERC con FG < 45 ml/min o ERT | 1 | 1 | ||||||||
| Puntuación máxima | 12 | 15 | ||||||||||||
ERC: enfermedad renal crónica; ERT: enfermedad renal terminal; FG: filtrado glomerular.
Las guías de la ESC sobre fibrilación auricular, ya desde 201216, las estadounidenses de la AHA/ACC 201417 y las del NICE18 recomiendan emplear el esquema CHA2DS2-VASc para la evaluación del riesgo embólico de los pacientes con FA (clase I B). Se recomienda el tratamiento anticoagulante oral para los pacientes varones con FA y CHA2DS2-VASc ≥ 2 y mujeres con CHA2DS2-VASc ≥ 3, con un nivel de recomendación de clase I3. En el caso de los pacientes varones con CHA2DS2-VASc = 1 y las mujeres con valor de 2, se recomienda que se debería considerar la anticoagulación oral, con un balance del riesgobeneficio (clase IIa), y para los pacientes con CHA2DS2-VASc = 0, que son los pacientes con «verdadero bajo riesgo», el tratamiento anticoagulante no está recomendado19,20. Estas recomendaciones indican la falta de reconocimiento actual del sexo femenino como verdadero factor de riesgo a la hora de indicar la anticoagulación oral3, y recientemente se ha demostrado que el sexo femenino no se puede considerar un factor de riesgo embólico21. De ahí que se haya propuesto una ligera modificación del acrónimo, CHA2DS2-VA, que elimina la referencia al sexo.
Diferentes estudios en varias cohortes22-24 han demostrado que el esquema CHA2DS2-VASc es superior a otras escalas para clasificar correctamente a los pacientes en bajo riesgo, con mayores poder predictivo y asociación con los eventos trombóticos, tanto en los pacientes anticoagulados como en los no anticoagulados24.
Hay datos que indican que el empeoramiento de la función renal se asocia con un incremento de eventos cardiovasculares y trombóticos en los pacientes con FA25. Un 10-15% de los pacientes con FA padecen enfermedad renal crónica (ERC), y el riesgo aumenta significativamente en la ERC con un filtrado glomerular < 60 ml/min. Sin embargo, la presencia de la función renal como un factor de riesgo puntuable en los esquemas de riesgo existentes ha mostrado resultados controvertidos. En una cohorte de 978 pacientes con FA tratados con acenocumarol, Roldán et al.26 demostraron que añadir la presencia de ERC a los esquemas CHADS2 y CHA2DS2-VASc no mejora el poder predictivo de ictus o embolia sistémica ni la mortalidad por cualquier causa. Asimismo, en la cohorte de 4.576 pacientes del estudio AMADEUS27, se evaluó la repercusión de añadir a los esquemas CHADS2 y CHA2DS2- VASc el empeoramiento de la función renal. A pesar de que los pacientes con aclaramiento de creatinina (AcCr) < 60 ml/min presentaban un aumento del riesgo de ictus o eventos trombóticos en comparación con los pacientes con AcCr > 60 ml/min, no se apreció diferencia estadísticamente significativa en el poder predictivo de eventos con la adición de la función renal. Así, a pesar de que el deterioro de la función renal implica un aumento del riesgo de embolias, añadir la función renal a los esquemas de riesgo CHADS2 y CHA2DS2-VASc no mejora el poder predictivo de estos esquemas.
Estratificación del Riesgo IsquémicoCon respecto a la valoración del riesgo isquémico de los pacientes con FA que además tienen cardiopatía isquémica aguda o precisan revascularización, se han utilizado diferentes escalas de riesgo. Las principales son la escala GRACE para la predicción del riesgo de muerte en los pacientes con infarto28, la escala REACH para valorar la aparición de eventos cardiovasculares en pacientes con enfermedad arterioesclerótica29, la escala SYNTAX para graduar la anatomía coronaria y guiar la selección del mejor método de revascularización30 y la SYNTAX II para predecir los eventos clínicos adversos tras la revascularización31.
La limitación fundamental es que ninguna de estas escalas de riesgo se diseñó para valorar el riesgo isquémico en una población con FA y enfermedad coronaria. En un estudio retrospectivo32, se valoró si estas escalas eran adecuadas para predecir eventos isquémicos y, como era de esperar, los resultados fueron moderados; la escala SYNTAX fue la que mostró mayor capacidad predictiva de eventos no mortales y eventos adversos cardiovasculares mayores (con unos estadísticos c de 0,634 y 0,612 respectivamente), mientras que la escala GRACE fue la que mejor se asoció con la mortalidad total (estadístico c = 0,682).
El último documento de consenso de la European Heart Rhythm Association (EHRA) y del Grupo europeo de trombosis sobre FA y cardiopatía isquémica plantea por primera vez la presencia de un riesgo isquémico más allá del riesgo embólico. Se plantea que el tratamiento antitrombótico debe tener en cuenta el riesgo isquémico, y las variables que considerar son la intervención urgente frente a la electiva, una escala SYNTAX alta y en el síndrome coronario agudo, una puntuación de la escala GRACE > 140 si se ha revascularizado el tronco de la coronaria izquierda, la descendente anterior proximal, una bifurcación o una trombosis del stent4(tabla 2).
Factores que influyen en el riesgo isquémico
| • Síndrome coronario agudo como evento clínico |
| • Trombosis del stent |
| • Elevada puntuación GRACE |
| • Elevada puntuación SYNTAX |
| • Intervención sobre tronco de la coronaria izquierda o la descendente anterior |
| • Infarto de miocardio recurrente |
| • Intervención sobre bifurcación |
El incremento del riesgo hemorrágico, especialmente la temida hemorragia intracraneal, es una complicación inherente al tratamiento con anticoagulantes orales. La incidencia anual de hemorragia intracraneal asociada con la anticoagulación aumenta de 0,8 a 44,4/100.000 habitantes32. Por ello es necesario conocer el riesgo hemorrágico individual de los pacientes antes de iniciar el tratamiento antitrombótico. Existen numerosos factores de riesgo que predisponen a la hemorragia, por lo que se han desarrollado varias escalas para evaluar el riesgo hemorrágico. Una de las primeras escalas fue HEMORR2HAGES, derivada de los factores de riesgo hemorrágico del National Registry of Atrial Fibrillation33. No obstante, esta escala se usa poco en la práctica clínica debido a que implica numerosos factores y la necesidad de utilizar estudios genéticos.
La siguiente escala propuesta y la que más se emplea en la práctica clínica diaria es la HAS-BLED, que se validó en la Euro Heart Survey in Atrial Fibrillation Cohort34. El acrónimo HAS-BLED representa cada uno de los factores de riesgo hemorrágico (tabla 3). Una puntuación de 0-1 clasifica como bajo riesgo; 2 puntos, como riesgo moderado y una puntuación ≥ 3, como alto riesgo. El esquema HAS-BLED es el que presenta mayor poder predictivo de hemorragia intracraneal en comparación con otros esquemas de riesgo hemorrágico35,36, y además está validado para predecir el riesgo de sangrado con ACOD37. También está validado para predecir el riesgo hemorrágico durante la terapia puente38 y la intervención coronaria percutánea tanto en pacientes con FA39 como sin ella40,41. La escala HAS-BLED es fácil de recordar y, sobre todo, identifica los factores modificables (p. ej., control de la presión arterial y suspensión del tratamiento concomitante con un antiagregante plaquetario) para reducir el riesgo hemorrágico de nuestros pacientes.
Escalas de riesgo hemorrágico
| HEMORR2HAGES | ATRIA | HAS-BLED | ORBIT | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| H | Disfunción hepática o renal | 1 | Anemia | 3 | H | Hipertensión | 1 | O | Edad > 74 años | 1 |
| E | Alcohol | 1 | Disfunción renal grave (AcCr < 30 ml/min) | 3 | A | Función renal o hepática anormal | 1 o 2 | R | Reducción de Hb/anemia | 2 |
| M | Enfermedad maligna | 1 | Edad ≥ 75 años | 2 | S | Ictus | 1 | B | Hemorragia previa | 2 |
| O | Edad > 75 años | 1 | Hemorragia previa | 1 | B | Hemorragia previa | 1 | I | Insuficiencia renal | 1 |
| R | Reducción en recuento plaquetario | 1 | Hipertensión | 1 | L | Labilidad del INR | 1 | T | Tratamiento con antiagregantes plaquetarios | 1 |
| R | Resangrado | 2 | E | Edad > 65 años | 1 | |||||
| H | Hipertensión | 1 | D | Fármacos/alcohol | 1 o 2 | |||||
| A | Anemia | 1 | ||||||||
| 1 | ||||||||||
| G | Genética | |||||||||
| E | Excesivo riesgo de caída | 1 | ||||||||
| S | Ictus | 1 | ||||||||
| Puntuación máxima | 12 | Puntuación máxima | 10 | Puntuación máxima | 9 | Puntuación máxima | 7 | |||
| Categorías de riesgo | Categorías de riesgo | Categorías de riesgo | Categorías de riesgo | |||||||
| Bajo riesgo: 0-1 puntos | Bajo riesgo: 0-2 | Bajo riesgo: 0-3 puntos | Bajo riesgo: 0-3 puntos | |||||||
| Riesgo intermedio: 2-3 puntos | Riesgo moderado: 4 puntos | Riesgo moderado: 2 | Riesgo moderado: 3 | |||||||
| Riesgo alto: ≥ 4 | Alto riesgo: ≥ 5 puntos | Alto riesgo: ≥ 3 | Alto riesgo: ≥ 4 | |||||||
AcCr: aclaramiento de creatinina; INR: razón internacional normalizada.
En los últimos años se han propuesto otras escalas, como la ATRIA21 o la ORBIT42. En el caso de la escala ATRIA, su pobre poder predictivo y su incapacidad para predecir la hemorragia intracraneal en comparación con la escala HAS-BLED se ha demostrado en varios estudios20,43. En una población de 937 pacientes anticoagulados con acenocumarol, el esquema HAS-BLED presentó mayor poder predictivo (estadístico c, 0,68 frente a 0,59; p = 0,035) en comparación con el esquema ATRIA, lo que refuerza el valor del sencillo esquema HAS-BLED44.
Se ha comparado el poder predictivo de las escalas HAS-BLED, ATRIA y ORBIT45 en la predicción de cualquier hemorragia clínicamente relevante. Las 3 escalas mostraron un moderado poder predictivo de hemorragia mayor, aunque el esquema HAS-BLED fue mejor que los otros. Por último, conviene mencionar que también se ha valorado el papel de las escalas CHADS2 y CHA2DS2-VASc en la evaluación de los eventos hemorrágicos, y ambas tienen menor poder predictivo que el esquema HAS-BLED46.
La nueva guía europea de FA3 no recomienda explícitamente el uso de una escala de sangrado u otra, y destaca que una puntuación elevada no debe ser motivo de que no se inicie o se suspenda la anticoagulación. Esta guía destaca que se debe identificar los factores de riesgo hemorrágico y corregir los modificables o tratables3(tabla 4). Sin embargo, recientemente se ha comprobado que la valoración del riesgo de hemorragia mediante los factores modificables no da más información que la escala HAS-BLED47. Por último, aunque se ha propuesto el papel de los biomarcadores en la estratificación del riesgo hemorrágico, con un grado de recomendación bajo (IIb) en la última guía europea3, la evidencia es escasa, ya que se basa en una población seleccionada de los ensayos clínicos de los ACOD48. De hecho, se ha demostrado recientemente su escaso valor actual en la práctica clínica49.
Factores de riesgo hemorrágico modificables y no modificables
| Hipertensión (especialmente la arterial sistólica) |
| INR lábil o tiempo en rango terapéutico < 60% |
| Medicación que predispone a la hemorragia (fármacos antiagregantes y antiinflamatorios) |
| Consumo excesivo de alcohol |
| Anemia |
| Deterioro de la función renal o trasplante renal |
| Deterioro de la función hepática |
| Plaquetopenia o alteración de la función plaquetaria |
| Edad > 65 años |
| Antecedente de hemorragia mayor |
| Ictus previo |
| Malignidad |
| Factores genéticos predisponentes |
| Biomarcadores (troponina de alta sensibilidad, factor 15 de diferenciación de crecimiento [GDF15], aclaramiento de creatinina) |
INR: razón internacional normalizada.
El tratamiento anticoagulante disminuye el riesgo de fenómenos embólicos y la mortalidad de los pacientes con FA, aunque a expensas de elevar el riesgo hemorrágico. Por todo ello resulta crucial valorar el riesgo individual a la hora de tomar la decisión de iniciar un tratamiento anticoagulante. Para ello se dispone de varias escalas de riesgo trombótico y hemorrágico que pueden ayudar en la práctica clínica (tabla 5). Recientemente se ha reconocido la presencia de factores moduladores del riesgo isquémico en pacientes con FA que precisan revascularización coronaria, que deben tenerse en cuenta a la hora de indicar el tratamiento antitrombótico más adecuado para cada paciente.
Recomendaciones de las guías de práctica clínica
| ESC 20163 | AHA/ACC 201417 | NICE* | |
|---|---|---|---|
| Riesgo trombótico | El esquema CHA2DS2-VASc es el recomendado para evaluar el riesgo tromboembólico en pacientes con fibrilación auricular no valvularClase I, nivel de evidencia A | Para los pacientes con fibrilación auricular no valvular, se recomienda el esquema CHA2DS2-VASc para la evaluación del riesgo trombóticoClase I, nivel de evidencia B | Se recomienda la utilización del esquema de riesgo CHA2DS2-VASc para evaluar el riesgo trombótico de los pacientes con:• Fibrilación auricular persistente, permanente o paroxística tanto sintomática como asintomática• Flutter auricular• Recurrencia de FA tras cardioversión |
| Riesgo hemorrágico | Se recomienda evaluar el riesgo hemorrágico de los pacientes tratados con anticoagulantes orales, para identificar los factores de riesgo de hemorragia mayor modificablesClase lia, nivel de evidencia B | Se recomienda revaluar periódicamente la necesidad y el tipo de tratamiento antitrombótico, evaluando los riesgos trombótico y hemorrágicoClase I, nivel de evidencia C | Se recomienda la utilización del esquema HAS-BLED para evaluar el riesgo hemorrágico de los pacientes que inician o toman anticoagulantes. Es necesario monitorizar y realizar una modificación frecuente de:• Hipertensión incontrolada• Labilidad del INR• Uso concomitante de AINE o AAS• Gran consumo de alcohol |
AAS: ácido acetilsalicilico; AINE: antiinflamatorios no esteroideos; FA: fibrilación auricular; INR: razón internacional normalizada.
No se declara ninguno.
Información Sobre el SuplementoEste artículo forma parte del suplemento titulado «Actualización en el tratamiento de los pacientes con fibrilación auricular sometidos a intervención coronaria», que ha sido patrocinado por Boehringer Ingelheim.